
Aluminio
Sabías ...
SOS Children produjo este sitio web para las escuelas, así como este sitio web video sobre África . SOS Niño patrocinio es cool!
| Aluminio | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
13 Al | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Apariencia | |||||||||||||||||||||||||
metálico gris plateado  Las líneas espectrales de aluminio | |||||||||||||||||||||||||
| Propiedades generales | |||||||||||||||||||||||||
| Nombre, símbolo, número | de aluminio, Al, 13 | ||||||||||||||||||||||||
| Pronunciación | Reino Unido / ˌ æ lj ʉ m ɪ n yo ə m / AL -ew- Min -ee-əm; EE.UU. / ə lj U m ɨ n əm / | ||||||||||||||||||||||||
| Categoría metálico | metálica posterior a la transición | ||||||||||||||||||||||||
| Grupo, período, bloque | 13, 3, p | ||||||||||||||||||||||||
| Peso atómico estándar | 26,981 5 386 (13) | ||||||||||||||||||||||||
| Configuración electrónica | [ Ne ] 3s 2 3p 1 2, 8, 3 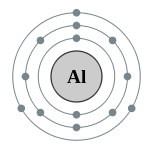 | ||||||||||||||||||||||||
| Historia | |||||||||||||||||||||||||
| Predicción | Antoine Lavoisier (1787) | ||||||||||||||||||||||||
| Primer aislamiento | Friedrich Wöhler (1827) | ||||||||||||||||||||||||
| Nombrado por | Humphry Davy (1807) | ||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||
| Densidad (cerca rt) | 2,70 g · cm -3 | ||||||||||||||||||||||||
| Líquido densidad en mp | 2,375 g · cm -3 | ||||||||||||||||||||||||
| Punto de fusion | 933,47 K , 660.32 ° C, 1220.58 ° F | ||||||||||||||||||||||||
| Punto de ebullicion | 2792 K, 2519 ° C, 4566 ° F | ||||||||||||||||||||||||
| Calor de fusión | 10.71 kJ · mol -1 | ||||||||||||||||||||||||
| El calor de vaporización | 294.0 kJ · mol -1 | ||||||||||||||||||||||||
| Capacidad calorífica molar | 24.200 J · mol -1 · K -1 | ||||||||||||||||||||||||
| Presión del vapor | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Propiedades atómicas | |||||||||||||||||||||||||
| Estados de oxidación | 3, 2, 1 ( óxido anfótero) | ||||||||||||||||||||||||
| Electronegatividad | 1,61 (escala de Pauling) | ||||||||||||||||||||||||
| Energías de ionización ( más) | Primero: 577.5 kJ · mol -1 | ||||||||||||||||||||||||
| Segundo: 1816,7 kJ · mol -1 | |||||||||||||||||||||||||
| Tercero: 2744,8 kJ · mol -1 | |||||||||||||||||||||||||
| Radio atómico | 143 pm | ||||||||||||||||||||||||
| Radio covalente | 121 ± 16:00 | ||||||||||||||||||||||||
| Van der Waals radio | 184 pm | ||||||||||||||||||||||||
| Miscelánea | |||||||||||||||||||||||||
| Estructura cristalina | cara cúbica centrada  | ||||||||||||||||||||||||
| Ordenamiento magnético | paramagnético | ||||||||||||||||||||||||
| La resistividad eléctrica | (20 ° C) 28,2 nΩ · m | ||||||||||||||||||||||||
| Conductividad térmica | 237 W · m -1 · K -1 | ||||||||||||||||||||||||
| Expansión térmica | (25 ° C) 23,1 m · m -1 · K -1 | ||||||||||||||||||||||||
| Velocidad del sonido (varilla delgada) | ( rt) (laminado) 5.000 m · s -1 | ||||||||||||||||||||||||
| El módulo de Young | 70 GPa | ||||||||||||||||||||||||
| Módulo de corte | 26 GPa | ||||||||||||||||||||||||
| Módulo de volumen | 76 GPa | ||||||||||||||||||||||||
| Relación de Poisson | 0.35 | ||||||||||||||||||||||||
| Dureza de Mohs | 2.75 | ||||||||||||||||||||||||
| Dureza Vickers | 167 MPa | ||||||||||||||||||||||||
| Dureza Brinell | 245 MPa | ||||||||||||||||||||||||
| Número de registro del CAS | 7429-90-5 | ||||||||||||||||||||||||
| La mayoría de los isótopos estables | |||||||||||||||||||||||||
| Artículo principal: Los isótopos de aluminio | |||||||||||||||||||||||||
|
|||||||||||||||||||||||||
De aluminio (o de aluminio) es un elemento químico en el grupo de boro con el símbolo Al y número atómico 13. Es de color blanco plateado, y no es soluble en agua bajo circunstancias normales.
El aluminio es el tercer elemento más abundante (después de oxígeno y silicio ), y el metal más abundante en la Tierra 's corteza . Se representa aproximadamente el 8% en peso de superficie sólida de la Tierra. De metal de aluminio es tan reactivo químicamente que los especímenes nativos son poco frecuentes y se limitan a extremo ambientes reductores. En cambio, se encuentra combinado en más de 270 diferentes minerales . El jefe mineral de aluminio es bauxita.
El aluminio es notable por bajo del metal de la densidad y por su capacidad para resistir la corrosión debido al fenómeno de pasivación. Los componentes estructurales hechos de aluminio y su aleaciones son vitales para el industria aeroespacial, y son importantes en otras áreas de transporte y los materiales estructurales. Los compuestos más útiles de aluminio, al menos sobre una base de peso, son los óxidos y sulfatos.
A pesar de su prevalencia en el medio ambiente, no se conocen las sales de aluminio para ser utilizado por cualquier forma de vida. De acuerdo con su capacidad de penetración, el aluminio es bien tolerado por las plantas y los animales. Debido a su prevalencia, potenciales beneficiosos (o de otro tipo) funciones biológicas de los compuestos de aluminio son de interés de continuar.
Características

Físico
El aluminio es un relativamente suave, durable y ligero, dúctil y maleable de metal con la apariencia que van desde plateado a gris opaco, dependiendo de la rugosidad de la superficie. No es magnético y no se inflama fácilmente. Una película fresca de aluminio sirve como un buen reflector (aproximadamente 92%) de luz visible y un excelente reflector (tanto como 98%) de medio y la radiación del infrarrojo lejano. La límite de elasticidad de aluminio puro es 7.11 MPa, mientras aleaciones de aluminio tienen límites elásticos que van desde 200 MPa a 600 MPa. De aluminio tiene alrededor de un tercio de la densidad y rigidez de acero . Es fácilmente mecanizada, fundido, dibujado y extruido.
Átomos de aluminio están dispuestos en una cara cúbica centrada (norteamericana) de estructura. El aluminio tiene una la energía de falla de apilamiento de aproximadamente 200 mJ / m 2.
El aluminio es un buen térmica y conductor eléctrico, que tiene 59% de la conductividad del cobre, tanto térmica como eléctrica, mientras que sólo el 30% de la densidad del cobre. El aluminio es capaz de ser un superconductor , con una temperatura crítica superconductor de 1,2 Kelvin y un campo magnético crítico de aproximadamente 100 gauss (10 militeslas).
Químico
Corrosión resistencia puede ser excelente debido a una capa superficial fina de óxido de aluminio que se forma cuando el metal está expuesto al aire, impidiendo efectivamente más oxidación. Las fuertes aleaciones de aluminio son menos resistentes a la corrosión debido a la reacciones galvánicas con aleación de cobre . Esta resistencia a la corrosión es también a menudo reduce en gran medida por las sales acuosas, especialmente en la presencia de metales diferentes.
Debido a su resistencia a la corrosión, el aluminio es uno de los pocos metales que retienen reflectancia plateado en forma de polvo fino, por lo que es un componente importante de pinturas de color de plata. Acabado de espejo de aluminio tiene la mayor reflectancia de cualquier metal en la 200-400 nm ( UV ) y la 3.000-10.000 nm (lejos ) Regiones IR; en el rango visible 400-700 nm se superó ligeramente por estaño y plata y en el 700-3000 (IR cercano) por la plata, el oro , y cobre.
El aluminio se oxida por el agua para producir hidrógeno y calor:
- 2 Al + 3 H 2 O → Al 2 O 3 + 3 H 2
Esta conversión es de interés para la producción de hidrógeno. Los desafíos incluyen eludir la capa de óxido formada que inhibe la reacción y los gastos asociados con el almacenamiento de energía por la regeneración del metal Al.
Isótopos
El aluminio tiene muchos conocidos isótopos , cuyo número de masa rango 21 a 42; Sin embargo, sólo el 27 por Al ( isótopos estables ) y el 26 de Al ( isótopo radiactivo, t 1/2 = 7,2 × 10 5 y) se producen naturalmente. Al 27 tiene una abundancia natural por encima de 99,9%. Al 26 se produce a partir de argón en la atmósfera por espalación causada por rayos cósmicos protones . Isótopos de aluminio han encontrado aplicación práctica en salir marinos sedimentos, nódulos de manganeso, hielo glacial, cuarzo en la roca exposiciones, y meteoritos. La relación de 26 Al 10 Be se ha utilizado para estudiar el papel del transporte, deposición de sedimentos de almacenamiento, los tiempos de entierro, y la erosión en escalas de tiempo mayo 10 a junio 10 del año. Cosmogénico 26 Al se aplicó por primera vez en los estudios de la Luna y los meteoritos. Fragmentos de meteoritos, después de la salida de sus órganos principales, están expuestos a un intenso bombardeo de rayos cósmicos durante su viaje por el espacio, causando considerable 26 Al producción. Después de caer a la Tierra, el blindaje atmosférica reduce drásticamente 26 Al producción, y su descomposición se puede usar entonces para determinar la edad terrestre del meteorito. Meteorito investigación también ha demostrado que 26 Al fue relativamente abundante en el momento de la formación de nuestro sistema planetario. La mayoría de los científicos de meteoritos creen que la energía liberada por la desintegración de 26 Al era responsable de la fusión y diferenciación de algunos asteroides después de su formación, hace 4550 millones años.
Presencia natural
Se crea aluminio estable cuando el hidrógeno se fusiona con el magnesio , ya sea en grandes estrellas o en las supernovas .
En la corteza de la Tierra , el aluminio es el más abundante (8,3% en peso) elemento metálico y el tercero más abundante de todos los elementos (después del oxígeno y silicio). Debido a su fuerte afinidad al oxígeno, que casi nunca se encuentra en estado elemental; en lugar de ello se encuentra en óxidos o silicatos. feldespatos , el grupo más común de los minerales en la corteza de la Tierra, son aluminosilicatos. Metal de aluminio nativo sólo se puede encontrar como una fase de menor importancia en bajos niveles de oxígeno entornos de fugacidad, tales como los interiores de ciertos volcanes. Nativo de aluminio ha sido reportado en surgencias frías en el noreste talud continental del Mar de China Meridional y Chen et al. (2011) han propuesto una teoría de su origen como resultante por reducción de tetrahydroxoaluminate Al (OH) 4 - a aluminio metálico por bacterias .
También ocurre en los minerales berilo, criolita, granate, espinela y turquesa . Las impurezas en Al 2 O 3, como el cromo o hierro rendimiento del piedras preciosas rubí y zafiro, respectivamente.
Aunque el aluminio es un elemento extremadamente común y extendido, los minerales de aluminio comunes no son fuentes económicas de metal. Casi todo el aluminio metálico se produce a partir de la mineral de bauxita (AlOx (OH) 3-2 x). La bauxita se produce como una intemperie producto de bajo contenido de hierro y roca de sílice en condiciones climáticas tropicales. Grandes depósitos de bauxita se encuentran en Australia, Brasil , Guinea y Jamaica y las zonas mineras principales para el mineral se encuentran en Australia , Brasil, China, , India , Guinea, Indonesia , Jamaica, Rusia y Suriname .
Producción y refinamiento

Formas de aluminio fuertes enlaces químicos con oxígeno. En comparación con la mayoría de los otros metales, es difícil de extraer a partir del mineral, tales como bauxita, debido a la alta reactividad del aluminio y el punto de fusión alto de la mayoría de sus menas. Por ejemplo, la reducción directa con carbono , que se utiliza para producir hierro , no es químicamente posible porque el aluminio es un agente reductor más fuerte que el carbono. Reducción carbotérmica indirecta puede llevarse a cabo utilizando de carbono y Al 2 O 3, que forma un intermedio Al 4 C 3 y esto puede producir otro metal de aluminio a una temperatura de 1900-2000 ° C. Este proceso está todavía en desarrollo; que requiere menos energía y produce menos CO 2 que la Proceso Hall-Héroult, el proceso industrial importante para la extracción de aluminio. De fundición electrolítica de la alúmina era originalmente un costo prohibitivo en parte debido a la alto punto de fusión de la alúmina, u óxido de aluminio, (alrededor de 2000 ° C (3600 ° F)). Muchos minerales, sin embargo, se disolverá en un segundo mineral ya fundido, incluso si la temperatura de la masa fundida es significativamente menor que el punto de la primera mineral de fusión. Fundido criolita fue descubierto para disolver de alúmina a temperaturas significativamente menor que el punto de fusión de la alúmina pura sin interferir en el proceso de fundición. En el Proceso de Héroult Hall, alúmina se disuelve primero en fundido criolita con calcio fluoruro y luego electrolíticamente reducido a de aluminio a una temperatura entre 950 y 980 ° C (1740 a 1800 ° F). La criolita es un compuesto químico de aluminio y sodio fluoruros: (Na 3 AlF 6). Aunque criolita se encuentra como un mineral en Groenlandia , su forma sintética se utiliza en la industria. El propio óxido de aluminio se obtiene por la bauxita de refinación en el Proceso Bayer.
El proceso electrolítico sustituye el Proceso de Wöhler, que supuso la reducción de cloruro de aluminio anhidro con potasio . Tanto de la electrodos utilizados en la electrólisis de óxido de aluminio son de carbono. Una vez que la alúmina refinado se disuelve en el electrolito, que se disocia y sus iones son libres de moverse. La reacción en el cátodo es:
- Al 3+ + 3 e - → Al
Aquí, el ion de aluminio está siendo reducida. El metal de aluminio y luego se hunde hasta el fondo y es extraida, generalmente echado en grandes bloques llamados tochos de aluminio para su posterior procesamiento.
En el ánodo, se forma oxígeno:
- 2 O 2 → O2 + 4 e -
Hasta cierto punto, el ánodo de carbono es consumido por la posterior reacción con el oxígeno para formar dióxido de carbono. Por tanto, los ánodos en una celda de reducción deben ser reemplazadas regularmente, puesto que se consumen en el proceso. Los cátodos no se erosionan, principalmente debido a procesos electroquímicos y el movimiento metal. Después de cinco a diez años, dependiendo de la corriente utilizada en la electrólisis, una célula tiene que ser reconstruido debido al desgaste del cátodo.
La electrólisis de aluminio con el Proceso Hall-Héroult consume mucha energía, pero los procesos alternativos siempre resultaron ser menos viable económicamente y / o ecológicamente. El consumo de energía específica media en todo el mundo es de aproximadamente 15 ± 0,5 kilovatios-hora por kilogramo de aluminio producido (52 a 56 MJ / kg). Las fundiciones más modernas alcanzan aproximadamente 12,8 kW · h / kg (46,1 MJ / kg). (Compare esto con el calor de reacción, 31 MJ / kg, y la energía libre de Gibbs de reacción, 29 MJ / kg.) corrientes de línea Reducción de tecnologías más antiguas son típicamente de 100 a 200 kiloamperios; fundiciones con tecnología de última generación funcionan a unos 350 kA. Los ensayos han sido reportados con 500 células kA.
El proceso Hall-Heroult produce aluminio con una pureza de por encima de 99%. La purificación adicional se puede hacer por el Proceso Hoope. El proceso implica la electrólisis de aluminio fundido con una sal de sodio, bario y fluoruro de aluminio electrolito. El aluminio resultante tiene una pureza de 99,99%.
La energía eléctrica representa aproximadamente 20% a 40% del costo de producción de aluminio, dependiendo de la ubicación de la fundición. Producción de aluminio consume aproximadamente el 5% de la electricidad generada en las fundiciones estadounidenses tienden a estar situado donde la energía eléctrica es abundante y de bajo costo, tales como los Emiratos Árabes Unidos con el suministro de gas natural, y el exceso de Islandia y Noruega con la energía generada a partir de recursos renovables. El más grande del mundo fundiciones de aluminio son la República Popular de China, Rusia y Quebec y Columbia Británica en Canadá .
En 2005, la República Popular de China es el mayor productor de aluminio con casi una quinta cuota mundial, seguido por Rusia, Canadá y los EE.UU., informa el British Geological Survey.
Durante los últimos 50 años, Australia se ha convertido en un importante productor de mineral de bauxita y un importante productor y exportador de alúmina (antes de ser superado por China en 2007). Australia produce 68 millones toneladas de bauxita en 2010. Los depósitos australianos tener algunos problemas de refinación, un poco de ser alta en sílice, pero tienen la ventaja de ser poco profunda y relativamente fácil a la mía.
Reciclaje

El aluminio es teóricamente 100% reciclable sin ninguna pérdida de sus cualidades naturales. De acuerdo con la Internacional de Recursos del Grupo Especial de Las existencias del metal en el informe de la Sociedad, lo global cápita balance de aluminio en uso en la sociedad por (es decir, en automóviles, edificios, aparatos electrónicos, etc.) es de 80 kg. Mucho de esto es en los países más desarrollados (350-500 kg per cápita) en lugar de los países menos desarrollados (35 kg per cápita). Conocer las existencias per cápita y su vida útil aproximada es importante para el reciclaje de planificación.
La recuperación del metal a través de reciclaje se ha convertido en un uso importante de la industria del aluminio. El reciclaje es una actividad de bajo perfil hasta finales de 1960, cuando el creciente uso de aluminio latas de bebidas trajeron a la conciencia pública.
El reciclaje implica la fusión de la chatarra, un proceso que requiere sólo el 5% de la energía utilizada para producir aluminio a partir del mineral, aunque una parte importante (hasta 15% del material de entrada) se pierde como escoria (óxido de ceniza similares). La escoria puede someterse a un procedimiento adicional para extraer aluminio.
En Europa aluminio experimenta altas tasas de reciclaje, que van desde el 42% de las latas de bebidas, el 85% de materiales de construcción y el 95% de los vehículos de transporte.
El aluminio reciclado se conoce como aluminio secundario, pero mantiene las mismas propiedades físicas como el aluminio primario. De aluminio secundario se produce en una amplia gama de formatos y se emplea en 80% de las inyecciones de aleación. Otro uso importante es para la extrusión.
Blanco escoria de la producción de aluminio primario y de operaciones de reciclaje secundarios aún contiene cantidades útiles de aluminio que se pueden extraer industrialmente. El proceso produce palanquillas de aluminio, junto con un material de desecho altamente compleja. Estos residuos son difíciles de manejar. Reacciona con el agua, liberando una mezcla de gases (incluidos, entre otros, hidrógeno , acetileno , y amoníaco ), que se inflama espontáneamente en contacto con el aire; en contacto con el aire húmedo resultados en la liberación de grandes cantidades de gas amoníaco. A pesar de estas dificultades, los residuos han encontrado uso como relleno en asfalto y hormigón.
Compuestos
Estado de oxidación +3
La gran mayoría de los compuestos, incluyendo todos los Al-que contienen minerales y todos los compuestos de aluminio comercialmente importantes, la función de aluminio en el estado de oxidación 3+. El número de coordinación de tales compuestos varía, pero generalmente es de seis Al 3+ coordenada o tetracoordinado. Casi todos los compuestos de aluminio (III) son incoloros.
Haluros
Todos los cuatro trihaluros son bien conocidos. A diferencia de las estructuras de los tres trihaluros más pesados, fluoruro de aluminio (AlF3) cuenta con seis coordenadas Al. El entorno de coordinación octaédrica para AlF 3 está relacionado con la compacidad de ion fluoruro, seis de los cuales puede encajar alrededor de la pequeña Al 3+ centro. AlF 3 sublima (con grietas) en 1291 ° C (2356 ° F). Con haluros más pesados, los números de coordinación son más bajos. Los otros son trihaluros dimérica o polimérico con tetraédricos centros de Al. Estos materiales se preparan mediante el tratamiento de metal de aluminio con el halógeno, aunque existen otros métodos. La acidificación de los óxidos o hidróxidos proporciona hidratos. En solución acuosa, los haluros menudo forman mezclas, que contiene generalmente de seis coordinar los centros de Al, que son función tanto haluro y ligandos acuo. Cuando el aluminio y fluoruro están juntos en solución acuosa, forman fácilmente iones complejos tales como [AlF (H 2 O) 5] 2+, AlF 3 (H 2 O) 3, y [AlF 6] 3-. En el caso del cloruro, se forman grupos de polialuminio, tales como [Al 13 O 4 (OH) 24 (H 2 O) 12] 7+.
Óxido e hidróxidos
De aluminio forma un óxido estable, conocido por su nombre mineral corindón . Zafiro y rubí son corindón impuro contaminada con trazas de otros metales. Los dos hidróxidos de óxido, AlO (OH), son bohemita y diáspora. Hay tres trihidróxidos: bayerita, gibbsita, y nordstrandite, que difieren en su estructura cristalina ( polimorfos). La mayoría se producen a partir de minerales por una variedad de procesos húmedos utilizando ácido y base. El calentamiento de los hidróxidos conduce a la formación de corindón. Estos materiales son de importancia central para la producción de aluminio y son en sí mismos extremadamente útil.
Carburo de aluminio (Al 4 C 3) se realiza por calentamiento de una mezcla de los elementos por encima de 1000 ° C (1832 ° F). Los cristales de color amarillo pálido consisten en centros de aluminio tetraédricos. Reacciona con agua o ácidos diluidos para dar metano . La acetiluro, Al 2 (C 2) 3, se realiza haciendo pasar el acetileno sobre el aluminio calentado.
Nitruro de aluminio (AlN) es el único conocido por nitruro de aluminio. A diferencia de los óxidos tetraédricos que cuenta con centros de Al. Se puede hacer de los elementos a 800 ° C (1472 ° F). Es estable al aire material con una alta útilmente conductividad térmica. Fosfuro de aluminio (ALP) se hace de manera similar, y se hidroliza para dar fosfina:
- AlP + 3 H 2 O → Al (OH) 3 + PH 3
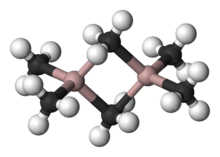
Una variedad de compuestos de fórmula empírica AlR 3 y AlR 1,5 Cl 1,5 existen. Estas especies por lo general cuentan tetraédricos centros de Al, por ejemplo " trimetilaluminio "tiene la fórmula Al2 (CH 3) 6 (ver figura). Con grupos orgánicos grandes, triorganoaluminium existe como monómeros de tres coordenadas, como triisobutilaluminio. Tales compuestos son ampliamente utilizados en la química industrial, a pesar del hecho de que son a menudo altamente pirofórico. Existen pocos análogos de entre compuestos de organoaluminio y organoboro excepto para grupos orgánicos grandes.
El hidruro de aluminio importante es hidruro de litio y aluminio (LiAlH 4), que se utiliza en como agente reductor en la química orgánica . Se puede producirse a partir de hidruro de litio y tricloruro de aluminio:
- 4 LiH + AlCl3 → LiAlH4 + 3 LiCl
Varios derivados útiles de LiAlH 4 se conocen, por ejemplo, sodio y bis (2-metoxietoxi) dihydridoaluminate. El hidruro simple, hidruro o alano aluminio, sigue siendo una curiosidad de laboratorio. Es un polímero con la fórmula (ALH 3) n, en contraste con el hidruro de boro correspondiente con la fórmula (BH 3) 2.
Estados de oxidación +1 y +2
Aunque la gran mayoría de los compuestos de aluminio disponen de Al 3+ centros, los compuestos con estados de oxidación más bajos son conocidos y en algún momento de significación como precursores de las especies de Al 3+.
De aluminio (I)
AlF, AlCl y AlBr existen en la fase gaseosa cuando el trihaluro se calienta con aluminio. La composición Ali es inestable a temperatura ambiente con respecto a la triyoduro:
- 3 AlI → AlI 3 + 2 Al
Un derivado estable de monoiodide el aluminio es el cíclico aducto formado con trietilamina, Al 4 I 4 (NEt3) 4. También es de interés teórico, sino sólo de la existencia fugaz son de Al 2 O y Al 2 S. Al 2 O se hace calentando el óxido normal, Al 2 O 3, con silicio a 1800 ° C (3272 ° F) en una vacío. Tales materiales rápidamente desproporciona a los materiales de partida.
Aluminio (II)
Compuestos muy sencillos Al (II) se invocan u observado en las reacciones de Al metálico con oxidantes. Por ejemplo, monóxido de aluminio, AlO, se ha detectado en la fase gaseosa después de la explosión y en los espectros de absorción estelar. Más investigados a fondo son compuestos de la fórmula R 4 Al 2 donde R es un gran orgánica ligando.
Análisis
La presencia de aluminio se puede detectar en el análisis cualitativo usando Aluminon.
Aplicaciones
Uso general
El aluminio es el más utilizado metales no ferrosos. La producción mundial de aluminio en 2005 fue de 31,9 millones de toneladas. Es superior a la de cualquier otro metal, excepto hierro (837,5 millones de toneladas). Pronóstico para el 2012 es 42-45000000 toneladas, impulsado por el aumento de la producción china.
El aluminio se alea casi siempre, lo que mejora notablemente sus propiedades mecánicas, especialmente cuando templado. Por ejemplo, el común láminas de aluminio y latas de bebidas son aleaciones de 92% a 99% de aluminio. El principal agentes de aleación son cobre, zinc , magnesio , manganeso , y silicio (por ejemplo, duraluminio) y los niveles de estos otros metales están en el rango de unos pocos por ciento en peso.



Algunos de los muchos usos para el metal de aluminio en:
- Transporte ( coches , aviones, camiones, vagones de ferrocarril, embarcaciones marinas, bicicletas , etc.) como lámina, tubo, piezas de fundición, etc.
- Embalaje ( latas, papel, etc.)
- Construcción ( ventanas, puertas, revestimiento, cables de construcción, etc.).
- Una amplia gama de artículos para el hogar, desde utensilios de cocina a bates de béisbol, relojes.
- Calle postes de iluminación, velero mástiles, bastones, etc.
- Capas exteriores de la electrónica de consumo, también los casos de los equipos por ejemplo, equipo fotográfico.
- Líneas de transmisión eléctricas de distribución de energía
- Acero y MKM Imanes Alnico
- Aluminio súper pureza (SPA, 99,980% a 99,999% Al), utilizado en la electrónica y CDs .
- Los disipadores de calor para los aparatos electrónicos como transistores y CPUs .
- Material de sustrato de laminados de metal-core revestidos de cobre utilizados en alto brillo Iluminación LED.
- El aluminio en polvo se utiliza en pintar, y en pirotecnia, tales como combustibles para cohetes sólidos y termita.
- El aluminio puede hacerse reaccionar con ácido clorhídrico o con hidróxido de sodio para producir gas hidrógeno.
- Una variedad de países, entre ellos Francia , Italia , Polonia , Finlandia , Rumania , Israel , y la ex Yugoslavia , han emitido monedas acuñadas en aluminio o aluminio-cobre aleaciones.
- Algunas placas de diamante de aluminio modelos de guitarra deportivas en la superficie de los instrumentos, generalmente cromo o negro. Kramer y Travis Bean son tanto conocido por tener guitarras producidas con el cuello hecha de aluminio, lo que le da al instrumento un sonido muy distinto.
El aluminio se alea generalmente - se utiliza como metal puro sólo cuando resistencia a la corrosión y / o trabajabilidad es más importante que la resistencia o dureza. Una capa delgada de aluminio se puede depositar sobre una superficie plana por deposición física de vapor o (muy poco frecuente) deposición química de vapor u otro medios químicos para formar recubrimientos ópticos y espejos.
Compuestos de aluminio
Debido a que el aluminio es abundante y la mayoría de sus derivados presentan baja toxicidad, los compuestos de aluminio disfrutan de amplias aplicaciones y algunas veces a gran escala.
Alúmina
El óxido de aluminio (Al 2 O 3) y los oxihidróxidos asociados y trihidróxidos son producidos o extraídos de minerales a gran escala. La gran mayoría de este material se convierte en aluminio metálico. Alrededor del 10% de la capacidad de producción se utiliza para otras aplicaciones. Un uso importante es como un absorbente, por ejemplo alúmina eliminar el agua de los hidrocarburos, para permitir que los procesos posteriores que son envenenados por la humedad. Óxidos de aluminio son catalizadores comunes para los procesos industriales, por ejemplo, la Proceso de Claus para convertir sulfuro de hidrógeno a azufre en refinerías y para la alquilación de aminas . Muchos catalizadores industriales son "Compatible", lo que significa generalmente que un catalizador caro (por ejemplo, platino ) se dispersa en un material de gran superficie, como la alúmina. Al ser un material muy duro ( dureza Mohs 9), alúmina se utiliza ampliamente como un abrasivo y la producción de aplicaciones que explotan su inercia, por ejemplo, en lámparas de sodio de alta presión.
Sulfatos
Varios sulfatos de aluminio encuentran aplicaciones. Sulfato de aluminio (Al 2 (SO 4) 3 (H 2 O) 18) se produce en la escala anual de varios miles de millones de kilogramos. Alrededor de la mitad de la producción se consume en tratamiento de aguas. La siguiente aplicación principal es en la fabricación de papel. También se utiliza como mordiente, en extintor de fuego, como aditivo alimentario, en prueba de fuego, y en el curtido de cuero. Sulfato de aluminio y amonio, que también se llama alumbre de amonio, (NH 4) Al (SO4) 2 · 12H 2 O, se utiliza como una mordiente y en curtido de pieles. Sulfato de potasio aluminio ([Al (K)] (SO 4) 2) (H 2 O) 12 se utiliza de manera similar. El consumo de los dos ex-alumnos está disminuyendo.
Cloruros
Cloruro de aluminio (AlCl3) se utiliza en petróleo refinación y en la producción de sintético de caucho y polímeros. Aunque tiene un nombre similar, clorhidrato de aluminio tiene menos y muy diferentes aplicaciones, por ejemplo como un agente de endurecimiento y una antitranspirante. Es un intermediario en la producción de metal de aluminio.
Compuestos de nicho
Dada la escala de compuestos de aluminio, una aplicación pequeña escala todavía podría implicar miles de toneladas. Uno de los muchos compuestos utilizados en este nivel intermedio incluyen acetato de aluminio, una sal utilizada en la solución como una astringente. Borato de aluminio (Al 2 O 3 · B 2 O 3) se utiliza en la producción de vidrio y cerámica. Fluorosilicato de aluminio (Al 2 (SiF 6) 3) se utiliza en la producción de sintética piedras preciosas, vidrio y cerámica. Fosfato de aluminio (AlPO 4) se utiliza en la fabricación: de vidrio y de cerámica, productos de pasta y papel, cosméticos, pinturas y barnices y en la toma dental cemento. El hidróxido de aluminio (Al (OH) 3) se utiliza como una antiácido, como mordiente, en el agua de purificación, en la fabricación de vidrio y de cerámica, y en la impermeabilización de telas. hidruro de litio y aluminio es un potente agente reductor utilizado en la química orgánica . Organoaluminiums se utilizan como Ácidos de Lewis y cocatalizadores. Por ejemplo, metilaluminoxano es un cocatalizador para Ziegler-Natta olefina de polimerización para producir polímeros de vinilo tales como polietileno.
Las aleaciones de aluminio en aplicaciones estructurales

Aleaciones de aluminio con una amplia gama de propiedades se utilizan en las obras de ingeniería. Sistemas de aleación están clasificados por un sistema numérico ( ANSI) o por nombres que indican sus principales constituyentes de aleación ( DIN y ISO).
La fuerza y la durabilidad de las aleaciones de aluminio varían ampliamente, no sólo como resultado de los componentes de la aleación específica, sino también como resultado de tratamientos de calor y los procesos de fabricación. La falta de conocimiento de estos aspectos tiene de vez en cuando llevó a estructuras diseñadas y ganado una mala reputación de aluminio de manera incorrecta.
Una importante limitación estructural de las aleaciones de aluminio es su resistencia a la fatiga. A diferencia de los aceros, aleaciones de aluminio tienen bien definida límite de fatiga, lo que significa que el fallo por fatiga finalmente se produce, incluso bajo pequeñas cargas cíclicas. Esto implica que los ingenieros deben evaluar estas cargas y diseño para un vida fija en lugar de una vida infinita.
Otra propiedad importante de las aleaciones de aluminio es su sensibilidad al calor. Procedimientos taller con calefacción se complican por el hecho de que el aluminio, a diferencia del acero, se derrite sin primero rojo brillante. Las operaciones de formado donde una soplete se utiliza, por tanto, requiere alguna experiencia, ya que no hay signos visuales revelan lo cerca que el material es a la fusión. Las aleaciones de aluminio, al igual que todas las aleaciones estructurales, también están sujetos a tensiones internas siguientes operaciones de calentamiento tales como la soldadura y fundición. El problema con las aleaciones de aluminio en este sentido es su bajo punto de fusión , lo que las hace más susceptibles a las distorsiones de alivio de la tensión inducida térmicamente. Alivio de tensión controlada se puede hacer durante la fabricación por el tratamiento térmico de las piezas en un horno, seguido de enfriamiento en efecto gradual recocido de las tensiones.
El bajo punto de fusión de aleaciones de aluminio no ha impedido su uso en los cohetes; incluso para el uso en la construcción de cámaras de combustión donde los gases pueden alcanzar 3.500 K. La Agena motor de la etapa superior se utilizó un diseño de aluminio regenerativa enfriado para algunas partes de la boquilla, incluida la región térmicamente crítico garganta.
Otra aleación de algún valor es bronce de aluminio (Cu-Al aleación).
Historia

Los antiguos griegos y romanos utilizaron sales de aluminio como mordientes de tintura y como astringentes para curar las heridas; alumbre todavía se utiliza como una astringente. En 1761, Guyton de Morveau sugirió llamar a la alumina alumbre base. En 1808, Humphry Davy identificó la existencia de una base de metal de alumbre, que en un principio denominado alumium y aluminio más tarde (ver sección etimología , más adelante).
El metal fue producido por primera vez en 1825 en una forma impura por danesa físico y químico Hans Christian Oersted. Reaccionó anhidro cloruro de aluminio con potasio amalgama, produciendo un trozo de metal que mira similar al estaño. Friedrich Wöhler era consciente de estos experimentos y los citó, pero después de rehacer los experimentos de Oersted, concluyó que este metal era puro potasio. Se llevó a cabo un experimento similar en 1827 mediante la mezcla de cloruro de aluminio anhidro con el potasio y el aluminio producido. Wöhler se acredita generalmente con aislamiento de aluminio ( Latina alumen, alumbre), sino también orsted se pueden enumerar como su descubridor. Además, Pierre Berthier descubrió aluminio en el mineral de bauxita y se extrajo con éxito. Francés Henri Etienne Sainte-Claire Deville mejoró el método de Wöhler en 1846, y describió sus mejoras en un libro en 1859, el principal de los cuales es la sustitución de sodio para el potasio considerablemente más caro. Deville probable que también concibió la idea de la electrólisis de óxido de aluminio disuelto en criolita; Charles Martin Hall y Paul Héroult podría haber desarrollado el proceso más práctico después de Deville.
Antes de Proceso Hall-Héroult fue desarrollado a finales de 1880, el aluminio era extremadamente difícil de extraer de sus diversos minerales. Esto hizo que el aluminio puro más valioso que el oro. Barras de aluminio fueron exhibidas en la Exposición Universal de 1855. Napoleón III de Francia es conocido por haber dado un banquete donde los invitados más destacados recibieron utensilios de aluminio, mientras que el resto hizo hacer con el oro.
De aluminio fue seleccionado como el material que se utilizará para la piedra angular 100 oz (2,8 kg) de la Monumento a Washington en 1884, un momento en que uno onza (30 gramos) cuesta el salario diario de un trabajador común en el proyecto. El toque final, que se estableció en el lugar el 6 de diciembre de 1884, en una ceremonia de dedicación elaborado, fue el más grande de una sola pieza de aluminio fundido en el momento, cuando el aluminio era tan caro como la plata.
La Cowles empresas suministran aleación de aluminio en cantidad en el Estados Unidos e Inglaterra usando fundiciones como el horno de Carl Wilhelm Siemens por 1.886. Charles Martin Hall de Ohio en los EE.UU. y Paul Héroult de Francia desarrolló independientemente del Hall-Héroult proceso electrolítico que hizo la extracción de aluminio a partir de los minerales más baratos y ahora es el principal método utilizado en todo el mundo. Proceso de Hall, en 1888 con el respaldo financiero de Alfred E. Hunt, comenzó la Pittsburgh Reduction Company hoy conocido como Alcoa.Proceso de Héroult estaba en producción en 1889 enSuizaen aluminio Industrie, ahoraAlcan, y alBritish Aluminium, ahoraLuxfer Group y Alcoa, por 1896 enEscocia.
En 1895, el metal estaba siendo utilizado como material de construcción tan lejanos comoSydney, Australia en la cúpula del edificio de la Secretaría General.
Muchos armadas han utilizado una lata de aluminio superestructura por sus buques; el fuego 1975 a bordo de USS Belknap que destripó su superestructura de aluminio, así como la observación de daño de batalla a los buques británicos durante la Guerra de las Malvinas, llevó a muchas marinas de conmutación a todos de acero superestructuras. La Arleigh Burke clase fue el primer barco estadounidense, construyéndose en su totalidad de acero.
De alambre de aluminio una vez fue ampliamente utilizado para el cableado eléctrico doméstico. Debido a fallos de corrosión inducida-, un número de incendios como resultado.
Etimología
Dos variantes del nombre del metal son de uso corriente, de aluminio y de aluminio (además de la obsoleta alumium ). La Unión Internacional de Química Pura y Aplicada (IUPAC) adoptó el aluminio como el nombre de la norma internacional para el elemento en 1990, pero tres años más tarde, reconoció de aluminio como una variante aceptable. De ahí su tabla periódica incluye tanto. IUPAC prefiere el uso de aluminio en sus publicaciones internas, aunque casi como muchas publicaciones de la IUPAC utilizan la ortografía de aluminio .
La mayoría de los países utilizan la ortografía de aluminio . En los Estados Unidos, la ortografía de aluminio predomina. La Canadiense Diccionario Oxford prefiere aluminio , mientras que el australiano Macquarie Diccionario prefiere aluminio . En 1926, la Sociedad Americana de Química decidió oficialmente de utilizar aluminio en sus publicaciones; Diccionarios americanos suelen etiquetar la ortografía de aluminio como una variante británica.
El nombre de aluminio se deriva de su estatus como una base de alumbre. Es tomado de francés antiguo; su fuente última, Alumen , a su vez es una América palabra que literalmente significa "sal amarga".
La primera cita que figura en el Diccionario Inglés de Oxford para cualquier palabra que se usa como un nombre para este elemento es alumium , que el químico e inventor británico Humphry Davy empleó en 1808 para el metal que estaba tratando de aislar electrolíticamente a partir del mineral de alúmina . La cita es a partir de las revistas Philosophical Transactions de la Royal Society de Londres : "Si hubiera sido tan afortunados como para haber obtenido más ciertas evidencias sobre este tema, y de haber adquirido las sustancias metálicas que estuve en busca de, debería haber propuesto para ellas los nombres de silicio, alumium, circonio, y glucium ".
Davy se posó en aluminio para el momento en que publicó su libro de 1812 Química Filosofía : "Esta sustancia parece contener un metal raro, pero hasta ahora Aluminio no se ha obtenido en un estado perfectamente libre, aunque las aleaciones del mismo con otras sustancias MetalLine han sido adquiridos suficientemente distintos para indicar la naturaleza probable de alúmina ". Pero ese mismo año, un colaborador anónimo al Quarterly Review, una revista político-literaria británica, en una reseña del libro de Davy, se opuso a aluminio y propuso el nombre de aluminio ", por lo que tomaremos la libertad de escribir la palabra, en preferencia al aluminio, que tiene un sonido menos clásica ".
El -ium sufijo se ajustaba a la precedente establecido en otros elementos recién descubiertos de la época: el potasio, sodio, magnesio, calcio y estroncio (todos los cuales Davy aisló). Sin embargo, -um ortografía para los elementos no eran desconocidos en el momento, como por ejemplo platino , conocido por los europeos desde el siglo 16, el molibdeno , descubierto en 1778, y el tantalio , descubierto en 1802. El -um sufijo es consistente con la ortografía universales alúmina para el óxido, como lantana es el óxido de lantano y magnesia, óxido de cerio, y óxido de torio son los óxidos de magnesio , cerio , y torio respectivamente.
La ortografía utilizada en todo el siglo 19 por la mayoría de los químicos estadounidenses era de aluminio , pero el uso común es menos clara. El aluminio ortografía se utiliza en el Diccionario de 1828. Webster En su panfleto de publicidad para su nuevo método electrolítico de producir el metal de 1892, Charles Martin Hall utilizó el -um ortografía, a pesar de su constante uso de la -ium ortografía en todas las patentes que presentado entre 1886 y 1903. En consecuencia se ha sugerido que la ortografía refleja una más fácil de pronunciar palabras con una sílaba menos, o que la ortografía en el volante fue un error. La dominación del Salón de la producción del metal se aseguró de que la ortografía de aluminio se convirtió en la norma en América del Norte; el Diccionario Webster Unabridged de 1913, sin embargo, continuó utilizando el -ium versión.
Preocupaciones de salud
| NFPA 704 |
|---|
 0 0 0 |
| Diamante de fuego por un disparo de aluminio |
A pesar de su abundancia natural, el aluminio no tiene ninguna función conocida en biología. Es notablemente no tóxico, sulfato de aluminio que tiene una DL50 de 6207 mg / kg (oral, ratón), que corresponde a 500 gramos para una persona 80 kg. A pesar de la toxicidad aguda extremadamente baja, los efectos en la salud de aluminio son de interés en vista de la presencia generalizada del elemento en el medio ambiente y en el comercio.
Algunos de toxicidad se puede remontar a la deposición en los huesos y el sistema nervioso central, que se aumenta sobre todo en pacientes con función renal reducida. Debido a que el aluminio compite con el calcio para la absorción, una mayor cantidad de aluminio en la dieta pueden contribuir a la mineralización ósea reducida (osteopenia) observado en los bebés prematuros y recién nacidos con retraso en el crecimiento. En dosis muy altas, el aluminio puede causar neurotoxicidad, y está asociado con la función alterada de la barrera sangre-cerebro. Un pequeño porcentaje de personas son alérgicas al aluminio y la experiencia dermatitis de contacto, trastornos digestivos, vómitos u otros síntomas tras el contacto o la ingestión de productos que contengan aluminio, tales como desodorantes o antiácidos. En aquellos sin alergias, el aluminio no es tan tóxico como metales pesados, pero no hay pruebas de cierta toxicidad si se consume en cantidades excesivas. Aunque el uso de aluminio utensilios de cocina no se ha demostrado que conducen a la toxicidad del aluminio en general, el consumo excesivo de antiácidos que contienen compuestos de aluminio y el uso excesivo de antitranspirantes que contienen aluminio proporcionar niveles más significativos de exposición. Los estudios han demostrado que el consumo de alimentos ácidos o líquidos con aluminio aumenta significativamente la absorción de aluminio, y maltol se ha demostrado que aumenta la acumulación de aluminio en el tejido nervioso y óseo. Además, el aluminio aumenta relacionado con el estrógeno de la expresión génica en humanos células de cáncer de mama cultivadas en el laboratorio. Los efectos similares al estrógeno de estas sales han dado lugar a su clasificación como metalloestrogen.
Los efectos de aluminio en los antitranspirantes ha sido examinado en el transcurso de décadas con poca evidencia de irritación de la piel. Sin embargo, su aparición en los antitranspirantes, colorantes (tales como aluminio lago), y aditivos alimentarios es controvertido en algunos sectores. Aunque hay poca evidencia de que la exposición normal de aluminio presenta un riesgo para los adultos sanos, algunos estudios apuntan a los riesgos asociados con el aumento de la exposición al metal. Aluminio en los alimentos puede ser absorbido más de aluminio a partir de agua. Algunos investigadores han expresado preocupación de que el aluminio en los antitranspirantes puede aumentar el riesgo de cáncer de mama, y el aluminio polémica ha sido implicado como un factor en la enfermedad de Alzheimer . La Camelford suceso de contaminación por agua implicado un número de personas que consumen sulfato de aluminio. Las investigaciones sobre los efectos en la salud a largo plazo aún están en curso, pero las concentraciones de aluminio cerebro elevada han sido encontrados en las autopsias de las víctimas, y más investigación para determinar si existe un vínculo con la angiopatía amiloide cerebral ha sido el encargado.
De acuerdo con la Sociedad de Alzheimer, la opinión médica y científica es que los estudios no han demostrado de forma convincente una relación causal entre el aluminio y la enfermedad de Alzheimer. Sin embargo, algunos estudios, tales como los de la cohorte PAQUID, citan la exposición de aluminio como un factor de riesgo para la enfermedad de Alzheimer . Algunos Se han encontrado placas cerebrales para contener el aumento de los niveles de metal. La investigación en esta área ha sido concluyente; acumulación de aluminio puede ser una consecuencia de la enfermedad en lugar de un agente causal. En cualquier caso, si hay alguna toxicidad de aluminio, debe ser a través de un mecanismo muy específico, ya que la exposición humana total a el elemento en forma de arcilla de origen natural en el suelo y el polvo es enormemente grande durante toda la vida. El consenso científico no existe todavía sobre si la exposición de aluminio podría aumentar directamente el riesgo de enfermedad de Alzheimer.
Efecto sobre plantas
El aluminio es primordial entre los factores que reducen el crecimiento de las plantas en suelos ácidos. Aunque generalmente es inofensivo para el crecimiento de plantas en suelos de pH neutro, la concentración en suelos ácidos tóxicos de Al 3+ cationes aumenta y perturba el crecimiento y la función de raíz.
La mayoría de los suelos ácidos están saturados con aluminio en lugar de los iones de hidrógeno. Por consiguiente, la acidez del suelo es un resultado de la hidrólisis de compuestos de aluminio. Este concepto de "potencial de cal corregido" para definir el grado de saturación de bases en los suelos se convirtió en la base para los procedimientos que ahora se utilizan en los laboratorios de ensayo de suelo para determinar el " requisito de la cal "de los suelos.
Trigo 's adaptación para permitir la tolerancia de aluminio es tal que el aluminio induce una liberación de compuestos orgánicos que se unen a los de aluminio nocivos cationes . Sorgo se cree que tienen el mismo mecanismo de tolerancia. El primer gen para la tolerancia de aluminio ha sido identificado en el trigo. Se demostró que la tolerancia al aluminio de sorgo está controlada por un solo gen, como para el trigo. Este no es el caso en todas las plantas.


