
Dubnium
Acerca de este escuelas selección Wikipedia
Esta selección Escuelas fue originalmente elegido por SOS para las escuelas en el mundo en desarrollo que no tienen acceso a Internet. Está disponible como una descarga intranet. Apadrinar un niño para hacer una diferencia real.
| Dubnium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
105 Db | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| desconocido | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades generales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | dubnium, Db, 105 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pronunciación | / d U b n yo ə m / Doob -nee-əm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoría Elemento | metal de transición | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 5, 7, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atómico estándar | [268] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Rn ] 5f 14 6d 3 7s 2 (Valor de referencia) 2, 8, 18, 32, 32, 11, 2 (Valor de referencia)  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Historia | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Descubrimiento | Instituto Conjunto de Investigación Nuclear (1968) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido (prevista) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad (cerca rt) | 29 (valor de referencia) g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidación | 5, 4, 3 (valor de referencia) (Estados de oxidación sólo en negrita son conocidos experimentalmente) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energías de ionización ( más) | Primero: 664,8 (estimado) kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Segundo: 1546.7 (estimado) kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tercero: 2378.4 (estimado) kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico | 139 (estimado) pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 149 (estimado) pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelánea | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registro del CAS | 53850-35-4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de dubnium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dubnium es un elemento químico con el símbolo Db y número atómico 105, el nombre de la ciudad de Dubna en Rusia , donde fue producido por primera vez. Es un elemento sintético (un elemento que se puede crear en un laboratorio pero no se encuentra en la naturaleza) y radiactivos; la conocida más estable isótopo , dubnium-268, tiene una vida media de aproximadamente 28 horas.
En el tabla periódica de los elementos, es una elemento d-bloque y en el elementos transactínidos. Es un miembro de la Séptimo período y pertenece a la grupo de 5 elementos. Experimentos químicos han confirmado que dubnium comporta como el más pesado homólogo de tantalio en el grupo 5. Las propiedades químicas de dubnium se caracterizan sólo en parte. Son similares a las de otros grupos de 5 elementos.
En la década de 1960, cantidades microscópicas de dubnium fueron producidos en los laboratorios de la antigua Unión Soviética y en California . La prioridad del descubrimiento y por lo tanto el denominación del elemento se disputó entre los científicos soviéticos y americanos, y no fue hasta 1997 que Unión Internacional de Química Pura y Aplicada (IUPAC) estableció dubnium como el nombre oficial para el elemento.
Historia
Descubrimiento
Dubnium se informa descubrió por primera vez en 1968 en la Instituto Conjunto de Investigación Nuclear Dubna (entonces en la Unión Soviética ). Los investigadores no bombardearon un objetivo americio-243 con neón-22 iones . Se informó de un 9,40 MeV y una actividad alfa 9.70 MeV y se asignan las caries al isótopo 260 Db o 261 Db:
- 243
95 Am + 22
10 Ne → 265- x
105 Db + x n
Dos años más tarde, el equipo de Dubna separó sus productos de reacción mediante cromatografía de gradiente térmico después de la conversión de cloruros por la interacción con NbCl 5. El equipo identificó un 2,2 segundo actividad espontánea fisión contenida dentro de un cloruro volátil retratar propiedades eka-tantalio, probablemente dubnium-261 pentacloruro, 261 DbCl 5.
En el mismo año, un equipo dirigido por Albert Ghiorso trabajar en la Universidad de California, Berkeley concluyente sintetiza el elemento bombardeando un objetivo californio-249 con nitrógeno-15 iones. El equipo publicó una síntesis convincente de 260 dB en la reacción entre objetivo californio-249 y nitrógeno-15 iones y midió la desintegración alfa del 260 Db con una vida media de 1,6 segundos y una energía de desintegración de 9.10 MeV, en correlación con la decadencia hija de lawrencium -256:
- 249
98 Cf + 15
7 N → 260
105 Db + 4 n
Estos resultados de los científicos de Berkeley no confirmaron los soviéticos conclusiones relativas a la 9.40 MeV o 9.70 MeV desintegración alfa de dubnium-260, dejando sólo dubnium-261 como sea posible isótopo producido. En 1971, el equipo de Dubna repitió su reacción mediante una mejor puesta a punto y fueron capaces de confirmar los datos de la desintegración de 260 Db utilizando la reacción:
- 243
95 Am + 22
10 Ne → 260
105 Db + 5 n
En 1976, el equipo de Dubna continuó su estudio de la reacción mediante cromatografía de gradiente térmico y fueron capaces de identificar el producto como dubnium-260 pentabromuro, 260 DbBr 5.
En 1992, el IUPAC / IUPAP Grupo de Trabajo Transfermium evaluó las reclamaciones de los dos grupos y se llegó a la conclusión de que la confianza en el descubrimiento creció de resultados de ambos laboratorios y la afirmación del descubrimiento debe ser compartida.
Controversia Naming


El soviético, después de Rusia, el equipo propuso el nombre nielsbohrium (Ns) en honor del físico nuclear danés Niels Bohr . El equipo de Estados Unidos propuso que el nuevo elemento debe ser nombrado hahnio (Ha), en honor del fallecido alemán químico Otto Hahn. En consecuencia hahnio era el nombre que los científicos europeos más estadounidenses y occidentales utilizan y aparece en muchos artículos publicados en ese momento, y nielsbohrium se utilizó en la Unión Soviética y Países del Este.
Una elemento nombrar polémica se desató entre los dos grupos. La Unión Internacional de Química Pura y Aplicada (IUPAC) unnilpentium así adoptada (UNP) como temporal, Nombre de elemento sistemático. El intento de resolver el problema, en 1994, la IUPAC propuso el nombre joliotium (Jl), después de que el físico francés Frédéric Joliot-Curie, que fue propuesto originalmente por el equipo soviético para el elemento 102, más tarde nombrado nobelio . Los dos reclamos principales todavía no estaban de acuerdo sobre los nombres de los elementos 104-106. Sin embargo, en 1997 resolvieron la disputa y adoptó el nombre actual, dubnium (Db), después de que el ruso ciudad de Dubna, la ubicación de la Instituto Conjunto de Investigación Nuclear. Se argumentó por la IUPAC que el laboratorio de Berkeley ya había sido reconocida en varias ocasiones en la denominación de los elementos (es decir, el berkelio , californio , americio ) y que la aceptación de los nombres rutherfordio y seaborgio para los elementos 104 y 106 debe ser compensado por el reconocimiento de la contribuciones del equipo ruso al descubrimiento de los elementos 104, 105 y 106.
Propiedades químicas
Propiedades extrapolado
El elemento 105 se prevé que sea el tercer miembro de la serie 6d de metales de transición y el miembro más pesado del grupo V de la tabla periódica, por debajo de vanadio , niobio y tántalo . Debido a que está colocado justo debajo de tantalio, sino que también puede ser llamado eka-tantalio. Todos los miembros del grupo retratan fácilmente su estado de oxidación de 5 y el estado se vuelve más estable ya que el grupo es descendiente. Por lo tanto se espera dubnium para formar un 5 estado estable. Para este grupo, 4 y 3 estados también son conocidos por los miembros más pesados y dubnium también pueden formar estos estados de oxidación reducción.
En una extrapolación de las químicas de niobio y tántalo , dubnium debe reaccionar con el oxígeno para formar una pentóxido inerte, Db 2 O 5. En alcalino, la formación de un complejo de orthodubnate, DBO 3-
4, se espera. La reacción con los halógenos debe formar fácilmente los pentahaluros, DBX 5. Los pentachlorides de niobio y tantalio existen como sólidos volátiles o moléculas bipiramidales trigonales monoméricas en la fase de vapor. Por lo tanto, DbCl 5 se espera que sea un sólido volátil. Del mismo modo, el pentafluoruro, DBF 5, debe ser aún más volátil. La hidrólisis de los haluros se conoce para formar fácilmente los oxihalogenuros, MOX 3. Así, los haluros de DBX 5 deberían reaccionar con agua para formar dBox 3. La reacción con ión fluoruro es también bien conocido por los homólogos más ligeros y se espera dubnium para formar una gama de fluoro-complejos. En particular, la reacción del pentafluoruro con HF debe formar un ion hexafluorodubnate, DBF -
6. El exceso de fluoruro debe conducir a DBF 2-
7 y DbOF 2-
5. Si se retratan propiedades eka-tantalio, mayores concentraciones de fluoruro deben formar finalmente DBF 3-
8 desde NBF 3-
8 no se conoce.
Química Experimental
La química de dubnium se ha estudiado durante varios años utilizando thermochromatography gas. Los experimentos han estudiado las características de adsorción relativas de isótopos de niobio , tantalio y dubnium radioisótopos. Los resultados han indicado la formación de grupo típico 5 haluros y oxihaluros, a saber, DbCl 5, DbBr 5, DbOCl 3 y DbOBr 3. Los informes sobre estos primeros experimentos suelen referirse a Dubnium como hahnio.
| Fórmula | Nombres (s) |
|---|---|
| DbCl 5 | dubnium pentacloruro; dubnium (V) cloruro |
| DbBr 5 | dubnium pentabromuro; dubnium (V) bromuro |
| DbOCl 3 | oxicloruro dubnium; dubnium (V) óxido de tricloruro; dubnyl (V) cloruro de |
| DbOBr 3 | oxibromuro dubnium; dubnium óxido de tribromuro de (V); dubnyl (V) bromuro de |
Historia nucleosíntesis
Fusión fría
Esta sección se ocupa de la síntesis de núcleos de dubnium por las llamadas reacciones de fusión "en frío". Estos son procesos que crean núcleos compuestos a baja energía de excitación (~ 10 a 20 MeV, por lo tanto, "frío"), lo que lleva a una mayor probabilidad de supervivencia de la fisión. El núcleo excitado entonces decae al estado fundamental a través de la emisión de sólo uno o dos neutrones.
- 209 Bi (50 Ti, xn) 259-x Db (x = 1,2,3)
Los primeros intentos de sintetizar dubnium utilizando reacciones de fusión fría se llevaron a cabo en 1976 por el equipo de FLNR, Dubna usando la reacción anterior. Ellos fueron capaces de detectar un 5 s actividad espontánea de fisión (SF) que se asignan a 257 Db. Esta asignación fue posteriormente corregida a 258 Db. En 1981, el equipo de GSI estudió esta reacción utilizando la técnica mejorada de la correlación genética de padre-hija decae. Ellos fueron capaces de identificar positivamente 258 Db, el producto de la canal de la evaporación de neutrones 1n. En 1983, el equipo de Dubna volvió a examinar la reacción utilizando el método de identificación de un descendiente mediante separación química. Tuvieron éxito en la medición de alfa decae de descendientes conocidos de la cadena de desintegración que comienzan con 258 Db. Esto fue tomada como proporcionar alguna evidencia de la formación de núcleos dubnium. El equipo en el GSI volvió a examinar la reacción en 1985 y fueron capaces de detectar 10 átomos de 257 Db. Después de una importante actualización de sus instalaciones en 1993, en 2000 el equipo midió 120 desintegraciones de 257 Db, 16 desintegraciones de 256 dB y la decadencia de 258 dB en la medición de las funciones 1n, 2n y excitación 3n. Los datos recogidos para 257 Db permite un primer estudio espectroscópico de este isótopo e identificaron un isómero, 257m Db, y una primera determinación de una estructura de nivel de atenuación de 257 dB. La reacción se utiliza en estudios espectroscópicos de isótopos de mendelevio y einsteinium en 2003-2004.
- 209 Bi (49 Ti, xn) 258-x Db (x = 2?)
Esta reacción fue estudiada por Yuri Oganessian y el equipo en Dubna en 1983. Observaron un 2,6 s actividad SF asignado provisionalmente a 256 Db. Resultados posteriores sugieren una posible reasignación a 256 Rf, resultante de la ~ 30% rama CE en 256 dB.
- 209 Bi (48 Ti, xn) 257-x Db (x = 1?)
Esta reacción fue estudiada por Yuri Oganessian y el equipo en Dubna en 1983. Se observó actividad un 1,6 s con una rama alfa ~ 80% con un ~ 20% SF rama. La actividad fue asignado provisionalmente a 255 Db. Resultados posteriores sugieren una reasignación a 256 Db.
- 208 Pb (51 V, x n) 259-x Db (x = 1,2)
El equipo de Dubna también estudió esta reacción en 1976 y de nuevo fueron capaces de detectar la actividad del 5 s SF, primero asignado provisionalmente a 257 Db y más tarde a 258 Db. En 2006, el equipo de LBNL volvió a investigar esta reacción como parte de su programa de proyectil impar-Z. Ellos fueron capaces de detectar 258 dB y 257 dB en su medición de los canales de evaporación de neutrones 1n y 2n.
- 207 Pb (51 V, xn) 258-x Db
El equipo de Dubna estudió también esta reacción en 1976, pero esta vez no fueron capaces de detectar el 5 es la actividad SF, primero asignado provisionalmente a 257 Db y más tarde a 258 Db. En su lugar, ellos fueron capaces de medir la actividad SF un 1,5 s, asignado provisionalmente a 255 Db.
- 205 Tl (54 Cr, xn) 259-x Db (x = 1?)
El equipo de Dubna también estudió esta reacción en 1976 y de nuevo fueron capaces de detectar la actividad del 5 s SF, primero asignado provisionalmente a 257 Db y más tarde a 258 Db.
Fusión caliente
Esta sección se ocupa de la síntesis de núcleos de dubnium por las llamadas reacciones de fusión "calientes". Estos son procesos que crean núcleos compuestos de alta energía de excitación (~ 40 a 50 MeV, por lo tanto, "caliente"), lo que lleva a una reducción de la probabilidad de supervivencia de la fisión y cuasi-fisión. El núcleo excitado entonces decae al estado fundamental a través de la emisión de neutrones 3-5.
- 232 Th (31 P, x n) 263-x Db (x = 5)
Hay informes muy limitados que se estudió esta rara reacción utilizando un rayo P-31 en 1989 por Andreyev et al. en el FLNR. Una fuente sugiere que no hay átomos se detectaron, mientras que una fuente mejor de los rusos sí mismos indica que 258 Db se sintetizó en el canal 5n con un rendimiento de 120 pb.
- 238 U (27 Al, xn) 265-x Db (x = 4,5)
En 2006, como parte de su estudio sobre el uso de blancos de uranio en la síntesis elemento superpesado, el equipo dirigido por Ken LBNL Gregorich estudió las funciones de excitación para los canales 4n y 5n en esta nueva reacción.
- 236 U (27 Al, xn) 263-x Db (x = 5,6)
Esta reacción fue estudiada por primera vez por Andreyev et al. en el FLNR, Dubna en 1992. Ellos fueron capaces de observar 258 dB y 257 dB en los canales 5n y salida 6n con rendimientos de 450 pb y 75 pb, respectivamente.
- 243 Am (22 Ne, xn) 265-x Db (x = 5)
Los primeros intentos de sintetizar dubnium se realizaron en 1968 por el equipo en el Laboratorio Flerov de Reacciones Nucleares (FLNR) en Dubna, Rusia. Se observan dos líneas alfa que se asignan provisionalmente a 261 dB y 260 dB. Repitieron el experimento en 1970 en busca de fisión espontánea. Encontraron una actividad de 2,2 s SF que se asignan a 261 dB. En 1970, el equipo de Dubna comenzó a trabajar en el uso de thermochromatography gradiente para detectar dubnium en experimentos químicos como cloruro volátil. En su primera carrera que detectaron una actividad SF volátil con propiedades de adsorción similares a NbCl 5 ya diferencia HfCl4. Esto fue tomado para indicar la formación de núcleos de dvi-niobio como DbCl 5. En 1971, repitieron el experimento de química usando mayor sensibilidad y observaron alfa disminuye desde un componente DVI-niobio, llevado a confirmar la formación de 260 Db. El método se repitió en 1976 usando la formación de bromuros y obtuvo resultados casi idénticos, lo que indica la formación de una, DVI-niobio-como DbBr volátil 5.
- 241 Am (22 Ne, xn) 263-x Db (x = 4,5)
En 2000, los científicos chinos en el Instituto de Física Moderna (IMP), Lanzhou, anunciaron el descubrimiento del isótopo previamente desconocido 259 Db formado en el canal de la evaporación de neutrones 4n. También fueron capaces de confirmar las propiedades de desintegración de 258 Db.
- 248 cm (19 M, x n) 267-x Db (x = 4,5)
Esta reacción se estudió por primera vez en 1999 en el Instituto Paul Scherrer (PSI) para producir 262 Db para estudios químicos. A sólo 4 átomos se detectaron con una sección transversal de 260 pb. Los científicos japoneses en JAERI estudiaron la reacción adicional en 2002 y determinaron rendimientos para el isótopo 262 Db durante sus esfuerzos para estudiar la química acuosa de dubnium.
- 249 Bk (18 O, x n) 267-x Db (x = 4,5)
Después del descubrimiento de 260 Db por Albert Ghiorso en 1970 en la Universidad de California (UC), el mismo equipo continuó en 1971 con el descubrimiento del nuevo isótopo 262 Db. También observaron una sin asignar 25 s actividad SF, probablemente asociado con la rama SF ahora conocido de 263 Db. En 1990, un equipo dirigido por Kratz en LBNL definitivamente descubrió el nuevo isótopo 263 Db en el canal de la evaporación de neutrones 4n. Esta reacción ha sido utilizado por el mismo equipo en varias ocasiones con el fin de intentar confirmar una captura de electrones (CE) sucursal en 263 Db conduce a longevo 263 Rf (ver rutherfordio ).
- 249 Bk (16 O, x n) 265-x Db (x = 4)
Después del descubrimiento de 260 Db por Albert Ghiorso en 1970 en la Universidad de California (UC), el mismo equipo continuó en 1971 con el descubrimiento del nuevo isótopo 261 Db.
- 250 Cf (15 N, x n) 265-x Db (x = 4)
Después del descubrimiento de 260 Db por Ghiorso en 1970 en LBNL, el mismo equipo continuó en 1971 con el descubrimiento del nuevo isótopo 261 Db.
- 249 Cf (15 N, x n) 264-x Db (x = 4)
En 1970, el equipo en el Laboratorio Nacional Lawrence Berkeley (LBNL) estudió esta reacción y se identificó el isótopo 260 Db en su experimento descubrimiento. Utilizaron la técnica moderna de la correlación genética de padres e hija se desintegra para confirmar su asignación. En 1977, el equipo de Oak Ridge repitió el experimento y fueron capaces de confirmar el descubrimiento por la identificación de los rayos X K de la hija lawrencium .
- 254 Es (13 C, xn) 267-x Db
En 1988, los científicos como el Laboratorio Nacional Lawrence Livermore (LLNL) utilizan la reacción de fusión caliente asimétrica con un objetivo einsteinium-254 para buscar los nuevos nucleidos 264 dB y 263 dB. Debido a la baja sensibilidad del experimento causado por el pequeño objetivo Es-254, fueron incapaces de detectar cualquier residuo de evaporación (ER).
Decaimiento de nucleidos más pesados
Los isótopos de dubnium también se han identificado en la desintegración de elementos más pesados. Las observaciones hasta la fecha se resumen en la siguiente tabla:
| Residuo de evaporación | Isótopo dubnium observada |
|---|---|
| 294 Uus | 270 Db |
| 288 Uup | 268 Db |
| 287 Uup | 267 Db |
| 282 Uut | 266 Db |
| 267 Bh | 263 Db |
| 278 Uut, 266 Bh | 262 Db |
| 265 Bh | 261 Db |
| 272 Rg | 260 Db |
| 266 millones de toneladas, 262 Bh | 258 Db |
| 261 Bh | 257 Db |
| 260 Bh | 256 Db |
Isótopos
| Isótopo | Año descubierto | reacción descubrimiento |
|---|---|---|
| 256 Db | 1983 ?, 2000 | 209 Bi (50 Ti, 3n) |
| 257 Db g | 1985 | 209 Bi (Ti 50, 2n) |
| 257 Db m | 2000 | 209 Bi (Ti 50, 2n) |
| 258 Db | 1976 ?, 1981 | 209 Bi (50 Ti, n) |
| 259 Db | 2001 | 241 Am (22 Ne, 4n) |
| 260 Db | 1970 | 249 Cf (15 N, 4n) |
| 261 Db | 1971 | 249 Bk (16 O, 4n) |
| 262 Db | 1971 | 249 Bk (18 O, 5N) |
| 263 Db | 1971 ?, 1990 | 249 Bk (18 O, 4n) |
| 264 Db | desconocido | |
| 265 Db | desconocido | |
| 266 Db | 2006 | 237 Np (48 Ca, 3n) |
| 267 Db | 2003 | 243 Am (48 Ca, 4n) |
| 268 Db | 2003 | 243 Am (48 Ca, 3n) |
| 269 Db | desconocido | |
| 270 Db | 2009 | 249 Bk (48 Ca, 3n) |
Isomería
- 260 Db
Los datos recientes sobre la decadencia de 272 Rg ha puesto de manifiesto que algunas cadenas de desintegración continúan hasta 260 Db con extraordinarias largos tiempos de vida de lo esperado. Estos decaimientos se han relacionado con un nivel de descomposición de isómeros por desintegración alfa con una vida media de ~ 19 s. Se requiere investigación adicional para permitir una asignación definida.
- 258 Db
La evidencia de un estado de isómeros en 258 Db se ha recopilado a partir del estudio de la decadencia de 266 Mt y 262 Bh. Se ha observado que esos decaimientos asignados a una rama de captura de electrones (CE) tiene una vida media significativamente diferente a los descomposición por emisión alfa. Esto se ha llevado a sugerir la existencia de un estado de isómeros en descomposición por la CE, con una vida media de ~ 20 s. Se necesitan más estudios para confirmar esta asignación.
- 257 Db
Un estudio de la formación y descomposición de 257 Db ha probado la existencia de un estado de isómeros. Inicialmente, 257 Db fue llevado a la decadencia por emisión alfa con energías 9.16,9.07 y 8.97 MeV. Una medición de las correlaciones de estos decae con los de 253 Lr han demostrado que la decadencia 9,16 MeV pertenece a un isómero separado. El análisis de los datos en relación con la teoría han asignado esta actividad a un estado estable meta, 257m Db. El estado fundamental se desintegra por emisión alfa con energías 9.07 y 8.97 MeV. Fisión espontánea de 257m, g Db no fue confirmada en experimentos recientes.
Esquemas de nivel de decadencia espectroscópicas
- 257 Db
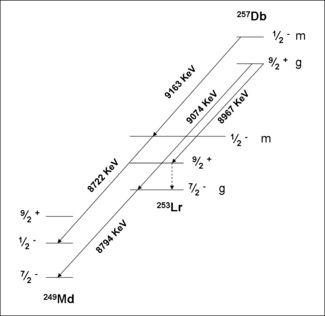
Isótopos retraídos
- 255 Db
En 1983, científicos de la Dubna llevó a cabo una serie de experimentos de apoyo en su búsqueda para el descubrimiento de Bohrium . En dos de estos experimentos, alegaron que habían detectado unos ~ 1,5 s actividad espontánea de la fisión de la reacciones 207 Pb (51 V, x n) y 209 Bi (48 Ti, xn). La actividad fue asignado a 255 Db. La investigación posterior sugirió que la asignación se debe cambiar a 256 Db. Como tal, el isótopo 255 Db actualmente no se reconoce en la carta de los radionucleidos y se necesita más investigación para confirmar este isótopo.

