
Francio
Acerca de este escuelas selección Wikipedia
Esta selección wikipedia ha sido elegido por los voluntarios que ayudan Infantil SOS de Wikipedia para esta Selección Wikipedia para las escuelas. Una rápida conexión para el apadrinamiento de niños es http://www.sponsor-a-child.org.uk/
| Francio | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
87 Fr | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Apariencia | ||||||||||||||||||||||||||||
| Desconocido, pero probablemente metálico | ||||||||||||||||||||||||||||
| Propiedades generales | ||||||||||||||||||||||||||||
| Nombre, símbolo, número | francio, Fr, 87 | |||||||||||||||||||||||||||
| Pronunciación | / F r æ n s yo ə m / FRAN -ver-əm | |||||||||||||||||||||||||||
| Categoría Elemento | de metal alcalino | |||||||||||||||||||||||||||
| Grupo, período, bloque | 1 (metales alcalinos) , 7, s | |||||||||||||||||||||||||||
| Peso atómico estándar | (223) | |||||||||||||||||||||||||||
| Configuración electrónica | [ Rn ] 7s 1 2, 8, 18, 32, 18, 8, 1 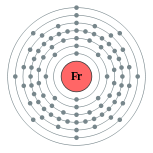 | |||||||||||||||||||||||||||
| Historia | ||||||||||||||||||||||||||||
| Descubrimiento | Marguerite Perey (1939) | |||||||||||||||||||||||||||
| Primer aislamiento | Marguerite Perey (1939) | |||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||
| Fase | sólido presumiblemente | |||||||||||||||||||||||||||
| Densidad (cerca rt) | ? 1,87 (extrapolado) g · cm -3 | |||||||||||||||||||||||||||
| Punto de fusion | ? 300 K ,? 27 ° C,? 80 ° F | |||||||||||||||||||||||||||
| Punto de ebullicion | ? 950 K,? 677 ° C,? 1250 ° F | |||||||||||||||||||||||||||
| Calor de fusión | ca. 2 kJ · mol -1 | |||||||||||||||||||||||||||
| El calor de vaporización | ca. 65 kJ · mol -1 | |||||||||||||||||||||||||||
| Presión de vapor (extrapolado) | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||
| Estados de oxidación | 1 (fuertemente óxido básico) | |||||||||||||||||||||||||||
| Electronegatividad | 0,7 (escala de Pauling) | |||||||||||||||||||||||||||
| Energías de ionización | Primero: 380 kJ · mol -1 | |||||||||||||||||||||||||||
| Radio covalente | 260 (extrapolado) pm | |||||||||||||||||||||||||||
| Van der Waals radio | 348 (extrapolado) pm | |||||||||||||||||||||||||||
| Miscelánea | ||||||||||||||||||||||||||||
| Estructura cristalina | centrada en el cuerpo cúbico (extrapolado) | |||||||||||||||||||||||||||
| Ordenamiento magnético | Paramagnético | |||||||||||||||||||||||||||
| La resistividad eléctrica | 3 μ (calculado) Ω · m | |||||||||||||||||||||||||||
| Conductividad térmica | 15 (extrapolado) W · m -1 · K -1 | |||||||||||||||||||||||||||
| Número de registro del CAS | 7440-73-5 | |||||||||||||||||||||||||||
| La mayoría de los isótopos estables | ||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de francio | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
El francio es un elemento químico con el símbolo Fr y número atómico 87. Era conocido como eka- cesio y actinio K. Es uno de los dos menos elementos electronegativos, el otro es de cesio . Francio es un altamente metal radiactivo que se desintegra en astato , radio y radón . Como un metal alcalino , tiene uno electrón de valencia.
Francio granel nunca se ha visto. Debido a la apariencia general de los otros elementos en su columna de la tabla periódica, se supone que francio aparecería como un metal altamente reflectante, si es lo suficientemente podrían ser recogidos juntos para ser visto como un sólido o líquido a granel. Sin embargo la preparación de una muestra de este tipo es imposible, ya que el calor extremo de la decadencia (la más larga vida media isotópica es sólo 22 minutos) se evaporaría inmediatamente cualquier cantidad visible del elemento.
El francio fue descubierto por Marguerite Perey en Francia (de la que el elemento toma su nombre) en 1939. Fue el último elemento descubierto en la naturaleza , en lugar de mediante síntesis. Fuera del laboratorio, francio es extremadamente rara, con trazas encontradas en uranio y torio minerales, donde el isótopo de francio-223 formas continuamente y se desintegra. Tan poco como existe 20-30 g (uno onzas) en un momento dado a lo largo de la corteza terrestre ; los otros isótopos son totalmente sintético. La cantidad más grande producida en el laboratorio era un grupo de más de 300 mil átomos.
Características
Francio es la más inestable de los elementos presentes en la naturaleza: su isótopo más estable, francio-223, tiene una vida media de sólo 22 minutos. En contraste, astato , el segundo menos estable elemento natural, tiene una vida media de 8,5 horas. Todos los isótopos de decaimiento francio en cualquiera astato, radio o el radón. Francio también es menos estable que todos los elementos sintéticos de hasta el elemento 105 .
Francio es un metal alcalino cuyas propiedades químicas mayoría parecerse a los de cesio . Un elemento pesado con una sola valencia de electrones, tiene el más alto peso equivalente de cualquier elemento. Francio-Si el líquido de una sustancia de este tipo se crease-debe tener una tensión superficial de 0,05092 N / m en su punto de fusión. Punto de fusión del francio se afirmó que había sido calculada en alrededor de 27 ° C (80 ° F, 300 K). Sin embargo, el punto de fusión es incierta debido a la rareza y la radiactividad extrema del elemento. Por lo tanto, el valor estimado punto de ebullición de 677 ° C (1250 ° F, 950 K) también es incierto.
Linus Pauling estima la electronegatividad del francio en el 0,7 en el Escala de Pauling, el mismo que el de cesio ; el valor para el cesio ya ha sido refinado a 0,79, aunque no hay datos experimentales que permitan un refinamiento de la relación calidad-francio. Francio tiene una ligeramente mayor energía de ionización de cesio, 392,811 (4) kJ / mol a diferencia de 375.7041 (2) kJ / mol para el cesio, como sería de esperar a partir de efectos relativistas, y esto implica que el cesio es el menos electronegativo de los dos.
Francio coprecipitados con varios de cesio sales, tales como perclorato de cesio, que da lugar a pequeñas cantidades de perclorato de francio. Esta coprecipitación se puede utilizar para aislar el francio, adaptando el método de coprecipitación de cesio radiactivo Glendenin y Nelson. Es, además, se coprecipitar con muchas otras sales de cesio, incluyendo el yodato, la picrato, el tartrato (también rubidio tartrato), el cloroplatinato, y el silicotungstate. También coprecipitados con ácido silicotúngstico, y con ácido perclórico, sin otro metal alcalino como una portadora, que proporciona otros métodos de separación. Casi todas las sales de francio son solubles en agua .
Aplicaciones
Debido a su inestabilidad y rareza, no hay aplicaciones comerciales para el francio. Se ha utilizado con fines de investigación en los campos de la biología y de la estructura atómica . Su uso como un potencial de ayuda de diagnóstico para varios tipos de cáncer también ha sido explorada, pero esta aplicación se ha considerado poco práctico.
La capacidad del francio a sintetizar, atrapado, y se enfría, junto con su relativamente sencilla estructura atómica han convertido en el tema de especializados espectroscopia experimentos. Estos experimentos han conducido a la información más específica sobre niveles de energía y la las constantes de acoplamiento entre partículas subatómicas. Los estudios sobre la luz emitida por francio-210 iones láser atrapados han proporcionado datos precisos sobre las transiciones entre niveles de energía atómica que son bastante similares a los predichos por la teoría cuántica .
Historia
Ya en 1870, los químicos pensaron que debería haber un metal alcalino más allá de cesio , con un número atómico de 87. Se refirió luego a por el nombre provisional eka-cesio. Los equipos de investigación intentaron localizar y aislar este elemento que falta, y se realizaron al menos cuatro reclamaciones falsas que se había encontrado el elemento antes de que se hizo un descubrimiento auténtico.
Descubrimientos erróneas e incompletas
Químico soviético DK Dobroserdov fue el primer científico que afirman haber encontrado eka-cesio o francio. En 1925, se observó la radiactividad débil en una muestra de potasio , otro metal alcalino, e incorrectamente concluyó que eka-cesio fue la contaminación de la muestra (la radiactividad de la muestra era en realidad el radioisótopo de potasio de origen natural, potasio-40). Luego publicó una tesis sobre sus predicciones de las propiedades del eka-cesio, en el que él nombró el elemento russium después de su país de origen. Poco después, Dobroserdov comenzó a centrarse en su carrera docente en el Instituto Politécnico de Odessa, y él no persiguió el elemento más.
El año siguiente, en inglés químicos Gerald JF Druce y Frederick H. Loring analizaron Fotografías de rayos X de manganeso (II) sulfato. Observaron líneas espectrales que se supone que son de eka-cesio. Ellos anunciaron su descubrimiento del elemento 87 y propusieron el nombre alkalinium, como lo sería el metal alcalino más pesado.
En 1930, Fred Allison del Alabama Instituto Politécnico afirmó haber descubierto el elemento 87 al analizar polucita y lepidolita usando su máquina magneto-óptico. Allison pidió que se le nombró virginium después de su estado natal, Virginia, junto con los símbolos Vi y Vm. En 1934, sin embargo, HG MacPherson de UC Berkeley refutó la eficacia del dispositivo de Allison y la validez de este falso descubrimiento.
En 1936, el físico rumano Horia Hulubei y su colega francés Yvette Cauchois también analizó polucita, esta vez usando su aparato de rayos X de alta resolución. Observaron varias líneas de emisión débiles, que se supone que son los de elemento 87. Hulubei y Cauchois informó su descubrimiento y propusieron el nombre moldavio, junto con el símbolo Ml, después Moldavia, la provincia rumana donde nació Hulubei. En 1937, el trabajo de Hulubei fue criticado por el físico estadounidense FH Hirsh Jr., quien rechazó los métodos de investigación de Hulubei. Hirsh estaba seguro de que el eka-cesio no se encuentra en la naturaleza, y que en su lugar había observado Hulubei mercurio o bismuto líneas de rayos X. Hulubei, sin embargo, insistió en que su aparato y los procedimientos de rayos X eran demasiado precisa para cometer semejante error. Debido a esto, Jean Baptiste Perrin, Ganador del Premio Nobel y mentor de Hulubei, moldavio avalado como el verdadero eka-cesio más Francio recientemente descubierto de Marguerite Perey. Perey, sin embargo, criticó continuamente el trabajo de Hulubei hasta que ella fue acreditado como el único descubridor del elemento 87.
Análisis de Perey
Eka-cesio fue descubierto en 1939 por Marguerite Perey del Instituto Curie en París, Francia , cuando purificó una muestra de actinio -227 que se había notificado a tener una energía de desintegración de 220 keV. Sin embargo, Perey advirtió partículas de desintegración con un nivel de energía inferior a 80 keV. Perey pensó esta actividad decadencia podría haber sido causado por un producto de la desintegración no identificados previamente, uno que fue separado durante la purificación, pero surgió de nuevo fuera de la pura 227 Ac. Varias pruebas eliminaron la posibilidad de que el elemento desconocido siendo torio , radio, plomo , bismuto o talio . Los nuevos productos exhibidos propiedades químicas de un metal alcalino (como coprecipitación con sales de cesio), lo que llevó Perey a creer que era el elemento 87, causada por la desintegración alfa del 227 Ac. Perey intentó entonces determinar la proporción de desintegración beta de desintegración alfa en 227 Ac. Su primera prueba puso el alfa de ramificación en el 0,6%, una cifra que luego revisó al 1%.
Perey nombró el nuevo isótopo del actinio-K (que ahora se conoce como francio-223) y en 1946, propuso el nombre catium para su elemento recién descubierto, ya que creía que era la más electropositivo de cationes de los elementos. Irène Joliot-Curie, uno de los supervisores de Perey, se opuso el nombre debido a su connotación de gato en lugar de cationes. Perey sugirió entonces francio, después de Francia. Este nombre fue adoptado oficialmente por el Unión Internacional de Química Pura y Aplicada en 1949, convirtiéndose en el segundo elemento después de galio para ser nombrado después de Francia. Se asignó el símbolo Fa, pero esta abreviatura fue revisado a la corriente Fr poco después. El francio fue el último elemento descubierto en la naturaleza, en lugar de sintetizar, a raíz de renio en 1925. La investigación adicional en la estructura del francio se llevó a cabo, entre otros, Sylvain Lieberman y su equipo CERN en los años 1970 y 1980.
Aparición

Natural
Francio-223 es el resultado de la desintegración alfa del actinio-227 y se puede encontrar en cantidades traza en uranio y torio minerales . En una muestra dada de uranio, se estima que sólo un átomo de francio por cada 1 x 10 18 átomos de uranio. También se calcula que hay a lo sumo 30 g de francio en la corteza de la Tierra en cualquier momento.
Síntesis
Francio pueden ser sintetizados en la reacción nuclear:
- 197 Au + 18 O → 210 Fr + 5 n
Este proceso, desarrollado por Stony Brook Física, los rendimientos de francio isótopos con masas de 209, 210, y 211, que luego son aisladas por el trampa magneto-óptica (MOT). La tasa de producción de un isótopo particular depende de la energía del haz de oxígeno. Un 18 O haz de la Stony Brook LINAC crea 210 Fr en el objetivo de oro con la reacción nuclear 197 Au + 18 O → 210 Fr + 5n. La producción requiere algún tiempo para desarrollar y entender. Era esencial para operar el objetivo de oro muy cerca de su punto de fusión y para asegurarse de que su superficie estaba muy limpio. La reacción nuclear incrusta los átomos francio profunda en el objetivo de oro, y que debe ser eliminado de manera eficiente. Los átomos se difunden rápidamente a la superficie del objetivo de oro y se liberan en forma de iones; Sin embargo, esto no sucede todo el tiempo. Los iones francio se guían por las lentes electrostáticas hasta que aterrizan en una superficie de itrio caliente y se convierten en punto muerto de nuevo. El francio se inyecta entonces en una ampolla de vidrio. A vigas de campo y láser magnéticos se enfrían y se limitan los átomos. Aunque los átomos permanecen en la trampa por sólo unos 20 segundos antes de escapar (o en descomposición), un flujo constante de átomos de frescas sustituye a los que se perdieron, manteniendo el número de átomos atrapados más o menos constante para minuto o más. Inicialmente, alrededor de 1000 átomos de francio quedaron atrapados en el experimento. Este fue gradualmente mejorada y la configuración es capaz de atrapar más de 300.000 átomos neutros de francio un tiempo. Aunque se trata de átomos neutrales "metálicos" ("francio de metal"), se encuentran en un estado no consolidado gaseoso. Francio Suficiente es atrapado que una cámara de vídeo puede capturar la luz emitida por los átomos, ya que son fluorescentes. Los átomos aparecen como una esfera brillante alrededor de 1 milímetro de diámetro. Esta fue la primera vez que alguien había visto nunca francio. Los investigadores ahora pueden hacer mediciones muy sensibles de la luz emitida y absorbida por los átomos atrapados, proporcionando los primeros resultados experimentales en diversas transiciones entre niveles de energía atómica en francio. Mediciones iniciales muestran muy buen acuerdo entre los valores experimentales y cálculos basados en la teoría cuántica. Otros métodos de síntesis incluyen el bombardeo de radio con neutrones, y el bombardeo de torio con protones, deuterones o helio iones . Francio no ha, a partir de 2012, ha sintetizado en cantidades lo suficientemente grandes como para pesar.
Isótopos
Hay 34 isótopos conocidos de francio que van en masa atómica de 199 a 232. El francio tiene siete metaestable isómeros nucleares. El 223 y francio-221 son los únicos isótopos que ocurren en la naturaleza, aunque el primero es mucho más común.
Francio-223 es el isótopo más estable, con una vida media de 21,8 minutos, y es muy poco probable que un isótopo de francio con una vida media más larga nunca será descubierto o sintetizado. El 223 es el quinto producto del actinio serie de desintegración como el isótopo hijo de 227 Ac. El 223 se desintegra en el radio-223 por desintegración beta (1149 keV energía de desintegración), con un menor (0,006%) camino Alpha Decay a astato-219 (5,4 MeV energía de desintegración).
Francio-221 tiene una vida media de 4,8 minutos. Es el noveno producto de la neptunio serie de desintegración como un isótopo hijo de actinio-225. Francio-221 luego decae en astato-217 por desintegración alfa (energía de desintegración 6,457 MeV).
El menos estable isótopo estado fundamental es francio-215 con una vida media de 0,12 mS. (9.54 MeV Alpha Decay a astato-211): Su isómero metaestable, francio-215m, es aún menos estable, con una vida media de sólo 3,5 ns.


