
El gadolinio
Antecedentes
Esta selección Escuelas fue originalmente elegido por SOS para las escuelas en el mundo en desarrollo que no tienen acceso a Internet. Está disponible como una descarga intranet. SOS Children ha cuidado de niños en África durante cuarenta años. ¿Puedes ayudar a su trabajo en África ?
| El gadolinio | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
64 Di-s | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | |||||||||||||||||||||||||||||||||||||||||||||||||
blanco plateado  | |||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades generales | |||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | gadolinio, Di-s, 64 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Pronunciación | / ˌ ɡ æ d ə l ɪ n yo ə m / GAD -ə- LIN -ee-əm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Categoría Elemento | lantánidos | ||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | n / a, 6, F | ||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atómico estándar | 157.25 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Xe ] 4f 7 5d 1 6s 2 2, 8, 18, 25, 9, 2 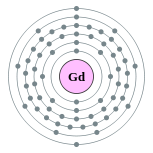 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Historia | |||||||||||||||||||||||||||||||||||||||||||||||||
| Descubrimiento | Jean Charles Galissard de Marignac (1880) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Primer aislamiento | Lecoq de Boisbaudran (1886) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad (cerca rt) | 7,90 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Líquido densidad en mp | 7.4 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusion | 1585 K , 1312 ° C, 2394 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullicion | 3546 K, 3273 ° C, 5923 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusión | 10.05 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| El calor de vaporización | 301.3 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidad calorífica molar | 37.03 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Presión de vapor (calculados) | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | |||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidación | 1, 2, 3 (medianamente óxido básico) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 1,20 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Energías de ionización | Primero: 593.4 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Segundo: 1170 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Tercero: 1990 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico | 180 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 196 ± 18:00 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelánea | |||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | hexagonal compacta | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamiento magnético | ferromagnético / paramagnético transición a 293,4 K | ||||||||||||||||||||||||||||||||||||||||||||||||
| La resistividad eléctrica | ( rt) (α, poli) 1,310 μΩ · m | ||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 10.6 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Expansión térmica | (100 ° C, α, poli) 9,4 m / (m · K) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido (varilla delgada) | (20 ° C) 2680 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| El módulo de Young | (Forma α) 54,8 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de corte | (Forma α) 21,8 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de volumen | (Forma α) 37,9 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Relación de Poisson | (Forma α) 0,259 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Vickers | 570 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registro del CAS | 7440-54-2 | ||||||||||||||||||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | |||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de gadolinio | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
El gadolinio es un elemento químico con el símbolo de Di-s y número atómico 64. Es un color blanco plateado, maleable y dúctil metales de las tierras raras. Se encuentra en la naturaleza sólo en forma combinada (sal). El gadolinio se detectó por primera espectroscópicamente en 1880 por de Marignac que separa su óxido y se le atribuye su descubrimiento. Se llama así por gadolinita, uno de los minerales en el que se encontró, a su vez el nombre de químico Johan Gadolin. El metal fue aislado por Paul Emile Lecoq de Boisbaudran en 1886.
El gadolinio de metal posee inusuales metalúrgicos propiedades, en la medida en que tan poco como 1% de gadolinio puede mejorar significativamente la trabajabilidad y la resistencia a alta temperatura oxidación de hierro , cromo , y relacionado aleaciones. El gadolinio como un metal o sal tiene excepcionalmente alta absorción de neutrones y por lo tanto se utiliza para el blindaje de neutrones en la radiografía y en reactores nucleares. Como la mayoría de las tierras raras, el gadolinio forma trivalentes iones que tienen propiedades fluorescentes. Por lo tanto, Gd (III) sales se han utilizado como fósforos verdes en diversas aplicaciones.
El ión Gd (III) se produce en sales solubles en agua es muy tóxico para los mamíferos. Sin embargo, Gd (III) compuestos quelados son mucho menos tóxicos debido a que llevan Gd (III) a través de los riñones y fuera del cuerpo antes de que el ion libre puede ser liberado en los tejidos. Debido a su propiedades paramagnéticas, soluciones de quelato orgánico gadolinio complejos se utilizan como administrado por vía intravenosa RM agentes de contraste basados en gadolinio en medicina imagen de resonancia magnética. Sin embargo, en una pequeña minoría de pacientes con insuficiencia renal, por lo menos cuatro de tales agentes se han asociado con el desarrollo de la enfermedad inflamatoria nodular rara La fibrosis sistémica nefrogénica. Esto se cree que es debido a la gadolinio de iones en sí, ya que las moléculas portadoras Gd (III) asociados con la enfermedad difieren.
Características

Propiedades físicas
El gadolinio es un blanco plateado maleable y dúctil metales de las tierras raras. Se cristaliza en hexagonal, primer embalado forma α- a temperatura ambiente, pero, cuando se calienta a temperaturas superiores a 1235 ° C, se transforma en su forma β-, que tiene una centrada en el cuerpo estructura cúbica.
El gadolinio-157 tiene el mayor neutrones térmicos capturar sección transversal entre los nucleidos estables: 259000 graneros. Sólo xenon-135 tiene una sección transversal superior, 2 millones de graneros, pero que isótopo es inestable.
El gadolinio es ferromagnético a temperaturas inferiores a 20 ° C (68 ° F) y es fuertemente paramagnético encima de esta temperatura. El gadolinio demuestra una efecto magnetocalórico por lo que su temperatura aumenta cuando entra en un campo magnético y disminuye cuando se sale del campo magnético. La temperatura bajó a (5 ° C (41 ° F)) para el gadolinio aleación de Gd 85 Er 15, y el efecto es considerablemente más fuerte para la aleación Gd 5 ( Si 2 Ge 2), pero a una temperatura mucho más baja (<85 K (-188,2 ° C; -306.7 ° F)).
Individuales átomos de gadolinio se han aislado por encapsulación de los mismos en moléculas de fullereno y visualizado con microscopio electrónico de transmisión. Individuales átomos de Di-s y pequeños racimos Gd también se han incorporado en nanotubos de carbono.
Propiedades químicas
El gadolinio se combina con la mayoría de los elementos para formar derivados de Gd (III). nitrógeno, carbono, azufre, fósforo, boro, selenio, silicio y arsénico a temperaturas elevadas, la formación de compuestos binarios.
A diferencia de otros elementos de tierras raras, el gadolinio metálico es relativamente estable en el aire seco. Sin embargo, empaña rápidamente en aire húmedo, formando un libremente adherirse gadolinio (III) óxido (Gd 2 O 3), que astillas, exponiendo más superficie a la oxidación.
- 4 Gd + 3 O 2 → 2 Gd 2 O 3
El gadolinio es un fuerte agente, lo que reduce los óxidos de varios metales en sus elementos reductores. El gadolinio es muy electropositivo y reacciona lentamente con el agua fría y bastante rápidamente con agua caliente para formar hidróxido de gadolinio:
- 2 Gd + 6 H 2 O → 2 Di-s (OH) 3 + 3 H 2
El gadolinio de metal es atacado fácilmente por diluida de ácido sulfúrico para formar soluciones que contienen la incoloro Gd (III) iones, que existe como [Gd (OH 2) 9] 3+ complejos:
- 2 Gd + 3 H 2 SO 4 + 18 H 2 O → 2 [Gd (H 2 O) 9] 3+ + 3 SO 4 2 + 3 H 2
El gadolinio de metal reacciona con los halógenos (x 2) a temperatura alrededor de 200 ° C:
- 2 Gd + 3 X 2 → 2 GDX 3
Los compuestos químicos
En la gran mayoría de sus compuestos, Gd adopta el estado de oxidación +3. Se conocen los cuatro trihaluros. Todos son blanco excepto para el yoduro, que es amarillo. Lo más comúnmente encontrado de los haluros se gadolinio (III) cloruro (GdCl 3). El óxido se disuelve en ácidos para dar las sales, tales como nitrato de gadolinio (III).
El gadolinio (III), como la mayoría de los iones lantánidos, formas complejos con alto números de coordinación. Esta tendencia se ilustra por el uso del agente quelante DOTA, un octa ligando dentado. Las sales de [Gd (DOTA)] - son útiles en imagen de resonancia magnética. Una variedad de complejos de quelatos relacionados se han desarrollado, incluyendo gadodiamide.
Reducción de compuestos de gadolinio se conocen, especialmente en el estado sólido. Gadolinio (II) haluros se obtienen por calentamiento de Gd (III) en presencia de haluros metálicos Gd en recipientes de tantalio. El gadolinio también forman sesquicloruro de Gd 2 Cl 3, que se puede reducir aún más a GdCl por recocido a 800 ° C. Este gadolinio (I) de cloruro de formularios plaquetas con estructura de tipo grafito en capas.
Isótopos
Naturalmente gadolinio ocurra se compone de 6 estables isótopos , 154 Di-s, Di-s 155, 156 Di-s, Di-s 157, 158 y 160 Gd Gd, y 1 radioisótopo, 152 Di-s, con 158 Di-s es la más abundante (24,84% abundancia natural). El decaimiento beta doble predicho de 160 Di-s nunca se ha observado (el límite sólo inferior en su vida media de más de 1,3 × 10 21 años se ha establecido experimentalmente).
Veintinueve radioisótopos se han caracterizado, con ser más estable-alfa descomposición 152 Gd (de origen natural) con una vida media de 1,08 × 10 14 años, y 150 Gd con una vida media de 1,79 × 10 6 años. Todos los isótopos radiactivos restante tienen una vida media de menos de 74,7 años. La mayoría de ellos tiene una vida media de menos de 24,6 segundos. Isótopos de gadolinio tienen 4 metaestable isómeros, con el ser más estable 143m Di-s (T ½ = 110 segundos), 145 millones de Di-s (t ½ = 85 segundos) y 141m Di-s (T ½ = 24,5 segundos).
Isótopos con masas atómicas más bajo que el isótopo estable más abundante, 158 Di-s, principalmente a través de la descomposición captura de electrones a la UE ( europio ) isótopos. A mayores masas atómicas, la primaria modo de decaimiento es desintegración beta, y los productos primarios son Tb ( terbio ) isótopos.
Historia
El gadolinio se llama desde el mineral gadolinita, a su vez nombra para finlandés químico y geólogo Johan Gadolin. En 1880, Suiza químico Jean Charles de Marignac Galissard observó líneas espectroscópicas debido a gadolinio en muestras de gadolinita (que en realidad contiene relativamente poco gadolinio, pero lo suficiente para mostrar un espectro), y en el mineral separada cerite. Este último mineral resultó contener mucho más del elemento con la nueva línea espectral, y Jean Charles de Marignac Galissard finalmente separó un óxido mineral de cerite que se dio cuenta fue el óxido de este nuevo elemento. Nombró el óxido " gadolinia. "Porque se dio cuenta de que" gadolinia "fue el óxido de un nuevo elemento, se le atribuye el descubrimiento de gadolinio. Francés químico Paul Émile Lecoq de Boisbaudran realmente lleva a cabo la separación de metal gadolinio de gadolinia, en 1886.
Aparición
El gadolinio es un constituyente en muchos minerales tales como monacita y bastnäsite, que son óxidos. El metal es demasiado reactivo de existir de forma natural. Irónicamente, como se señaló anteriormente, el mineral gadolinita realidad contiene sólo trazas de Di-s. La abundancia en la corteza terrestre es de aproximadamente 6,2 mg / kg. Las principales zonas mineras son China, EE.UU., Brasil, Sri Lanka, India y Australia con reservas que se espera superar el millón de toneladas. La producción mundial de gadolinio puro es de aproximadamente 400 toneladas por año.
Producción
El gadolinio se produce tanto de monacita y bastnäsite.
- Minerales trituradas se extraen con clorhídrico o ácido sulfúrico , que convierte los óxidos insolubles en cloruros o sulfatos solubles.
- Los filtrados ácidos se neutralizan parcialmente con sosa cáustica a pH 3-4. El torio precipita en forma de su hidróxido y se retira.
- La solución restante se trata con oxalato de amonio para convertir tierras raras en su insoluble oxalatos. Los oxalatos se convierten en óxidos por calentamiento.
- Los óxidos se disuelven en ácido nítrico que excluye a uno de los componentes principales, de cerio , óxido de cuya es insoluble en HNO 3.
- La solución se trata con nitrato de magnesio para producir una mezcla cristalizado de sales dobles de gadolinio, samario y europio .
- Las sales se separan por cromatografía de intercambio iónico.
- Los iones de tierras raras se lavan a continuación selectivamente a cabo por el agente complejante adecuado.
El gadolinio metálico se obtiene de su óxido o sales calentando con calcio a 1450 ° C en atmósfera de argón. Esponja de gadolinio puede ser producido por la reducción de fundido GdCl 3 con un metal apropiado a temperaturas inferiores a 1312 ° C (punto de fusión Gd) en una presión reducida.
Aplicaciones
El gadolinio no tiene aplicaciones a gran escala, pero tiene una variedad de usos especializados.
El gadolinio tiene la sección transversal máxima de neutrones entre los nucleidos estables:. 61.000 graneros de 155 Di-s y 259.000 graneros para 157Gd 157 Di-s se ha utilizado para atacar los tumores en la terapia de neutrones. Este elemento es muy eficaz para su uso con radiografía de neutrones y en el blindaje de reactores nucleares. Se utiliza como una medida de apagado secundaria, emergencia en algunos reactores nucleares, en particular de la Tipo CANDU. El gadolinio también se utiliza en sistemas de propulsión marinos nucleares como un veneno consumible.
El gadolinio también posee inusuales metalúrgicos propiedades, con tan poco como 1% de gadolinio mejora de la trabajabilidad y la resistencia del hierro , cromo , y relacionado aleaciones a altas temperaturas y oxidación.
El gadolinio es paramagnético a temperatura ambiente, con una punto de Curie ferromagnético de 20 ° C. Iones paramagnéticos, tales como el gadolinio, se mueven de forma diferente dentro de un campo magnético. Este rasgo hace gadolinio útil para formación de imágenes por resonancia magnética (MRI). Soluciones de orgánica gadolinio complejos y compuestos de gadolinio se utilizan como intravenoso Agente de contraste de resonancia magnética para mejorar las imágenes en medicina imágenes por resonancia magnética y La angiografía por resonancia magnética (ARM) procedimientos. Magnevist es el ejemplo más extendido. Los nanotubos llenos de gadolinio, apodados "gadonanotubes," son 40 veces más efectivo que este agente de contraste de gadolinio tradicional. Una vez inyectado, agentes de contraste basados en gadolinio se acumulan en los tejidos anormales en el cerebro y el cuerpo. Esta acumulación proporciona un mayor contraste entre los tejidos normales y anormales, lo que permite a los médicos a localizar mejor los crecimientos de células poco comunes y tumores.
El gadolinio como un fósforo también se utiliza en otras imágenes. En Sistemas de rayos X, el gadolinio está contenido en la capa de fósforo, suspendido en una matriz de polímero en el detector. terbio - dopado oxisulfuro de gadolinio (Gd 2 O 2 S: Tb) en la capa de fósforo convierte los rayos X liberados de la fuente en luz. Este material emite luz verde a 540 nm debido a la presencia de Tb 3+, que es muy útil para mejorar la calidad de imagen. La conversión de la energía de Gd es de hasta 20%, lo que significa que una quinta parte de los rayos X en huelga la capa de fósforo puede ser convertida en fotones de luz. Oxiortosilicato gadolinio (Gd 2 SiO 5, GSO, por lo general dopado por 0,1-1% de Ce ) es un único cristal que se utiliza como una centelleador en imágenes médicas, tales como La tomografía por emisión de positrones o para la detección de neutrones.
Compuestos de gadolinio también se utilizan para hacer verde fósforos para el color TV tubos, y en la fabricación de discos compactos .
El gadolinio-153 se produce en un reactor nuclear de europio elemental o los objetivos de gadolinio enriquecidos. Tiene una vida media de 240 ± 10 días y emite radiación gamma con fuertes picos a 41 keV y 102 keV. Se utiliza en muchas aplicaciones de control de calidad, tales como fuentes de línea y los fantasmas de calibración, para asegurar que los sistemas de imagen de medicina nuclear funcionan correctamente y producen imágenes útiles de distribución de radioisótopos dentro del paciente. También se utiliza como una fuente de rayos gamma en las mediciones de absorción de rayos X o en medidores de densidad ósea para detección de osteoporosis, así como en el sistema de formación de imágenes de rayos X portátil Lixiscope.
El gadolinio se utiliza para hacer gadolinio granate de itrio (Di-s: Y 3 Al 5 O 12); tiene aplicaciones de microondas y se utiliza en la fabricación de diversos componentes ópticos y como material de sustrato para las películas magneto-óptico.
El gadolinio galio Garnet (GGG, Di-s 3 Ga 5 O 12) fue utilizado para los diamantes de imitación y para la computadora memoria de burbuja.
Papel biológico
El gadolinio tiene ninguna función biológica nativa conocida, pero sus compuestos se utilizan como herramientas de investigación en biomedicina. Compuestos Gd 3+ son componentes de Los agentes de contraste de MRI. Se utiliza en diferentes ion experimentos de electrofisiología de canales para bloquear canales de fuga de sodio y se extienden los canales iónicos activados.
Seguridad
Como un ion libre, se informó de gadolinio a menudo para ser altamente tóxicos, pero los agentes de contraste de MRI son compuestos quelados y se consideran lo suficientemente seguro para ser utilizado en la mayoría de las personas. Gadolinio iones libres de toxicidad en animales se debe a la interferencia con un número de procesos dependientes de los canales de calcio-ion. La dosis letal 50% es de aproximadamente 100-200 mg / kg. No hay toxicidad prolongados se han reportado después de la exposición a dosis bajas de iones de gadolinio. Los estudios de toxicidad en roedores, sin embargo muestran que la quelación de gadolinio (que también mejora su solubilidad) disminuye su toxicidad con respecto a la de iones libres por al menos un factor de 100 (es decir, la dosis letal para los quelatos de Gd-aumenta en 100 veces) . Se cree por lo tanto que la toxicidad clínica de agentes de contraste de Gd en los seres humanos dependerá de la fuerza del agente quelante; sin embargo, esta investigación todavía no está completa. Acerca de una docena de diferentes agentes de Gd quelado han sido aprobados como agentes de contraste de MRI de todo el mundo.
Los agentes de contraste de gadolinio MRI han resultado más seguro que los agentes de contraste yodados utilizados en radiografía de rayos X o tomografía computarizada. Las reacciones anafilactoides son raros, ocurre en aproximadamente desde 0,03 hasta 0,1%.
Aunque los agentes de gadolinio han demostrado ser útiles para los pacientes con insuficiencia renal, en pacientes con insuficiencia renal grave que requieren diálisis, existe el riesgo de una rara pero grave enfermedad, llamada fibrosis nefrogénica sistémica (NSF) o dermopatía fibrosante nefrogénica, que se ha relacionado con el uso de cuatro MRI agentes de contraste que contienen gadolinio. Los parece a la enfermedad escleromixedema y hasta cierto punto esclerodermia. Puede ocurrir meses después de contraste ha sido inyectado. Su asociación con gadolinio y no la molécula portadora se confirma por su ocurrencia en materiales de contraste de gadolinio en el que se lleva por muy diferentes moléculas portadoras.
Las actuales recomendaciones de la de Estados Unidos es que los pacientes de diálisis sólo deben recibir agentes de gadolinio cuando sea esencial y considerar la realización de un contraste yodado CT mejorado cuando sea factible. Si un contraste mejorado MRI se debe realizar en un paciente de diálisis, se recomienda que ciertos agentes de contraste de alto riesgo deben evitarse y que se considere una dosis más baja. El Colegio Americano de Radiología recomienda que contraste mejorado exámenes de resonancia magnética pueden realizar como de cerca antes de la diálisis como sea posible como medida de precaución, aunque esto no ha sido probado para reducir la probabilidad de desarrollar NSF.



