Glucosa
Acerca de este escuelas selección Wikipedia
Este contenido de Wikipedia ha sido seleccionada por SOS para su utilización en las escuelas de todo el mundo. ¿Quieres saber sobre el patrocinio? Ver www.sponsorachild.org.uk
| D -Glucosa | |
|---|---|
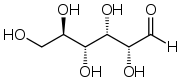 | |
 La glucosa C6H12O6 | |
Nombre IUPAC Preferida D-glucosa | |
(2 R, 3 S, 4 R, 5 R) 2,3,4,5,6-Pentahydroxyhexanal | |
Otros nombres Glicemia | |
| Identificadores | |
| Abreviaturas | Glc |
| CAS | 50-99-7 |
| PubChem | 5793 |
| Propiedades físicas | 5589 |
| UNII | 5SL0G7R0OK |
| Número CE | 200-075-1 |
| KEGG | C00031 |
| MeSH | Glucosa |
| ChEBI | CHEBI: 4167 |
| ChEMBL | CHEMBL1222250 |
| Número RTECS | LZ6600000 |
| Código ATC | B05 V04 CA02, V06 DC01 |
| Beilstein Referencia | 1281604 |
| Gmelin Referencia | 83256 |
| 3DMet | B04623 |
| Imágenes-Jmol 3D | Image 1 Image 2 |
SONRISAS
| |
InChI
| |
| Propiedades | |
| Fórmula molecular | C 6 H 12 O 6 |
| Masa molar | 180,16 g mol -1 |
| Apariencia | Polvo blanco |
| Densidad | 1,54 g / cm 3 |
| Punto de fusion | α- D-glucosa: 146 ° C |
| Solubilidad en agua | 91 g / 100 ml |
| Termoquímica | |
| Std entalpía de formación Δ f H | -1271 KJ / mol |
| Std entalpía de combustión Δ c H | -2805 KJ / mol |
| Molar estándar entropía S | 209.2 J K -1 mol -1 |
| Calor específico, C | |
| Peligros | |
| MSDS | ICSC 0865 |
| Índice de la UE | no enlistado |
| NFPA 704 |  1
0 0 |
Excepto cuando se indique lo contrario, los datos se den materiales en su condiciones normales (25 ° C, 100 kPa) | |
| Exenciones y referencias | |
La glucosa ( / ɡ l U k oʊ s / O / - k oʊ z /; C 6 H 12 O 6, también conocido como D-glucosa, dextrosa o azúcar de uva) es un simple monosacárido encuentra en las plantas. Es uno de los tres monosacáridos dietéticos, junto con fructosa y galactosa, que se absorbe directamente en el torrente sanguíneo durante la digestión. Un importante de hidratos de carbono en la biología , las células utilizan como la principal fuente de energía y un intermedio metabólico. La glucosa es uno de los principales productos de la fotosíntesis y combustibles para respiración celular. Existe glucosa en varias estructuras moleculares diferentes, pero todas estas estructuras se puede dividir en dos familias de imágenes especulares ( estereoisómeros). Sólo existe un conjunto de estos isómeros en la naturaleza, los derivados de la " forma de mano derecha "de la glucosa, denotado D-glucosa. -glucosa D se conoce como dextrosa a veces, aunque el uso de este nombre está totalmente desaconsejado. El término dextrosa se deriva de glucosa dextrógiro. Por tanto, este nombre es confuso cuando se aplica a la enantiómero, que gira la luz en la dirección opuesta. El almidón y la celulosa se polímeros derivados de la deshidratación de D-glucosa. El otro estereoisómero, llamado L-glucosa, casi nunca se encuentra en la naturaleza.
El nombre de "glucosa" viene del griego palabra glukus (γλυκύς), que significa "dulce". El sufijo " ose "denota un azúcar .
Función
¿Por qué la glucosa y no otro monosacárido tal como no se entiende claramente la fructosa-es tan ampliamente utilizado en los organismos. Una de las razones podría ser que la glucosa tiene una tendencia más baja, en relación con otros azúcares de hexosa, que reaccionan de forma no específica con los amino grupos de proteínas . Esta reacción ( glicación) reduce o destruye la función de muchos enzimas. La baja tasa de glicación es debido a la preferencia de la glucosa para el menos reactivo cíclico isómero. Sin embargo, muchas de las complicaciones a largo plazo de la diabetes (por ejemplo, la ceguera , insuficiencia renal, y neuropatía periférica) son probablemente debido a la glicación de las proteínas o lípidos. En contraste, la adición de enzimas reguladas de la glucosa a las proteínas por glicosilación es a menudo esencial para su función. Otra razón de por qué la glucosa es el más común de azúcar es que es la más estable conformacionalmente entre otras posibilidades.
Analito en la prueba de sangre médica
La glucosa es un médico común analito en muestras de sangre. Comer o en ayunas antes de tomar una muestra de sangre tiene un efecto sobre el resultado. Un alto nivel de glucosa en ayunas nivel de azúcar en la sangre puede ser un signo de prediabetes o diabetes mellitus .
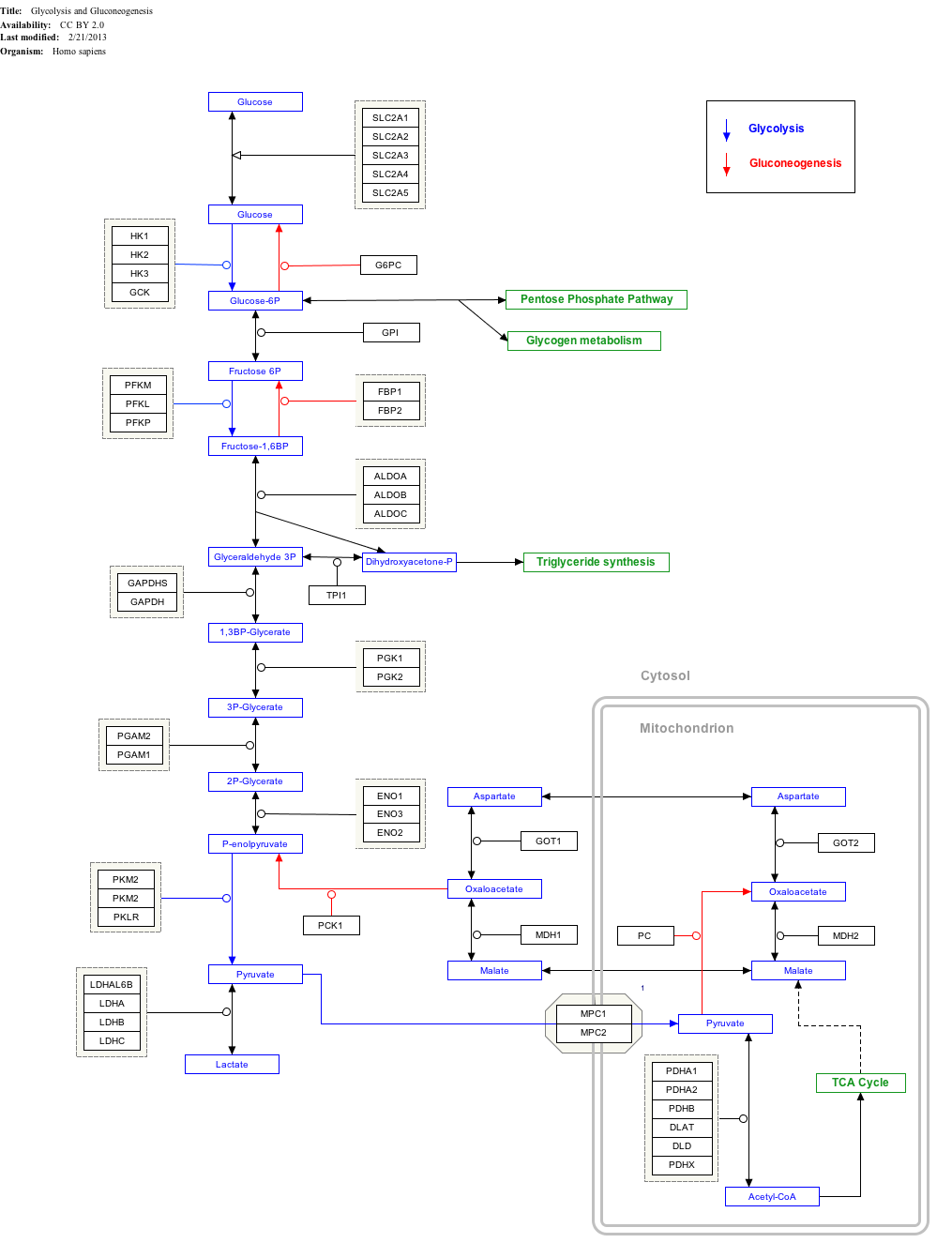
La glucólisis
| ||||||||||||||||||||
| Compuesto C00031 en KEGG Pathway base de datos. Enzima 2.7.1.1 en KEGG Pathway base de datos. Compuesto C00668 en KEGG Pathway base de datos. Reacción R01786 en Base de datos KEGG Pathway. | ||||||||||||||||||||
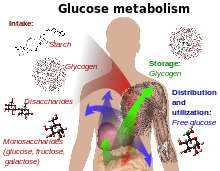
-Glucosa Compuestos que contienen y formas isoméricas son digeridos y absorbidos por el cuerpo en los intestinos, que incluye almidón, glucógeno, disacáridos y monosacáridos.
-Glucosa Se almacena en principalmente el hígado y los músculos en forma de glucógeno.
-Se Distribuidos y utilizados en tejidos como la glucosa libre.
El uso de la glucosa como fuente de energía en las células es a través de la respiración aeróbica o anaeróbica. Ambos empezar con los primeros pasos de la glucólisis vía metabólica. El primer paso de este es el la fosforilación de la glucosa por hexoquinasa para prepararlo para su desglose más tarde para proporcionar energía. La razón principal de la fosforilación inmediata de la glucosa por un hexoquinasa es para evitar la difusión fuera de la célula. La fosforilación añade un acusado grupo fosfato por lo que la glucosa 6-fosfato no puede cruzar fácilmente la membrana celular. Irreversible primeros pasos de una ruta metabólica son comunes a efectos de regulación.
En la respiración anaeróbica una molécula de glucosa produce una ganancia neta de dos moléculas de ATP (cuatro moléculas de ATP se producen durante la glucólisis pero dos son requeridos por las enzimas utilizadas durante el proceso). En la respiración aeróbica una molécula de glucosa es mucho más rentable que un patrimonio neto de 32 moléculas de ATP se genera (34 bruto con dos que se requiere en el proceso).
Haz clic en los genes, las proteínas y los metabolitos siguientes para vincular a los respectivos artículos.
- ^ El itinerario de ruta interactiva se puede editar en WikiPathways: "GlycolysisGluconeogenesis_WP534".
Precursor
Organismos utilizan glucosa como un precursor para la síntesis de varias sustancias importantes. Almidón, celulosa, y glucógeno ("almidón animal") son la glucosa común polímeros ( polisacáridos). Algunos de estos polímeros como el almidón o glucógeno sirven como reservas de energía mientras que otros como la celulosa y la quitina (que está hecho de un derivado de la glucosa) tiene funciones estructurales. Los oligosacáridos de glucosa combinados con otros azúcares sirven como importantes reservas de energía. Éstos incluyen lactosa, el azúcar predominante en la leche que un disacárido de glucosa-galactosa y sacarosa , otro disacárido de glucosa y fructosa. La glucosa también se añade a ciertas proteínas y lípidos en un proceso llamado glicosilación. Esto es a menudo crítico para su funcionamiento. Las enzimas que se unen a otras moléculas de glucosa suelen utilizar glucosa fosforilada para alimentar la formación del nuevo bono por la ruptura del enlace de glucosa-fosfato.
Aparte de su uso directo como un monómero, la glucosa se puede descomponer para sintetizar una amplia variedad de otras biomoléculas. Esto es importante como la glucosa sirve tanto como una tienda primaria de energía, sino también como una fuente de carbono orgánico. La glucosa se puede descomponer y se convierte en lípidos. También es un precursor para la síntesis de otras moléculas importantes como la vitamina C ( ácido ascórbico). Aunque las plantas y algunos microbios pueden crear todos los compuestos que necesitan de glucosa por los minerales necesarios, todos los animales y muchos microbios no pueden sintetizar algunos o
Estructura y nomenclatura
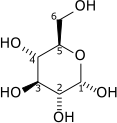
La glucosa es un monosacárido con la fórmula C 6 H 12 O 6 o H- (C = O) - (CHOH) 5 -H, cuyos cinco hidroxilo (OH) grupos se organizan de una manera específica a lo largo de su seis de carbono columna vertebral.
Forma de cadena abierta
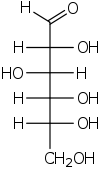
En su fugaz forma de cadena abierta, la molécula de glucosa tiene un abierto (en lugar de columna vertebral cíclica) y no ramificados de seis átomos de carbono, C-1 a C-6; donde C-1 es parte de una grupo aldehído H (C = O) -, y cada uno de los otros cinco carbonos lleva un grupo hidroxilo -OH. El restante lazos de los carbonos de cadena principal son satisfechas por hidrógeno átomos -H. Por lo tanto la glucosa es una hexosa y una aldosa reductasa, o una aldohexosa.
Cada uno de los cuatro carbonos C-2 a C-5 es una estereocentro, lo que significa que sus cuatro enlaces se conectan a cuatro sustituyentes diferentes. (Carbon C-2, por ejemplo, se conecta a - (C = O) H, -OH, -H, y - (CHOH) 4 H.) En -glucosa D, estas cuatro partes deben estar en una específica tridimensional arreglo. Es decir, cuando la molécula se dibuja en el Proyección de Fischer, los hidroxilos en C-2, C-4 y C-5 debe estar en el lado derecho, mientras que en C-3 debe estar en el lado izquierdo.
Las posiciones de los cuatro hidroxilos se invierten exactamente en el diagrama de Fischer . L-glucosa D - y L-glucosa son dos de los 16 posibles aldohexosas; los otros 14 son alosa, altrosa, manosa, gulosa, idosa, galactosa, y talosa, cada uno con dos enantiómeros, "D -" y "L -".
Formas cíclicas
En las soluciones, la forma de cadena abierta de la glucosa (ya sea "D -" o "L -") existe en equilibrio con varios isómeros cíclicos , conteniendo cada uno un anillo de átomos de carbono cerrados por un átomo de oxígeno. En solución acuosa sin embargo, más de 99% de moléculas de glucosa, en cualquier momento dado, existir como piranosa. La forma de cadena abierta está limitada a aproximadamente 0,25% y existe furanosa en cantidades insignificantes. Los términos "glucosa" y "D-glucosa" se utilizan generalmente para estas formas cíclicas así. El anillo surge de la forma de cadena abierta por una reacción de adición nucleófila entre el grupo aldehído - (C = O) H en C-1 y la -OH grupo hidroxilo en C-4 o C-5, produciendo una grupo hemiacetal -C (OH) HO-.
La reacción entre C-1 y C-5 crea una molécula con un anillo de seis miembros, llamado piranosa, después de que el éter cíclico piran, la molécula más simple con el mismo anillo de carbono-oxígeno. La reacción (mucho más raro) entre C-1 y C-4 crea una molécula con un anillo de cinco miembros, llamada furanosa, después de que el éter cíclico furano. En cualquier caso, cada carbono en el anillo tiene un hidrógeno y uno hidroxilo unido, a excepción de la última de carbono (C-4 o C-5), donde el hidroxilo se sustituye por el resto de la molécula abierto (que es - (C ( CH 2 OH) HOH) -H o - (CHOH) -H, respectivamente).
La reacción de cierre de anillo hace que el carbono C-1 quiral, también, ya que sus cuatro enlaces conducen a -H, -OH, con el carbono C-2, y al oxígeno del anillo. Estas cuatro partes de la molécula pueden estar dispuestas alrededor de C-1 (la anomérico de carbono) de dos maneras distintas, designado por los prefijos "α-" y "β-". Cuando una molécula de glucopiranosa se dibuja en el Proyección de Haworth, la designación "α-" significa que el grupo hidroxilo unido al C-1 y el grupo OH -CH 2 en C-5 mentiras en lados opuestos del plano del anillo (a disposición trans), mientras que "β-" significa que están en el mismo lado del plano (una disposición cis).
Por lo tanto, la de cadena abierta isómero D-glucosa da lugar a cuatro isómeros cíclicos distintas: -glucopyranose α- D, -glucopyranose β- D, D -glucofuranose α-, β- y -glucofuranose D; que son todos quiral.
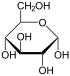 α- D - | 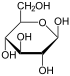 β- D - | 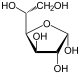 α- D - | 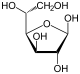 β- D - |
α- D -
Glucopyranose
β- D -
Glucopyranose
El otro de cadena abierta isómero L-glucosa de manera similar da lugar a cuatro formas cíclicas distintas de L-glucosa, cada imagen del espejo de la D -glucosa correspondiente.
Los anillos no son planas pero retorcido en tres dimensiones. El anillo de glucopiranosa (α o β) puede asumir varias formas no planas, análogo a la "silla" y conformaciones "barco" de ciclohexano. Del mismo modo, el anillo glucofuranosa puede asumir diversas formas, análogas a las conformaciones "sobre" de ciclopentano.
Las formas de glucopiranosa de glucosa predominan en solución, y son las únicas formas observadas en el estado sólido. Ellos son sólidos incoloros, cristalinos altamente solubles en agua y ácido acético , poco soluble en metanol y etanol . Se funden a 146 ° C (295 ° F) (α) y 150 ° C (302 ° F) (β), y se descomponen a temperaturas más altas en carbono y agua.
Isómeros rotacionales
Cada isómero de la glucosa está sujeta a isomería rotacional. Dentro de la forma cíclica de la glucosa, la rotación puede ocurrir alrededor del ángulo de torsión O6-C6-C5-O5, denominado ω -Angulo, para formar tres conformaciones escalonadas rotamer llamados gauche gauche - (gg), gauche - trans (gt) y trans - gauche (tg). Para metil α- D -glucopyranose en el equilibrio de la relación de moléculas en cada conformación rotámero se reporta como 57: 38: 5 gg: GT: tg. Esta tendencia para la -Angulo ω a prefieren adoptar una conformación gauche se atribuye a la efecto gauche.
Propiedades físicas
Soluciones

Todas las formas de la glucosa son incoloras y fácilmente soluble en agua, ácido acético , y varios otros disolventes. Ellos son sólo escasamente soluble en metanol y etanol .
La forma de cadena abierta es termodinámicamente inestable, y de forma espontánea isomeriza a las formas cíclicas. (A pesar de la reacción de cierre de anillo podría, en teoría, crear cuatro o de tres anillos de átomos, éstos serían muy tensas y no se observan.) En las soluciones a temperatura ambiente, los cuatro isómeros cíclicos interconvierten sobre una escala de tiempo de horas, en un proceso llamado mutarrotación. A partir de las proporciones, la mezcla converge relación estable de α: β 36:64. La relación sería α: β 11:89 si no fuera por la influencia de la efecto anomérico. Mutarrotación es considerablemente más lento a temperaturas cercanas a 0 ° C.
Mutarrotación consiste en una inversión temporal de la reacción de formación del anillo, lo que resulta en la forma de cadena abierta, seguida por una re-formación del anillo. La etapa de cierre del anillo puede utilizar un grupo -OH diferente a la que recreada por la etapa de apertura (conmutación así entre piranosa y furanosa formas), y / o el nuevo grupo hemiacetal creado en C-1 puede tener el mismo o diferente que el uso de las manos original (por lo tanto la conmutación entre la α y β formas). Así, aunque la forma de cadena abierta es apenas detectable en solución, es un componente esencial del equilibrio.
Estado sólido
Dependiendo de las condiciones, las tres principales formas sólidas de glucosa se pueden cristalizar a partir de soluciones de agua: α-glucopiranosa, β-glucopiranosa, y hidrato de β-glucopiranosa.
La actividad óptica
Ya sea en agua o en la forma sólida, D-glucosa es dextrógiro, lo que significa que girará la dirección de luz polarizada hacia la derecha. El efecto es debido a la quiralidad de las moléculas, y de hecho el isómero imagen especular, L-glucosa, se levógiro (gira la luz polarizada hacia la izquierda) en la misma cantidad. La fuerza del efecto es diferente para cada uno de los cinco tautómeros.
Tenga en cuenta que la D - prefijo no se refiere directamente a las propiedades ópticas del compuesto. Se indica que el centro quiral C-2 tiene la misma imparcialidad que el de D -glyceraldehyde (que fue tan marcada debido a que es dextrógiro). El hecho de que D-glucosa es dextrógiro es un efecto combinado de sus cuatro centros quirales, no sólo de C-2; y de hecho algunos de los demás -aldohexoses D son levógiro.
Producción
| Metabolismo de común monosacáridos y algunas de las reacciones bioquímicas de la glucosa |
|---|
 |

Biosíntesis
En las plantas y algunos procariotas, la glucosa es un producto de la fotosíntesis. En los animales y hongos, los resultados de glucosa de la descomposición de glucógeno, un proceso conocido como glucogenólisis. En las plantas el sustrato desglose es almidón.
En los animales, la glucosa se sintetiza en el hígado y riñones a partir de intermedios no carbohidratos, tales como piruvato, lactato y glicerol, por un proceso conocido como gluconeogénesis.
En algunas aguas profundas bacterias , la glucosa es producida por quimiosíntesis.
Comercial
La glucosa se produce comercialmente a través de la hidrólisis enzimática de almidón. Muchos cultivos pueden ser usados como la fuente de almidón. El maíz , arroz , trigo , yuca, hoja de maíz y sagú son todos utilizado en diversas partes del mundo. En el Estados Unidos , almidón de maíz (de maíz) se utiliza casi exclusivamente. La mayoría de glucosa comercial se produce como un componente de azúcar invertido, una mezcla aproximadamente 1: 1 de la glucosa y fructosa. En principio, la celulosa puede ser hidrolizada a glucosa, pero este proceso todavía no es comercialmente práctico.
Historia
Debido a que la glucosa es una necesidad básica de muchos organismos, una correcta comprensión de su composición química y la estructura contribuyó en gran medida a un avance general de la química orgánica. Este entendimiento se produjo en gran medida como resultado de las investigaciones de Emil Fischer, un químico alemán que recibió el 1902 Premio Nobel de Química , como resultado de sus hallazgos. La síntesis de la glucosa estableció la estructura de material orgánico y por lo tanto forma la primera validación definitiva de Las teorías de Jacobus Henricus van't Hoff de la cinética química y la disposición de los enlaces químicos en las moléculas que contienen carbono. Entre 1891 y 1894, Fischer estableció la configuración estereoquímica de todos los azúcares conocidos y predijo correctamente la posible isómeros, aplicando la teoría de los átomos de carbono asimétricos de van't Hoff.