
Holmium
Acerca de este escuelas selección Wikipedia
SOS ofrecen una descarga completa de esta selección de escuelas para su uso en escuelas intranets. ¿Quieres saber sobre el patrocinio? Ver www.sponsorachild.org.uk
| Holmium | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
67 Ho | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Apariencia | |||||||||||||||||||||||||||||||||||||
blanco plateado  | |||||||||||||||||||||||||||||||||||||
| Propiedades generales | |||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | holmio, Ho, 67 | ||||||||||||||||||||||||||||||||||||
| Pronunciación | / h oʊ l m yo ə m / HOHL -mee-əm | ||||||||||||||||||||||||||||||||||||
| Categoría Elemento | lantánidos | ||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | n / a, 6, F | ||||||||||||||||||||||||||||||||||||
| Peso atómico estándar | 164.93032 | ||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Xe ] 4f 11 6s 2 2, 8, 18, 29, 8, 2 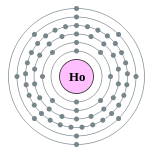 | ||||||||||||||||||||||||||||||||||||
| Historia | |||||||||||||||||||||||||||||||||||||
| Descubrimiento | Marc Delafontaine (1878) | ||||||||||||||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||||||||||
| Densidad (cerca rt) | 8,79 g · cm -3 | ||||||||||||||||||||||||||||||||||||
| Líquido densidad en mp | 8,34 g · cm -3 | ||||||||||||||||||||||||||||||||||||
| Punto de fusion | 1734 K , 1461 ° C, 2662 ° F | ||||||||||||||||||||||||||||||||||||
| Punto de ebullicion | 2993 K, 2720 ° C, 4928 ° F | ||||||||||||||||||||||||||||||||||||
| Calor de fusión | 17.0 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||
| El calor de vaporización | 265 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||
| Capacidad calorífica molar | 27.15 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||||||||
| Presión del vapor | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | |||||||||||||||||||||||||||||||||||||
| Estados de oxidación | 3, 2, 1 ( óxido básico) | ||||||||||||||||||||||||||||||||||||
| Electronegatividad | 1,23 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||
| Energías de ionización | Primero: 581.0 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||
| Segundo: 1140 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||
| Tercero: 2204 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||
| Radio atómico | 176 pm | ||||||||||||||||||||||||||||||||||||
| Radio covalente | 192 ± 19:00 | ||||||||||||||||||||||||||||||||||||
| Miscelánea | |||||||||||||||||||||||||||||||||||||
| Estructura cristalina | hexagonal compacta | ||||||||||||||||||||||||||||||||||||
| Ordenamiento magnético | paramagnético | ||||||||||||||||||||||||||||||||||||
| La resistividad eléctrica | ( rt) (poli) 814 nΩ · m | ||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 16.2 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||
| Expansión térmica | ( rt) (poli) 11,2 m / (m · K) | ||||||||||||||||||||||||||||||||||||
| Velocidad del sonido (varilla delgada) | (20 ° C) 2760 m · s -1 | ||||||||||||||||||||||||||||||||||||
| El módulo de Young | 64.8 GPa | ||||||||||||||||||||||||||||||||||||
| Módulo de corte | 26.3 GPa | ||||||||||||||||||||||||||||||||||||
| Módulo de volumen | 40.2 GPa | ||||||||||||||||||||||||||||||||||||
| Relación de Poisson | 0,231 | ||||||||||||||||||||||||||||||||||||
| Dureza Vickers | 481 MPa | ||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 746 MPa | ||||||||||||||||||||||||||||||||||||
| Número de registro del CAS | 7440-60-0 | ||||||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | |||||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de holmio | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
Holmio es un elemento químico con el símbolo de Ho y su número atómico 67. Parte de la serie de los lantánidos , holmio es un elemento de tierras raras. Holmio fue descubierto por el químico sueco Per Theodor Cleve. Su óxido fue aislado por primera vez a partir de minerales de tierras raras en 1878 y el elemento fue nombrado después de la ciudad de Estocolmo.
Holmio elemental es un blanco plateado relativamente suave y maleable de metal . Es demasiado reactivo que se encuentran sin combinar en la naturaleza, pero cuando se aísla, es relativamente estable en el aire seco a temperatura ambiente. Sin embargo, reacciona con el agua y se oxida fácilmente, y también se quema en el aire cuando se calienta.
Holmium se encuentra en los minerales monacita y gadolinita, y normalmente se extrae comercialmente de monacita utilizando técnicas de intercambio iónico. Sus compuestos en la naturaleza, y en casi la totalidad de su química de laboratorio, se trivalently oxidados, que contiene iones de Ho (III). Iones de holmio trivalente tienen propiedades fluorescentes similares a muchos otros iones de tierras raras (mientras produciendo su propio conjunto de líneas de emisión de luz únicos), y los iones de holmio son por lo tanto se utiliza de la misma manera como algunas otras tierras raras en ciertas aplicaciones de láser y colorante de vidrio.
Holmio tiene el mayor fuerza magnética de cualquier elemento y por lo tanto se utiliza para la piezas polares de los más fuertes estáticas imanes . Debido holmio absorbe fuertemente los neutrones, que también se utiliza en barras de control nuclear.
Características
Propiedades físicas

Holmio es un elemento relativamente blando y maleable que es bastante corrosión resistentes y estables en aire seco a temperatura y presión estándar. En el aire húmedo y a mayores temperaturas , sin embargo, rápidamente oxida, formando un óxido amarillento. En su forma pura, holmio posee una metálica, lustre plateado brillante.
Óxido de holmio tiene algunos cambios bastante drásticos de color en función de las condiciones de iluminación. Durante el día, es un color amarillo tannish. Bajo tricromática luz, es un rojo anaranjado ardiente, casi indistinguible de la aparición de óxido de erbio en las mismas condiciones de iluminación. El cambio está relacionado con las bandas de emisión nítidas de los iones trivalentes de estos elementos, en calidad de fósforos.
Holmio tiene el mayor momento magnético (10,6 μ
B) de cualquier elemento natural y posee otras propiedades magnéticas inusuales. Cuando se combina con itrio , forma altamente magnéticos compuestos. Holmium es paramagnético en condiciones ambientales, pero es ferromagnético a temperaturas por debajo de 19 K .
Propiedades químicas
De metal Holmium empaña lentamente en el aire y se quema fácilmente para formar holmio (III) óxido de:
- 4 Ho + 3 O 2 → 2 Ho 2 O 3
Holmium es muy electropositivo y en general es trivalente. Reacciona lentamente con agua fría y bastante rápidamente con agua caliente para formar hidróxido de holmio:
- 2 Ho (s) + 6 H2O (l) → 2 Ho (OH) 3 (ac) + 3 H 2 (g)
Holmium de metal reacciona con todos los halógenos:
- 2 Ho (s) + 3 F 2 (g) → 2 HoF 3 (s) [rosa]
- 2 Ho (s) + 3 Cl 2 (g) → 2 HOCl 3 (s) [amarilla]
- 2 Ho (s) + 3 Br 2 (g) → 2 HOBr 3 (s) [amarilla]
- 2 Ho (s) + 3 I 2 (g) → 2 Hoi 3 (s) [amarilla]
Holmium se disuelve fácilmente en diluida de ácido sulfúrico para formar soluciones que contienen los Ho (III) iones amarillas, que existen como un [Ho (OH 2) 9] 3+ complejos:
- 2 Ho (s) + 3 H 2 SO 4 (ac) → 2 Ho 3+ (ac) + 3 SO 2-
4 (aq) + 3 H 2 (g)
Estado de oxidación más común de holmio es 3. Holmium en solución es en forma de Ho 3+ rodeado por nueve moléculas de agua. Holmium se disuelve en los ácidos.
Isótopos
Natural holmio contiene uno estable isótopo , holmio-165. Algunos isótopos radiactivos sintéticos son conocidos; el más estable es holmio-163, con una vida media de 4.570 años. Todos los otros radioisótopos tienen la mitad del estado fundamental no vive superior a 1,117 días, y la mayoría tienen una vida media de 3 horas. Sin embargo, el metaestable 166 m1 Ho tiene una vida media de alrededor de 1.200 años, debido a su alta giro. Este hecho, combinado con una alta energía de excitación que resulta en una particularmente rico espectro de decaimiento los rayos gamma producidos cuando los de-excita estado metaestable, hace que este isótopo útil en física nuclear experimentos como un medio para calibrar las respuestas de energía y la eficiencia intrínsecas de espectrómetros de rayos gamma.
Historia
Holmium (Holmia, América nombre para Estocolmo ) fue descubierto por Marc Delafontaine y Jacques-Louis Soret en 1878 que se percató de la aberrante espectrográfico bandas de absorción del elemento entonces desconocido (lo llaman "Elemento X"). Más tarde, en 1878, Per Teodor Cleve descubrió independientemente el elemento mientras se encontraba trabajando en erbia tierra ( óxido de erbio).
Usando el método desarrollado por Carl Gustaf Mosander, Cleve elimina primero todos los contaminantes conocidos de erbia. El resultado de ese esfuerzo era dos nuevos materiales, uno marrón y verde. Llamó a la Holmia sustancia marrón (después del nombre latino de la ciudad de Cleve casa, Estocolmo) y el verde thulia. Holmia fue encontrado más tarde a ser el óxido de holmio y thulia fue óxido de tulio. En el papel clásico de Henry Moseley en números atómicos, holmio fue asignado un número atómico de 66. Evidentemente, la preparación de holmio que le habían dado para investigar habían sido groseramente impuro, dominado por disprosio vecino (sin trama y). Habría visto las líneas de emisión de rayos x para ambos elementos, pero por supuesto que los dominantes pertenecían a holmio, en lugar de la impureza disprosio.
Ocurrencia y producción

Como el resto de las tierras raras, holmio no se encuentra de forma natural como elemento libre. Esto ocurre combina con otros elementos en gadolinita, monacita, y otros minerales de tierras raras. Las principales zonas mineras son de China , Estados Unidos , Brasil , India , Sri Lanka y Australia con reservas de holmio estimados 400.000 toneladas.
Holmium constituye 1,4 partes por millón de la corteza terrestre en peso. Esto hace que sea el elemento más abundante en la 56a corteza terrestre. Holmium constituye el 1 parte por millón de los suelos , 400 partes por cuatrillón de agua de mar , y casi ninguno de la atmósfera de la tierra . Holmium es raro que un lantánidos. Se compone de 500 partes por billón del universo en peso.
Se extrae comercialmente a través de de intercambio iónico de la arena monacita (0,05% de holmio), pero todavía es difícil de separar de otras tierras raras. El elemento se ha aislado a través de la reducción de su anhidro cloruro o fluoruro metálico con calcio . Su abundancia estimada en la Tierra corteza 's es de 1,3 mg / kg. Holmium obedece a la Oddo-Harkins regla: como un elemento de número impar, es menos abundante que su inmediata de número par vecinos, disprosio y erbio . Sin embargo, es el más abundante de los pesados impares lantánidos . La fuente de corriente principales son algunas de las arcillas de iones de adsorción del sur de China. Algunos de estos tienen una composición de tierras raras similar a la encontrada en . xenotima o gadolinita itrio constituye las dos terceras partes del total en peso; holmio es de alrededor de 1.5%. Los mismos minerales originales son muy magra, tal vez sólo el 0,1% de los lantánidos total, pero se extraen fácilmente. Holmium es relativamente barato para un metal de tierras raras con el precio de alrededor de US $ 1000 por kg.
Aplicaciones

Holmio tiene la fuerza magnética más alta de cualquier elemento, y por lo tanto se utiliza para crear el más fuerte generada artificialmente campos magnéticos, cuando se coloca dentro de imanes de alta resistencia como una pieza de polo magnético (también llamado concentrador de flujo magnético). Dado que puede absorber neutrones de fisión de raza nucleares, sino que también se usa en barras de control nucleares.
Holmium se utiliza en itrio de hierro - granate (YIG) - y itrio lantano -fluoride (YLF) láseres de estado sólido encuentran en equipos de microondas (que a su vez se encuentra en una variedad de entornos médicos y dentales). Láseres de holmio emiten a 2,08 micrómetros, y por lo tanto son seguros para los ojos. Se utilizan en aplicaciones médicas, dentales y de fibra óptica.
Holmium es uno de los colorantes utilizados para zirconia cúbica y de vidrio , proporcionando coloración amarilla o roja. De vidrio que contiene soluciones de óxido de óxido de holmio y holmio (por lo general en ácido perclórico) tiene picos de absorción óptica agudos en el rango espectral 200-900 nm. Por lo tanto, se utilizan como un estándar de calibración para espectrofotómetros ópticos y están disponibles comercialmente.
Los radiactivos de vida larga pero Ho-166 m1 (ver "isótopos" arriba) es utilizado en la calibración de los espectrómetros de rayos gamma.
Papel biológico
Holmium no juega ningún papel biológico en los seres humanos , pero sus sales son capaces de estimular metabolismo. Los seres humanos suelen consumir alrededor de un miligramo de holmio un año. Las plantas no tome fácilmente el holmio del suelo. Algunas verduras han tenido mide su contenido holmio, y que ascendía a 100 partes por billón.
Toxicidad
Grandes cantidades de holmiium sales pueden causar graves daños si inhalado, consumido por vía oral, o inyectada. No se conocen los efectos biológicos de holmio durante un largo período de tiempo. Holmio tiene un bajo nivel de toxicidad aguda.

