
Yodo
Sabías ...
SOS Children ha intentado que el contenido de Wikipedia más accesible por esta selección escuelas. patrocinio SOS Niño es cool!
| Yodo | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
53 I | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | |||||||||||||||||||||||||||||||||||||||||||||||||
lustroso color gris metalizado, violeta en forma de gas  | |||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades generales | |||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | yodo, I, 53 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Pronunciación | / aɪ . ə d aɪ n / OJO -ə-din, / aɪ . ə d ɨ n / OJO -ə-dən, o / aɪ . ə d yo n / OJO -ə-din | ||||||||||||||||||||||||||||||||||||||||||||||||
| Categoría Elemento | halógeno | ||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 17 (halógenos) , 5, p | ||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atómico estándar | 126.90447 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Kr ] 4d 10 5s 2 5p 5 2, 8, 18, 18, 7 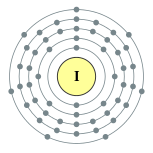 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Historia | |||||||||||||||||||||||||||||||||||||||||||||||||
| Descubrimiento | Bernard Courtois (1811) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Primer aislamiento | Bernard Courtois (1811) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad (cerca rt) | 4,933 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusion | 386,85 K , 113,7 ° C, 236,66 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullicion | 457,4 K, 184,3 ° C, 363,7 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||
| Punto Triple | 386,65 K (113 ° C), 12.1 kPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Punto crítico | 819 K, 11,7 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusión | (I 2) 15,52 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| El calor de vaporización | (I 2) 41,57 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidad calorífica molar | (I 2) 54,44 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Presión de vapor (romboidal) | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | |||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidación | 7, 5, 3, 1, -1 (Fuertemente ácida óxido) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 2,66 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Energías de ionización | Primero: 1008,4 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Segundo: 1845,9 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Tercero: 3180 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico | 140 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 139 ± 15:00 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radio | 198 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelánea | |||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | ortorrómbica  | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamiento magnético | diamagnético | ||||||||||||||||||||||||||||||||||||||||||||||||
| La resistividad eléctrica | (0 ° C) de 1,3 × 10 7 Ω · m | ||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 0,449 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de volumen | 7,7 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registro del CAS | 7553-56-2 | ||||||||||||||||||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | |||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de yodo | |||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||
El yodo es un elemento químico con el símbolo I y número atómico 53. El nombre es de griegos ioeidēs ἰοειδής, significando violeta o púrpura, debido al color de vapor de yodo elemental.
El yodo y sus compuestos se utilizan principalmente en la nutrición , e industrialmente en la producción de ácido acético y cierta polímeros. Número atómico relativamente alto de yodo, bajo toxicidad, y la facilidad de apego a los compuestos orgánicos se han convertido en una parte de muchos Materiales de contraste de rayos X en la medicina moderna. El yodo tiene sólo un isótopo estable . Un número de yodo radioisótopos también se utilizan en aplicaciones médicas.
El yodo se encuentra en la Tierra principalmente como el soluble en agua altamente ion yoduro, I -, que se concentra en los océanos y las piscinas de salmuera. Al igual que los otros halógenos , yodo libre se produce principalmente como molécula diatómica I 2, y luego sólo momentáneamente después de ser oxidada de yoduro por un oxidante como el oxígeno libre. En el universo y en la Tierra, el número atómico elevado de yodo hace que sea relativamente elemento raro. Sin embargo, su presencia en el agua de mar se ha dado un papel en la biología. Es el más pesado elemento esencial utilizado ampliamente por la vida en las funciones biológicas (sólo de tungsteno , empleado en enzimas por unas pocas especies de bacterias, es más pesado). Rareza de yodo en muchos suelos, debido a la baja abundancia inicial como un elemento de la corteza, y también la lixiviación de yoduro soluble por el agua de lluvia, ha dado lugar a muchos problemas de deficiencia en los animales terrestres y las poblaciones humanas del interior. La deficiencia de yodo afecta a cerca de dos mil millones de personas y es la principal causa prevenible de discapacidad intelectual.
El yodo es requerido por los animales superiores, que lo utilizan para sintetizar hormonas tiroideas, que contengan el elemento. Debido a esta función, radioisótopos de yodo se concentran en el glándula tiroides junto con yodo radioactivo. Si se inhala, el radioisótopo yodo-131, que tiene un alto fisión rendimiento del producto, se concentra en la tiroides, pero es fácil de remediar con yoduro de potasio tratamiento.
Características
El yodo bajo condiciones normales es un azul-negro sólido. Se puede ver aparentemente sublimando a temperaturas normales en un gas violeta-rosa que tiene un olor irritante. Esta halógeno forma compuestos con muchos elementos, pero es menos reactivos que los otros miembros de su Grupo VII (halógenos) y tiene un poco de luz metálica reflectancia.

El yodo elemental se disuelve fácilmente en la mayoría de los orgánicos disolventes tales como hexano o cloroformo debido a su falta de polaridad, pero es sólo ligeramente soluble en agua. Sin embargo, la solubilidad del yodo elemental en agua se puede aumentar mediante la adición de yoduro de potasio . El yodo molecular reacciona reversiblemente con el ion negativo, la generación de la anión triyoduro I 3 - en equilibrio , que es soluble en agua. Esta es también la formulación de algunos tipos de medicinal (antiséptico) de yodo, aunque tintura de yodo se disuelve clásicamente el elemento acuoso en etanol .
El yodo se funde a la temperatura relativamente baja de 113,7 ° C, aunque el líquido es a menudo oscurecida por un vapor violeta densa de yodo gaseoso.
El yodo en la fase gaseosa es de color violeta, esto es debido a ciertas longitudes de onda de la luz visible absorbida cuando una transición electrónica de la π * MO ocupado más alto a la desocupado más bajo σ * MO en la molécula se produce. Cuando se disuelve el yodo en disolventes polares que son disolventes fuertes donantes, tales como cetonas , éteres , piridina, la formación de complejo de transferencia de carga lleva a la modificación de la brecha de energía entre los dos orbitales moleculares, así diferentes longitudes de onda se absorbe y yodo tiene un color diferente en disolventes con diferente polaridad.
Soluciones de yodo en disolventes fuertes donantes, tales como acetona , tetrahidrofurano, piridina aparece de color marrón o amarillo (λ max = 460-480 nm), mientras que en disolventes de los donantes más débiles tales como diclorometano aparece de color rojo carmesí, en hidrocarburos aromáticos tales como benceno y tolueno aparece de color rosa o marrón rojizo. En disolventes no polares, tales como hexano, sin complejos de transferencia de carga está formada, y la solución aparece violeta (λ max = 520-540 nm), ya que la brecha de energía en I 2 en disolventes no polares es esencialmente la misma que en la fase de gas. Cuando una solución de color pardo de yodo en un disolvente donante fuerte se calienta, se observa una transición de color de marrón a violeta como el complejo de transferencia de carga débilmente unido se disocia en al disolvente y yodo moléculas libres.
Complejos de transferencia de carga también se pueden formar entre el yodo y un ión de metal, en el que los electrones en el π lleno * orbitales de moléculas de yodo fueron donados a los 5 años, de baja altitud vacías y 5d orbitales, por su parte retrodonación del metal se produce, lo que debilita y alarga el vínculo I-I. Un ejemplo es [AgI 2] [SbF 6], donde existe una cadena polimérica del complejo de transferencia de carga [(AgI 2) n] n + en el compuesto.

Aparición
El yodo es rara en el sistema solar y la corteza terrestre (47-60th en abundancia); sin embargo, sales de yoduro son a menudo muy soluble en agua. El yodo se produce en ligeramente mayor concentraciones en el agua de mar que en rocas, 0,05 vs 0,04 ppm. Los minerales que contienen yodo incluyen caliche, que se encuentra en Chile . El marrón algas Laminaria y Fucus encuentra en las zonas templadas del hemisferio norte contienen 0,028 a 0,454 por ciento en peso seco de yodo. Aparte de tungsteno , el yodo es el elemento más pesado que es esencial en los organismos vivos. Acerca de 19000 toneladas se producen anualmente a partir de fuentes naturales.
Organoyodos son producidos por formas de vida marina, el ser más notable yodometano (comúnmente llamado yoduro de metilo). Acerca de 214 kilotoneladas / año de yodometano es producido por el medio marino, por la actividad microbiana en los arrozales y por la quema de material biológico. El yodometano volátil se divide en la atmósfera como parte de un ciclo de yodo global.
Estructura y unión
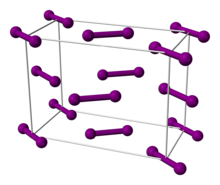

El yodo normalmente existe como una molécula diatómica con un II longitud de enlace de 270 pm, en uno de los enlaces sencillos más largas conocidas. Las I 2 moléculas tienden a interactuar a través de los débiles van der Waals fuerzas llaman la Las fuerzas de dispersión de London, y esta interacción es responsable del punto de fusión más alto en comparación con los halógenos más compactos, que son también diatómico. Dado que el tamaño atómico de yodo es mayor, su punto de fusión es mayor. El sólido cristaliza como cristales ortorrómbicos. El motivo de cristal en el Notación de Hermann-Mauguin es CMCA (n ° 64), Pearson símbolo OS8. El bono II es relativamente débil, con una bond energía de disociación de 36 kcal / mol, y la mayoría de los bonos a yodo son más débiles que los haluros más ligeros. Una consecuencia de esta unión débil es la tendencia relativamente alta de I 2 moléculas disociarse en yodo atómico.
Producción
De los varios lugares en los que el yodo se produce en la naturaleza, sólo dos fuentes son comercialmente útil: el caliche, que se encuentra en Chile , y las salmueras que contienen yodo de yacimientos de gas y petróleo, sobre todo en Japón y Estados Unidos. El caliche contiene nitrato de sodio, que es el producto principal de las actividades mineras, y pequeñas cantidades de yodato de sodio y yoduro de sodio. En la extracción de nitrato de sodio, el yodato de sodio y yoduro de sodio se extraen. La alta concentración de yodo en el caliche y la extensa minería hizo Chile el mayor productor de yodo en 2007.
La mayoría de los otros productores utilizan salmuera natural que ocurre para la producción de yodo. El japonés Minami Kanto campo de gas al este de Tokio y el americano Campo de gas de la Cuenca de Anadarko en el noroeste Oklahoma son las dos mayores fuentes de yodo de salmuera. La salmuera tiene una temperatura de más de 60 ° C debido a la profundidad de la fuente. La salmuera es primero purificada y se acidifica utilizando ácido sulfúrico , a continuación, la presente yoduro se oxida al yodo con cloro . Una solución de yodo se produce, pero es diluido y debe concentró. Aire es soplado en la solución, haciendo que el yodo para Evaporar, a continuación, se pasa a una torre de absorción que contiene ácido donde el dióxido de azufre se añade a reducir el yodo. La yoduro de hidrógeno (HI) se hace reaccionar con cloro para precipitar el yodo. Después de la filtración y purificación del yodo está lleno.
- 2 HI + Cl 2 → I 2 ↑ + 2 HCl
- I 2 + 2 H2O + SO2 → 2 HI + H 2 SO 4
- 2 HI + Cl 2 → I 2 ↓ + 2 HCl
La producción de yodo del agua de mar a través de la electrólisis no se utiliza debido a la abundancia suficiente de salmuera ricos en yodo. Otra fuente de yodo es kelp, utilizado en los siglos 18 y 19, pero ya no es económicamente viable.
Muestras comerciales a menudo contienen altas concentraciones de impurezas, que pueden eliminarse por sublimación. El elemento también se puede preparar en una forma ultra-puro a través de la reacción del yoduro de potasio con cobre (II) sulfato , lo que da de cobre (II) de yoduro inicialmente. Que se descompone espontáneamente a de cobre (I) yoduro y yodo:
- Cu 2+ + 2 I - → CuI 2
- 2 CuI 2 → 2 CuI + I 2
Hay también otros métodos de aislamiento de este elemento en el laboratorio, por ejemplo, el método usado para aislar otros halógenos: oxidación del yoduro en yoduro de hidrógeno (a menudo hecha in situ con un yoduro y ácido sulfúrico) por dióxido de manganeso (véase más adelante en la química descriptiva).
Los isótopos y sus aplicaciones
De los 37 conocidos (caracterizados) isótopos de yodo, sólo uno, 127 I, es estable.
El radioisótopo de más larga vida, 129 I, tiene una vida media de 15,7 millones de años. Este es el tiempo suficiente para que sea un elemento permanente del medio ambiente en las escalas de tiempo humanas, pero demasiado corto para que exista como isótopo primordial hoy en día. En lugar de ello, yodo-129 es una radionúclido extinto, y su presencia en el sistema solar primitivo se infiere de la observación de un exceso de su hija xenon-129. Este nucleido también está recién hecha por los rayos cósmicos y como un subproducto de la fisión nuclear humano, que se utiliza para supervisar como una muy larga vida contaminante ambiental.
El siguiente más larga vida de radioisótopos, yodo-125, tiene una vida media de 59 días. Se utiliza como una etiqueta conveniente gamma-emisores para las proteínas en ensayos biológicos, y unos pocos pruebas de imágenes de medicina nuclear donde se requiere una vida media más larga. También se utiliza comúnmente en braquiterapia implantado cápsulas, que matan los tumores de corto alcance local, la radiación gamma (pero donde el isótopo nunca se libera en el cuerpo).
El yodo-123 (vida media 13 horas) es el isótopo de elección para imagen de medicina nuclear de la glándula tiroides, que se acumula de forma natural todos los isótopos de yodo.
Yodo-131 (vida media 8 días) es un isótopo beta emisores de luz, que es un producto de fisión nuclear común. Se administra preferentemente a los seres humanos sólo en dosis muy altas que destruyen todos los tejidos que se acumulan (normalmente la tiroides), que a su vez impide que estos tejidos de desarrollar cáncer de una dosis más baja (paradójicamente, una alta dosis de este isótopo aparece más seguro para el tiroides que una dosis baja). Al igual que otros radioyodos, I-131 se acumula en la glándula tiroides, pero a diferencia de los otros, en pequeñas cantidades es altamente cancerígeno hay, al parecer, debido a la alta mutación celular local debido a los daños causados desintegración beta. Debido a esta tendencia de 131 I a la causa gran daño a las células que se acumulan y otras células cerca de ellos (0,6 a 2 mm de distancia, la gama de los rayos beta), que es el único radioisótopo de yodo utilizado como terapia directa, para matar tejidos tales como cánceres que ocupan moléculas yodadas artificialmente (ejemplo, el compuesto iobenguano, también conocido como MIBG). Por la misma razón, sólo el isótopo de yodo I-131 se utiliza para tratar La enfermedad de Grave y esos tipos de cáncer de tiroides (a veces en forma metastásico) donde las funciones del tejido que requiere la destrucción, todavía se acumule yoduro de forma natural.
No radiactivo ordinaria yoduro de potasio (yodo-127), en un número de formas convenientes (comprimidos o solución) puede ser usado para saturar la capacidad de la glándula tiroides para tomar hasta más de yodo, y por lo tanto proteger contra la contaminación accidental de yodo-131 generada por la fisión nuclear accidentes, como el desastre de Chernobyl y más recientemente el Accidentes nucleares Fukushima I, así como de la contaminación de este isótopo en lluvia radiactiva de las armas nucleares .
Historia
El yodo fue descubierto por el químico francés Bernard Courtois en 1811. Nació a un fabricante de salitre (una parte vital de la pólvora ). En el momento de las guerras napoleónicas , Francia estaba en guerra y el salitre estaba en gran demanda. Salitre producido del francés camas Niter requeridos carbonato de sodio, que puedan ser aislados de algas recogidos en las costas de Normandía y Brittany. Para aislar el carbonato de sodio, algas fue quemado y las cenizas se lavó con agua. El resto de residuos se destruyó mediante la adición de ácido sulfúrico . Courtois vez añadió ácido sulfúrico excesiva y una nube de vapor de rosa de la púrpura. Señaló que el vapor se cristalizó en las superficies frías, por lo que los cristales oscuros. Courtois sospechó que se trataba de un nuevo elemento, pero carecía de fondos para perseguir más lejos.
Courtois dio muestras de sus amigos, Charles Bernard Desormes (1777-1862) y Nicolas Clément (1779-1841), para continuar la investigación. También le dio algo de la sustancia a químico Joseph Louis Gay-Lussac (1778-1850), y para físico André-Marie Ampère (1775-1836). El 29 de noviembre de 1813, Dersormes y Clément hicieron el descubrimiento de Courtois público. Describieron la sustancia a una reunión de la Instituto Imperial de Francia. El 6 de diciembre, Gay-Lussac anunció que la nueva sustancia era o bien un elemento o un compuesto de oxígeno. Era Gay-Lussac, quien sugirió el nombre "iode", de la palabra griega ιώδες (iodes) para violeta (por el color de vapor de yodo). Ampère había dado algo de su muestra a Humphry Davy (1778-1829). Davy hizo algunos experimentos sobre el fondo y señaló su similitud con el cloro . Davy envió una carta de fecha 10 de diciembre a la Real Sociedad de Londres declarando que había identificado un nuevo elemento. Argumentos estallaron entre Davy y Gay-Lussac sobre quién identificado yodo primero, pero los científicos reconocieron Courtois como el primero en aislar el elemento.
Aplicaciones
Aditivo alimentario humano
Esta aplicación muy importante es discutido en las secciones al final de este artículo, que tratan yodo en la biología.
Alimentación animal
La producción de diyoduro -etilendiamonio (EDDI) consume una gran fracción de yodo disponible. EDDI se proporciona al ganado como un suplemento nutricional.
Catálisis
La principal aplicación de yodo es como un co-catalizador para la producción de ácido acético por el Monsanto y Procesos Cativa. En estas tecnologías, que apoyan la demanda mundial de ácido acético, ácido yodhídrico convierte el metanol material de alimentación en yoduro de metilo, que se somete carbonilación. La hidrólisis del yoduro de acetilo resultante se regenera ácido yodhídrico y da ácido acético.
Tratamiento desinfectante y agua
El yodo elemental se utiliza como desinfectante en diversas formas. Existe El yodo como el elemento, o como el agua solubles anión triyoduro I 3 - generado in situ mediante la adición yoduro a yodo elemental pobremente soluble en agua (la reacción química inversa hace que algunos de yodo elemental libre disponible para la antisepsia). De manera alternativa, el yodo puede provenir de yodóforos, que contienen yodo complejado con un agente solubilizante (ion yoduro pueden considerarse en términos generales como el yodóforo en soluciones de agua triyoduro). Ejemplos de tales preparaciones incluyen:
- La tintura de yodo: yodo en etanol, o yodo y yoduro de sodio en una mezcla de etanol y agua.
- De Lugol yodo: el yodo y el yoduro en agua sola, formando principalmente triyoduro. A diferencia de tintura de yodo, Lugol cuenta con una cantidad minimizada de yodo libre (I 2) componente.
- Povidona yodada (un yodóforo).
El uso médico y radiológico
El yoduro de potasio ha sido utilizado como una expectorante, aunque este uso es cada vez más común. En medicina, el yoduro de potasio normalmente se utiliza para tratar la aguda tirotoxicosis, generalmente como una solución saturada de yoduro de potasio llamado SSKI. También se utiliza para bloquear la captación de yodo-131 en la glándula tiroides (véase la sección isótopos más arriba), cuando este isótopo se utiliza como parte de radiofármacos (como iobenguano) que no están dirigidos a los tejidos de la tiroides o de tipo tiroides.
Yodo-131 (por lo general en la forma química de yoduro) es un componente de lluvia radiactiva y una particularmente peligrosa debido a la propensión de la glándula tiroides para concentrar yodo ingerido, donde se mantiene por períodos de más de media vida radiológica de este isótopo de ocho días. Por esta razón, si se espera que la gente de estar expuestos a una cantidad significativa de yodo radiactivo ambiental (yodo-131 en la lluvia), pueden ser instruidos para tomar tabletas de yoduro de potasio no radiactivos. La dosis típica de adultos es de un comprimido de 130 mg por 24 horas, el suministro de 100 mg (100.000 microgramos ) de yodo, como ion yoduro. (Dosis diaria típica de yodo para mantener una salud normal es del orden de 100 microgramos;. Ver "Ingesta Dietética" a continuación) Al ingerir esta gran cantidad de yodo no radiactivo, captación de yodo radiactivo por la glándula tiroides se reduce al mínimo. Ver el artículo sobre el yoduro de potasio para más información sobre este tema.
Contraste radiológico
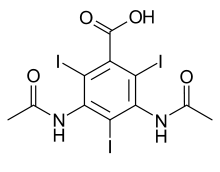
El yodo, como físicamente denso elemento con alta densidad de electrones y de alta número atómico , es bastante de radio-opaco (es decir, que absorbe bien los rayos X). Esta propiedad puede aprovecharse plenamente mediante el filtrado de los rayos X de imagen de manera que sean más enérgico que "K-borde" de yodo a 33,3 keV, o la energía, donde el yodo comienza a absorber los rayos X fuertemente debido al efecto fotoeléctrico de electrones en su caparazón K. Los compuestos orgánicos de un cierto tipo (derivados del benceno sustituidos típicamente yodo) son utilizados en la medicina como de rayos X agentes de radiocontraste para inyección intravenosa. Esto es a menudo en conjunción con técnicas de rayos X avanzadas tales como angiografía y TC. En la actualidad, todos los agentes de contraste radiológico solubles en agua se basan en yodo.
Otros usos
Yoduros inorgánicos encuentran usos especializados. El hafnio, circonio, titanio se purifican por el van Arkel proceso, que implica la formación reversible de las tetraiodides de estos elementos. El yoduro de plata es un ingrediente importante de la película fotográfica tradicional. Miles de kilogramos de yoduro de plata se consumen anualmente para siembra de nubes.
El Compuesto de organoyodo eritrosina es un importante agente colorante de alimentos. Yoduros de perfluoroalquilo son precursores de tensioactivos importantes, tales como ácido perfluorooctanosulfónico.
La química del yodo
El yodo adopta una variedad de estados de oxidación, comúnmente van desde (formalmente) I (VII) a I (-I), e incluyendo los estados intermedios de I (V), I (III) y I (I). Prácticamente, sólo el estado de oxidación -1 es de importancia, siendo la forma encontrada en sales de yoduro y organoyodos. El yodo es un Ácido de Lewis. Con donantes de electrones tales como trifenilfosfina y piridina forma una complejo de transferencia de carga. Con el anión yoduro forma la ion triyoduro. El yodo y el forma de ion yoduro una par redox. I 2 es fácilmente Reduje y yo - se oxida fácilmente.
Solubilidad
Siendo una molécula no polar, el yodo es altamente soluble en disolventes orgánicos no polares, incluyendo etanol (20,5 g / 100 ml a 15 ° C, 21,43 g / 100 ml a 25 ° C), dietil éter (20,6 g / 100 ml a 17 ° C, 25,20 g / 100 ml a 25 ° C), cloroformo, ácido acético , glicerol, benceno (14,09 g / 100 ml a 25 ° C), tetracloruro de carbono (2,603 g / 100 ml a 35 ° C), y disulfuro de carbono (16,47 g / 100 ml a 25 ° C). El yodo elemental es poco soluble en agua, con una disolución gramo en 3450 ml a 20 ° C y 1.280 ml a 50 ° C, aunque es mucho más soluble en solución de yoduro ya que forma iones poliyoduro. Las soluciones acuosas de etanol y son de color marrón que refleja el papel de estos disolventes como Bases de Lewis. Soluciones en cloroformo, tetracloruro de carbono, disulfuro de carbono y son de color violeta, el color de vapor de yodo.
Las reacciones redox
En la vida cotidiana, yoduros se oxidan lentamente por el oxígeno atmosférico en la atmósfera para dar yodo libre. La evidencia de esta conversión es la coloración amarilla de ciertas muestras envejecidas de sales de yoduro y algunos organoyodos. La oxidación de yoduro a yodo en el aire es también responsable de la lenta pérdida de contenido de yoduro en sal yodada si se expone al aire. Algunas sales de yodato utilizan para evitar la pérdida de yodo.
El yodo se reduce fácilmente. Lo más común es la interconversión de I - y yo 2. El yodo molecular se puede preparar por oxidación yoduros con cloro:
- 2 I - + Cl 2 → I 2 + 2 Cl -
o con dióxido de manganeso en solución de ácido:
- 2 I - 4 + H + + MnO2 → I 2 + 2 H2O + Mn 2+
El yodo se reduce a ácido yodhídrico por sulfuro de hidrógeno y hidracina:
- 8 I 2 + 8 H 2 S → 16 HI + S 8
- 2 I 2 + N 2 H 4 → 4 HI + N 2
Cuando se disuelve en fumante ácido sulfúrico (65% oleum), yodo forma una solución de color azul intenso. El color azul es debido a la I +
2 catión, el resultado de yodo se oxida por SO 3:
- 2 I 2 + 2 SO 3 + H 2 SO 4 → 2 I +
2 + SO 2 + 2 HSO -
4
La I +
2 catiónico se forma también en la oxidación de yodo por SbF 5 o TaF 5. La resultante I +
2 Sb
2 F -
11 o I +
2 Ta
2 F -
11 se puede aislar en forma de cristales de color azul profundo. Las soluciones de estas sales se vuelven rojas cuando se enfría por debajo de -60 ° C, debido a la formación de la I 2+
4 cación:
- 2 I +
2 Yo 2+
Yo 2+
4
En condiciones alcalinas un poco más, me 2+
4 desproporciona en I +
3 y un (III) compuesto de yodo. El exceso de yodo puede entonces reaccionar con I +
3 para formar I +
5 (verde) y yo 3+
15 (negro).
Óxidos de yodo
Los óxidos más conocidos son los aniones, IO -
3 y IO -
4, pero varios otros óxidos son conocidos, tales como el oxidante fuerte pentóxido de yodo.
Por contraste con cloro , la formación del ion de hipohalito (IO -) en soluciones acuosas neutras de yodo es insignificante.
- I 2 + H 2 O
 H + + I - + HIO (K = 2,0 × 10 -13) en soluciones básicas (tales como acuosa de hidróxido de sodio ), yodo convierte en una reacción de dos etapas para yoduro y yodato:
H + + I - + HIO (K = 2,0 × 10 -13) en soluciones básicas (tales como acuosa de hidróxido de sodio ), yodo convierte en una reacción de dos etapas para yoduro y yodato:
I 2 + 2 OH - → I - + IO - + H 2 O (K = 30) 3 IO - → 2 I - + IO -
3(K = 10 20)
Derivados orgánicos de la hypoiodate ( 2-yodoxibenzoico ácido, y Dess-Martin peryodinano) se utilizan en la química orgánica.
Ácido yódico (HIO 3), ácido periódico (HIO 4) y sus sales son oxidantes fuertes y son de alguna utilidad en síntesis orgánica. El yodo se oxida a yodato por el ácido nítrico , así como por cloratos:
- I 2 + 10 HNO 3 → 2 HIO 3 + 10 NO 2 + 4 H2O
- I 2 + 2 ClO -
3 → 2 IO -
3 + Cl 2
Compuestos de yodo inorgánicos
El yodo forma compuestos con todos los elementos, excepto para los gases nobles. Desde la perspectiva de las aplicaciones comerciales, es un compuesto importante ácido yodhídrico, utilizado como un co-catalizador en el Cativa proceso para la producción de ácido acético. Titanio y aluminio yoduros se utilizan en la producción de butadieno, un precursor de los neumáticos de goma.
Sales de metales alcalinos son sólidos incoloros comunes que son altamente solubles en agua. El yoduro de potasio es una fuente conveniente de la anión yoduro; es más fácil de manejar que yoduro de sodio porque no es higroscópico. Ambas sales se utilizan principalmente en la producción de sal yodada. El yoduro de sodio es especialmente útil en el Reacción de Finkelstein, debido a que es soluble en acetona , mientras que el yoduro de potasio es menos. En esta reacción, una cloruro de alquilo se convierte en una yoduro de alquilo. Esto se basa en la insolubilidad de cloruro de sodio en acetona para conducir la reacción:
- R-Cl (acetona) + NaI (acetona) → RI (acetona) + NaCl (s)
A pesar de tener la electronegatividad más bajo de los halógenos comunes, yodo reacciona violentamente con algunos metales, tales como aluminio:
- 3 I 2 + 2 Al → 2 AlI 3
Esta reacción produce 314 kJ por mol de aluminio, comparable al de termita 425 kJ. Sin embargo, la reacción inicia espontáneamente, y si no confinado, provoca una nube de yodo gaseoso debido a la alta temperatura.
Compuestos interhalogenados
Compuestos interhalogenados son bien conocidos; ejemplos incluyen monocloruro de yodo y tricloruro; pentafluoruro de yodo y heptafluoride.
Compuestos orgánicos
Existen muchos organoyodos; el más sencillo es yodometano, aprobó como suelo fumigante. Compuestos orgánicos yodados se utilizan como reactivos sintéticos.
La síntesis orgánica
Organoyodos se pueden hacer de muchas maneras. Por ejemplo, yoduro de metilo puede prepararse a partir de metanol , fósforo rojo y yodo. El reactivo de yodación es triyoduro de fósforo que se forma in situ:
- 3 CH 3 OH + PI 3 → 3 CH 3 I + H 3 PO 3
La prueba de yodoformo utiliza una solución alcalina de yodo para reaccionar con metil cetonas para dar al grupo triiodomethide dejando lábil, formando yodoformo que precipita.
Arilo y alquilo yoduros tanto de forma Reactivos de Grignard. El yodo se usa a veces para activar el magnesio en la preparación de reactivos de Grignard. Yoduros de alquilo tal como yodometano son buenos agentes alquilantes. Algunos inconvenientes de utilizar de organoyodos en la síntesis química son:
- compuestos de yodo son más caros que los bromuros y cloruros correspondientes, en ese orden
- yoduros son agentes alquilantes mucho más fuertes, y por lo tanto son más tóxicos (por ejemplo, yoduro de metilo es muy tóxico (T +).
- yoduros de bajo peso molecular tienden a tener un peso equivalente mucho mayor, en comparación con otros agentes alquilantes (por ejemplo, yoduro de metilo frente carbonato de dimetilo), debido a la masa atómica del yodo.
Química analítica y bioanálisis

El yodo es útil en química analítica, debido a sus reacciones con alquenos , almidón y agentes oxidantes y reductores. Las especies altamente coloreadas que participan en estas reacciones hacen que sea fácil para detectar los puntos finales en muchas determinaciones analíticas. El yodo es una mancha general común utilizado en cromatografía de capa fina. El yodo forma un complejo intenso azul con los polímeros de glucosa almidón y glucógeno. Varios métodos de análisis se basan en esta propiedad:
- Yodometría. La concentración de un oxidante se puede determinar mediante la adición a un exceso de yoduro, para destruir el yodo elemental / triyoduro como resultado de la oxidación por el oxidante. La indicador de almidón se utiliza entonces como el indicador cerca del punto final, con el fin de aumentar el contraste visual (azul oscuro se vuelve incolora, en lugar de el amarillo de triyoduro diluida convertirse incoloro).
- Una Prueba de yodo puede ser utilizado para probar una sustancia muestra para la presencia de almidón. La Reacción del reloj de yodo es una extensión de las técnicas en yodometría.
- Las soluciones de yodo se utilizan en plumas de detección de billetes falsificados; la premisa es que los billetes falsos hicieron uso de papel disponibles en el mercado contienen almidón.
- El almidón-yoduro de papel se utilizan para probar la presencia de oxidantes tales como peróxidos. Los oxidantes convierten yoduro a yodo, que se muestra como azul. Una solución de yoduro de almidón y puede realizar la misma función.
- Durante colposcopia, el yodo de Lugol se aplica a la vagina y cuello uterino. Normales manchas de tejido vaginal de color marrón debido a su alto contenido de glucógeno (una reacción de color similar al de almidón), mientras que el tejido anormal sospechoso de cáncer no se mancha, y por lo tanto se ve pálido en comparación con el tejido circundante. Biopsia del tejido sospechoso puede entonces ser realizada. Esto se llama una Prueba de Schiller.
El valor de yodo o el número de yodo se utiliza para indicar el número de dobles enlaces carbono-carbono en aceites vegetales y ácidos grasos .
El uso de químicos sintéticos Clandestino
En los Estados Unidos, la Drug Enforcement Administration (DEA) se refiere a yodo y compuestos que contienen yodo (yoduros iónicos, yodoformo, yoduro de etilo, etc.) como reactivos útiles para la fabricación clandestina de metanfetamina.
Papel biológico
El yodo es un elemento esencial oligoelementos para la vida, el elemento más pesado comúnmente necesitan los organismos vivos. Sólo de tungsteno , un componente de un par de enzimas bacterianas, tiene un número atómico más alto y el peso atómico.

El papel principal de yodo en biología animal es como un constituyente de la tiroides hormonas tiroxina (T4) y triyodotironina (T3). Estos están hechos de productos de condensación adición del ácido amino tirosina, y se almacenan antes de su liberación en una que contiene yodo- proteína llamada tiroglobulina. T4 y T3 contienen cuatro y tres átomos de yodo por molécula , respectivamente. La glándula tiroides absorbe activamente yoduro de la sangre para producir y liberar estas hormonas en la sangre, las acciones que están regulados por una segunda hormona TSH de la pituitaria. Las hormonas tiroideas son filogenéticamente moléculas muy antiguas que son sintetizados por la mayoría multicelulares organismos , y que incluso tienen algún efecto sobre organismos unicelulares.
Las hormonas tiroideas juegan un papel fundamental en biología, que actúa sobre la transcripción de genes para regular la la tasa metabólica basal. El total de la deficiencia de hormonas tiroideas puede reducir la tasa metabólica basal hasta el 50%, mientras que en la producción excesiva de hormonas tiroideas la tasa metabólica basal se puede incrementar en un 100%. T4 actúa principalmente como un precursor de T3, que es (con pequeñas excepciones) la hormona biológicamente activa. En los anfibios hormonas tiroideas de yodo metamorfosis y ejercen un modelo experimental bien estudiado de apoptosis en las células de branquias, la cola y las aletas de los renacuajos.
El yodo tiene una relación con nutricional de selenio . Una familia de enzimas dependiente de selenio llamada deiodinasas convierte T4 a T3 (la hormona activa) mediante la eliminación de un átomo de yodo del anillo de tirosina exterior. Estas enzimas también convierten a T4 T3 inversa (rT3) mediante la eliminación de un átomo de yodo anillo interior, y convertir a T3 3,3'-diyodotironina (T2) también mediante la eliminación de un átomo de anillo interior. Ambos de estos últimos son hormonas inactivadas que están listos para su eliminación y que tienen, en esencia, no hay efectos biológicos. Una familia de enzimas no dependiente de selenio entonces deiodinates aún más los productos de estas reacciones.
El yodo representa el 65% del peso molecular de T4 y 59% de la T3. Quince a 20 mg de yodo se concentra en el tejido de la tiroides y las hormonas, pero 70% de yodo del cuerpo se distribuye en otros tejidos, incluyendo las glándulas mamarias, ojos, mucosa gástrica, paredes arteriales, el cuello uterino, y las glándulas salivales. En las células de estos tejidos, yoduro entra directamente por symporter sodio-yoduro (NIS). Su papel en el tejido mamario está relacionado con el desarrollo fetal y neonatal, pero su papel en los otros tejidos es desconocida.
La ingesta dietética
El diario Ingesta Dietética de Referencia recomendada por los Estados Unidos Instituto de Medicina está entre 110 y 130 g para los bebés de hasta 12 meses, 90 mg para los niños de hasta ocho años, 130 mg para niños de hasta 13 años, 150 mg para los adultos, 220 mg para las mujeres embarazadas y 290 mg de madres lactantes. El nivel superior de consumo tolerable (UL) para los adultos es de 1100 mg / día (1,1 mg / día). El límite superior tolerable se evaluó mediante el análisis del efecto de la suplementación de hormona estimulante de la tiroides.
La glándula tiroides no necesita más de 70 microgramos / día para sintetizar las cantidades diarias requeridas de T4 y T3. Los niveles de cantidad diaria recomendada de yodo superior parecen necesarias para la función óptima de un número de sistemas corporales, incluyendo cáncer de mama lactantes, mucosa gástrica, las glándulas salivales, la mucosa oral, las paredes arteriales
Las fuentes naturales de yodo incluyen la vida marina, tales comoalgas y ciertos mariscos, así como las plantas que crecen en suelos ricos en yodo.La sal yodada es fortificada con yodo.
A partir de 2000, la ingesta media de yodo de los alimentos en los Estados Unidos fue de 240 a 300 mg / día para los hombres y de 190 a 210 mg / día para las mujeres. En Japón, el consumo es mucho mayor, que oscila entre 5,280 mg / día a 13 800 g / día, este debido al consumo frecuente de algas o algas marinas kombu.
Después de los programas de fortificación de yodo (por ejemplo, la sal yodada) han puesto en práctica, algunos casos de inducido por yodo se han observado hipertiroidismo (el llamado fenómeno de Jod-Basedow). La condición parece ocurrir principalmente en personas mayores de cuarenta años, y el riesgo parece mayor cuando la deficiencia de yodo es grave y el aumento inicial en la ingesta de yodo es alta.
Tratamiento de la información, las habilidades motoras finas, y la resolución de problemas visuales se mejoran mediante la reposición de yodo en los niños moderadamente yodo deficientes.
Deficiencia
En aproximadamente dos tercios de los hogares de la Tierra, la sal de mesa está yodada. Sin embargo, esto todavía deja un estimado de dos mil millones de personas en yodo deficiente. El yodo es necesario para las hormonas tiroxina esenciales producidos por y concentrados en la glándula tiroides.
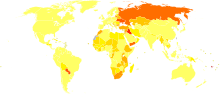
En las zonas donde hay poco yodo en la dieta, las zonas del interior normalmente remotas y semiárido climas ecuatoriales donde se comen ningún alimento marinos, la deficiencia de yodo da lugar a hipotiroidismo, cuyos síntomas son fatiga extrema, bocio, lentitud mental, la depresión, el peso ganancia y la temperatura corporal basal bajas. La deficiencia de yodo es la principal causa prevenible de retardo mental, resultado que se produce principalmente cuando los bebés o niños pequeños se prestan hypothyroidic por la falta del elemento. La adición de yodo a la sal de mesa se ha eliminado en gran medida este problema en las naciones más ricas, pero, a partir de marzo de 2006, la deficiencia de yodo sigue siendo un grave problema de salud pública en el mundo en desarrollo. La deficiencia de yodo es también un problema en algunas zonas de Europa.
Otros posibles efectos de salud siendo investigados por estar relacionados con la deficiencia incluyen:
- El cáncer de mama.La mama se concentra fuertemente y de forma activa de yodo en la leche materna para el beneficio del niño en desarrollo, y puede desarrollar una hiperplasia de bocio como, a veces se manifiesta comoenfermedad fibroquística de la mama, cuando los niveles de yodo son bajos.
- El cáncer de estómago . Algunos investigadores han encontrado una correlación epidemiológica entre la deficiencia de yodo, el bocio deficiencia de yodo y el cáncer gástrico. Una disminución de la incidencia de la tasa de mortalidad por cáncer de estómago después de la implementación de las yodo-profilaxis eficaz ha informado también.
Precauciones y toxicidad de yodo elemental
El yodo elemental (I 2 ) es tóxico si se toma por vía oral. La dosis letal para un humano adulto es de 30 mg / kg, que es aproximadamente 2.1 a 2.4 gramos (incluso si experimentos en ratas demostraron que estos animales podrían sobrevivir después de comer un / dosis 14.000 mg kg). El exceso de yodo puede ser más citotóxico en presencia de deficiencia de selenio. La administración de suplementos de yodo en poblaciones deficientes en selenio es, en teoría, problemática, en parte por esta razón. Su toxicidad se deriva de sus propiedades oxidantes, que hacen que sea capaz de desnaturalizar proteínas (y así también enzimas).
Yodo elemental es un irritante oxidante y el contacto directo con la piel puede causar lesiones, por lo que los cristales de yodo debe ser manejado con cuidado. Las soluciones con alta concentración de yodo elemental, tales como tintura de yodo y solución de Lugol son capaces de causar daños en los tejidos si se prolonga su uso para la limpieza y antisépticos.
Sensibilidad de yodo
Algunas personas desarrollan una sensibilidad al yodo. Aplicación de tintura de yodo puede causar una erupción. Algunos casos de reacción a la povidona yodada (Betadine) dieron lugar a quemaduras químicas. El uso médico de yodo (es decir, como un agente de contraste, véase más arriba) puede causar un shock anafiláctico en pacientes altamente yodo-sensibles. Algunos casos de sensibilidad al yodo pueden ser clasificados oficialmente como alergias yodo. Sensibilidad de yodo es rara, pero tiene un efecto considerable dada la gran utilización de medios de contraste a base de yodo.

