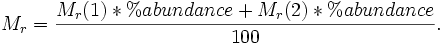Isótopo
Antecedentes de las escuelas de Wikipedia
Esta selección Escuelas fue originalmente elegido por SOS para las escuelas en el mundo en desarrollo que no tienen acceso a Internet. Está disponible como una descarga intranet. Visite el sitio web de Aldeas Infantiles SOS en http://www.soschildren.org/
Los isótopos son cualquiera de las diferentes formas de un elemento de cada masa atómica diferente que tiene ( número de masa). Los isótopos de un elemento tienen núcleos con el mismo número de protones (el mismo número atómico ), pero diferentes números de neutrones . Por lo tanto, los isótopos tienen diferentes números de masa, que dan el número total de nucleones-el número de protones y neutrones.
La nucleido es cualquier núcleo atómico particular, con un número atómico Z específico y número de masa A; es equivalentemente un núcleo atómico con un número específico de protones y neutrones. Colectivamente, todos los isótopos de todos los elementos forman el conjunto de nucleidos. La distinción entre los términos de isótopos y nucleido tiene algo borrosa, y que a menudo se utilizan indistintamente isotópica se utiliza mejor cuando se hace referencia a varios nucleidos diferentes del mismo elemento;. Nucleido es más genérico y se utiliza al hacer referencia a un solo núcleo o varios núcleos de diferentes elementos. Por ejemplo, es más correcto decir que un elemento tal como flúor consta de un núclido estable en lugar de que tiene un isótopo estable.
En la nomenclatura IUPAC , isótopos y nucleidos se especifican por el nombre del elemento en particular, dando implícitamente el número atómico, seguido por un guión y el número de masa (por ejemplo, helio-3, carbono-12, carbono-13, yodo-131 y de uranio-238). En forma simbólica, el número de nucleones se denota como una prefijo superíndice a la símbolo químico (por ejemplo, 3 Él, 12 C, 13 C, 131 I y 238 U).
Sobre 339 nucleidos producen de forma natural en la Tierra, de los cuales alrededor del 79% son estables. Contando los núclidos radiactivos que no se encuentran en la naturaleza que han sido creados artificialmente, más de 3.100 nucleidos se conocen actualmente.
Historia del término
El término fue acuñado isótopo en 1913 por Margaret Todd, un médico escocés, durante una conversación con Frederick Soddy (con quien estaba lejanamente emparentado). Soddy, un químico de la Universidad de Glasgow, ha explicado que se desprendía de sus investigaciones como si varios elementos ocupaban cada posición en la tabla periódica . Por lo tanto Todd sugirió el término griego para "en el mismo lugar" como un nombre adecuado. Soddy adoptó el término y pasó a ganar el Premio Nobel de Química en 1921 por su trabajo sobre las sustancias radiactivas.
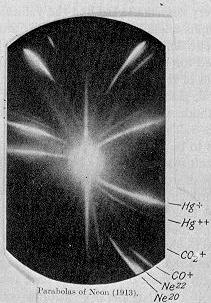
En 1913, como parte de su exploración en la composición de rayos canales, JJ Thomson canalizan una corriente de neón ionizado a través de una magnético y un campo eléctrico y se midieron su deflexión mediante la colocación de una placa fotográfica en su camino. Thomson observó dos parches de luz sobre la placa fotográfica (ver imagen a la derecha), que sugirió dos parábolas diferentes de desviación. Thomson llegó a la conclusión de que algunos de los átomos en el gas eran de mayor masa que el resto.
Variación en las propiedades entre isótopos
Propiedades químicas y atómicas
Un átomo neutro tiene el mismo número de electrones como protones. Por lo tanto, los diferentes isótopos de un elemento dado todas tienen el mismo número de protones y electrones y la misma estructura electrónica, y porque el comportamiento químico de un átomo se determina en gran parte por su estructura electrónica, los diferentes isótopos exhiben comportamiento químico casi idénticos. La principal excepción a esto es la efecto isotópico cinético: debido a sus masas más grandes, isótopos más pesados tienden a reaccionar algo más lentamente que los isótopos más ligeros del mismo elemento. Esto es más pronunciado para protium (1 H) vis-à-vis deuterio (2 H), ya que el deuterio tiene dos veces la masa de Protium. El efecto de masa entre deuterio y el protium relativamente luz también afecta al comportamiento de sus respectivos enlaces químicos, por medio de cambiar el centro de gravedad ( reducción de la masa) de los sistemas atómicos. Sin embargo, para los elementos más pesados, la masa absoluta de núcleo en relación a los electrones si mucho más, y la diferencia de masa relativa entre isótopos es mucho menor, y por lo tanto los efectos de diferencia de masa sobre la química son generalmente insignificantes.
Del mismo modo, dos moléculas que se diferencian sólo en la naturaleza isotópica de sus átomos ( isotopólogos) tendrá idéntica estructura electrónica y las propiedades físicas y químicas, por tanto, casi indistinguibles (otra vez con deuterio que proporcionan la principal excepción a esta regla). Los modos de vibración de una molécula se determinan por su forma y por las masas de sus átomos constituyentes. En consecuencia, isotopólogos tendrán diferentes conjuntos de modos de vibración. Desde modos de vibración permiten una molécula de absorber fotones de energías correspondiente, isotopólogos tienen diferentes propiedades ópticas en el rango infrarrojo.
Propiedades y la estabilidad nuclear
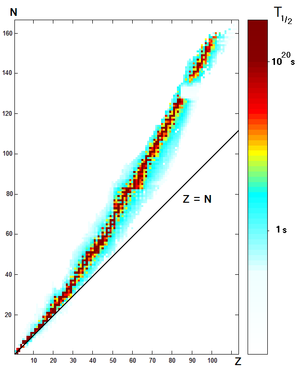
Los núcleos atómicos consisten en protones y neutrones unidos por la fuerza nuclear fuerte. Debido a que los protones tienen carga positiva, se repelen entre sí. Los neutrones, que son eléctricamente neutros, permiten una cierta separación entre los protones cargados positivamente, lo que reduce la repulsión electrostática. Los neutrones también estabilizan el núcleo debido a distancias cortas que se atraen entre sí y protones a partes iguales por la la fuerza nuclear fuerte, y esta fuerza adicional de unión también compensa la repulsión eléctrica entre los protones. Por esta razón, uno o más neutrones son necesarios para dos o más protones a estar unidos en un núcleo. Como el número de protones aumenta, una proporción cada vez mayor de neutrones son necesarios para formar un núcleo estable (véase el gráfico de la derecha). Por ejemplo, aunque el neutrón: relación de protones de 3 Él es 1: 2, el neutrón: relación de protones de 238 U es mayor que 3: 2. Como regla general, no hay, para cada número atómico (cada elemento) sólo un puñado de isótopos estables, siendo la media de 3,4 isótopos estables por elemento que tiene cualquier isótopos estables. Dieciséis elementos tienen sólo un único isótopo estable, mientras que el mayor número de isótopos estables observados para cualquier elemento , es diez.
Aunque los isótopos exhiben comportamiento electrónico y química casi idéntica, su comportamiento nuclear varía dramáticamente. Adición de neutrones para isótopos pueden variar sus espines nucleares y formas nucleares, causando diferencias en captura de neutrones secciones transversales y espectroscopia gamma y nucleares propiedades de resonancia magnética.
Si demasiados o muy pocos neutrones están presentes en lo que respecta a la relación óptima, el núcleo se vuelve inestable y sujeta a ciertos tipos de desintegración nuclear. Isótopos inestables con un número no óptima de neutrones se desintegran por desintegración alfa, desintegración beta, o por otros medios exóticos, tales como fisión espontánea y decaimiento clúster.
Presencia en la naturaleza
Los elementos se componen de uno o más isótopos naturales, que son normalmente estables. Algunos elementos tienen isótopos inestables (radiactivos), ya sea porque su descomposición es tan lento que una fracción aún permanece desde que fueron creados (ejemplos: uranio, potasio), o porque se crean continuamente a través de la radiación cósmica (tritio, el carbono-14) o por la desintegración de un isótopo en la primera categoría (radio, radón).
A tan sólo 80 elementos tienen isótopos estables, y 16 de ellos tienen sólo un isótopo estable. La mayoría de los elementos se producen de forma natural en la Tierra en varios isótopos estables, con el mayor número de isótopos estables para un elemento de ser diez, de estaño (elemento número 50). Hay alrededor de 94 elementos que se encuentran de forma natural en la Tierra (hasta el plutonio, elemento 94, inclusive), aunque algunos se detectan sólo en cantidades muy pequeñas, tales como plutonio-244. Lindsay estima que los elementos que se encuentran naturalmente en la Tierra (algunos sólo como radioisótopos) se producen como 339 isótopos (nucleidos) en total. Sólo 269 de estos isótopos naturales son estables, y los otros 70 son radiactivos, pero ocurren en la Tierra debido a su relativamente larga vida media, o de otros medios de producción natural. An ~ 2700 isótopos radiactivos adicionales que no se encuentran en la naturaleza se han creado en los reactores nucleares y en los aceleradores de partículas. Muchos no isótopos de vida corta que se encuentran naturalmente en la Tierra también se han observado por análisis espectroscópico, se crean de forma natural en las estrellas o supernovas. Un ejemplo es se encuentra de aluminio-26, que no se encuentra naturalmente en la Tierra, pero que en abundancia en una escala astronómica.
Las masas atómicas de los elementos tabulados son promedios que dan cuenta de la presencia de múltiples isótopos con diferentes masas. Un buen ejemplo es el cloro , que tiene la composición 35 Cl, 75,8%, y 37 Cl, 24,2%, dando una masa atómica de 35,5. Valores como este confundidos científicos antes del descubrimiento de los isótopos, como la mayoría de las masas atómicas de los elementos de luz están cerca de múltiplos enteros de hidrógeno.
Según generalmente aceptados cosmología sólo los isótopos de hidrógeno y helio y trazas de algunos isótopos de litio, berilio y boro fueron creados en el Big Bang, mientras que el resto fueron sintetizados en estrellas y supernovas. (Ver nucleosíntesis.) Las respectivas abundancias en consecuencia Tierra de las cantidades formadas por estos procesos, su propagación a través de la galaxia, y sus tasas de descomposición. Después de la fusión inicial del sistema solar, los isótopos fueron redistribuidos de acuerdo con la masa y la composición isotópica de elementos varía ligeramente de un planeta a otro. Esto a veces hace que sea posible rastrear el origen de los meteoritos.
La masa molecular de los isótopos
La masa molecular (M r) de un elemento está determinado por sus nucleones. Por ejemplo, el carbono-12 (12C) tiene 6 protones y 6 neutrones . Cuando una muestra contiene dos isótopos de la ecuación siguiente se aplica donde M r (1) y M r (2) son las masas moleculares de cada isótopo individual, y la abundancia% es el porcentaje de abundancia de este isótopo en la muestra.
Aplicaciones de los isótopos
Existen varias aplicaciones que aprovechan las propiedades de los distintos isótopos de un elemento dado.
El uso de las propiedades químicas y biológicas
- El análisis isotópico es la determinación de firma isotópica, la abundancia relativa de los isótopos de un elemento dado en una muestra particular. Para pueden producirse sustancias biogénicas en particular, las variaciones significativas de isótopos de C, N y O. Análisis de tales variaciones tiene una amplia gama de aplicaciones, tales como la detección de adulteración de productos alimenticios. La identificación de ciertos meteoritos como haber originado en Marte se basa en parte en la firma isotópica de los gases traza contenidos en ellos.
- Otra aplicación común es marcaje isotópico, el uso de isótopos inusuales como trazadores o marcadores en las reacciones químicas. Normalmente, los átomos de un elemento dado son indistinguibles entre sí. Sin embargo, mediante el uso de isótopos de diferentes masas, que pueden distinguirse por espectrometría de masas o espectroscopia infrarroja (ver "Propiedades"). Por ejemplo, en 'etiquetado de isótopos estables con aminoácidos en cultivo celular ( SILAC) 'isótopos estables se utilizan para cuantificar proteínas . Si se utilizan isótopos radiactivos, que pueden ser detectados por la radiación que emiten (esto se denomina marcaje con radionúclidos).
- Una técnica similar a marcaje con radionúclidos es datación radiométrica: utilizando la conocida vida media de un elemento inestable, se puede calcular la cantidad de tiempo que ha transcurrido desde que existía un nivel conocido de isótopos. El ejemplo más conocido es datación por radiocarbono utiliza para determinar la edad de materiales carbonosos.
- Sustitución isotópica se puede utilizar para determinar el mecanismo de una reacción a través de la efecto isotópico cinético.
El uso de propiedades nucleares
- Varias formas de espectroscopía se basan en las propiedades nucleares únicas de isótopos específicos. Por ejemplo, espectroscopia de resonancia magnética nuclear (RMN) se puede utilizar sólo para isótopos con un espín nuclear no nulo. Los isótopos más comunes utilizados con espectroscopía de RMN son de 1 H, 2 D, 15 N, 13 C y 31 P.
- Espectroscopia Mössbauer se basa también en las transiciones nucleares de isótopos específicos, como el 57 Fe.
- Los radionucleidos también tienen usos importantes. La energía nuclear y armas nucleares desarrollo requieren relativamente grandes cantidades de isótopos específicos. El proceso de separación de isótopos representa un desafío tecnológico significativo, pero más con elementos pesados como el uranio o plutonio, que con elementos más ligeros, como el hidrógeno, litio, carbono, nitrógeno, y oxígeno. Los elementos más ligeros enumerado por difusión de gas de sus compuestos como el CO y NO. Isótopos de uranio se han separado a granel por difusión de gas, centrifugación de gas, la separación de ionización láser, y (en el Proyecto Manhattan) por un tipo de producción de espectroscopia de masas .