
Magnesio
Antecedentes de las escuelas de Wikipedia
Esta selección Escuelas fue originalmente elegido por SOS para las escuelas en el mundo en desarrollo que no tienen acceso a Internet. Está disponible como una descarga intranet. patrocinio SOS Niño es cool!
| Magnesio | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
12 Mg | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Apariencia | |||||||||||||||||||||||||
brillante sólido gris  Las líneas espectrales de magnesio | |||||||||||||||||||||||||
| Propiedades generales | |||||||||||||||||||||||||
| Nombre, símbolo, número | de magnesio, Mg, 12 | ||||||||||||||||||||||||
| Pronunciación | / m æ ɡ n yo z yo ə m / imán NEE -zee-əm | ||||||||||||||||||||||||
| Categoría Elemento | metal alcalinotérreo | ||||||||||||||||||||||||
| Grupo, período, bloque | 2 (metales alcalinotérreos) , 3, s | ||||||||||||||||||||||||
| Peso atómico estándar | 24,3050 (6) | ||||||||||||||||||||||||
| Configuración electrónica | [ Ne ] 3s 2 2, 8, 2 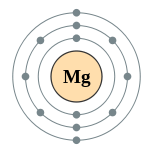 | ||||||||||||||||||||||||
| Historia | |||||||||||||||||||||||||
| Descubrimiento | José Negro (1755) | ||||||||||||||||||||||||
| Primer aislamiento | Humphry Davy (1808) | ||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||
| Densidad (cerca rt) | 1,738 g · cm -3 | ||||||||||||||||||||||||
| Líquido densidad en mp | 1,584 g · cm -3 | ||||||||||||||||||||||||
| Punto de fusion | 923 K , 650 ° C, 1202 ° F | ||||||||||||||||||||||||
| Punto de ebullicion | 1363 K, 1091 ° C, 1994 ° F | ||||||||||||||||||||||||
| Calor de fusión | 8.48 kJ · mol -1 | ||||||||||||||||||||||||
| El calor de vaporización | 128 kJ · mol -1 | ||||||||||||||||||||||||
| Capacidad calorífica molar | 24.869 J · mol -1 · K -1 | ||||||||||||||||||||||||
| Presión del vapor | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Propiedades atómicas | |||||||||||||||||||||||||
| Estados de oxidación | 2, 1 (Fuertemente óxido básico) | ||||||||||||||||||||||||
| Electronegatividad | 1,31 (escala de Pauling) | ||||||||||||||||||||||||
| Energías de ionización ( más) | Primero: 737.7 kJ · mol -1 | ||||||||||||||||||||||||
| Segundo: 1450,7 kJ · mol -1 | |||||||||||||||||||||||||
| Tercero: 7732,7 kJ · mol -1 | |||||||||||||||||||||||||
| Radio atómico | 160 pm | ||||||||||||||||||||||||
| Radio covalente | 141 ± 19:00 | ||||||||||||||||||||||||
| Van der Waals radio | 173 pm | ||||||||||||||||||||||||
| Miscelánea | |||||||||||||||||||||||||
| Estructura cristalina | hexagonal compacta | ||||||||||||||||||||||||
| Ordenamiento magnético | paramagnético | ||||||||||||||||||||||||
| La resistividad eléctrica | (20 ° C) 43,9 nΩ · m | ||||||||||||||||||||||||
| Conductividad térmica | 156 W · m -1 · K -1 | ||||||||||||||||||||||||
| Expansión térmica | (25 ° C) 24,8 m · m -1 · K -1 | ||||||||||||||||||||||||
| Velocidad del sonido (varilla delgada) | ( rt) (recocido) 4940 m · s -1 | ||||||||||||||||||||||||
| El módulo de Young | 45 GPa | ||||||||||||||||||||||||
| Módulo de corte | 17 GPa | ||||||||||||||||||||||||
| Módulo de volumen | 45 GPa | ||||||||||||||||||||||||
| Relación de Poisson | 0,290 | ||||||||||||||||||||||||
| Dureza de Mohs | 2.5 | ||||||||||||||||||||||||
| Dureza Brinell | 260 MPa | ||||||||||||||||||||||||
| Número de registro del CAS | 7439-95-4 | ||||||||||||||||||||||||
| La mayoría de los isótopos estables | |||||||||||||||||||||||||
| Artículo principal: Los isótopos de magnesio | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
El magnesio es un elemento químico con el símbolo Mg y número atómico 12. Su número de oxidación común es 2. Se trata de un metal alcalinotérreo y el octavo más abundante elemento en la corteza de la Tierra y el noveno en el conocido universo en su conjunto. El magnesio es el cuarto elemento más común en la Tierra como un todo (detrás de hierro, el oxígeno y el silicio), lo que representa el 13% de la masa del planeta y una gran parte del manto del planeta. La abundancia relativa de magnesio se relaciona con el hecho de que fácilmente se acumula en supernovas estrellas de una adición secuencial de tres núcleos de helio a carbono (que a su vez está hecho de tres núcleos de helio). Debido a la alta de iones de magnesio solubilidad en agua, es el tercer elemento más abundante disuelto en el agua de mar .
El elemento libre (metal) no se encuentra naturalmente en la Tierra, ya que es altamente reactivo (aunque una vez producido, se reviste en una capa delgada de óxido (ver pasivación), que en parte máscaras Esta reactividad). El metal libre arde con una luz blanca brillante característica, por lo que es un ingrediente útil en las erupciones. El metal se obtiene de forma principalmente por la electrólisis de sales de magnesio obtenidos a partir de salmuera. Comercialmente, el principal uso para el metal es como un agente para tomar aleación de aluminio aleaciones -magnesio, a veces llamado magnalium o magnelium. Dado que el magnesio es menos denso que el aluminio, estas aleaciones son apreciados por su relativa ligereza y resistencia.
En la biología humana, el magnesio es el elemento más abundante undécimo en masa en el cuerpo humano. Sus iones son esenciales para todos los que viven las células , donde juegan un papel importante en la manipulación de importancia biológica compuestos de polifosfato como ATP , ADN , y RNA. Cientos de por lo tanto enzimas requieren iones de magnesio para funcionar. Compuestos de magnesio se utilizan en medicina como común laxantes, antiácidos (por ejemplo, leche de magnesia), y en un número de situaciones en las que la estabilización de anormal Se requiere de excitación del nervio y el espasmo de los vasos sanguíneos (por ejemplo, para tratar eclampsia). Los iones de magnesio son agria al gusto, y en concentraciones bajas que ayudan a impartir una acidez natural fresca aguas minerales.
En la vegetación, el magnesio es el ion metálico en el centro de clorofila, y por tanto es un aditivo común para fertilizantes .
Origen y características
Propiedades físicas y químicas
Magnesio elemental es un blanco plateado, metal ligero bastante fuerte (dos tercios de la densidad del aluminio). Ella empaña ligeramente cuando se expone al aire, aunque a diferencia de los metales alcalinos , un ambiente libre de oxígeno es necesario para el almacenamiento ya que el magnesio está protegida por una delgada capa de óxido que es bastante impermeable y difícil de eliminar. Al igual que su menor periódica grupo tabla de vecinos de calcio , de magnesio reacciona con el agua a temperatura ambiente, aunque reacciona mucho más lentamente que el calcio. Al sumergirse en el agua, hidrógeno burbujas casi imperceptiblemente comienzan a formarse en la superficie del metal, aunque si son en polvo, reacciona mucho más rápidamente. La reacción se produce más rápidamente con temperaturas más altas (ver precauciones). La capacidad de magnesio para reaccionar con el agua puede ser aprovechado para producir energía y ejecutar una a base de magnesio motor. El magnesio también reacciona exotérmicamente con la mayoría de los ácidos, tales como ácido clorhídrico (HCl). Como con aluminio, zinc y muchos otros metales, la reacción con ácido clorhídrico produce el cloruro de hidrógeno del gas de metal y libera.
El magnesio es un altamente de metal inflamable, pero si bien es fácil de encender cuando en polvo o afeitado en tiras finas, es difícil de encender en masa o bulto. Una vez encendido, es difícil de extinguir, siendo capaz de quemar en nitrógeno (formando nitruro de magnesio), dióxido de carbono (formando óxido de magnesio y de carbono ) y agua (formación de óxido de magnesio y de hidrógeno). Esta propiedad fue utilizada en armas incendiarias utilizados en la bombardeo de ciudades en la Segunda Guerra Mundial , la única práctica defensa civil siendo para sofocar una llamarada ardiente bajo la arena seca para excluir a la atmósfera. En la quema en el aire, el magnesio produce una luz blanca brillante que incluye una fuerte ultravioleta. Así polvo de magnesio ( polvo de destello) se utilizó como una fuente de iluminación en los primeros días de la fotografía . Más tarde, se utilizó cinta de magnesio en bombillas de flash de encendido eléctrico. Polvo de magnesio se utiliza en la fabricación de fuegos artificiales y marina bengalas donde se requiere una luz blanca brillante. Temperaturas de llama de magnesio y aleaciones de magnesio pueden llegar a 3.100 ° C (3.370 K; 5610 ° F), aunque altura de la llama por encima del metal de combustión es por lo general menos de 300 mm (12 in). El magnesio puede ser utilizado como una fuente de ignición para termita, una por lo demás difícil de inflamar la mezcla de aluminio y óxido de hierro en polvo.
Compuestos de magnesio son típicamente cristales blancos. La mayoría son solubles en agua, proporcionando el magnesio-amargo sabor de iones Mg 2+. Pequeñas cantidades de iones de magnesio disuelto contribuyen a la acidez y el sabor de las aguas naturales. Ion magnesio en grandes cantidades es un laxante iónico, y sulfato de magnesio (nombre común: sal de Epsom) se utiliza a veces para este propósito. La llamada "leche de magnesia" es una suspensión en agua de uno de los pocos compuestos de magnesio insolubles, hidróxido de magnesio. Las partículas no disueltas dan lugar a su aparición y el nombre. La leche de magnesia es una leve base comúnmente utilizada como un antiácido, que tiene algún efecto secundario laxante.
Isótopos
El magnesio tiene tres estables isótopos : 24 mg, 25 mg y 26 mg. Todos están presentes en cantidades significativas (véase la tabla de isótopos arriba). Alrededor del 79% de Mg es de 24 Mg. El isótopo 28 Mg es radiactivo y en la década de 1950 a 1970 se hizo comercialmente por varias plantas de energía nuclear para uso en experimentos científicos. Este isótopo tiene una vida media relativamente corta (21 horas) y por lo que su uso estaba limitado por los tiempos de envío.
26 Mg ha encontrado aplicación en isotópica geología , similar a la de aluminio. 26 Mg es una producto hija radiogenic de 26 Al, que tiene una vida media de 717.000 años. Grandes enriquecimientos de 26 Mg estable se han observado en el Ca-Al-ricos inclusiones de algunos condrita carbonosa meteoritos. La abundancia anómala de 26 Mg se atribuye a la decadencia de su matriz 26 Al en las inclusiones. Por lo tanto, el meteorito debe haberse formado en el nebulosa solar antes del 26 de Al había decaído. Por lo tanto, estos fragmentos se encuentran entre los objetos más antiguos del sistema solar y han conservado la información sobre su historia temprana.
Es convencional para trazar 26 mg / 24 mg en contra de una relación Al / Mg. En una isócrona citas trama, la relación Al / Mg trazado es de 27 Al / 24 Mg. La pendiente de la isócrona no tiene ningún significado edad, pero indica la 26 Al / 27 relación Al inicial en la muestra en el momento en que los sistemas fueron separados de un depósito común.
Creación
El magnesio se produce en las estrellas más grandes de 3 masas solares mediante la fusión de helio y neón en el proceso alfa a temperaturas superiores a 600 megakelvins.
Aparición
| País | 2010 la producción ( toneladas) |
|---|---|
| China | 650000 |
| Rusia | 40000 |
| Israel | 30000 |
| Kazajstán | 20000 |
| Brasil | 16000 |
| Ucrania | 2000 |
| Serbia | 2000 |
Aunque el magnesio se encuentra en más de 60 minerales , sólo dolomita, magnesita, brucite, carnalita, talco , y olivino son de importancia comercial.
El Mg 2+ cación es el segundo catión más abundante en agua de mar (que se producen en torno al 12% de la masa de sodio allí), lo que hace que el agua de mar y la sal del mar en una fuente comercial atractivo de Mg. Para extraer el magnesio, hidróxido de calcio se añade al agua de mar para formar hidróxido de magnesio precipitar.
- MgCl2 + Ca (OH) 2 → Mg (OH) 2 + CaCl2
El hidróxido de magnesio ( brucita) es insoluble en agua por lo que se puede filtrar hacia fuera, y se hace reaccionar con ácido clorhídrico para obtener concentrado cloruro de magnesio.
- Mg (OH) 2 + 2 HCl → MgCl2 + 2 H 2 O
De cloruro de magnesio, la electrólisis produce magnesio.
En el Estados Unidos , el magnesio se obtiene principalmente por la electrólisis de cloruro de magnesio fundido desde salmueras, pozos y agua de mar . En el cátodo, el ion Mg 2+ se reduce por dos electrones al metal de magnesio:
- Mg 2 + 2 + e - → Mg
En el ánodo, cada par de iones Cl - se oxida a cloro gas, la liberación de dos electrones para completar el circuito:
- 2 Cl - → Cl 2 (g) + 2 e -
Los Estados Unidos han sido tradicionalmente el principal proveedor mundial de este metal, suministrando el 45% de la producción mundial, incluso en fecha tan reciente como 1995. En la actualidad, la cuota de mercado de Estados Unidos es del 7%, con un único productor nacional a la izquierda, los Estados Unidos de magnesio, un Empresa Renco Group en Utah nació a partir de ahora extinta Magcorp.
A partir de 2005, China, ha asumido el control como el proveedor dominante, vinculado al 60% del mercado mundial, que aumentó del 4% en 1995. A diferencia de lo anterior, se describe proceso electrolítico, China es casi totalmente dependiente de un método diferente de obtener el metal de sus minerales, la silicothermic Proceso Pidgeon (la reducción del óxido a altas temperaturas con el silicio).
Historia

El nombre de magnesio origina del griego palabra por un distrito en Tesalia llamado Magnesia. Se relaciona con magnetita y manganeso , que también se originó en esta área, y requiere la diferenciación como sustancias separadas. Ver manganeso para esta historia.
El magnesio es el octavo elemento más abundante en la corteza de la Tierra en masa y empatado en el séptimo lugar con hierro en términos de molaridad. Se encuentra en grandes depósitos de magnesita, dolomita y otros minerales , y en las aguas minerales, donde ion magnesio es soluble. En 1618, un agricultor en Epsom en Inglaterra trató de dar su vacas agua de un pozo allí. Las vacas se negaron a beber porque de sabor amargo del agua, pero el granjero se dieron cuenta de que el agua parecía sanar arañazos y erupciones cutáneas. La sustancia se hizo conocido como Sales de Epsom y su fama se extendió. Con el tiempo fue reconocido como sulfato de magnesio hidratado, MgSO4 · 7 H 2 O.
El metal en sí fue producido por primera vez por Sir Humphry Davy en Inglaterra en 1808. Él utilizó la electrólisis de una mezcla de magnesia y óxido de mercurio. Antoine Bussy preparó en forma coherente en 1831. La primera sugerencia de Davy para un nombre era magnium, pero el nombre de magnesio se utiliza ahora.
Aplicaciones
Como el metal

El magnesio es el tercer metal estructural más comúnmente utilizado, después de hierro y aluminio. Se le ha llamado el metal más ligero útiles por La tabla periódica de los vídeos.
Las principales aplicaciones del magnesio son, en orden: componente de las aleaciones de aluminio, en fundición a presión (aleado con zinc ), para eliminar el azufre en la producción de hierro y acero, la producción de titanio en el Proceso de Kroll.
El magnesio, en su forma más pura, puede ser comparado con el aluminio, y es fuerte y ligero, por lo que se utiliza en varias aplicaciones de fabricación de piezas de gran volumen, incluyendo componentes de automoción y camiones. Especialidad, ruedas de coche de alta calidad de aleación de magnesio se llaman " rines de magnesio ", aunque el término es a menudo más ampliamente aplicó erróneamente incluir ruedas de aluminio.
El alto contenido de magnesio se utiliza para el cárter de la tarde en la Segunda Guerra Mundial Motor de aviación radial dieciocho cilindros Wright Duplex Ciclón era un grave problema para los primeros ejemplos de la Boeing B-29 bombardero pesado, como los fuegos de motor en vuelo podrían establecer los cárteres de motores encendidos, literalmente, "quemando" el ala mástil aparte en menos de un fracaso ala minutos causando.
Un anterior Mercedes-Benz modelo de coche de carreras, el Mercedes-Benz 300 SLR, había un cuerpo hecho de Elektron, una aleación de magnesio; estos coches han rodado (con éxitos) en Le Mans, el Mille Miglia, y otros eventos de carreras de clase mundial en 1955 (aunque uno estaba involucrado en el único peor accidente en la historia de las carreras de autos, en términos de pérdidas de vidas humanas, en la carrera de Le Mans.) sin cuartel búsqueda de Porsche para reducir el peso de sus coches de carreras llevó al uso de marcos de aleación de magnesio en el famoso 917/053 que ganó Le Mans en 1971, y todavía tiene el récord de distancia absoluta.
El Grupo Volkswagen ha utilizado magnesio en sus componentes del motor durante muchos años. Por mucho tiempo, Porsche utiliza aleación de magnesio para su bloques debido a la ventaja de peso del motor. Hay un renovado interés en los bloques de motor de aleación de magnesio, tal como se presenta en el 2006 BMW 325i y 330i modelos.
El motor de BMW utiliza un inserto de aleación de aluminio para las paredes de los cilindros y las chaquetas de enfriamiento rodeadas por un AJ62A de aleación de magnesio de alta temperatura.
La aplicación de aleación AE44 magnesio en el Corvette 2006 Cuna del motor Z06 ha avanzado la tecnología de diseño de piezas de automóviles robustos en magnesio. Tanto estas aleaciones son los últimos acontecimientos en alta temperatura baja arrastrarse aleaciones de magnesio.
Mitsubishi Motors también utiliza magnesio (aleación de magnesio de marca) para sus paletas de cambio. La estrategia general para tales aleaciones es para formar intermetálico precipita en el límites de grano, por ejemplo, añadiendo mischmetal o de calcio . Nueva desarrollo de aleaciones y los costos más bajos que hacen de magnesio competitiva con aluminio aumentará el número de aplicaciones de automoción.

El segundo campo de aplicación de magnesio es dispositivos electrónicos. Debido a su bajo peso, buenas propiedades mecánicas y eléctricas, el magnesio es ampliamente utilizado para la fabricación de teléfonos móviles, ordenadores portátiles y computadoras tablet, cámaras y otros componentes electrónicos.
Históricamente, el magnesio fue uno de los principales metales de construcción aeroespacial y fue utilizado para los aviones militares alemanes ya en la Primera Guerra Mundial y ampliamente para la aviación alemana en la Segunda Guerra Mundial.
Los alemanes acuñaron el nombre ' Elektron 'de aleación de magnesio. El término se sigue utilizando hoy en día. La aplicación de magnesio en la industria aeroespacial comercial se restringe generalmente a los componentes relacionados con el motor, ya sea debido a los riesgos percibidos con piezas de magnesio en caso de incendio, o corrosión. Actualmente el uso de aleaciones de magnesio en la industria aeroespacial está aumentando, principalmente gracias a la creciente importancia de la economía de combustible y la necesidad de reducir el peso. El desarrollo y prueba de nuevas aleaciones de magnesio continúa, especialmente Elektron 21, que ha pasado con éxito pruebas exhaustivas aeroespacial para su utilización en los componentes del motor, internos y fuselajes. La Comunidad Europea se ejecuta tres proyectos de magnesio I + D en la prioridad Aeroespacial del Programa Marco de Seis.
Niche utiliza del metal
El magnesio, siendo fácilmente disponibles y relativamente no tóxico, tiene una variedad de usos:
- El magnesio es inflamable, quemando a una temperatura de aproximadamente 3100 ° C (3370 K; 5610 ° F), y el temperatura de autoignición de cinta de magnesio es de aproximadamente 473 ° C (746 K; 883 ° F). Produce una intensa luz blanca, brillante cuando se quema. Alta temperatura de combustión de magnesio hace que sea una herramienta útil para el inicio de incendios de emergencia durante la recreación al aire libre. Otros usos incluyen flash fotografía , bengalas, pirotecnia y fuegos artificiales bengalas. El magnesio también se utiliza a menudo para encender la termita, u otros materiales que requieren una alta temperatura de encendido.
 Firestarter magnesio (en la mano izquierda), se utiliza con un navaja y pedernal para crear chispas que encienden las virutas
Firestarter magnesio (en la mano izquierda), se utiliza con un navaja y pedernal para crear chispas que encienden las virutas
- En la forma de virutas o cintas, para preparar Reactivos de Grignard, que son útiles en síntesis orgánica.
- Como un agente aditivo en propulsores convencionales y la producción de grafito nodular de hierro fundido.
- Como un agente reductor para la producción de uranio y otros metales de su sales.
- Como un sacrificial (galvánica) ánodo para proteger los tanques subterráneos, tuberías, estructuras enterradas y calentadores de agua.
- Aleado con zinc para producir la hoja de zinc utilizado en fotograbado placas en la industria gráfica, de células secas paredes de la batería, y de techado.
- Como un metal, el uso principal de este elemento es como un aditivo de aleación de aluminio con estas aleaciones de aluminio-magnesio que se utilizan principalmente para latas de bebidas.
En compuestos de magnesio
Compuestos de magnesio, principalmente óxido de magnesio (MgO), se utilizan como material refractario en revestimiento interior de hornos para la producción de hierro , acero , metales no ferrosos, vidrio y cemento. Óxido de magnesio y otros compuestos de magnesio también se utilizan en las industrias agrícola, químicas, y de la construcción.
El magnesio hace reaccionar con un haluro de alquilo da una Reactivo de Grignard, que es una herramienta muy útil para la preparación de alcoholes .
En la agricultura y la biología, el ion magnesio es necesario para toda la vida (ver magnesio en la biología), por lo que las sales de magnesio se incluyen con frecuencia en diversos alimentos , fertilizantes (magnesio es un componente de clorofila), y medios de cultivo.
Usos de nicho e ilustrativos de compuestos de magnesio
Biológico
Las preparaciones farmacéuticas de magnesio se utilizan para tratar La deficiencia de magnesio y hipomagnesemia, así como eclampsia. Por lo general, en dosis más bajas, el magnesio se incluye comúnmente en preparaciones minerales dietéticos, incluyendo a muchos preparados multivitamínicos.
Ordenado por tipo de sal de magnesio, aplicaciones biológicas de magnesio incluyen:
- El sulfato de magnesio, ya que el heptahidratado llamados sales de Epsom, se utiliza como sales de baño, como un laxante, y como altamente soluble fertilizantes .
- El hidróxido de magnesio, se suspendió en agua, se utiliza en leche de magnesia antiácidos y laxantes.
- Cloruro de magnesio, óxido, gluconato, malato, orotato, glicinato y citrato se utilizan como suplementos orales de magnesio. Algunos han afirmado que los suplementos orales de magnesio son terapéuticos para Síndrome de piernas inquietas (SPI) en algunos individuos.
- Borato de magnesio, salicilato de magnesio, y sulfato de magnesio se utilizan como antisépticos.
- Bromuro de magnesio se utiliza como un leve sedante (esta acción es debido a la bromuro, no el magnesio).
- El estearato de magnesio es un poco inflamable blanco polvo con propiedades lubricantes. En farmacéutica tecnología, se utiliza en la fabricación de numerosos tipos de comprimidos para evitar que los comprimidos se peguen al equipo durante el proceso de compresión de la tableta (es decir, cuando se pulsa la sustancia de la tableta en forma de tableta).
- Polvo de carbonato de magnesio se utiliza por los atletas como gimnastas , levantadores de pesas y los escaladores para eliminar la humedad y mejorar el agarre en un aparato de gimnasia, levantamiento de bar y escalada en rocas.
No biológica
- Magnesita calcinada a muerte ( óxido de magnesio) se utiliza para fines refractarios como el ladrillo y los revestimientos de hornos y convertidores.
El óxido de magnesio de la calcinación se utiliza como un aislante eléctrico en cables resistentes al fuego.
- Sulfito de magnesio se utiliza en la fabricación de papel ( proceso al sulfito).
- Fosfato de magnesio se usa para madera a prueba de fuego utilizado en la construcción.
- Hexafluorosilicato de magnesio se utiliza en tratamiento antipolilla de textiles .
- En la forma de virutas o cintas, Mg es útil en la purificación de disolventes , por ejemplo la preparación de etanol super-seco
Papel biológico
Debido a la interacción importante entre iones fosfato y magnesio, iones de magnesio son esenciales para la básica química de ácidos nucleicos de la vida, y por lo tanto son esenciales para todas las células de todos los organismos vivos conocidos. Más de 300 enzimas requieren la presencia de iones de magnesio para su acción catalítica, incluyendo todas las enzimas que utilizan o sintetizar ATP , o los que utilizan otro nucleótidos para sintetizar ADN y RNA. ATP existe en las células normalmente como un quelato de ATP y un ión de magnesio.
Las plantas tienen un uso adicional para el magnesio en ese clorofilas son magnesio centrada porfirinas. La deficiencia de magnesio en las plantas causa final de la temporada amarillamiento entre las venas de las hojas, especialmente en las hojas más viejas, y puede ser corregido mediante la aplicación de Sales de Epsom (que es rápidamente lixiviado), o bien triturado dolomítica piedra caliza para el suelo.

El magnesio es un componente vital de una dieta humana sana. La deficiencia de magnesio Humano (incluidas las condiciones que muestran pocos síntomas evidentes) es relativamente raro, aunque sólo el 32% de las personas en los Estados Unidos cumple con el RDA-DRI; niveles bajos de magnesio en el cuerpo se ha asociado con el desarrollo de una serie de enfermedades humanas, tales como el asma , la diabetes , y osteoporosis. Tomado en la cantidad adecuada de magnesio juega un papel en la prevención tanto de apoplejía y ataque cardiaco. Los síntomas de las personas con fibromialgia, migrañas, y las niñas que pasan por su síndrome premenstrual son menos severos y magnesio pueden reducir la duración de los síntomas de la migraña.
Cuerpos humanos adultos contienen cerca de 24 gramos de magnesio, con 60% en el esqueleto, 39% intracelular (20% en el músculo esquelético), y 1% extracelular. Los niveles séricos son típicamente 0,7 a 1,0 mmol / L o 1.8 a 2.4 mEq / L. Niveles de magnesio en suero pueden parecer normales, incluso en casos de deficiencia intracelular subyacente, aunque conoce ningún mecanismo mantiene un nivel homeostático en la sangre que no sea la excreción renal de los niveles en sangre elevados.
El magnesio intracelular se correlaciona con intracelular de potasio . El magnesio se absorbe en el tracto gastrointestinal, con más absorbida cuando el estado es menor. En los seres humanos, magnesio parece facilitar calcio absorción. La ingesta de la absorción de magnesio inhibición de proteínas de alta y baja, y otros factores como la fosfato, fitato, y grasa afecta la absorción. Magnesio en la dieta absorbido se excreta principalmente por la orina, aunque la mayoría de magnesio "administrado por vía oral" se excreta a través de las heces. Estado de magnesio puede ser evaluado a través de más o menos el suero y las concentraciones de Mg eritrocitos y excreción urinaria y fecal, pero es probable que las pruebas de carga de magnesio intravenoso es el más preciso y práctico en la mayoría de las personas. En estas pruebas, el magnesio se inyecta por vía intravenosa; una retención del 20% o más indica deficiencia. Otras deficiencias de nutrientes se identifican a través de biomarcadores, pero ninguno se establecen para el magnesio.
Las especias, frutos secos, cereales, café, cacao, té, y las verduras son fuentes ricas en magnesio. Vegetales de hojas verdes como la espinacas también son ricos en magnesio, ya que contienen clorofila. Observaciones de reducción de la ingesta de magnesio en la dieta de los países occidentales modernos en comparación con las generaciones anteriores pueden estar relacionados con la refinación de alimentos y fertilizantes modernos que no contienen magnesio.
Numeroso preparaciones farmacéuticas de magnesio, así como de magnesio suplementos dietéticos están disponibles. El óxido de magnesio, una de las formas más comunes en los suplementos dietéticos de magnesio, ya que tiene alto contenido de magnesio por peso, se ha informado de la menor biodisponible. El citrato de magnesio ha sido reportado como más biodisponible que formas (glicinato) de óxido o de aminoácidos quelato.
El exceso de magnesio en la sangre se filtra libremente en los riñones, y por esta razón es difícil tener una sobredosis de magnesio a partir de fuentes de la dieta solamente. Con los suplementos, la sobredosis es posible, sin embargo, sobre todo en personas con función renal deficiente; de vez en cuando, con el uso de altas dosis catárticas de sales de magnesio, grave hipermagnesemia se ha informado a ocurrir incluso sin disfunción renal. El alcoholismo puede producir una deficiencia de magnesio, que es fácilmente reversible por administración oral o parenteral, dependiendo del grado de deficiencia.
Detección en fluidos biológicos
Las concentraciones de magnesio en el plasma o suero pueden medirse para supervisar su eficacia y seguridad en los que recibieron el fármaco terapéuticamente, para confirmar el diagnóstico de las posibles víctimas de envenenamiento o en colaborar en la investigación forense en un caso de sobredosis fatal. Los niños nacidos de madres que recibieron sulfato de magnesio parenteral durante el parto pueden presentar toxicidad a la concentración de magnesio que se consideraban apropiados para las madres.
El magnesio en la depresión resistente al tratamiento (TRD)
Ha habido cierta especulación de que la deficiencia de magnesio puede conducir a la depresión. Líquido cefalorraquídeo (LCR) de magnesio cerebral se ha encontrado bajo en la depresión suicida resistente al tratamiento y en pacientes que han intentado suicidarse. Magnesio cerebro se ha encontrado bajo en TRD utilizando espectroscopia de resonancia magnética nuclear de fósforo, un medio preciso para medir el magnesio cerebro. Sangre y magnesio CSF no aparecen bien correlacionados con la depresión mayor. Cloruro de magnesio en dosis relativamente pequeñas se encontró como eficaz en el tratamiento de la depresión de tipo 2 de edad avanzada diabéticos con hipomagnesemia como la imipramina 50 mg al día.
El magnesio en la enfermedad
Los resultados de un meta-análisis de ensayos clínicos aleatorios han demostrado que los suplementos de magnesio reduce la presión arterial alta de forma dependiente de la dosis. Niveles bajos de magnesio en suero se asocian con síndrome metabólico, la diabetes mellitus tipo 2 y la hipertensión . Niveles bajos de magnesio en suero se han asociado con un mayor riesgo de desarrollar síndrome metabólico. Terapia de magnesio es recomendado por la ACC / AHA / ESC 2006 Directrices para la gestión de pacientes con arritmias ventriculares y la prevención de la muerte súbita en los pacientes con ventricular asociado con arritmia torsade de pointes que presentan síndrome de QT largo, así como para el tratamiento de pacientes con arritmias inducidas por intoxicación-digoxina. El magnesio es también el fármaco de elección en el manejo de preeclampsia y eclampsia.
Además de su papel terapéutico, el magnesio tiene un efecto beneficioso adicional sobre calcificación. Los pacientes con enfermedad renal crónica tienen una alta prevalencia de calcificación vascular, y la enfermedad cardiovascular es la causa principal de muerte en esta población. Varios estudios in vitro y en animales apuntan hacia un papel protector de magnesio a través de múltiples mecanismos moleculares. El magnesio es un antagonista del calcio natural y dos estudios en humanos y en animales han demostrado que baja los niveles circulantes de magnesio se asocian con la calcificación vascular. Los resultados de un estudio observacional realizado en la población japonesa en general demostraron que los niveles de magnesio sérico más bajos se asociaron significativamente y de forma independiente con un mayor promedio de grosor íntima-media y el riesgo de al menos dos placas carotídeas. Los suplementos de magnesio podría ser útil en la reducción de la progresión de la aterosclerosis en pacientes en diálisis crónica. Magnesio sérico bajo puede ser un factor de riesgo independiente de muerte en los pacientes con enfermedad renal crónica, y los pacientes con niveles séricos de magnesio ligeramente elevados podría tener una ventaja de supervivencia sobre los que tenían niveles más bajos de magnesio.
Precauciones de seguridad para el metal de magnesio
El metal magnesio y sus aleaciones son peligros de explosión; que son altamente inflamables en su forma pura en estado fundido o en polvo o en forma de cinta. Ardor o magnesio metal fundido reacciona violentamente con el agua. Cuando se trabaja con el magnesio en polvo, gafas de seguridad con soldadura protección para los ojos están empleados, debido a que la luz blanca brillante producida por la quema de magnesio contiene ultravioleta luz que puede dañar permanentemente las retinas de los ojos.
El magnesio es capaz de reducir el agua a muy inflamable de hidrógeno gas:
- Mg (s) + 2 H2O (l) → Mg (OH) 2 (s) + H 2 (g)
Como resultado, el agua no puede extinguir incendios de magnesio. El gas hidrógeno producido sólo intensifica el fuego. Arena seca es un agente asfixiante eficaz, pero sólo en superficies relativamente nivelada y plana.
El magnesio también reacciona con el dióxido de carbono para formar óxido de magnesio y de carbono :
- 2 Mg (s) + CO → 2 2 MgO (s) + C (s)
Por lo tanto, los extintores de incendios de dióxido de carbono no se pueden utilizar para la extinción de incendios de magnesio tampoco.
La quema de magnesio se inactivó por lo general mediante el uso de una Clase D seco extintor de fuego químico, o cubriendo el fuego con arena o fundición de magnesio flujo para eliminar la fuente de aire.


