
Manganeso
Acerca de este escuelas selección Wikipedia
Esta selección se hace para las escuelas por caridad para niños leer más . Haga clic aquí para obtener información sobre el apadrinamiento de niños.
| Manganeso | ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
25 Mn | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
| Apariencia | ||||||||||||||||||||||||||||||||||||||||
metálico plateado  | ||||||||||||||||||||||||||||||||||||||||
| Propiedades generales | ||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | manganeso, Mn, 25 | |||||||||||||||||||||||||||||||||||||||
| Pronunciación | / m æ ŋ ɡ ən yo z / MANG -gə-Neez | |||||||||||||||||||||||||||||||||||||||
| Categoría Elemento | metal de transición | |||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 7, 4, d | |||||||||||||||||||||||||||||||||||||||
| Peso atómico estándar | 54.938045 (5) | |||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Ar ] 4s 2 3d 5 2, 8, 13, 2 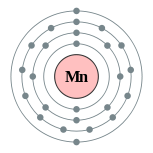 | |||||||||||||||||||||||||||||||||||||||
| Historia | ||||||||||||||||||||||||||||||||||||||||
| Descubrimiento | Torbern Olof Bergman (1770) | |||||||||||||||||||||||||||||||||||||||
| Primer aislamiento | Johann Gottlieb Gahn (1774) | |||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | |||||||||||||||||||||||||||||||||||||||
| Densidad (cerca rt) | 7,21 g · cm -3 | |||||||||||||||||||||||||||||||||||||||
| Líquido densidad en mp | 5,95 g · cm -3 | |||||||||||||||||||||||||||||||||||||||
| Punto de fusion | 1519 K , 1246 ° C, 2275 ° F | |||||||||||||||||||||||||||||||||||||||
| Punto de ebullicion | 2334 K, 2061 ° C, 3742 ° F | |||||||||||||||||||||||||||||||||||||||
| Calor de fusión | 12.91 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||
| El calor de vaporización | 221 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||
| Capacidad calorífica molar | 26.32 J · mol -1 · K -1 | |||||||||||||||||||||||||||||||||||||||
| Presión del vapor | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||
| Estados de oxidación | 7, 6, 5, 4, 3, 2, 1, -1, -2, -3 (óxidos de: ácidos, básicos o anfóteros dependiendo del estado de oxidación) | |||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 1,55 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||
| Energías de ionización ( más) | Primero: 717.3 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||
| Segundo: 1509,0 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||
| Tercero: 3248 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||
| Radio atómico | 127 pm | |||||||||||||||||||||||||||||||||||||||
| Radio covalente | 139 ± 5 (de bajo espín), 161 ± 8 (alta rotación) pm | |||||||||||||||||||||||||||||||||||||||
| Miscelánea | ||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | centrada en el cuerpo cúbico  | |||||||||||||||||||||||||||||||||||||||
| Ordenamiento magnético | paramagnético | |||||||||||||||||||||||||||||||||||||||
| La resistividad eléctrica | (20 ° C) 1,44 μΩ · m | |||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 7.81 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||
| Expansión térmica | (25 ° C) 21,7 m · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido (varilla delgada) | (20 ° C) 5150 m · s -1 | |||||||||||||||||||||||||||||||||||||||
| El módulo de Young | 198 GPa | |||||||||||||||||||||||||||||||||||||||
| Módulo de volumen | 120 GPa | |||||||||||||||||||||||||||||||||||||||
| Dureza de Mohs | 6.0 | |||||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 196 MPa | |||||||||||||||||||||||||||||||||||||||
| Número de registro del CAS | 7439-96-5 | |||||||||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | ||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de manganeso | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
El manganeso es un elemento químico , designado por el símbolo Mn. Tiene el número atómico 25. Se encuentra como un elemento libre en la naturaleza (a menudo en combinación con hierro), y en muchos minerales. El manganeso es un metal con importantes usos de aleaciones de metales industriales, sobre todo en los aceros inoxidables.
Históricamente, el manganeso es el nombre de varios minerales negros (como pirolusita) de la misma región de Magnesia en Grecia, que dio nombre a sonido similar de magnesio , Mg, y magnetita, un mineral del elemento hierro, Fe. A mediados del siglo 18, el químico sueco Carl Wilhelm Scheele había utilizado pirolusita para producir cloro . Scheele y otros eran conscientes de que pirolusita (ahora se sabe que el dióxido de manganeso) contenía un nuevo elemento, pero no fueron capaces de aislarlo. Johan Gottlieb Gahn fue el primero en aislar una muestra impura de metal de manganeso en 1774, por reducir el dióxido de carbono .
Fosfatación de manganeso se utiliza como un tratamiento para la prevención de la herrumbre y la corrosión en el acero. Dependiendo de su estado de oxidación, iones de manganeso tienen varios colores y se utilizan industrialmente como pigmentos . La permanganatos de alcalinos y metales alcalinotérreos son oxidantes poderosos. El dióxido de manganeso se utiliza como el material de cátodo (aceptor de electrones) en zinc-carbono y pilas alcalinas.
En biología, manganeso (II) iones funcionan como cofactores para una gran variedad de enzimas con muchas funciones. Enzimas manganeso son particularmente esencial en la desintoxicación de los radicales libres superóxido en los organismos que deben lidiar con oxígeno elemental. El manganeso también funciones en el complejo generador de oxígeno de las plantas fotosintéticas. El elemento es un oligoelemento necesario para todos los organismos vivos conocidos. En cantidades mayores, y aparentemente con mucha mayor actividad por inhalación, manganeso puede causar una síndrome de envenenamiento en los mamíferos, con el daño neurológico que a veces es irreversible.
Características
Propiedades físicas

El manganeso es un gris plateado de metal que se asemeja hierro. Es duro y muy frágil, difícil de fusible, pero fácil de oxidar. De metal de manganeso y sus iones comunes son paramagnético. Manganeso empaña lentamente en el aire y "roya" como el hierro, en agua que contiene oxígeno disuelto.
Isótopos
Naturalmente manganeso que ocurren se compone de una estable isótopo , 55 Mn. Dieciocho radioisótopos se han caracterizado, con ser más estable 53 Mn con una vida media de 3,7 millones de años, 54 Mn con una vida media de 312,3 días, y 52 Mn con una vida media de 5,591 días. Todos los restantes isótopos radiactivos tienen vidas medias que son menos de tres horas y la mayoría de ellos tienen vidas medias que son menos de un minuto. Este elemento también tiene tres estados de la meta.
El manganeso es parte del hierro grupo de elementos, que se cree que son sintetizados en grandes estrellas poco antes de la supernova explosión. 53 Mn decae a 53 Cr con una vida media de 3,7 millones de años. Debido a su vida media relativamente corta, 53 Mn se produce sólo en pequeñas cantidades debido a la acción de los rayos cósmicos sobre el hierro en las rocas. Contenidos isotópicos de manganeso se suelen combinar con cromo contenidos isotópicos y han encontrado aplicación en geología isotópica y datación radiométrica. Mn-Cr relaciones isotópicas refuerzan la evidencia de los 26 de Al y 107 Pd para la historia temprana del Sistema Solar . Las variaciones en 53 CR / 52 relaciones de Cr y Mn / Cr de varios meteoritos indican una relación Mn 53 Mn / 55 inicial que sugiere Mn-Cr composición isotópica debe ser el resultado de la caries in situ de 53 Mn en cuerpos planetarios diferenciados. Por lo tanto 53 Mn proporciona evidencia adicional para procesos de nucleosíntesis inmediatamente antes de la coalescencia del Sistema Solar .
Los isótopos de manganeso varían en peso atómico de 46 u (46 Mn) a 65 u (65 Mn). El primario modo de decaimiento antes del isótopo estable más abundante, 55 Mn, es captura de electrones y el modo primario después de que se desintegración beta.
Propiedades químicas
Los más comunes estados de oxidación del manganeso son 2, 3, 4, 6 y 7, aunque se observan estados de oxidación -3-7. Mn 2+ menudo compite con Mg 2+ en los sistemas biológicos. Los compuestos de manganeso, donde el manganeso se encuentra en estado de oxidación 7, que se limitan al óxido inestable Mn 2 O 7 y los compuestos de anión permanganato intensamente púrpura MnO 4 -, son de gran alcance agentes oxidantes. Los compuestos con estados de oxidación 5 (azul) y 6 (verde) son agentes oxidantes fuertes y son vulnerables a desproporción.


El estado de oxidación más estable para el manganeso es 2, que tiene un color rosa pálido, y muchos de manganeso (II) compuestos son conocidos, tales como manganeso (II) sulfato (MnSO 4) y manganeso (II) cloruro (MnCl2). Este estado de oxidación también se ve en la rodocrosita mineral ( manganeso (II) carbonato). El estado de oxidación +2 es el estado utilizado en los organismos para las funciones esenciales que viven; otros estados son tóxicos para el cuerpo humano. El 2 oxidación de Mn resulta de la eliminación de los dos electrones 4s, dejando un ion de "alto spin" en la que los cinco de los orbitales 3d contienen un solo electrón. La absorción de luz visible por este ión se lleva a cabo solamente por una transición de espín-prohibido en la que uno de los electrones d debe emparejarse con otro, para dar el átomo de un cambio en el giro de dos unidades. La improbabilidad de tal transición se ve en la naturaleza uniformemente pálido y casi incoloro de Mn (II) compuestos con respecto a otros estados de oxidación de manganeso.
| Estados de oxidación de manganeso | |
|---|---|
| 0 | Mn 2 (CO) 10 |
| 1 | MNC 5 H 4 CH 3 (CO) 3 |
| 2 | MnCl2 |
| 3 | MNF 3 |
| 4 | MnO2 |
| 5 | K MnO 3 4 |
| 6 | K 2 MnO 4 |
| 7 | KMnO4 |
El estado de oxidación +3 es conocido en compuestos como manganeso (III) acetato de etilo, pero estos son bastante potente agentes oxidantes y también propensos a desproporción en solución al manganeso (II) y manganeso (IV). Compuestos sólidos de manganeso (III) se caracterizan por su preferencia por la coordinación octaédrica distorsionada debido a la Efecto Jahn-Teller y su fuerte color rojo púrpura.
El estado de oxidación 5+ puede obtenerse si el dióxido de manganeso se disuelve en fundido nitrito de sodio. Manganato sales (VI) también pueden ser producidos por compuestos de Mn de disolución, tales como dióxido de manganeso, en alcalinos fundidos mientras expone al aire.
Permanganato compuestos (7 oxidación estatales) son de color púrpura, y pueden dar un vidrio color violeta. El permanganato de potasio , permanganato de sodio y permanganato de bario son todos los oxidantes potentes. El permanganato de potasio, también llamado cristales de Condy, es un laboratorio de uso general reactivo debido a sus propiedades oxidantes y encuentra uso como un medicamento tópico (por ejemplo, en el tratamiento de enfermedades de los peces). Las soluciones de permanganato de potasio fueron de los primeros manchas y fijadores para ser utilizado en la preparación de células biológicas y tejidos para microscopía electrónica.
Historia
El origen del nombre de manganeso es compleja. En la antigüedad, dos minerales negros de Magnesia en lo que hoy es la Grecia moderna, ambos llamados magnes de su lugar de origen, pero se cree que difieren en género. Los magnes varones atraídos hierro, y fue el mineral de hierro que hoy conocemos como magnetita o magnetita, y que probablemente nos dio el término imán . El mineral magnes femeninos no atrajo hierro, pero fue utilizado para decolorar el vidrio. Este femeninos magnes más tarde fue llamado magnesia, conocidos ahora en los tiempos modernos como pirolusita o dióxido de manganeso. Ni este ni mineral de manganeso en sí es magnético. En el siglo 16, el dióxido de manganeso se llama ma n ga n eSUM (tenga en cuenta los dos n es en lugar de uno) por los fabricantes de vidrio, posiblemente como la corrupción y la concatenación de dos palabras, como alquimistas y vidrieros finalmente tuvieron que diferenciar un mag n ESIA n egra (el mineral negro) del alba mag n ESIA (un mineral de color blanco, también de Magnesia, también es útil en la fabricación de vidrio). Michele Mercati llamado magnesia negra Manganesa, y finalmente el metal aislado de ella se hizo conocido como el manganeso (alemán: Mangan). El nombre magnesia finalmente se utilizó para referirse sólo al blanco magnesia alba (óxido de magnesio), que proporcionó el nombre de magnesio para ese elemento libre, cuando fue finalmente aislado, mucho más tarde.

Varios óxidos de manganeso, por ejemplo dióxido de manganeso, son abundantes en la naturaleza, y debido a su color, estos óxidos se han utilizado como desde la Edad de Piedra . Las pinturas rupestres de Gargas contiene manganeso como pigmentos y estas pinturas rupestres son 30.000 y 24.000 años de antigüedad.
Los compuestos de manganeso fueron utilizadas por los vidrieros egipcios y romanos, ya sea a eliminar el color de vidrio o añadir color a la misma. El uso como "jabón vidrieros" continuó a través de la Edad Media hasta los tiempos modernos y es evidente en el vidrio del siglo 14 de Venecia.

Debido a la utilización en la fabricación de vidrio, dióxido de manganeso estaba disponible para alquimistas, los primeros químicos, y se utilizó para experimentos. Ignacio Gottfried Kaim (1770) y Johann Glauber (siglo 17) descubrió que el dióxido de manganeso podría convertirse en permanganato, un reactivo de laboratorio útil. A mediados del siglo 18, el químico sueco Carl Wilhelm Scheele utiliza dióxido de manganeso para producir cloro . En primer lugar, el ácido clorhídrico , o una mezcla de diluida de ácido sulfúrico y cloruro de sodio se hizo reaccionar con dióxido de manganeso, ácido clorhídrico después de la Se utilizó proceso de Leblanc y el dióxido de manganeso se recicló por la Proceso Weldon. La producción de cloro y hipoclorito contiene agentes de blanqueo era un gran consumidor de minerales de manganeso.
Scheele y otros químicos eran conscientes de que el dióxido de manganeso contenía un nuevo elemento, pero no fueron capaces de aislarlo. Johan Gottlieb Gahn fue el primero en aislar una muestra impura de metal de manganeso en 1774, por reducir el dióxido de carbono .
El contenido de manganeso de algunos minerales de hierro utilizados en Grecia llevó a las especulaciones de que el acero producido a partir de que el mineral contiene cantidades inadvertidas de manganeso, por lo que el Spartan acero excepcionalmente duro. Alrededor del principio del siglo 19, se utilizó manganeso en la fabricación de acero y se concedieron varias patentes. En 1816, se observó que la adición de manganeso a hierro hizo más difícil, sin hacer más frágil. En 1837, académico británico James Couper observó una asociación entre la exposición al manganeso pesados en minas con una forma de Enfermedad de Parkinson. En 1912, el manganeso fosfatación revestimientos de conversión electroquímicos para la protección de armas de fuego contra la herrumbre y la corrosión se patentado en los Estados Unidos, y han tenido un uso generalizado desde entonces.
La invención de la Pila Leclanché en 1866 y la posterior mejora de las baterías que contienen dióxido de manganeso como catódica despolarizador aumentó la demanda de dióxido de manganeso. Hasta la introducción de la batería de níquel-cadmio y de baterías que contienen litio, la mayoría de las baterías contienen manganeso. La batería de zinc-carbono y la pila alcalina normalmente utilizan dióxido de manganeso producidos industrialmente, porque el dióxido de manganeso que ocurren natural contiene impurezas. En el siglo 20, dióxido de manganeso ha visto amplio uso comercial como material catódico jefe de pilas secas desechables comerciales y pilas secas, tanto de la norma (zinc-carbón) y las alcalinas.
Ocurrencia y producción
Manganeso constituye alrededor del 1000 ppm (0,1%) de la corteza de la Tierra , por lo que es el elemento más abundante 12 allí. El suelo contiene 7-9000 ppm de manganeso con un promedio de 440 ppm. El agua de mar tiene sólo 10 ppm de manganeso y la atmósfera contiene 0,01 g / m 3. El manganeso se encuentra principalmente como pirolusita ( MnO 2), braunite, (Mn 2+ Mn 3+ 6) (SiO 12), psilomelane (Ba, H 2 O) 2 Mn 5 O 10, y en menor medida como rodocrosita ( MnCO 3).
 |  |  |  |  |
| Mineral de manganeso | Psilomelane (mineral de manganeso) | Especular es una aleación de hierro con un contenido de manganeso de aproximadamente el 15% | Óxido de manganeso dendritas en la piedra caliza de Solnhofen, Alemania - una especie de pseudofossil. La escala es en mm | Rodocrosita Mineral ( manganeso (II) carbonato) en la que el color rojo profundo es debido a las impurezas, no manganeso |
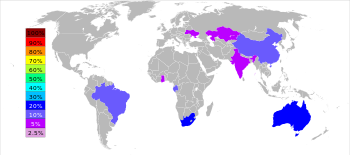
El mineral de manganeso más importante es pirolusita ( MnO 2). Otros minerales de manganeso de importancia económica por lo general muestran una relación espacial cerca de los minerales de hierro. Recursos terrestres son grandes, pero distribuida irregularmente. Alrededor del 80% de los recursos conocidos de manganeso mundo se encuentran en África del Sur ; otros importantes yacimientos de manganeso están en Ucrania , Australia , la India , de China , Gabón y Brasil . En 1978, 500 millones de toneladas de Se estimaron los nódulos de manganeso de existir en la fondo del océano. Los intentos de encontrar métodos económicamente viables de nódulos de manganeso de cosecha fueron abandonadas en la década de 1970. Para una artimaña de la Guerra Fría, la CIA había tenido el multimillonario Howard Hughes encargar un barco, el Hughes Glomar Explorer para ir a Hawai para cosechar los nódulos de manganeso. Esa nave comenzó una oleada de gente que quería recoger los nódulos de manganeso del fondo del mar, que es poco práctico. El Glomar Explorador Hughes fue construida en realidad para criar a un submarino ruso hundido, el K-129. Por desgracia para la CIA, la parte del submarino que contiene los libros de códigos se interrumpió mientras se estaba levantado, por lo que no consiguió lo que quería.
El manganeso se extrae en África del Sur, Australia, China, Brasil, Gabón, Ucrania, India y Ghana y Kazajstán . Fuentes estadounidenses de importación (1998-2001): el mineral de manganeso: Gabón, el 70%; Africa del Sur, 10%; Australia, 9%; México, 5%; y otra, 6%. Ferromanganeso: África del Sur, el 47%; Francia, el 22%; México, 8%; Australia, 8%; y otros, 15%. El manganeso contenido en todas las importaciones de manganeso: África del Sur, el 31%; Gabón, el 21%; Australia, el 13%; México, 8%; y otros, 27%.
Para la producción de ferromanganeso, el mineral de manganeso se mezcla con el mineral de hierro y carbono, y después se redujo ya sea en un alto horno o en un horno de arco eléctrico. La resultante ferromanganeso tiene un contenido de manganeso de 30 a 80%. El manganeso puro utilizado para la producción de aleaciones noniron es producido por lixiviación de mineral de manganeso con ácido sulfúrico y un subsiguiente proceso de extracción electrolítica.
Aplicaciones
El manganeso tiene sustituto satisfactorio en sus principales aplicaciones, que están relacionados con el uso de aleación metalúrgica. En aplicaciones de menor importancia, (por ejemplo, fosfatado manganeso), zinc y algunas veces vanadio son sustitutos viables. En la fabricación de baterías desechables, las células estándar y alcalinas de manganeso utilizando serán sustituidos generalmente en el futuro con tecnología de las baterías de litio.
Acero

El manganeso es indispensable planchar y la producción de acero en virtud de su azufre fijación, desoxidante, y aleación propiedades. La fabricación de acero, incluyendo su componente de fabricación de hierro, ha sido responsable de la demanda más de manganeso, en la actualidad en el intervalo de 85% a 90% de la demanda total. Entre una variedad de otros usos, el manganeso es un componente clave de bajo costo formulaciones de acero inoxidable.
Pequeñas cantidades de manganeso mejora la trabajabilidad del acero a altas temperaturas, debido a que forma un sulfuro de alta fusión y por lo tanto previene la formación de un líquido sulfuro de hierro en los límites de grano. Si el contenido de manganeso alcanza 4%, la fragilización del acero se convierte en una característica dominante. La fragilización disminuye a mayores concentraciones de manganeso y alcanza un nivel aceptable en el 8%. Acero que contiene de 8 a 15% de manganeso puede tener un alto resistencia a la tracción de hasta 863 MPa. De acero con 12% de manganeso se utilizó para British cascos de acero. Esta composición del acero fue descubierto en 1882 por Robert Hadfield y todavía se conoce como Acero Hadfield.
Las aleaciones de aluminio
La segunda gran aplicación para el manganeso es como agente de aleación de aluminio . De aluminio con un contenido de manganeso de alrededor de 1,5% tiene una mayor resistencia a la corrosión debido a la formación de granos de absorción de impurezas que puedan conducir a la corrosión galvánica. La resistente a la corrosión aleaciones de aluminio 3004 y 3104 con un contenido de manganeso de 0,8 a 1,5% son las aleaciones utilizadas para la mayor parte de la latas de bebidas. Antes año 2000, en exceso de 1,6 millones toneladas se han utilizado de esas aleaciones; con un contenido de 1% de manganeso, esta cantidad sería necesario 16.000 toneladas de manganeso.
Otros usos
Metilciclopentadienil tricarbonilo de manganeso se utiliza como un aditivo en la gasolina sin plomo para impulsar octanaje y reducir detonaciones del motor. El manganeso en este compuesto organometálico inusual está en el estado de oxidación +1.
El manganeso (IV) óxido (dióxido de manganeso, MnO 2) se utiliza como reactivo en química orgánica para la oxidación de bencílicos alcoholes (es decir, adyacente a una anillo aromático). El dióxido de manganeso se ha utilizado desde la antigüedad para neutralizar la oxidación tinte verdoso en el vidrio causado por trazas de contaminación por hierro. MnO 2 también se utiliza en la fabricación de oxígeno y cloro, y en el secado de pinturas negras. En algunas preparaciones, es un marrón pigmento que se puede utilizar para hacer pintar y es un constituyente de los recursos naturales ocre.
El manganeso (IV) óxido se utiliza en el tipo original de pila seca de la batería como un aceptor de electrones de zinc, y es el material negruzco encontrado al abrir las células de tipo linterna de carbono-zinc. El dióxido de manganeso se reduce a la MnO óxido-hidróxido de manganeso (OH) durante la descarga, la prevención de la formación de hidrógeno en el ánodo de la batería.
- MnO2 + H2O + -
e → MnO (OH) + OH -
El mismo material también funciona en más reciente pilas alcalinas (células generalmente, batería), que utilizan la misma reacción básica, sino una mezcla de electrolitos diferente. En 2002, se utilizaron más de 230.000 toneladas de dióxido de manganeso para este propósito.

El metal se utiliza en contadas ocasiones en las monedas; hasta el año 2000, la única moneda de Estados Unidos de utilizar manganeso fue la "Tiempos de guerra" de níquel a partir de 1942 a 1945. Una aleación de 75% de cobre y 25% de níquel se ha utilizado tradicionalmente para la producción de las monedas de níquel. Sin embargo, debido a la escasez de metal de níquel durante la guerra, fue sustituido por más disponibles plata y manganeso, lo que resulta en una aleación de 56% de cobre, 35% de plata y 9% de manganeso. Desde el año 2000, monedas de un dólar, por ejemplo la Dólar y el Sacagawea Presidenciales monedas de 1 dólar, se hacen de un latón que contiene 7% de manganeso con un núcleo de cobre puro. En ambos casos de níquel y el dólar, el uso de manganeso en la moneda era duplicar las propiedades electromagnéticas de una moneda de tamaño idéntico y valorado anterior, para fines de venta. En el caso de las monedas de dólar posteriores, la aleación de manganeso fue un intento de duplicar propiedades de la aleación de cobre / níquel utilizado en la anterior Dólar de Susan B. Anthony.
Los compuestos de manganeso se han utilizado como pigmentos y para la coloración de cerámica y vidrio. El color marrón de cerámica se basa a veces en los compuestos de manganeso. En la industria del vidrio, compuestos de manganeso se usan para dos efectos. El manganeso (III) reacciona con el hierro (II) para inducir un fuerte color verde en el vidrio mediante la formación de hierro de menos de color (III) y manganeso ligeramente rosado (II), compensando el color residual del hierro (III). Grandes cantidades de manganeso se utilizan para producir vidrio de color rosa.
Papel biológico
El manganeso es un nutriente traza esencial en todas las formas de vida. Las clases de enzimas que tienen manganeso cofactores son muy amplias, e incluyen oxidorreductasas, transferasas, hidrolasas, liasas, isomerasas, ligasas, lectinas, y integrinas. La transcriptasas de muchos revertir retrovirus (aunque no lentivirus tales como el VIH ) contienen manganeso. El más conocido de manganeso que contiene Los polipéptidos pueden estar arginasa, la toxina de la difteria, y que contienen Mn superóxido dismutasa ( Mn-SOD).
Mn-SOD es el tipo de SOD presente en las mitocondrias eucariota, y también en la mayoría de las bacterias (este hecho está en consonancia con la teoría bacteriana origen de las mitocondrias). La enzima Mn-SOD es probablemente uno de los más antiguos, para casi todos los organismos vivos en presencia del uso de oxígeno para hacer frente a los efectos tóxicos de superóxido, formado a partir de la reducción de 1 electrón de dioxígeno. Las excepciones incluyen unos pocos tipos de bacterias, como Lactobacillus plantarum y relacionados lactobacilos, que utilizan un mecanismo no enzimático diferente, con la participación de manganeso (Mn 2+) complejado con iones polifosfato directamente para esta tarea, lo que indica cómo posiblemente evolucionó esta función en la vida aeróbica.
El cuerpo humano contiene aproximadamente 12 mg de manganeso, que se almacena principalmente en los huesos; en el tejido, se concentra principalmente en el hígado y los riñones. En el cerebro humano, el manganeso está unido al manganeso metalloproteins, sobre todo glutamina sintetasa en astrocitos.
El manganeso también es importante en fotosintética la evolución de oxígeno en cloroplastos en las plantas. La compleja evolución de oxígeno (OEC) es una parte del fotosistema II contenida en las membranas tilacoides de los cloroplastos; es responsable de la terminal de fotooxidación de agua durante el reacciones luminosas de la fotosíntesis , y tiene un núcleo metaloenzima contiene cuatro átomos de manganeso. Por esta razón, la mayoría de los fertilizantes de plantas de amplio espectro contienen manganeso.
Precauciones
Los compuestos de manganeso son menos tóxicos que los de otros metales generalizadas, como el níquel y el cobre . Sin embargo, la exposición a polvos y humos de manganeso no debe superar el valor límite de 5 mg / m 3, incluso por períodos debido a su nivel de toxicidad cortos. Envenenamiento por manganeso se ha relacionado con la capacidad motora y trastornos cognitivos.
El permanganato exhibe una toxicidad mayor que los compuestos de manganeso (II). La dosis letal es de 10 g, y se han producido varias intoxicaciones fatales. El efecto oxidativo fuerte conduce a la necrosis de la membrana mucosa. Por ejemplo, el esófago se ve afectada si el permanganato se traga. Sólo una cantidad limitada es absorbida por los intestinos, pero esta cantidad pequeña muestra efectos severos en los riñones y en el hígado.
En 2005, un estudio sugirió un posible vínculo entre la inhalación de manganeso y la toxicidad del sistema nervioso central en ratas.
La exposición al manganeso en Estados Unidos está regulado por Administración de Seguridad y Salud.
En general, la exposición a concentraciones de aire ambient Mn por encima de 5 mg Mn / m3 puede conducir a síntomas inducidos por Mn. Aumentado expresión de la proteína ferroportina en células de riñón embrionario humano (HEK293) se asocia con la disminución de la concentración intracelular Mn y la citotoxicidad atenuada, caracterizado por la reversión de Mn-reducido la captación de glutamato y disminuida fuga de lactato deshidrogenasa.
Problemas de salud ambiental
El manganeso en el agua potable
Manganeso a base de agua tiene una biodisponibilidad mayor que el manganeso de la dieta. Según los resultados de un estudio de 2010, los niveles más altos de exposición al manganeso en el agua potable están asociados con un mayor deterioro intelectual y reducido cocientes de inteligencia en los niños de edad escolar. Es la hipótesis de que la exposición a largo plazo a los de manganeso que ocurren naturalmente en el agua de ducha pone hasta 8,7 millones de estadounidenses en riesgo.
El manganeso en la gasolina
Metilciclopentadienil tricarbonilo de manganeso (MMT) es un aditivo de la gasolina utilizada para reemplazar los compuestos de plomo para las gasolinas sin plomo, para mejorar el número de octano en bajo octanaje destilados número de gasolina. Funciona como un agente antidetonante por la acción de los grupos carbonilo. Los combustibles que contienen manganeso tienden a formar carburos de manganeso, que dañan las válvulas de escape. La necesidad de utilizar compuestos de plomo o de manganeso es meramente histórico, como la disponibilidad de los procesos de reforma que crean combustibles de calificación de alto octanaje incrementado. El uso de tales combustibles directamente o en mezcla con los destilados no reformados es universal en los países desarrollados (la UE, Japón, etc.). En EE.UU. el imperativo de ofrecer el precio más bajo posible por volumen de los combustibles de motor (baja tasa de impuestos sobre el combustible) y legistation laxa del contenido de combustible (antes de 2000) causó refinerías utilicen MMT. En comparación con 1953, los niveles de manganeso en el aire han descendido. Muchas competiciones de carreras prohíben específicamente compuestos de manganeso en combustible de carreras (compra, minibike). MMT contiene 24,4 a 25,2% de manganeso. Hay una fuerte correlación entre las concentraciones de manganeso atmosféricas elevadas y la densidad del tráfico automovilístico.
Papel en los trastornos neurológicos
Manganismo
Sobreexposición manganeso se asocia más frecuentemente con manganismo, un trastorno neurológico raro asociado con la ingestión excesiva de manganeso o inhalación. Históricamente, las personas empleadas en la producción o elaboración de aleaciones de manganeso han estado en riesgo de desarrollar manganismo; Sin embargo, las normas de higiene y seguridad protegen a los trabajadores en las naciones desarrolladas. El trastorno fue descrito por primera vez en 1837 por académico británico John Couper, que estudió dos pacientes que eran molinos de manganeso.
Manganismo es un trastorno bifásica. En sus primeras etapas, una persona intoxicada puede experimentar depresión, cambios de humor, conductas compulsivas, y la psicosis. Los primeros síntomas neurológicos dan paso a manganismo la última etapa, que se asemeja Enfermedad de Parkinson. Los síntomas incluyen debilidad, monótono y lento del habla, un rostro inexpresivo, temblor, marcha adelante-inclinada, incapacidad para caminar hacia atrás sin caerse, rigidez y problemas generales con la destreza, la marcha y el equilibrio. Desemejante La enfermedad de Parkinson, manganismo no está asociado con la pérdida del olfato y los pacientes son típicamente no responde al tratamiento con L DOPA. Los síntomas de la etapa tardía manganismo empeoran con el tiempo, incluso si se elimina la fuente de exposición y niveles de manganeso cerebro vuelva a la normalidad.
Trastornos del desarrollo de la infancia
Varios estudios recientes tratan de examinar los efectos de la crónica de dosis bajas de manganeso sobre exposición sobre el desarrollo en los niños. El primer estudio de este tipo se llevó a cabo en la provincia china de Shanxi. El agua potable no habían sido contaminados a través del riego de aguas residuales inadecuada y contenida 240-350 mg Mn / L. Aunque las concentraciones WMN iguales o inferiores a 300 mg Mn / L son considerados seguros por los EE.UU. EPA y 400 mg Mn / L se considera seguro por la OMS, los 92 niños incluidos en la muestra (entre 11 y 13 años de edad) de esta provincia muestran menor rendimiento en las pruebas de destreza manual y la rapidez, la memoria a corto plazo, y la identificación visual en comparación con los niños de una zona no contaminada. Más recientemente, un estudio de niños de 10 años de edad en Bangladesh mostró una relación entre la concentración de WMN en agua de pozo y las puntuaciones de CI disminuyó. Un tercer estudio realizado en Quebec examinó los escolares de entre 6 y 15 años que viven en hogares que reciben agua de un pozo que contiene 610 mg Mn / L; controles vivían en hogares que recibieron el agua de un 160 mg Mn / L también. Los niños del grupo experimental mostraron un aumento de conductas hiperactivas y de oposición.
Las enfermedades neurodegenerativas
Crónica de dosis bajas de manganeso intoxicación está fuertemente implicado en un número de enfermedades neurodegenerativas, incluyendo la enfermedad de Alzheimer , La enfermedad de Parkinson, y esclerosis lateral amiotrófica. También puede jugar un papel en el desarrollo de la esclerosis múltiple , El síndrome de piernas inquietas y la enfermedad de Huntington . Una proteína llamada DMT1 es el principal transportador relacionado con la absorción de manganeso desde el intestino, y puede ser el principal transportador de manganeso a través de la barrera hematoencefálica. DMT1 también transporta manganeso inhalado a través del epitelio nasal. El mecanismo putativo de acción es que la sobreexposición y / o desregulación de manganeso conduce a estrés oxidativo, disfunción mitocondrial, la excitotoxicidad mediada por glutamato, y los agregados de proteína.


