
Meitnerium
Acerca de este escuelas selección Wikipedia
SOS Children, una organización benéfica educación , organizó esta selección. SOS Children trabaja en 45 países africanos; puede ayudar a un niño en África ?
| Meitnerium | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
109 Mt | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Apariencia | |||||||||||||||||||||||||||||||||||||
| desconocido | |||||||||||||||||||||||||||||||||||||
| Propiedades generales | |||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | meitnerio, Mt, 109 | ||||||||||||||||||||||||||||||||||||
| Pronunciación | / m aɪ t n ɪər yo ə m / myt- TCEN -ee-əm o / m aɪ t n del ər yo ə m / MYT -nər-ee-əm | ||||||||||||||||||||||||||||||||||||
| Categoría Elemento | desconocido pero probablemente un metal de transición | ||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 9, 7, d | ||||||||||||||||||||||||||||||||||||
| Peso atómico estándar | [278] | ||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Rn ] 5f 14 6d 7 7s 2 (Calculado) 2, 8, 18, 32, 32, 15, 2 (Valor de referencia) 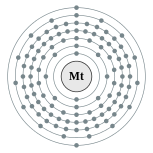 | ||||||||||||||||||||||||||||||||||||
| Historia | |||||||||||||||||||||||||||||||||||||
| Descubrimiento | Gesellschaft für Schwerionenforschung (1982) | ||||||||||||||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||||||||||||||
| Fase | sólido (prevista) | ||||||||||||||||||||||||||||||||||||
| Densidad (cerca rt) | 37.4 (prevista) g · cm -3 | ||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | |||||||||||||||||||||||||||||||||||||
| Estados de oxidación | 9, 8, 6, 4, 3, 1 (prevista) | ||||||||||||||||||||||||||||||||||||
| Energías de ionización ( más) | Primero: 800,8 (estimado) kJ · mol -1 | ||||||||||||||||||||||||||||||||||||
| Segundo: 1823.6 (estimado) kJ · mol -1 | |||||||||||||||||||||||||||||||||||||
| Tercero: 2904.2 (estimado) kJ · mol -1 | |||||||||||||||||||||||||||||||||||||
| Radio atómico | 122 (valor de referencia) pm | ||||||||||||||||||||||||||||||||||||
| Radio covalente | 129 (estimado) pm | ||||||||||||||||||||||||||||||||||||
| Miscelánea | |||||||||||||||||||||||||||||||||||||
| Estructura cristalina | cara cúbica centrada (prevista)  | ||||||||||||||||||||||||||||||||||||
| Ordenamiento magnético | paramagnético (prevista) | ||||||||||||||||||||||||||||||||||||
| Número de registro del CAS | 54038-01-6 | ||||||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | |||||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de meitnerio | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
Meitnerium es un elemento químico con el símbolo Mt y número atómico 109. Es un extremadamente radioactivo elemento sintético (un elemento que se puede crear en un laboratorio pero no se encuentra en la naturaleza); el isótopo conocido más estable, meitnerium-278, tiene una vida media de 7,6 segundos. Meitnerium fue creado por primera vez en 1982 por el GSI cerca Darmstadt, Alemania. Se llama así en honor al físico Lise Meitner.
En la tabla periódica , es una d-bloque Transactínido. Es un miembro de la Séptimo período y se coloca en el grupo 9 elementos, aunque no hay experimentos químicos han llevado a cabo para confirmar que se comporta como el más pesado homólogo de iridio en el grupo 9. Meitnerium se calcula que tiene propiedades similares a las de sus homólogos más ligeros, cobalto , rodio e iridio.
Historia
Descubrimiento
Meitnerium era primero sintetizado el 29 de agosto de 1982 por un equipo de investigación dirigido por el alemán Peter Armbruster y Gottfried Münzenberg en el Instituto de Investigación de Iones Pesados (Gesellschaft für Schwerionenforschung) en Darmstadt. El equipo bombardeó un blanco de bismuto-209 con núcleos acelerados de hierro -58 y detectado un solo átomo del isótopo meitnerium-266:
- 209
83 Bi + 58
26 Fe → 266
109 Mt + n
Naming
El nombramiento de meitnerio fue discutido en el elemento nombrar controversia con respecto a los nombres de los elementos 104 a 109, pero meitnerio fue la única propuesta y por lo tanto nunca se disputó. El nombre meitnerio (Mt) se sugirió en honor del físico austriaco Lise Meitner, co-descubridor del protactinio (con Otto Hahn), y uno de los descubridores de la fisión nuclear . En 1994 el nombre fue recomendado por IUPAC, y fue adoptado oficialmente en 1997.
Nucleosíntesis
Elementos súper pesados como meitnerio se producen mediante el bombardeo de elementos más ligeros en aceleradores de partículas que inducen reacciones de fusión. Considerando que el isótopo más ligero de meitnerio, meitnerio-266, se pueden sintetizar directamente de esta manera, todos los isótopos más pesados meitnerium sólo se han observado como productos de desintegración de elementos con mayores números atómicos .
Dependiendo de las energías involucradas, los primeros están separados en "caliente" y "frío". En las reacciones de fusión en caliente,, proyectiles de alta energía muy ligeros son acelerados hacia objetivos muy pesados ( actínidos ), dando lugar a núcleos compuestos en energía de alta excitación (~ 40-50 MeV) que puede evaporarse ya sea de fisión o varios 3 a 5) neutrones (. En las reacciones de fusión en frío, los núcleos condensados producidos tienen una energía de excitación relativamente baja (~ 10-20 MeV), que disminuye la probabilidad de que estos productos serán sometidos a las reacciones de fisión. Mientras los núcleos fundidos se enfríen a la estado fundamental, que requieren emisión de sólo uno o dos neutrones, y por lo tanto, permite la generación de productos más ricos en neutrones. Este último es un concepto diferente de la de la fusión nuclear, donde se reivindica que deberían alcanzarse en condiciones de temperatura ambiente (ver fusión fría).
Fusión fría
Después de la primera síntesis exitosa de meitnerio en 1982 por la Equipo GSI, un equipo de la Instituto Conjunto de Investigación Nuclear en Dubna, Rusia, también trató de observar el nuevo elemento al bombardear bismuto-209 con el hierro-58. En 1985 lograron alfa identidad decae desde el isótopo descendiente 246 Cf que indica la formación de meitnerio. La observación de otros dos átomos de 266 Mt de la misma reacción se reportó en 1988 y de otros 12 en 1997 por el equipo alemán en el GSI.
Lo mismo isótopo meitnerio también fue observado por el equipo ruso en Dubna en 1985 a partir de la reacción:
- 208
82 Pb + 59
27 Co → 266
109 Mt + n
mediante la detección de la desintegración alfa de los descendientes 246 núcleos Cf. En 2007, un equipo estadounidense en el Laboratorio Nacional Lawrence Berkeley (LBNL) confirmó la cadena de desintegración del isótopo 266 Mt de esta reacción.
Fusión caliente
En 2002-2003, el equipo en el LBNL intentó generar el isótopo 271 Mt para estudiar sus propiedades químicas bombardeando de uranio-238 con cloro -37, pero sin éxito. Otra posible reacción que formaría este isótopo sería la fusión de berkelium -249 con magnesio -26; Sin embargo, se espera que el rendimiento de esta reacción es muy baja debido a la alta radiactividad del objetivo berkelium-249. Otros isótopos de larga vida fueron atacados sin éxito por un equipo de Laboratorio Nacional Lawrence Livermore (LLNL) en 1988 bombardeando einsteinio -254 con neón -22.
Productos de desintegración
| Residuo de evaporación | Isótopo meitnerio observada |
|---|---|
| 294, 290 Uus UUP, 286 Uut, 282 Rg | 278 Mt |
| 288 Uup, 284 Uut, 280 Rg | 276 Mt |
| 287 Uup, 283 Uut, 279 Rg | 275 Mt |
| 282 Uut, 278 Rg | 274 Mt |
| 278 Uut, 274 Rg | 270 millones de toneladas |
| 272 Rg | 268 Mt |
Todos los isótopos de meitnerio excepto meitnerio-266 se han detectado sólo en las cadenas de desintegración de elementos con un mayor número atómico , como roentgenium . Roentgenium actualmente tiene siete isótopos conocidos; todos menos uno de ellos someterse alfa decae para convertirse en núcleos meitnerium, con números de masa entre 268 y 278. Los núcleos Roentgenium Padres pueden ser ellos mismos los productos de desintegración de ununtrium , Ununpentium , o ununseptium. Hasta la fecha, no hay otros elementos se han conocido a decaer a meitnerio. Por ejemplo, en enero de 2010, el equipo de Dubna ( ICIN) identificado meitnerium-278 como un producto en el decaimiento de ununseptium a través de una secuencia de desintegración alfa:
- 294
117 Uus → 290
115 Uup + 4
2 Él - 290
115 Uup → 286
113 Uut + 4
2 Él - 286
113 Uut → 282
111 Rg + 4
2 Él - 282
111 Rg → 278
109 Mt + 4
2 Él
Isótopos
| Isótopo | Media vida | Decaimiento modo | Descubrimiento año | Reacción |
|---|---|---|---|---|
| 265 Mt | 2? min | α? | desconocido | - |
| 266 Mt | 1.7 ms | α | 1982 | 209 Bi (58 Fe, n) |
| 267 Mt | 10? sra | α? | desconocido | - |
| 268 Mt | 21 ms | α | 1994 | 272 Rg (-, α) |
| 269 Mt | 0.2? s | α? | desconocido | - |
| 270 millones de toneladas | 5.0 ms | α | 2004 | 278 Uut (-, 2α) |
| 271 Mt | 5? s | α? | desconocido | - |
| 272 Mt | 10? s | α, SF? | desconocido | - |
| 273 Mt | 20? s | α, SF? | desconocido | - |
| 274 Mt | 0.44 s | α, SF | 2006 | 282 Uut (-, 2α) |
| 275 Mt | 9.7 ms | α | 2003 | 287 Uup (-, 3α) |
| 276 Mt | 0.72 s | α, SF | 2003 | 288 Uup (-, 3α) |
| 277 Mt | 1? min | α, SF? | desconocido | - |
| 278 Mt | 7.6 s | α | 2009 | 294 Uus (-, 4α) |
| 279 Mt | 6? min | α, SF? | desconocido | - |
Meitnerium no tiene isótopos estables o de origen natural. Varios isótopos radiactivos han sido sintetizados en el laboratorio, ya sea mediante la fusión de dos átomos o mediante la observación de la desintegración de elementos más pesados. Siete isótopos diferentes de meitnerio se han reportado con masas atómicas 266, 268, 270, 274 a 276, y 278, dos de los cuales, meitnerio-268 y meitnerio-270, han conocido, pero sin confirmar estados metaestables. La mayoría de éstos se desintegran principalmente a través de la desintegración alfa, aunque algunos pasan fisión espontánea.
Estabilidad y vida media
Todos los isótopos meitnerium son extremadamente inestable y radiactivos; En general, los isótopos más pesados son más estables que el encendedor. El conocido isótopo meitnerio más estable, 278 Mt, es también el más pesado conocido isótopo meitnerio; que tiene una vida media de 7,6 segundos. Un metaestable isómero nuclear, 270m Mt, se ha informado que también tienen una vida media de más de un segundo. El isótopos 276 Mt y 274 Mt tienen vidas medias de 0,72 y 0,44 segundos, respectivamente. Los cuatro isótopos restantes tienen vidas medias entre 1 y 20 milisegundos. El isótopo no descubierto 281 Mt ha pronosticado para ser el más estable hacia desintegración beta; sin embargo, no se conoce ningún isótopo meitnerium se ha observado que someterse desintegración beta. Algunos isótopos desconocidos, tales como 265 millones de toneladas, 272 toneladas, 273 toneladas, 277 Mt y 279 Mt, se predice que tienen una vida media más larga que los isótopos conocidos. Antes de su descubrimiento, 274 Mt también se prevé que tenga una larga vida media de 20 segundos; Sin embargo, se encontró más tarde para tener una vida media más corta de sólo 0,44 segundos.
Isomería Nuclear
- 270 millones de toneladas
Dos átomos de 270 Mt han sido identificados en el cadenas de desintegración de 278 Uut. Los dos desintegraciones tienen muy diferentes vidas y energías de desintegración y también se producen a partir de dos isómeros aparentemente diferentes de 274 Rg. El primer isómero decae por la emisión de una partícula alfa con energía 10,03 MeV y tiene una vida de 7,16 ms. La otra alfa decae con una vida útil de 1,63 s; No se midió la energía de desintegración. Una asignación a niveles específicos no es posible con los pocos datos que se requiere investigación disponible y más.
- 268 Mt
El espectro de la desintegración alfa de 268 Mt parece ser complicado de los resultados de varios experimentos. Se han observado partículas alfa de energías 10.28, 10.22 y 10.10 MeV, emitida por 268 átomos de Mt con una vida media de 42 ms, 21 ms y 102 ms, respectivamente. La decadencia de larga vida debe ser asignado a un nivel de isómeros. La discrepancia entre las otras dos vidas medias aún no se ha resuelto. Una asignación a niveles específicos no es posible con los datos se requiere la investigación disponible y más.
Propiedades predichas
Químico
Meitnerium es el séptimo miembro de la serie 6d de metales de transición . Desde elemento 112 ( copernicium ) se ha demostrado que es un metal de transición, se espera que todos los elementos de 104 a 112 formarían una cuarta serie de metales de transición, con meitnerium como parte de la metales del grupo del platino. Los cálculos sobre su potenciales de ionización y atómico y radios iónicos son similares a la de su homólogo más ligero iridio , lo que implica que las propiedades básicas de meitnerium se asemejan a los de la otra grupo 9 elementos, cobalto , rodio e iridio.
Predicción de las propiedades químicas probables de meitnerio no ha recibido mucha atención recientemente. Meitnerium se espera que sea un noble metal. Con base en los estados de oxidación más estable de los grupo más ligero 9 elementos, los estados de oxidación más estables de meitnerium se prevé están los 6, 3, 1 y estados, con el estado 3 es el más estable en soluciones acuosas. En comparación, el rodio y el iridio muestran un estado de oxidación máximo de 6, mientras que los estados más estables son 4 y 3 para el iridio y el 3 de rodio. Grupo 9 es el primer grupo en los metales de transición para mostrar estados de oxidación más bajos que el número de grupo, el estado 9 no ser conocido por cualquier elemento. El estado de oxidación 9 podría ser posible para meitnerium en el nonafluoride (MTF 9) y el [MTO 4] + catión, aunque se espera + [IrO 4] a ser más estable. Los tetrahaluros de meitnerium también se han predice que tienen estabilidades similares a las de iridio, de este modo permitiendo también un 4 estado estable. Se espera además que los estados de oxidación máximo de elementos de bohrium (elemento 107) a darmstadtium (elemento 110) pueden ser estables en la fase gaseosa, pero no en solución acuosa.
Física y atómica
Meitnerium se espera que sea un sólido en condiciones normales y asumir una cara cúbica centrada estructura cristalina. Debe ser un metal muy pesado con una densidad de alrededor de 37,4 g / cm 3, lo que sería el segundo más alto de cualquiera de los elementos conocidos 118, sólo superada por la que predice por su vecino hassio (41 g / cm 3). En comparación, el elemento más denso conocido que ha tenido midió su densidad, osmio , tiene una densidad de sólo 22,61 g / cm 3. Esto resulta de alto peso atómico de meitnerio, la lantánidos y actínidos contracciones, y efectos relativistas, aunque la producción de suficiente meitnerio para medir esta cantidad sería poco práctico, y la muestra decaería rápidamente. Meitnerium también se prevé que sea paramagnético.
Los teóricos han predicho el radio covalente de meitnerio a ser de 6 a 10 pm más grande que la de iridio. Por ejemplo, se espera que la distancia de enlace Mt-O para estar alrededor de 1,9 Å. Se espera que el radio atómico de meitnerio estar alrededor de 122 pm.
Química Experimental
Determinación inequívoca de las características químicas de meitnerio aún tiene que se han establecido debido a la corta vida media de los isótopos meitnerium y un número limitado de probabilidades compuestos volátiles que podrían estudiarse en una escala muy pequeña. Uno de los pocos compuestos meitnerium que son propensos a ser suficientemente volátil es hexafluoruro de meitnerium (MTF 6), como su homólogo más ligero hexafluoruro de iridio (IRF 6) es volátil por encima de 60 ° C y por lo tanto el compuesto análogo de meitnerium también podría ser suficientemente volátil; un octafluoride volátil (MTF 8) también podría ser posible. Para los estudios químicos que se llevarán a cabo en un transactinide, al menos cuatro átomos deben ser producidos, la vida media del isótopo utilizado debe ser de al menos 1 segundo, y la tasa de producción deben ser de al menos un átomo por semana. A pesar de que la vida media de 278 Mt, lo conocido isótopo meitnerium más estable, es 7,6 segundos, el tiempo suficiente para llevar a cabo estudios químicos, otro obstáculo es la necesidad de aumentar la tasa de producción de isótopos meitnerium y permitir experimentos para continuar durante semanas o meses para que se pueden obtener resultados estadísticamente significativos. Separación y detección deben llevarse a cabo de manera continua para separar los isótopos meitnerium y los sistemas automatizados pueden entonces experimentar en la fase gaseosa y la solución química de meitnerium como los rendimientos de los elementos más pesados se predicen a ser más pequeñas que las de los elementos más ligeros; algunas de las técnicas de separación utilizadas para bohrium y hassium podrían ser reutilizados. Sin embargo, la química experimental de meitnerio no ha recibido tanta atención como la de los elementos más pesados copernicium y flerovium .
La Laboratorio Nacional Lawrence Berkeley intentó sintetizar el isótopo 271 millones de toneladas en 2002-2003 para una posible investigación química de meitnerio porque se esperaba que podría ser más estables que los isótopos de todo, ya que cuenta con 162 neutrones , unas número mágico para los núcleos deformados; su vida media se prevé que sea de unos pocos segundos, el tiempo suficiente para una investigación química. Sin embargo, no se detectaron átomos de 271 millones de toneladas, y este isótopo de meitnerio es actualmente desconocido.
Un experimento de determinación de las propiedades químicas de un transactinide tendría que comparar un compuesto de transactinide que con compuestos análogos de algunos de sus homólogos más ligeros: por ejemplo, en la caracterización química de hassium, tetróxido de hassium (HSO 4) se comparó con el análogo de osmio compuesto, tetróxido de osmio (OsO4). En un paso previo a la determinación de las propiedades químicas de meitnerio, el GSI intentó sublimación de los compuestos de rodio rodio (III) óxido (Rh 2 O 3) y rodio (III) cloruro (RhCl3). Sin embargo, cantidades macroscópicas del óxido no se subliman hasta 1000 ° C y el cloruro haría sino hasta 780 ° C, y sólo en la presencia de carbono partículas de aerosol: estas temperaturas son demasiado altas para este tipo de procedimientos que se utilizarán en meitnerio, ya que la mayoría de los métodos actuales utilizados para la investigación de la química de los elementos superpesados no funcionan por encima de 500 ° C.


