
Neón
Antecedentes
SOS Children hizo esta selección Wikipedia junto a otros recursos de escuelas . El patrocinio de los niños ayuda a los niños en el mundo en desarrollo para aprender también.
| Neón | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
10 Ne | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Apariencia | |||||||||||||||||||||||||
gas incoloro que presenta un resplandor rojo-anaranjado cuando se coloca en un campo eléctrico de alta tensión  Gas de neón en un tubo de descarga, la llamada luz de neón. Las líneas espectrales de neón en la región visible | |||||||||||||||||||||||||
| Propiedades generales | |||||||||||||||||||||||||
| Nombre, símbolo, número | neón, Ne, 10 | ||||||||||||||||||||||||
| Pronunciación | / n yo ɒ n / | ||||||||||||||||||||||||
| Categoría Elemento | gases nobles | ||||||||||||||||||||||||
| Grupo, período, bloque | 18 (gases nobles) , 2, p | ||||||||||||||||||||||||
| Peso atómico estándar | 20,1797 (6) | ||||||||||||||||||||||||
| Configuración electrónica | [ Él ] 2s 2 2p 6 2, 8 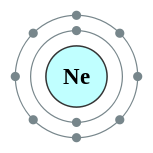 | ||||||||||||||||||||||||
| Historia | |||||||||||||||||||||||||
| Predicción | William Ramsay (1897) | ||||||||||||||||||||||||
| Descubrimiento | William Ramsay y Morris Travers (1898) | ||||||||||||||||||||||||
| Primer aislamiento | William Ramsay y Morris Travers (1898) | ||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||
| Fase | gas | ||||||||||||||||||||||||
| Densidad | (0 ° C, 101,325 kPa) 0,9002 g / L | ||||||||||||||||||||||||
| Líquido densidad en pb | 1,207 g · cm -3 | ||||||||||||||||||||||||
| Punto de fusion | 24.56 K , -248.59 ° C, -415.46 ° F | ||||||||||||||||||||||||
| Punto de ebullicion | 27.07 K, -246.08 ° C, -410.94 ° F | ||||||||||||||||||||||||
| Punto Triple | 24,5561 K (-249 ° C), 43 kPa | ||||||||||||||||||||||||
| Punto crítico | 44.4 K, 2,76 MPa | ||||||||||||||||||||||||
| Calor de fusión | 0,335 kJ · mol -1 | ||||||||||||||||||||||||
| El calor de vaporización | 1.71 kJ · mol -1 | ||||||||||||||||||||||||
| Capacidad calorífica molar | 5 R / 2 = 20.786 J · mol -1 · K -1 | ||||||||||||||||||||||||
| Presión del vapor | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Propiedades atómicas | |||||||||||||||||||||||||
| Estados de oxidación | 1, 0 | ||||||||||||||||||||||||
| Energías de ionización ( más) | Primero: 2080,7 kJ · mol -1 | ||||||||||||||||||||||||
| Segundo: 3952,3 kJ · mol -1 | |||||||||||||||||||||||||
| Tercero: 6122 kJ · mol -1 | |||||||||||||||||||||||||
| Radio covalente | 58 pm | ||||||||||||||||||||||||
| Van der Waals radio | 154 pm | ||||||||||||||||||||||||
| Miscelánea | |||||||||||||||||||||||||
| Estructura cristalina | cara cúbica centrada  | ||||||||||||||||||||||||
| Ordenamiento magnético | diamagnético | ||||||||||||||||||||||||
| Conductividad térmica | 49.1x10 -3 W · m -1 · K -1 | ||||||||||||||||||||||||
| Velocidad del sonido | (Gas, 0 ° C) 435 m · s -1 | ||||||||||||||||||||||||
| Módulo de volumen | 654 GPa | ||||||||||||||||||||||||
| Número de registro del CAS | 7440-01-9 | ||||||||||||||||||||||||
| La mayoría de los isótopos estables | |||||||||||||||||||||||||
| Artículo principal: Los isótopos de neón | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
El neón es un elemento químico con el símbolo Ne y número atómico 10. Es en grupo 18 (gases nobles) de la tabla periódica . El neón es un gas monoatómico incoloro, inodoro bajo condiciones estándar, con alrededor de dos tercios de la densidad del aire. Se descubrió (junto con criptón y xenón) en 1898 como uno de los tres elementos inertes raras residuales que quedan en el aire seco, después se eliminan nitrógeno, oxígeno, argón y dióxido de carbono. Neon fue el segundo de estos tres gases nobles por descubrir, y fue reconocido inmediatamente como un nuevo elemento de su color rojo brillante espectro de emisión. El nombre de neón se deriva de las palabras griegas que significan "nueva." Neon es químicamente inerte y no forma compuestos químicos no cargados.
Durante cósmica nucleogénesis de los elementos, grandes cantidades de neón se construye a partir de los procesos de fusión alfa-captura en las estrellas. Aunque neón es un elemento muy común en el universo y el sistema solar (que es quinto en la abundancia cósmica después del hidrógeno, helio, oxígeno y carbono), es muy raro en la Tierra. Se compone aproximadamente el 18,2 ppm de aire por volumen (esto es aproximadamente la misma que la fracción molecular o moles), y una fracción más pequeña en la corteza. La razón de la relativa escasez de neón en la Tierra y los (terrestres) planetas interiores, es que no hay formas de neón compuestos para arreglarlo a los sólidos, y es muy volátil, por lo tanto, que escapa de la planetesimales bajo el calor del Sol recién encendido en los inicios del Sistema Solar. Incluso la atmósfera de Júpiter es algo agotado de neón, presumiblemente por esta razón.
Neon da una clara rojizo brillo de color naranja cuando se utiliza, ya sea en baja tensión neón lámparas brillo o en alta tensión tubos de descarga o carteles publicitarios de neón. La línea de emisión rojo de neón también es responsable de la luz roja bien conocida de láseres de helio-neón. Neón es utilizado en algunas aplicaciones de tubo de plasma y refrigerantes pero tiene algunos otros usos comerciales. Se extrae comercialmente por la destilación fraccionada de aire líquido. Es considerablemente más caro que el helio, ya que el aire es su única fuente.
Historia

Neon (νέον griego (neón) que significa "nuevo") fue descubierto en 1898 por los químicos británicos Sir William Ramsay (1852-1916) y Morris W. Travers (1872-1961) en Londres. Neon fue descubierto cuando Ramsay heló una muestra de aire hasta que se convirtió en un líquido, después se calienta el líquido y capturó a los gases ya que hierven apagado. El gases de nitrógeno , oxígeno y argón habían sido identificados, pero los gases restantes fueron aislados en más o menos por orden de abundancia, en un período de seis semanas a partir de finales de mayo de 1898. El primero en ser identificado fue el criptón . El siguiente, después de criptón había sido retirado, era un gas que dio una luz roja brillante bajo descarga espectroscópica. Este gas, identificado en junio, fue nombrado el neón, el análogo griega de "novum" (nuevo), hijo el nombre de Ramsay sugirió. La característica brillante de color rojo-naranja que se emite por el neón gaseoso cuando está excitado eléctricamente se notó de inmediato; Travers más tarde escribió, "el resplandor de luz carmesí del tubo contó su propia historia y era un espectáculo digno de morar sobre y nunca olvidaré." Finalmente, el mismo equipo descubrió xenón por el mismo proceso, en julio.
Escasez de neón impedía su aplicación inmediata para la iluminación a lo largo de las líneas de Tubos Moore, que antes de nitrógeno y que se comercializaron en el año 1900. Después de 1902, La compañía de Georges Claude, Air Liquide, estaba produciendo cantidades industriales de neón como un subproducto de su negocio de licuefacción de aire. En diciembre 1910 Claude demostró moderna iluminación de neón basado en un tubo sellado de neón. Claude trató brevemente para conseguir tubos de neón que se utilizarán para la iluminación de interior, debido a su intensidad, pero no pudo, como dueños de casa rechazaron las fuentes de luz de neón, debido a su color. Finalmente en 1912, el socio de Claude comenzó a vender tubos de descarga de neón como carteles de publicidad, donde estaban instante más éxito como receptores de los ojos. Fueron introducidos a los EE.UU. en 1923, cuando dos grandes carteles de neón fueron comprados por un concesionario de coches de Los Ángeles Packard. El brillo y la detención de color rojo hicieron publicidad de neón completamente diferente de la competencia.
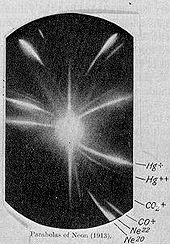
Neon desempeñó un papel en la comprensión básica de la naturaleza de los átomos en el año 1913, cuando JJ Thomson , como parte de su exploración en la composición de rayos canales, canalizados corrientes de iones de neón a través de una magnético y un campo eléctrico y se mide su desviación mediante la colocación de una placa fotográfica en su camino. Thomson observó dos parches separados de la luz sobre la placa fotográfica (ver imagen), lo que sugiere dos parábolas diferentes de desviación. Thomson, finalmente, llegó a la conclusión de que algunos de los átomos en las luces de neón de gas eran de masa mayor que el resto. Aunque no se entiende al momento por Thomson, este fue el primer descubrimiento de los isótopos de estables átomos. Fue hecha por el uso de una versión cruda de un instrumento que hoy plazo como un espectrómetro de masas .
Isótopos
El neón es el segundo gas inerte más ligero. Neon tiene tres isótopos estables :. 20 Ne (90,48%), 21 Ne (0,27%) y el 22 Ne (9.25%) 21 y 22 de Ne Ne son en parte primordial y en parte nucleogénicas (es decir, hecha por las reacciones nucleares de otros nucleidos con neutrones y otras partículas en el medio ambiente) y sus variaciones en abundancia natural se entiende bien. En contraste, 20 Ne (el jefe isótopo primordial realizado en estelar nucleosíntesis) no es conocido por ser nucleogénicas o radiogénico (salvo la producción de caries cluster, que se cree que produce sólo una pequeña cantidad). Las causas de la variación de 20 Ne en la Tierra han sido por lo tanto muy debatido.
El director reacciones nucleares que generan neón nucleogénicas isótopos empiezan desde 24 mg y 25 mg, que producen 21 Ne y 22 Ne, respectivamente, después de captura de neutrones y la emisión inmediata de una de partículas alfa. Los neutrones que producen las reacciones se producen principalmente por reacciones secundarias de espalación partículas alfa, a su vez derivan de uranio -Serie cadenas de desintegración. El resultado neto arroja una tendencia a la baja de 20 Ne / 22 Ne y mayores 21 Ne / 22 Ne proporciones observadas en rocas ricas en uranio como granitos . Neon-21 también se puede producir en una reacción nucleogénicas, cuando 20 Ne absorbe un neutrón de diversas fuentes naturales de neutrones terrestres.
Además, el análisis isotópico de terrestres expuestas rocas ha demostrado la cosmogénico producción (rayos cósmicos) de 21 Ne. Este isótopo es generado por reacciones de espalación en magnesio , sodio , silicio , y aluminio . Mediante el análisis de los tres isótopos, el componente cosmogónico se puede resolver desde magmático neón y neón nucleogénicas. Esto sugiere que el neón será una herramienta útil para determinar las edades de exposición cósmicas de rocas de la superficie y meteoritos.
Similar a xenón , neón contenido observado en muestras de volcánicas los gases se enriquece en 20 Ne, así como nucleogénicas 21 Ne, en relación con el contenido de 22 Ne. El contenido isotópico de neón de estas muestras derivados del manto representa una fuente no atmosférica de neón. Los 20 componentes de Ne-enriquecidos se atribuyen a los componentes del gas raras primordiales exóticas en la Tierra, posiblemente representando neón solar. Elevados 20 abundancias Ne se encuentran en los diamantes , lo que sugiere además un depósito de neón solar en la Tierra.
Características

El neón es el segundo gas noble más ligero, después de helio . Brilla de color rojizo-anaranjado en un tubo de descarga de vacío. También, neón líquido tiene la gama más estrecha de cualquier elemento: de 24,55 a 27,05 K K (-248,45 ° C a -245,95 ° C, o -415,21 ° F a -410,71 ° F). Tiene más de 40 veces la capacidad de refrigeración de líquido de helio y tres veces la de líquido de hidrógeno (en una base de volumen por unidad). En la mayoría de aplicaciones es un menos caro refrigerante que el helio.
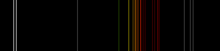
Plasma de neón tiene la más intensa de descarga de luz en tensiones y corrientes de todos los gases nobles normales. El color medio de esta luz para el ojo humano es de color rojo-naranja debido a muchas líneas en este rango; sino que también contiene una fuerte línea verde que está oculto, a menos que los componentes visuales son dispersadas por un espectroscopio.
Dos tipos bastante diferentes de iluminación de neón son de uso común. Lámparas de incandescencia de neón son generalmente pequeñas, con la mayoría opera en alrededor de 100 a 250 voltios . Ellos han sido ampliamente utilizados como indicadores de encendido y en equipos de pruebas de circuito, pero diodos emisores de luz (LEDs) dominan ahora en tales aplicaciones. Estos dispositivos de neón simples fueron los precursores de pantallas de plasma y pantallas de televisión de plasma. Señales de neón típicamente operan a voltajes mucho más altos (2-15 kilovoltios ), y los tubos luminosos son comúnmente metros de largo. El tubo de vidrio se forma a menudo en formas y letras para la señalización, así como aplicaciones arquitectónicas y artísticas.
Aparición
Los isótopos estables de neón se producen en las estrellas. 20 Ne se crea en la fusión de helio y oxígeno en el proceso alfa, que requiere temperaturas superiores a 100 mega de grados Kelvin y masas mayores de 3 masas solares.
Neon es abundante en una escala universal; es el quinto elemento más abundante en el universo químico en masa, después del hidrógeno, helio, oxígeno y carbono (véase el elemento químico ). Su rareza relativa en la Tierra, como el de helio, se debe a su relativa ligereza, alta presión de vapor a temperaturas muy bajas, e inercia química, todas las propiedades que tienden a evitar que sea atrapado en las de condensación de nubes de gas y polvo que se tradujo en la formación de planetas sólidos más pequeños y cálidos como la Tierra.
Neon es monoatómico, por lo que es más ligero que las moléculas de nitrógeno y oxígeno diatómico que forman el grueso de la atmósfera terrestre; un globo lleno de neón se elevará en el aire, aunque más lentamente que un globo de helio.
Abundancia Misa en el universo es aproximadamente 1 parte en 750 y en el Sol y, presumiblemente, en el sistema nebulosa proto-solar, alrededor de 1 parte en 600. El Sonda de entrada en la atmósfera nave espacial Galileo encontró que incluso en la atmósfera superior de Júpiter, la abundancia de neón se reduce (agotado) por un factor de aproximadamente 10, a un nivel de 1 parte en 6000 en masa. Esto puede indicar que incluso el hielo planetesimales que trajeron de neón en Júpiter desde el sistema solar exterior, formados en una región que estaba demasiado caliente para que ellos han mantenido su neón (abundancias de gases inertes más pesados en Júpiter son varias veces mayor que en el Sol).
Neon es raro en la Tierra, se encuentra en la atmósfera de la Tierra a 1 parte en 55.000, o 18,2 ppm por volumen (esto es aproximadamente la misma que la molécula o fracción molar), o 1 parte en 79.000 de aire en masa. Se compone de una fracción más pequeña en la corteza. Se produce industrialmente por criogénico destilación fraccionada del aire licuado.
Aplicaciones

Neón se utiliza a menudo en signos y produce una luz brillante de color naranja rojizo inconfundible. Aunque todavía se conoce como "neon", todos los demás colores se generan con los otros gases nobles o por muchos colores de iluminación fluorescente.
Neón se utiliza en tubos de vacío, los indicadores de alta tensión, pararrayos, tubos metros de las olas, de televisión , tubos y láseres de helio-neón. Neón licuado se utiliza comercialmente como criogénico refrigerante en aplicaciones que no requieren el rango de temperatura más baja alcanzable con más extrema de refrigeración de helio líquido.
Tanto el gas neón y neón líquido son relativamente caros - por pequeñas cantidades, el precio de neón líquido puede ser más de 55 veces mayor que la de helio líquido. El controlador para expensas de neón es la rareza de neón, que a diferencia de helio, sólo puede obtenerse a partir del aire.
La la temperatura del punto triple de neón (24,5561 K) es un punto fijo que define en el Escala Internacional de Temperatura de 1990.
Compuestos
Neon es el primer gas noble p-bloque. Neon se considera generalmente que es inerte. No se conocen los verdaderos compuestos neutros de neón. Sin embargo, los iones Ne +, (Ne Ar ) +, (Ne H ) +, y ( Él Ne +) se han observado de óptica y de espectrometría de masa estudios, y hay algunos informes no confirmados de un inestable hidrato.

