
Niobio
Sabías ...
SOS Children produjo este sitio web para las escuelas, así como este sitio web video sobre África . Apadrina un niño para hacer una diferencia real.
| Niobio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
41 Nb | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
metálico gris, azulado cuando se oxida  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades generales | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | niobio, Nb, 41 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pronunciación | / n aɪ oʊ b yo ə m / NY- OH -bee-əm; / k ə l ʌ m b yo ə m / kə- LUM -bee-əm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoría Elemento | metal de transición | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 5, 5, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atómico estándar | 92.90638 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Kr ] 4d 4 5s 1 2, 8, 18, 12, 1 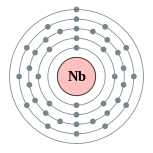 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Historia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Descubrimiento | Charles Hatchett (1801) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Primer aislamiento | Christian Wilhelm Blomstrand (1864) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reconocido como un distinto elemento por | Heinrich Rose (1844) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad (cerca rt) | 8,57 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusion | 2750 K , 2477 ° C, 4491 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullicion | 5017 K, 4744 ° C, 8571 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusión | 30 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| El calor de vaporización | 689.9 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidad calorífica molar | 24.60 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión del vapor | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidación | 5, 4, 3, 2, -1 (Levemente ácida óxido) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 1,6 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energías de ionización | Primero: 652.1 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Segundo: 1380 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tercero: 2416 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico | 146 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 164 ± 18:00 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelánea | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | centrada en el cuerpo cúbico  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamiento magnético | paramagnético | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La resistividad eléctrica | (0 ° C) 152 nΩ · m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 53,7 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Expansión térmica | 7,3 m / (m · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido (varilla delgada) | (20 ° C) 3480 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| El módulo de Young | 105 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de corte | 38 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de volumen | 170 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Relación de Poisson | 0.40 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza de Mohs | 6.0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Vickers | 1320 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 736 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registro del CAS | 7440-03-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de niobio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El niobio, anteriormente columbio, es un elemento químico con el símbolo Nb (anteriormente Cb) y número atómico 41. Es un suave, gris, dúctil metal de transición , que se encuentra a menudo en el mineral pirocloro, la principal fuente comercial para niobio, y columbita. El nombre proviene de la mitología griega : Niobe, hija de Tántalo.
El niobio tiene propiedades físicas y químicas similares a las del elemento de tantalio , y los dos son por lo tanto difíciles de distinguir. El químico Inglés Charles Hatchett informó de un nuevo elemento similar al tantalio en 1801 y la llamó columbio. En 1809, el químico Inglés William Hyde Wollaston concluyó erróneamente que el tantalio y el niobio eran idénticos. El químico alemán Heinrich Rose determinó en 1846 que los minerales de tantalio contienen un segundo elemento, que él nombró niobio. En 1864 y 1865, una serie de hallazgos científicos clarificó que niobio y columbio eran el mismo elemento (a diferencia de tantalio), y durante un siglo se usaron ambos nombres indistintamente. El niobio fue adoptado oficialmente como el nombre del elemento en 1949.
No fue sino hasta el siglo 20 que el niobio fue utilizado comercialmente por primera vez. Brasil es el principal productor de niobio y ferroniobio, una aleación de niobio y hierro. El niobio se utiliza sobre todo en aleaciones, la mayor parte en especial de acero tal como el utilizado en el gas de tuberías. Aunque aleaciones contienen sólo un máximo de 0,1%, ese pequeño porcentaje de niobio mejora la resistencia del acero. La estabilidad de temperatura de niobio que contiene superaleaciones es importante para su uso en chorro y motores de cohetes. El niobio se utiliza en varios superconductores materiales. Estos aleaciones superconductoras, que contiene también titanio y estaño , son ampliamente utilizados en la imanes superconductores de Escáneres de resonancia magnética. Otras aplicaciones del niobio incluyen su uso en soldadura, industria nuclear, la electrónica, la óptica, la numismática y joyería. En las dos últimas aplicaciones, baja toxicidad de niobio y capacidad para ser coloreados por anodización son ventajas particulares.
Historia


El niobio fue descubierto por el químico Inglés Charles Hatchett en 1801. Él encontró un nuevo elemento en una muestra de mineral que había sido enviado a Inglaterra desde Massachusetts, Estados Unidos en 1734 por un John Winthrop, y nombró a la columbita mineral y el nuevo elemento columbio después Columbia, el nombre poético de América . El columbio descubierto por Hatchett era probablemente una mezcla de el nuevo elemento de tántalo.
Posteriormente, hubo una considerable confusión sobre la diferencia entre columbio (niobio) y el tantalio estrechamente relacionados. En 1809, el químico Inglés William Hyde Wollaston comparó los óxidos derivados tanto columbio-columbita, con una densidad de 5,918 g / cm 3, y tantalum- tantalita, con una densidad de más de 8 g / cm 3, y llegó a la conclusión de que los dos óxidos, a pesar de la diferencia significativa en la densidad, eran idénticos; así se mantuvo el nombre tantalio. Esta conclusión se disputó en 1846 por el químico alemán Heinrich Rose, quien argumentó que había dos elementos diferentes en la muestra tantalita, y los nombres de los hijos de Tántalo: niobio (de Niobe), y pelopium (de Pelops). Esta confusión surgió de las mínimas diferencias observadas entre el tántalo y el niobio. Los nuevos elementos reivindicados pelopium, ilmenium y Dianium eran de hecho idéntico al niobio o mezclas de niobio y tantalio.
Las diferencias entre el tántalo y el niobio se demostraron inequívocamente en 1864 por Christian Wilhelm Blomstrand, y Henri Etienne Sainte-Claire Deville, así como Louis J. Troost, que determina las fórmulas de algunos de los compuestos en 1865 y, finalmente, por el químico suizo Jean Charles de Marignac Galissard en 1866, que todo resultó que sólo había dos elementos. Artículos sobre ilmenium continuaron apareciendo hasta 1871.
De Marignac fue el primero en preparar el metal en 1864, cuando él reducción de cloruro de niobio calentándolo en una atmósfera de hidrógeno . Aunque de Marignac fue capaz de producir niobio-tantalio libre a una escala mayor en 1866, no fue hasta principios del siglo 20 que el niobio fue utilizado comercialmente por primera vez, en filamentos de las lámparas incandescentes. Este uso se convirtió rápidamente en obsoletos a través de la sustitución de niobio con tungsteno , que tiene un punto de fusión más alto y por lo tanto es preferible para su uso en lámparas incandescentes. El descubrimiento de que el niobio mejora la resistencia del acero se hizo en la década de 1920, y esta aplicación sigue siendo su uso predominante. En 1961 el físico estadounidense Eugene Kunzler y compañeros de trabajo en Laboratorios Bell descubrió que niobio-estaño sigue presentando superconductividad en presencia de fuertes corrientes eléctricas y campos magnéticos, por lo que es el primer material para soportar las altas corrientes y campos necesarios para imanes de alta potencia útiles y eléctrico maquinaria. Este descubrimiento permitiría - dos décadas más tarde - la producción de largos cables de varias vueltas que podrían ser enrollado en bobinas para crear grandes y poderosas electroimanes para maquinaria rotativa, los aceleradores de partículas, o detectores de partículas.
Nombrar del elemento
Columbio (símbolo Cb) fue el nombre dado originalmente a este elemento por Hatchett, y este nombre se mantuvo en uso en revistas de la última de papel estadounidenses publicados por American Chemical Society con columbio en sus fechas del título de niobio-1953, mientras que se utilizó en Europa. Para poner fin a esta confusión, el nombre de niobio fue elegido para el elemento 41 en la 15ª Conferencia de la Unión de la Química en Amsterdam en 1949. Un año más tarde este nombre fue adoptado oficialmente por el Unión Internacional de Química Pura y Aplicada (IUPAC) después de 100 años de controversia, a pesar de la anterioridad cronológica del nombre de columbio. Este último nombre todavía se utiliza a veces en la industria estadounidense. Esta fue una especie de compromiso; la IUPAC aceptó tungsteno en vez de wolframio, en deferencia al uso de América del Norte; y niobio en vez de columbio, en deferencia al uso europeo. No todo el mundo estuvo de acuerdo, y mientras muchas sociedades químicas líderes y organizaciones gubernamentales se refieren a ella por el nombre oficial de la IUPAC, muchos metalúrgicos principales, las sociedades de metal, y el Servicio Geológico de Estados Unidos todavía se refieren al metal por el "columbio" original.
Características
Físico
El niobio es un brillante, gris, dúctil, paramagnético de metal en grupo 5 de la tabla periódica (ver tabla), aunque tiene una configuración atípica en su más externa capas de electrones en comparación con el resto de los miembros. (Esto se puede observar en la vecindad de rutenio (44), rodio (45), y paladio (46)).
| Z | Elemento | No. de electrones / shell |
|---|---|---|
| 23 | vanadio | 2, 8, 11, 2 |
| 41 | niobio | 2, 8, 18, 12, 1 |
| 73 | tantalio | 2, 8, 18, 32, 11, 2 |
| 105 | dubnium | 2, 8, 18, 32, 32, 11, 2 |
El niobio se convierte en un superconductor a temperaturas criogénicas. A la presión atmosférica, que tiene la temperatura crítica más alta de los superconductores elementales: 9,2 K . El niobio tiene la mayor profundidad de penetración magnética de cualquier elemento. Además, es uno de los tres elemental II superconductores tipo, junto con vanadio y tecnecio . Las propiedades superconductoras son fuertemente dependientes de la pureza del metal niobio. Cuando muy puro, que es relativamente blando y dúctil, pero las impurezas hacer más difícil.
El metal tiene un bajo capturar sección transversal para termales neutrones ; por lo que se utiliza en las industrias nucleares.
Químico
El metal adquiere un tinte azulado cuando se exponen al aire a temperatura ambiente durante períodos prolongados. A pesar de presentar un alto punto de fusión en forma elemental (2468 ° C), tiene una baja densidad en comparación con otros metales refractarios. Además, es resistente a la corrosión, presenta propiedades de superconductividad, y formas dieléctrico capas de óxido.
El niobio es un poco menos electropositivo y más compacto que su predecesor en la tabla periódica, de circonio , mientras que es prácticamente idéntica en tamaño a los átomos de tantalio más pesados, debido a la la contracción de los lantánidos. Como resultado, las propiedades químicas de niobio son muy similares a los de tántalo, que aparece directamente debajo de niobio en la tabla periódica . Aunque su resistencia a la corrosión no es tan notable como el de tantalio, su menor precio y mayor disponibilidad hacen niobio atractivo para usos menos exigentes, tales como revestimientos en plantas químicas.
Isótopos
Naturalmente niobio ocurra se compone de una estable isótopo , 93 °. A partir de 2003, al menos 32 radioisótopos también se han sintetizado, que van en masa atómica de 81 a 113. El más estable de estos es 92 Nb con una vida media de 34,7 millones de años. Uno de los menos estable es 113 Nb, con una vida media estimada de 30 milisegundos. Los isótopos que son más ligeros que el estable 93 Nb tienden a decaer por β + decadencia, y los que son más pesados tienden a decaer por β -. decaimiento, con algunas excepciones 81 Nb, 82 Nb, y 84 Nb tienen menor β + retardada caminos de desintegración de emisión de protones, 91 Nb decae por captura de electrones y por emisión de positrones, y 92 Nb decae por tanto β + y β - decaimiento.
Al menos 25 isómeros nucleares han descrito, que van de la masa atómica de 84 a 104. Dentro de este rango, sólo 96 Nb, 101 Nb, y 103 Nb no tienen isómeros. El más estable de isómeros de niobio es 93m Nb con una vida media de 16,13 años. El isómero menos estable es 84m Nb con una vida media de 103 ns. Todos los isómeros de decaimiento de niobio por transición isomérica o desintegración beta excepto 92m1 Nb, que tiene un menor captura de electrones cadena de desintegración.
Aparición
El niobio se estima en la 33ª elemento más común en la corteza terrestre, con 20 ppm. Algunos piensan que la abundancia en la Tierra debería ser mucho mayor, pero que el niobio "perdido" puede estar situado en el núcleo de la Tierra debido a la alta densidad del metal. El elemento libre no se encuentra en la naturaleza, pero ocurre en minerales. Los minerales que contienen niobio menudo también contienen tántalo, tales como columbita ((Fe, Mn) (Nb, Ta) 2 O 6) y columbita-tantalita (coltan o, (Fe, Mn) (Ta, Nb) 2 O 6). Minerales columbita-tantalita se encuentran generalmente como minerales accesorios en intrusiones pegmatita, y en rocas intrusivas alcalinas. Menos comunes son los niobatos de calcio , el uranio , el torio y el elementos de tierras raras tales como pirocloro ((Na, Ca) 2 Nb 2 O 6 (OH, F)) y euxenite ((Y, Ca, Ce, U, Th) (Nb, Ta, Ti) 2 O 6). Estas se han encontrado grandes depósitos de niobio asociado con carbonatitas ( carbonato- silicato de rocas ígneas ) y como un constituyente de pirocloro.
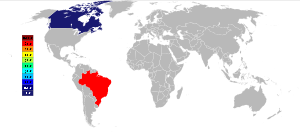
Los dos mayores yacimientos de pirocloro fueron encontrados en la década de 1950 en Brasil y Canadá, y ambos países siguen siendo los principales productores de concentrados de minerales de niobio. El depósito más grande se encuentra alojado dentro de una intrusión en carbonatita Araxá, Minas Gerais Brasil, propiedad de CBMM (Companhia Brasileira de Metalurgia e Mineração); Por otro depósito se encuentra en Goiás y propiedad de Anglo American plc (a través de su filial Mineração Catalão), también fue sede de un intrusión carbonatita. En total, estos dos minas brasileñas producen alrededor del 75% de la oferta mundial. El tercer mayor productor de niobio es el Niobec Mina carbonatita-organizada, Saint-Honouré cerca Chicoutimi, Quebec propiedad de Iamgold Corporation Ltd, que produce alrededor del 7% de la oferta mundial.
Producción
Después de la separación de los otros minerales, los óxidos mixtos de tántalo Ta 2 O 5 y niobio Nb 2 O 5 se obtienen. El primer paso en el tratamiento es la reacción de los óxidos con acido hidrofluorico:
- Ta 2 O 5 + 14 HF → 2 H 2 [TaF 7] + 5 H 2 O
- Nb 2 O 5 + 10 HF → 2 H 2 [NbOF 5] + 3 H 2 O
La primera separación a escala industrial, desarrollado por de Marignac, explota las diferentes solubilidades del complejo niobio y tántalo fluoruros, monohidrato oxypentafluoroniobate dipotásico (K 2 [NbOF 5] · H2O) y dipotásico heptafluorotantalate (K 2 [TaF 7]) en agua. Procesos nuevos usan la extracción de líquido de los fluoruros de solución acuosa de disolventes orgánicos como ciclohexanona. Los complejos de niobio y tantalio fluoruros se extraen por separado del disolvente orgánico con agua y, o bien precipitados por la adición de fluoruro de potasio para producir un complejo de fluoruro de potasio, o se precipita con amoníaco como el pentóxido de:
- H 2 [NbOF 5] + 2 KF → K 2 [NbOF 5] ↓ + 2 HF
Seguido por:
- 2 H 2 [NbOF 5] + 10 NH4OH → Nb 2 O 5 ↓ + 10 NH 4 F + 7 H 2 O
Se utilizan varios métodos para la reducción a niobio metálico. La electrólisis de una mezcla fundida de K 2 [NbOF 5] y cloruro de sodio es uno; el otro es la reducción del fluoruro con sodio . Con este método de niobio con una pureza relativamente alta puede ser obtenida. En la producción a gran escala se utiliza la reducción de Nb 2 O 5 con hidrógeno o de carbono. En el proceso que implica la reacción aluminotérmica una mezcla de óxido de hierro y óxido de niobio se hace reaccionar con aluminio :
- 3 Nb 2 O 5 + Fe 2 O 3 + 12 Al → 6 Nb + 2 Fe + 6 Al 2 O 3
Para mejorar la reacción, pequeñas cantidades de oxidantes como se añadió nitrato de sodio. El resultado es óxido de aluminio y ferroniobio, una aleación de hierro y niobio utilizado en la producción de acero. El ferroniobio contiene entre 60 y 70% de niobio. Sin adición de óxido de hierro, proceso aluminotérmica se utiliza para la producción de niobio. La purificación adicional es necesario para alcanzar el grado de superconductores aleaciones. Electron fusión por haz al vacío es el método utilizado por los dos principales distribuidores de niobio.
La Servicio Geológico de Estados Unidos estima que la producción aumentó de 38.700 toneladas en 2005 a 44.500 toneladas en 2006. Los recursos de todo el mundo se estima en 4,4 millones de toneladas. Durante el período de diez años entre 1995 y 2005, la producción aumentó más del doble, a partir de 17 800 toneladas en 1995. Desde 2009, la producción se mantiene estable en alrededor de 63 mil toneladas por año.
| País | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| | 160 | 230 | 290 | 230 | 200 | 200 | 200 | ? | ? | ? | ? | ? |
| | 30000 | 22000 | 26000 | 29000 | 29900 | 35000 | 40000 | 57300 | 58000 | 58000 | 58000 | 58000 |
| 2290 | 3200 | 3410 | 3280 | 3400 | 3310 | 4167 | 3020 | 4380 | 4330 | 4420 | 4400 | |
| | ? | 50 | 50 | 13 | 52 | 25 | ? | ? | ? | ? | ? | ? |
| | ? | ? | 5 | 34 | 130 | 34 | 29 | ? | ? | ? | ? | ? |
| | 35 | 30 | 30 | 190 | 170 | 40 | 35 | ? | ? | ? | ? | ? |
| | 28 | 120 | 76 | 22 | 63 | 63 | 80 | ? | ? | ? | ? | ? |
| Mundo | 32600 | 25600 | 29900 | 32800 | 34000 | 38700 | 44500 | 60400 | 62900 | 62900 | 62900 | 63000 |
Compuestos
El niobio es en muchos aspectos similar a tántalo y circonio . Reacciona con la mayoría de los no metales a altas temperaturas: de niobio reacciona con flúor a temperatura ambiente, con el cloro y el hidrógeno a 200 ° C , y con nitrógeno a 400 ° C, dando productos que son con frecuencia intersticial y no estequiométrica. El metal comienza a oxidar en aire a 200 ° C , y es resistente a la corrosión por fusionados álcalis y por los ácidos, incluyendo agua regia, clorhídrico , sulfúrico , nítrico y fosfórico . El niobio es atacado por ácido fluorhídrico y mezclas de ácido fluorhídrico / nítrico.
Aunque niobio exposiciones todos los estados de oxidación formales 5--1, en compuestos más comúnmente encontrados, que se encuentra en el estado 5. Característicamente, los compuestos en los estados de oxidación inferior a 5+ pantalla Nb-Nb unión.
Los óxidos y sulfuros
Formas de niobio óxidos con los estados de oxidación (5 Nb 2 O 5), 4 ( NbO 2), y 3 (Nb 2 O 3), así como con el estado de oxidación más raro 2 ( NBO). Encuentra más comúnmente es el pentóxido, precursor de casi todos los compuestos de niobio y aleaciones. Niobatos se generan disolviendo el pentóxido de básicas de hidróxido de soluciones o por fusión en óxidos de metales alcalinos. Ejemplos son niobato de litio (LiNbO3) y niobato de lantano (RELOC 4). En el niobato de litio es un trigonal distorsionada perovskita-como la estructura, mientras que el niobato de lantano contiene solitarios NbO 4 3- iones. También se conoce el sulfuro de niobio en capas (NBS 2).
Los materiales con un recubrimiento de película delgada de niobio (V) de óxido pueden ser producidos por deposición de vapor químico o procesos de deposición de capas atómicas, en cada caso por la descomposición térmica de niobio (V) etóxido por encima de 350 ° C.
Haluros

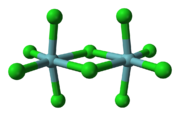
El niobio forma haluros en los estados de oxidación de 5 y 4, así como diversa compuestos subestequiométricas. Los pentahaluros (NBX 5) característica octaédricos centros N °. El niobio pentafluoruro (NBF 5) es un sólido blanco con un punto de 79,0 ° C y la fusión niobio pentacloruro (NbCl 5) es de color amarillo (ver imagen de la izquierda) con un punto de fusión 203,4 ° C. Ambos son hidroliza para dar óxidos y oxihaluros, como NbOCl 3. El pentacloruro es un reactivo versátil que se utiliza para generar el compuestos organometálicos, tales como dicloruro de niobocene ((C 5 H 5) 2 NbCl 2). Los tetrahaluros (NBX 4) son polímeros de color oscuro con enlaces Nb-NB, por ejemplo el negro tetrafluoruro higroscópico niobio (NBF 4) y niobio tetracloruro marrón (NbCl 4).
Compuestos de haluro de niobio aniónicos son bien conocidos, debido en parte a la Acidez de Lewis de los pentahaluros. El más importante es [NBF 7] 2-, que es un intermedio en la separación de Nb y Ta de los minerales. Este heptafluoride tiende a formar el oxopentafluoride más fácilmente que hace los complejos de halogenuros compound.Other tantalio incluyen octaédrico [NbCl 6] -:
- Nb 2 Cl 10 + 2 Cl - → 2 [NbCl 6] -
En cuanto a otros metales tempranos, una variedad de grupos de halogenuros reducidos son conocidos, el principal ejemplo de ser [Nb 6 Cl 18] 4-.
Nitruros y carburos
Otro compuestos binarios de niobio incluyen la nitruro de niobio (NbN), que se convierte en un superconductor a temperaturas bajas y se utiliza en los detectores de luz infrarroja. El principal carburo de niobio es NBC, una muy duro, refractario, material cerámico, que se utiliza comercialmente en brocas de la herramienta para las herramientas de corte.
Aplicaciones

Se estima que de 44.500 toneladas métricas de niobio extraídos en 2006, 90% se utilizó en la producción de acero estructural de alto grado, seguido por su uso en superaleaciones. El uso de aleaciones de niobio para los superconductores y en componentes electrónicos representan sólo una pequeña parte de la producción.
La producción de acero
El niobio es un eficaz elemento microaleación para el acero. La adición de niobio al acero provoca la formación de carburo de niobio y nitruro de niobio dentro de la estructura del acero. Estos compuestos mejoran el afino del grano, el retraso de recristalización, y endurecimiento por precipitación del acero. Estos efectos, a su vez aumentan la resistencia, la fuerza, la capacidad de formación, y la soldabilidad del acero microaleado. Microaleados aceros inoxidables tienen un contenido de niobio de menos de 0,1%. Es una importante adición a la aleación alta resistencia aceros de baja aleación que son ampliamente utilizados como componentes estructurales en los automóviles modernos. Estas aleaciones que contienen niobio son fuertes y se utilizan a menudo en la construcción del gasoducto.
Superaleaciones

Cantidades apreciables del elemento, ya sea en su forma pura o en forma de ferroniobio de alta pureza y de níquel niobio, se utilizan en níquel, cobalto -, y hierro basado superaleaciones para aplicaciones tales como motores a reacción componentes, turbinas de gas, subconjuntos de cohetes, sistemas cargador turbo y equipo resistente al calor y combustión. Niobio precipita una γ endurecimiento '' - fase dentro de la estructura del grano de la superaleación. Las aleaciones contienen hasta 6,5% de niobio. Un ejemplo de una superaleación que contiene niobio a base de níquel es Inconel 718, que consiste en aproximadamente 50% de níquel , 18,6% de cromo , 18,5% de hierro , 5% de niobio, 3,1% de molibdeno , 0,9% de titanio y 0,4% de aluminio . Estas superaleaciones se utilizan, por ejemplo, en los sistemas de trama de aire avanzadas tales como los utilizados en el Programa Gemini.
Una aleación utilizada para toberas de cohetes propulsores líquidos, como en el motor principal de la Apolo Lunar módulos, es C103, que consta de 89% de niobio, 10% de hafnio y 1% de titanio. Otra aleación de niobio fue utilizado para la boquilla de la Módulo de servicios de Apolo. Como niobio se oxida a temperaturas superiores a 400 ° C, una capa protectora es necesario para estas aplicaciones para prevenir la aleación se convierta en quebradizo.
Imanes superconductores
El niobio-germanio (Ge Nb 3), niobio-estaño (Nb 3 Sn), así como la niobio-titanio aleaciones se utilizan como una tipo II alambre superconductor para imanes superconductores. Estos imanes superconductores se utilizan en imágenes por resonancia magnética y instrumentos de resonancia magnética nuclear, así como en aceleradores de partículas. Por ejemplo, el Gran Colisionador de Hadrones utiliza 600 toneladas de hilos superconductores, mientras que el Reactor Experimental Termonuclear Internacional se estima utilizar 600 toneladas de Nb 3 Sn hebras y 250 toneladas de hilos NbTi. Tan sólo en 1992, se utilizaron cables de niobio-titanio para la construcción de más de US $ 1 mil millones de dólares en sistemas de imágenes de resonancia magnética clínicos.
Superconductor, otra
La Superconductor Radio Frecuencia (RF) cavidades utilizadas en el láseres de electrones libres y TESLA XFEL están hechos de niobio puro.
La alta sensibilidad del superconductor nitruro de niobio bolómetros ellos un detector ideal para hacer la radiación electromagnética en la banda de frecuencias de THz. Estos detectores se pusieron a prueba en el Heinrich Hertz Submilimétrica Telescope, el Telescopio del Polo Sur, la Receptor Lab Telescopio, y en APEX y ahora se utilizan en el instrumento HIFI a bordo del Observatorio Espacial Herschel.
Otros usos
Electrocerámica
Niobato de litio, que es una ferroeléctrico, se utiliza ampliamente en los teléfonos móviles y moduladores ópticos, y para la fabricación de dispositivos de ondas acústicas de superficie. Pertenece a la ABO 3 estructura ferroeléctricos como tantalato de litio y titanato de bario. El niobio se evaluó como una alternativa más barata a tántalo en condensadores, pero condensadores de tantalio son todavía predominante. El niobio se añade al vidrio a fin de alcanzar una mayor índice de refracción, una propiedad de utilidad para la industria óptica en la fabricación de finas gafas correctoras .
Aplicaciones para alérgicos: Medicina y joyas
Niobio y algunas aleaciones de niobio son fisiológicamente inertes y por lo tanto hipoalergénico. Por esta razón, el niobio se encuentra en muchos dispositivos médicos, tales como los marcapasos. El niobio tratado con hidróxido de sodio se forma una capa porosa que ayuda osteointegración.
Junto con titanio, tántalo, y aluminio, niobio también puede ser calentado eléctricamente y anodizado, lo que resulta en una amplia gama de colores usando un proceso conocido como metal reactivo anodizado que es útil en la fabricación de joyas. El hecho de que el niobio es hipoalergénico también se beneficia de su uso en joyería.
Numismática
El niobio se utiliza como un metal precioso en monedas conmemorativos, a menudo con plata u oro. Por ejemplo, Austria produjo una serie de niobio plata en euros monedas a partir de 2003; el color en estas monedas es creado por el difracción de la luz por una capa delgada de óxido producida por anodizado. En 2012, diez monedas disponibles que muestran una amplia variedad de colores en el centro de la moneda: azul, verde, marrón, púrpura, violeta o amarillo. Dos ejemplos más son el 2004 austriaco € 25 150 Años Semmering Alpine Ferrocarril moneda conmemorativa, y el 2006 austriaco € 25 Europeo de Navegación por Satélite moneda conmemorativa. La Casa de Moneda de Austria producido para Letonia una serie similar de monedas a partir de 2004, con un siguiente en 2007. En 2011, la Real Casa de la Moneda de Canadá inició la producción de una moneda de $ 5 de plata esterlina y niobio llamado Luna de cazadores en el que el niobio se oxida selectivamente, por tanto, la creación de acabados únicos donde no hay dos monedas son exactamente iguales.
Otro
Los sellos de arco de tubo de alta presión lámparas de vapor de sodio están hechas de niobio, o niobio con 1% de circonio , niobio porque tiene un coeficiente muy similares de expansión térmica a la sinterizado de alúmina cerámica tubo de arco, un material translúcido que resiste el ataque químico o reducción por el vapor de sodio y de sodio líquido caliente contenido dentro de la lámpara de operación. El metal también se utiliza en varillas de soldadura de arco para algunos estabilizaron grados de acero inoxidable. También se utiliza como material en ánodos para sistemas de protección catódica en algunos tanques de agua, que luego se sembraron generalmente por el platino.
Precauciones
El niobio no ha conocido papel biológico. Mientras el polvo de niobio es un irritante de los ojos y de la piel y un peligro de incendio, niobio elemental en una escala mayor es fisiológicamente inerte (y por lo tanto hipoalergénico) e inofensivo. Se utiliza con frecuencia en joyería y ha sido probado para su uso en algunos dispositivos médicos implantados.
Compuestos que contienen niobio-se encuentran raramente por la mayoría de la gente, pero algunos son tóxicos y deben ser tratados con cuidado. La exposición a corto y largo plazo para niobatos y cloruro de niobio, dos productos químicos que son solubles en agua, han sido probados en ratas. Las ratas tratadas con una sola inyección de pentacloruro de niobio o niobatos muestran una dosis letal media (LD 50) entre 10 y 100 mg / kg. Para la administración oral, la toxicidad es menor; un estudio con ratas produjo un LD 50 después de siete días de 940 mg / kg.


