
Sodio
Acerca de este escuelas selección Wikipedia
SOS Children ha intentado que el contenido de Wikipedia más accesible por esta selección escuelas. Todos los niños disponibles para el apadrinamiento de niños de Aldeas Infantiles SOS son atendidos en una casa de familia por la caridad. Leer más ...
| Sodio | |||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
11 Na | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| Apariencia | |||||||||||||||||||||||||||||
metálico blanco plateado  Las líneas espectrales de sodio | |||||||||||||||||||||||||||||
| Propiedades generales | |||||||||||||||||||||||||||||
| Nombre, símbolo, número | de sodio, Na, 11 | ||||||||||||||||||||||||||||
| Pronunciación | / s oʊ d yo ə m / SOH dee-əm | ||||||||||||||||||||||||||||
| Categoría Elemento | de metal alcalino | ||||||||||||||||||||||||||||
| Grupo, período, bloque | 1 (metales alcalinos) , 3, s | ||||||||||||||||||||||||||||
| Peso atómico estándar | 22.98976928 (2) | ||||||||||||||||||||||||||||
| Configuración electrónica | [ Ne ] 3s 1 2,8,1 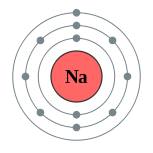 | ||||||||||||||||||||||||||||
| Historia | |||||||||||||||||||||||||||||
| Descubrimiento | Humphry Davy (1807) | ||||||||||||||||||||||||||||
| Primer aislamiento | Humphry Davy (1807) | ||||||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||
| Densidad (cerca rt) | 0,968 g · cm -3 | ||||||||||||||||||||||||||||
| Líquido densidad en mp | 0,927 g · cm -3 | ||||||||||||||||||||||||||||
| Punto de fusion | 370,87 K , 97.72 ° C, 207,9 ° F | ||||||||||||||||||||||||||||
| Punto de ebullicion | 1156 K, 883 ° C, 1621 ° F | ||||||||||||||||||||||||||||
| Punto crítico | (Extrapolado) 2573 K, 35 MPa | ||||||||||||||||||||||||||||
| Calor de fusión | 2.60 kJ · mol -1 | ||||||||||||||||||||||||||||
| El calor de vaporización | 97,42 kJ · mol -1 | ||||||||||||||||||||||||||||
| Capacidad calorífica molar | 28.230 J · mol -1 · K -1 | ||||||||||||||||||||||||||||
| Presión del vapor | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| Propiedades atómicas | |||||||||||||||||||||||||||||
| Estados de oxidación | 1, -1 (Fuertemente óxido básico) | ||||||||||||||||||||||||||||
| Electronegatividad | 0,93 (escala de Pauling) | ||||||||||||||||||||||||||||
| Energías de ionización ( más) | Primero: 495.8 kJ · mol -1 | ||||||||||||||||||||||||||||
| Segundo: 4562 kJ · mol -1 | |||||||||||||||||||||||||||||
| Tercero: 6910,3 kJ · mol -1 | |||||||||||||||||||||||||||||
| Radio atómico | 186 pm | ||||||||||||||||||||||||||||
| Radio covalente | 166 ± 21:00 | ||||||||||||||||||||||||||||
| Van der Waals radio | 227 pm | ||||||||||||||||||||||||||||
| Miscelánea | |||||||||||||||||||||||||||||
| Estructura cristalina | centrada en el cuerpo cúbico  | ||||||||||||||||||||||||||||
| Ordenamiento magnético | paramagnético | ||||||||||||||||||||||||||||
| La resistividad eléctrica | (20 ° C) 47,7 nΩ · m | ||||||||||||||||||||||||||||
| Conductividad térmica | 142 W · m -1 · K -1 | ||||||||||||||||||||||||||||
| Expansión térmica | (25 ° C) 71 m · m -1 · K -1 | ||||||||||||||||||||||||||||
| Velocidad del sonido (varilla delgada) | (20 ° C) 3200 m · s -1 | ||||||||||||||||||||||||||||
| El módulo de Young | 10 GPa | ||||||||||||||||||||||||||||
| Módulo de corte | 3,3 GPa | ||||||||||||||||||||||||||||
| Módulo de volumen | 6,3 GPa | ||||||||||||||||||||||||||||
| Dureza de Mohs | 0.5 | ||||||||||||||||||||||||||||
| Dureza Brinell | 0,69 MPa | ||||||||||||||||||||||||||||
| Número de registro del CAS | 7440-23-5 | ||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | |||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de sodio | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
El sodio es un elemento químico con el símbolo Na (del latín : natrium) en la tabla periódica y número atómico 11. Es un metal de color blanco plateado suave, altamente reactivo y es miembro de los metales alcalinos ; su único estable isótopo es de 23 Na. El metal libre no se produce en la naturaleza, sino que debe prepararse a partir de sus compuestos; que fue aislado por primera vez por Humphry Davy en 1807 por la electrólisis del hidróxido de sodio . El sodio es el sexto más abundante elemento en la corteza terrestre, y existe en numerosos minerales como feldespatos , sodalita y sal de roca. Muchas sales de sodio son altamente solubles en agua, y sus sales de sodio ha sido lixiviada por la acción del agua de modo que cloruro y el sodio son los elementos más comunes disueltos en peso en los órganos de la Tierra de agua oceánica .
Muchos compuestos de sodio son útiles, tal como hidróxido de sodio (lejía) para elaboración del jabón, y cloruro de sodio para el uso como un agente de descongelación y un nutriente ( sal comestible). El sodio es un elemento esencial para todos los animales y algunas plantas. En los animales, los iones de sodio se utilizan contra potasio iones a acumular cargos en las membranas celulares, permitiendo la transmisión de los impulsos nerviosos cuando se disipa la carga. La consecuente necesidad de animales para el sodio hace que se clasifica como macro-mineral inorgánico dietético.
Características
Físico
Sodio en temperatura y presión estándar es un metal blando que se puede cortar fácilmente con un cuchillo y es un buen conductor de la electricidad. Recién expuesto, el sodio tiene un lustre brillante, plateado que empaña rápidamente, formando una capa blanca de hidróxido de sodio y carbonato de sodio. Estas propiedades cambian a presiones elevadas: en 1.5 Mbar, el color cambia a negro, luego a rojo transparente en el 1,9 mbar, y finalmente claras transparente a 3 mbar. Todos estos alótropos son aislantes y electrides.
Cuando el sodio o sus compuestos se introducen en una llama, lo convierten amarillo, porque la excitado 3s electrones de sodio emiten un fotón cuando caen de 3p a 3s; la longitud de onda de este fotón corresponde a la La línea D a 589,3 nm. Interacciones spin-órbita que implican el electrón en el orbital 3p dividida la línea D en dos; estructuras hiperfinos involucran ambos orbitales causan muchas más líneas.
Químico

El sodio es generalmente menos reactivo que el potasio y el más reactivo que el litio . Como todos los metales alcalinos , reacciona exotérmicamente con agua, hasta el punto de que las piezas suficientemente grandes funden a una esfera y pueden explotar; Esta reacción produce sosa cáustica de hidróxido de sodio e inflamable de hidrógeno gas. Cuando se quema en el aire seco, que afecta principalmente las formas peróxido de sodio, así como algunos óxido de sodio. En aire húmedo, los resultados de hidróxido de sodio. De metal de sodio se altamente reductora, con la reducción de los iones de sodio que requieren -2,71 voltios, pero de potasio y de litio tienen incluso potenciales más negativos. Por lo tanto, la extracción de metal de sodio a partir de sus compuestos (tales como con cloruro de sodio) utiliza una cantidad significativa de energía.
Isótopos
20 isótopos de sodio son conocidos, pero sólo 23 Na es estable. Dos radiactivo, isótopos cosmogénicos son el subproducto de espalación de rayos cósmicos: 22 Na con una vida media de 2,6 años y 24 Na, con una vida media de 15 horas; todos los otros isótopos tienen una vida media de menos de un minuto. Dos isómeros nucleares han sido descubiertos, el más largo vivido un ser 24m Na, con una vida media de alrededor de 20,2 microsegundos. Radiación de neutrones aguda, como de una nuclear accidente de criticidad, convierte parte del establo 23 Na en la sangre humana a 24 Na; mediante la medición de la concentración de Na 24 en relación con Na 23, la dosis de radiación de neutrones de la víctima puede ser calculado.
Aparición
23 Na se crea en el Proceso de combustión del carbono mediante la fusión de dos de carbono unidos a los átomos; esto requiere temperaturas por encima de 600 megakelvins y una estrella con al menos tres masas solares. La corteza de la Tierra tiene un 2,6% de sodio en peso, por lo que es el sexto elemento más abundante en la Tierra. Debido a su alta reactividad, nunca se encuentra como elemento puro. Se encuentra en muchos minerales diferentes, algunos muy soluble, tal como halita y natrón, otros mucho menos soluble, tal como anfíbol, y zeolita. La insolubilidad de ciertos minerales tales como sodio criolita y feldespato surge de sus aniones poliméricos, que en el caso de feldespato es un polisilicato. En el medio interestelar, sodio se identifica por la línea D; a pesar de que tiene una alta temperatura de vaporización, su abundancia permitido que se detecta por Mariner 10 en de Mercurio atmósfera.
Compuestos
Los compuestos de sodio son de gran importancia comercial, siendo particularmente central para las industrias productoras de vidrio , papel, jabón, y textiles . Los compuestos de sodio que son los más importantes incluyen sal de mesa (Na Cl), ceniza de sosa (Na 2 CO 3 ), bicarbonato de sodio (Na HCO 3), soda cáustica (NaOH), de nitrato de sodio (Na NO 3 ), di- y tri-fosfatos de sodio, tiosulfato de sodio (Na 2 S 2 O 3 · 5H 2 O), y bórax (Na 2 B 4 O 7 · 10H 2 O). En sus compuestos, el sodio es generalmente iónicamente unido al agua y aniones, y se ve como una duro Ácido de Lewis.
Más jabones son sales de sodio de ácidos grasos . Jabones de sodio son más duros (mayor punto de fusión) jabones que los jabones de potasio. El cloruro de sodio se utiliza ampliamente para antihielo y de-formación de hielo y como conservante; bicarbonato de sodio se utiliza principalmente para cocinar. Junto con el potasio, muchos medicamentos importantes han sodio añadido para mejorar su biodisponibilidad; Aunque en la mayoría de los casos de potasio es el mejor de iones, se selecciona de sodio por su precio más bajo y peso atómico. Hidruro de sodio se utiliza como base para varias reacciones (tales como la reacción aldólica ) en la química orgánica, y como agente reductor en la química inorgánica.
Las soluciones acuosas
De sodio tiende a formar compuestos solubles en agua, tales como haluros, sulfatos, nitratos, carboxilatos y carbonatos. Las principales especies acuosas son los complejos acuo [Na (H 2 O) n] +, donde n = 4-6. La alta afinidad de sodio para oxígeno basado ligandos es la base de éteres corona; antibióticos macrólidos, que interfieren con el transporte de Na + en el organismo de la infección, son funcionalmente relacionadas y más complejo.
Precipitación directa de sales de sodio a partir de soluciones acuosas es raro, porque las sales de sodio normalmente tienen una alta afinidad por el agua; una excepción es bismutato de sodio (NaBiO 3). Debido a esto, las sales de sodio son generalmente aislados en forma de sólidos por evaporación o por precipitación con un disolvente orgánico, tal como etanol ; por ejemplo, sólo 0,35 g / L de cloruro de sodio se disuelve en etanol. Los éteres corona, como 15-corona-5, puede ser utilizado como una catalizador de transferencia de fase.
El contenido de sodio en mayor puede ser determinada por tratamiento con un gran exceso de acetato de uranilo zinc; la hexahidratado (UO 2) 2 ZnNa (CH 3 CO 2) · 6H 2 O precipitados, que puede ser pesado. Cesio y rubidio no interfieran con esta reacción, pero potasio y litio hacen. Las concentraciones más bajas de sodio pueden ser determinados por espectrofotometría de absorción atómica o por potenciometría utilizando electrodos selectivos de iones.
Electrides y sodides
Al igual que los otros metales alcalinos, el sodio se disuelve en amoníaco y algunas aminas para dar soluciones de colores intensos; la evaporación de estas soluciones deja una película brillante de sodio metálico. Las soluciones contienen el complejo de coordinación (Na (NH 3 6)) +, cuya carga positiva tiene como contrapartida electrones como aniones; criptandos permiten el aislamiento de estos complejos como sólidos cristalinos. Criptandos, como éteres corona y otros ionóforos, tienen una alta afinidad por el ión sodio; derivados de la alkalide Na - se pueden obtener mediante la adición de criptandos a soluciones de sodio en amoniaco a través de desproporción.
Compuestos organosodio
Muchos compuestos organosodio se han preparado. Debido a la alta polaridad de los enlaces C-Na, se comportan como fuentes de carbaniones (sales orgánicas con aniones ). Algunos derivados bien conocidos incluyen ciclopentadienuro de sodio (NaCl 5 H 5) y sodio tritilo ((C 6 H 5) 3 CNA).
Historia
La sal ha sido un producto importante en las actividades humanas, como se muestra por la palabra salario Inglés, que deriva de Salarium, las obleas de sal dan a veces a los soldados romanos, junto con sus otros salarios. En la Europa medieval, se utilizó un compuesto de sodio con el nombre latino de sodanum como un dolor de cabeza remedio. El nombre de sodio se cree que proceden de la suda árabe (صداع), es decir, dolor de cabeza, ya que las propiedades de dolor de cabeza, el alivio de carbonato de sodio o soda eran bien conocidos en los primeros tiempos. La abreviatura química para el sodio fue publicado por primera vez por Jöns Jakob Berzelius en su sistema de símbolos atómicos, y es una contracción del elemento de nueva natrium nombre en latín, que se refiere a la egipcia natrón, una sal mineral natural a base principalmente de carbonato de sodio hidratado. Natron históricamente tuvo varios usos industriales y domésticos importantes, más tarde eclipsado por otros compuestos de sodio. Aunque el sodio, a veces llamado soda, había sido ampliamente reconocida en los compuestos, el propio metal no fue aislado hasta 1807 por Sir Humphry Davy a través de la electrólisis de hidróxido de sodio .
Sodio imparte un color amarillo intenso a las llamas. Ya en 1860, Kirchhoff y Bunsen tomó nota de la alta sensibilidad de un ensayo a la llama de sodio, y se indica en Annalen der Physik und Chemie:
| " | En un rincón de la habitación 60 m 3 más alejada del aparato, que explotó 3 mg. de clorato de sodio con azúcar de la leche, mientras que la observación de la llama no luminosa antes de la hendidura. Después de un rato, brillaba un color amarillo brillante y mostró una línea de sodio fuerte que desapareció sólo después de 10 minutos. A partir del peso de la sal de sodio y el volumen de aire en la habitación, se calcula fácilmente que una parte en peso de aire no puede contener más de 1/20 de peso millonésima de sodio. | " |
La producción comercial
Disfrutando de las aplicaciones más especializadas, sólo alrededor de 100.000 toneladas de sodio metálico se producen anualmente. El sodio metálico se produce comercialmente por primera vez en 1855 por reducción carbotérmica de carbonato de sodio a 1100 ° C, en lo que se conoce como el Proceso Deville:
- Na 2 CO 3 + 2 C → 2 Na + 3 CO
Se desarrolló un proceso relacionado basado en la reducción de hidróxido de sodio en 1.886.
El sodio se produce ahora comercialmente a través de la electrólisis de fundido de cloruro de sodio , basado en un proceso patentado en 1924. Esto se hace en una Downs de la célula en la que el NaCl se mezcla con cloruro de calcio para disminuir el punto de fusión por debajo de 700 ° C. Como el calcio es menos electropositivo que el sodio, el calcio no se deposita en el cátodo. Este método es menos caro que el anterior Proceso Castner de electrólisis del hidróxido de sodio .
Sodio grado reactivo en cantidades tonelada vendida por cerca de US $ 3.30 / kg en 2009; inferior de metal pureza vende por mucho menos. El mercado para el sodio es volátil debido a la dificultad en su almacenamiento y envío; se deberá almacenar en un lugar seco atmósfera de gas inerte o anhidro aceite mineral para evitar la formación de una capa superficial de óxido de sodio o superóxido de sodio. Estos óxidos pueden reaccionar violentamente en presencia de orgánicos materiales. Pequeñas cantidades de sodio cuestan mucho más, en el rango de US $ 165 / kg; el alto costo se debe en parte a los gastos de envío material peligroso.
Aplicaciones
Aunque el sodio metálico tiene algunos usos importantes, las principales aplicaciones de sodio utilizarlo en sus múltiples compuestos; millones de toneladas de la de cloruro , hidróxido , y carbonato se producen anualmente.
Elemento gratuito
El sodio metálico se utiliza principalmente para la producción de borohidruro de sodio, azida de sodio, añil, y trifenilfosfina. Usos anteriores fueron para la fabricación de tetraetilo de plomo y titanio metálico; porque las aplicaciones para estos productos químicos se interrumpieron, de la producción de sodio disminuyó después de 1970. sodio también se usa como un metal de aleación, una agente anti-incrustaciones, y como agente reductor para los metales cuando otros materiales son ineficaces. Lámparas de vapor de sodio a menudo se utilizan para el alumbrado público en las ciudades y dan colores que van desde el amarillo-naranja a melocotón como la presión aumenta. Por sí mismo o con el potasio, el sodio es una desecante; se da una intensa coloración azul con benzofenona cuando el desecado es seco. En Organic Synthesis, de sodio se utiliza en diversas reacciones tales como la Reducción de Birch, y la prueba de fusión de sodio se lleva a cabo para analizar cualitativamente compuestos. Los láseres que emiten luz en la línea D, la utilización de sodio, se utilizan para crear artificial estrellas guía láser que ayudar en la óptica adaptativa para telescopios de luz visible en tierra.
Transferencia de calor
De sodio líquido se utiliza como una la transferencia de calor del fluido en algunos reactores rápidos, debido a su alta conductividad térmica y baja absorción de neutrones sección transversal, que se requiere para lograr un alto flujo de neutrones; el punto de ebullición alto permite que el reactor funcione a presión ambiente. Los inconvenientes de la utilización de sodio incluyen su opacidad, lo que dificulta el mantenimiento visual, y sus propiedades explosivas. Radioactivo sodio-24 puede estar formado por activación de neutrones durante el funcionamiento, lo que representa un peligro leve de radiación; la radiactividad se detiene en pocos días después de la retirada del reactor. Si un reactor necesita ser cerrado con frecuencia abajo, NaK se utiliza; debido a que es líquido a temperatura ambiente, tubos de refrigeración no se congelan. En este caso, el piroforicidad de potasio significa precauciones adicionales contra las fugas se deben tomar. Otra aplicación de transferencia de calor es en motores de combustión interna de alto rendimiento con válvulas de asiento, donde vástagos de válvula parcialmente lleno con el sodio se utilizan como una tubo de calor para enfriar las válvulas.
Papel biológico
En los seres humanos, el sodio es un nutriente esencial que regula el volumen de sangre, la presión arterial, el equilibrio osmótico y pH; el requisito mínimo fisiológica de sodio es de 500 miligramos por día. El cloruro de sodio es la fuente principal de sodio en la dieta, y se utiliza como condimento y conservante, tal como, por decapado y cecina; la mayor parte proviene de los alimentos procesados. La DRI para el sodio es de 2,3 gramos por día, pero en la gente común en los Estados Unidos consumen 3,4 gramos por día, la cantidad mínima que promueve la hipertensión ; esto a su vez provoca 7,6 millones de muertes prematuras en todo el mundo.
La sistema renina-angiotensina regula la cantidad de líquidos y de sodio en el cuerpo. Reducción de la presión arterial y la concentración de sodio en el resultado de riñón en la producción de renina, que a su vez produce aldosterona y angiotensina, reteniendo de sodio en la orina. Debido al aumento en la concentración de sodio, la producción de renina disminuye, y las de sodio de concentración vuelve a la normalidad. También es importante en sodio función de las neuronas y la osmorregulación entre las células y la líquido extracelular, su distribución en todos los animales mediada por Na + / K + -ATPasa; por lo tanto, el sodio es el catión más prominente en el líquido extracelular.
En Plantas C4, el sodio es una micronutrientes que ayuda en el metabolismo, específicamente en la regeneración de fosfoenolpiruvato y la síntesis de la clorofila. En otros, que sustituye a potasio en varios papeles, como el mantenimiento la presión de turgencia y ayudar en la apertura y cierre de los estomas. El exceso de sodio en el suelo limita la absorción de agua debido a la disminución potencial de agua, que puede resultar en el marchitamiento; concentraciones similares en el citoplasma puede dar lugar a la inhibición de la enzima, que a su vez causa la necrosis y clorosis. Para evitar estos problemas, las plantas mecanismos desarrollados que limitan la absorción de sodio por las raíces, las almacena en la celda vacuolas y controlarlos a través de largas distancias; el exceso de sodio también puede ser almacenado en el tejido vegetal de edad, lo que limita el daño a un nuevo crecimiento.
Precauciones
Es necesario tener cuidado en la manipulación de sodio elemental, ya que genera hidrógeno inflamable y cáustica de hidróxido de sodio al entrar en contacto con agua; de sodio en polvo puede quemar espontáneamente en el aire o el oxígeno. El exceso de sodio puede eliminarse de manera segura por hidrólisis en un gabinete ventilado; esto se realiza normalmente mediante tratamiento secuencial con isopropanol, etanol y agua. Isopropanol reacciona muy lentamente, generando el correspondiente alcóxido e hidrógeno. Los extintores de incendios a base de agua acelerar incendios de sodio; los basados en dióxido de carbono y bromoclorodifluorometano perder su eficacia cuando se disipan. Un agente de extinción eficaz es Met-LX, que comprende aproximadamente el 5% Saran en cloruro de sodio junto con agentes de flujo; que es más comúnmente aplicado a mano con una cuchara. Otros materiales incluyen Lith +, que tiene polvo de grafito y una organofosforados retardante de llama, y la arena seca.

