
Cloruro de sodio
Acerca de este escuelas selección Wikipedia
SOS cree que la educación da una mejor oportunidad en la vida para los niños en el mundo en desarrollo también. ¿Quieres saber sobre el patrocinio? Ver www.sponsorachild.org.uk
| Cloruro de sodio | |
|---|---|
 | |
 | |
Cloruro de sodio | |
Otros nombres La sal común; halita; sal de mesa | |
| Identificadores | |
| CAS | 7647-14-5 |
| Número RTECS | VZ4725000 |
| Propiedades | |
| Fórmula molecular | Na Cl |
| Masa molar | 58.442 g / mol |
| Apariencia | Cristales o polvo blancos o incoloros |
| Densidad | 2,16 g / cm³, sólida |
| Punto de fusion | 801 ° C |
| Punto de ebullicion | 1465 ° C (1738 K) |
| Solubilidad en agua | 35,9 g / 100 ml (25 ° C) |
| Estructura | |
| Coordinación geometría | Octaédrico |
| Peligros | |
| MSDS | MSDS externa |
| Frases R | 36 |
| Frases S | ninguno |
| Principal peligros | Aguijón irritante y poder |
| NFPA 704 |  0 1
0 |
| Punto de inflamabilidad | No es inflamable |
| Compuestos relacionados | |
| Otros aniones | NaF, NaBr, NaI |
| Otros cationes | LiCl, KCl, RbCl, CsCl, MgCl2, CaCl2 |
| Conexo sales | Acetato de sodio |
| Página de datos complementaria | |
| Estructura y propiedades | n, ε r, etc. |
| Termodinámica datos | Comportamiento de fase Sólido, líquido, gas |
| Los datos espectrales | UV, IR, RMN , MS |
| Excepto cuando se indique lo contrario, los datos se den materiales en su condiciones normales (25 ° C, 100 kPa) | |
| Exenciones y referencias | |
El cloruro de sodio, también conocido como sal común, sal de mesa, o halita, es un compuesto químico con la fórmula Na Cl . El cloruro de sodio es la sal más responsable de la salinidad del océano y de la fluido extracelular de muchos multicelulares organismos . A medida que el principal ingrediente en sal comestible, se utiliza comúnmente como una condimentos y alimentos conservante. En un gramo de cloruro de sodio, hay aproximadamente 0,3933 gramos de sodio, y 0,6067 gramos de cloro.
Producción y uso
La sal se produce actualmente en masa por la evaporación del agua de mar o salmuera de otras fuentes, tales como pozos de salmuera y lagos de sal, y por sal de roca minera, llamado halita. En 2002, la producción mundial se estima en 210 millones de toneladas métricas, los cinco principales productores son Estados Unidos (40,3 millones de toneladas), China (32,9), Alemania (17,7), India (14,5) y Canadá (12,3).
Además de los usos habituales de sal en de cocción, la sal se utiliza en muchas aplicaciones, desde la fabricación de pulpa y papel para el establecimiento de colorantes en la industria textil y de la tela, para producir jabones y detergentes. En los países fríos, se utilizan grandes cantidades de sal de roca para ayudar a las carreteras libres de hielo durante el invierno, aunque "Ruta de la Sal" pierde su capacidad de fusión a temperaturas inferiores a -15 ° C y -20 ° C (5 ° F a -4 ° F ). El cloruro de sodio se utiliza a veces como un barato y seguro desecante debido a su propiedades higroscópicas, lo que hace salazón un método eficaz de conservación de los alimentos históricamente. A pesar de que los desecantes más efectivos disponibles, pocos son seguros para los seres humanos para ingerir.

Israelíes y jordanas estanques de evaporación de sal en el extremo sur del Mar Muerto

Montones de sal, Salar de Uyuni, Bolivia .

Moderno mina de sal de roca cerca Mount Morris, Nueva York.

Lagunas de evaporación, Aigues-Mortes, Francia
| La solubilidad del NaCl en diversos disolventes (G NaCl / 100 g de disolvente a 25 ° C) | |
|---|---|
| H 2 O | 26 |
| El amoníaco líquido | 3.02 |
| El metanol | 1.4 |
| Ácido fórmico | 5.2 |
| Sulfolano | 0,005 |
| El acetonitrilo | 0.0003 |
| Acetona | 0.000042 |
| Formamida | 9.4 |
| Dimetilformamida | 0.04 |
| Referencia: Burgess, J. iones metálicos en solución (Ellis Horwood, Nueva York, 1978) ISBN 0-85312-027-7 | |
Usos sintéticos
La sal es también la materia prima utilizada para producir el cloro que a su vez es necesario para la producción de muchos materiales modernos incluyendo PVC y pesticidas. Industrialmente, el cloro elemental se produce generalmente por la electrólisis de cloruro de sodio disuelto en agua. Junto con cloro, este proceso de cloro-álcali produce hidrógeno gas y de hidróxido de sodio , de acuerdo con la ecuación química
- 2NaCl + 2H 2 O → Cl 2 + H 2 + 2NaOH
Sodio metálico se produce comercialmente a través de la electrólisis de cloruro de sodio líquido. Esto se hace en una Células de Down en el que el cloruro de sodio se mezcla con cloruro de calcio para disminuir el punto de fusión por debajo de 700 ° C. Como el calcio es más electropositivo que el sodio, no se formará de calcio en el cátodo. Este método es menos caro que el método anterior de electrólisis del hidróxido de sodio.
El cloruro de sodio se utiliza en otros procesos químicos para la producción a gran escala de compuestos que contienen sodio o cloro. En el Proceso Solvay, cloruro de sodio se utiliza para la producción de carbonato de sodio y cloruro de calcio . En el Proceso Mannheim y en el Proceso de Hargreaves, se utiliza para la producción de sulfato de sodio y ácido clorhídrico .
Usos biológicos
Muchos microorganismos no pueden vivir en un ambiente demasiado salada: el agua se extrae de sus células por ósmosis. Por esta razón la sal se utiliza para conservar algunos alimentos, como el tocino o el pescado ahumado y también se puede utilizar para separar sanguijuelas que se hayan adherido a alimentarse. También se ha usado para desinfectar heridas. En medievales tiempos sal se frota en las superficies del hogar como un agente de limpieza.
Las funciones biológicas
En los seres humanos, un alto consumo de sal se demostró para atenuar la producción de óxido nítrico. El óxido nítrico (NO) contribuye a la homeostasis del recipiente mediante la inhibición de la contracción del músculo liso vascular y el crecimiento, la agregación plaquetaria y la adhesión de leucocitos al endotelio [ ]
Estructura cristalina
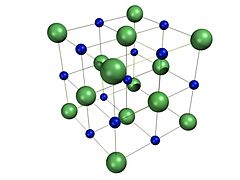
El cloruro de sodio forma cristales cúbicos con simetría . En éstos, los más grandes de cloruro de iones , que se muestra a la derecha como esferas verdes, están dispuestos en una cúbica primer embalaje, mientras que los más pequeños de sodio iones, que se muestra a la derecha como esferas azules, rellene los campos octaédricos entre ellos.
Cada ion está rodeado por seis iones de la otra clase. Esta misma estructura básica se encuentra en muchos otros minerales , y es conocido como el estructura halita. Esta disposición se conoce como cerca cúbico lleno (PCCh). Se puede representar como dos cúbicos (FCC) retículos interpenetrantes caras centradas, o una celosía fcc con una base dos átomos. Se conoce más comúnmente como la estructura cristalina rocksalt.
Se lleva a cabo junto con una enlace iónico y fuerzas electrostáticas .
La sal del camino
Mientras que la sal era una vez un bien escaso en la historia, la producción industrializada ha hecho sal abundante. Alrededor del 51% de la producción mundial ahora es utilizado por los países fríos a caminos de hielo en invierno, tanto en contenedores desarenadores y propagación por vehículos de servicio de invierno. Esto funciona porque la sal y el agua forman una mezcla eutéctica. Adición de sal al agua bajará la temperatura de congelación del agua, dependiendo de la concentración. La salinidad del agua se mide en gramos de sal por kilogramo (1000 g) de agua, y las temperaturas de congelación son los siguientes.
| S (g / kg) | 0 | 10 | 20 | 24.7 | 30 | 35 |
| T (congelación) (C) | 0 | -0,5 | -1.08 | -1.33 | -1.63 | -1.91 |
Gran parte de la sal del camino utilizado en Europa proviene de minas en Carrickfergus.
Aditivos
La sal de mesa venden en el mercado hoy en día no es el cloruro de sodio puro. En 1911 carbonato de magnesio se añadió primero a la sal para hacer que fluya más libremente. En 1924 cantidades traza de yodo en forma de yoduro de sodio, yoduro de potasio o yodato de potasio se añadieron primero, para reducir la incidencia de sencillo bocio.
Sal para el deshielo en el Reino Unido por lo general contiene sodio hexacianoferrato (II) a menos de 100 ppm como un agente anti-apelmazamiento. En los últimos años este aditivo también se ha utilizado en la sal de mesa.
Productos químicos comunes
Los productos químicos utilizados en las sales de deshielo se encuentran sobre todo a ser cloruro de sodio (NaCl) o cloruro de calcio (CaCl2). Ambas son similares y son eficaces en las carreteras de deshielo. Cuando se producen estas sustancias químicas, que son extraídos / hechas, aplastado a gránulos finos, luego tratados con un agente anti-apelmazamiento. La adición de sal reduce el punto del agua, lo que permite que el líquido sea estable a temperaturas más bajas y permite que el hielo se derrita congelación. También se han utilizado productos químicos de deshielo alternativos. Las sustancias químicas como acetato de magnesio calcio y formiato de potasio se están produciendo. Estas sustancias tienen algunos de los efectos químicos negativos en el medio ambiente comúnmente asociado con NaCl y CaCl2.

