
Hidróxido de sodio
Antecedentes de las escuelas de Wikipedia
SOS ofrecen una descarga completa de esta selección de escuelas para su uso en escuelas intranets. SOS Children trabaja en 45 países africanos; puede ayudar a un niño en África ?
| Hidróxido de sodio | |
|---|---|
 | |
 | |
Hidróxido de sodio | |
Otros nombres Lejía, soda cáustica | |
| Identificadores | |
| CAS | 1310-73-2 |
| Propiedades | |
| Fórmula molecular | NaOH |
| Masa molar | 39,9971 g / mol |
| Apariencia | Sólido blanco |
| Densidad | 2,1 g / cm³, sólida |
| Punto de fusion | 318 ° C (591 K) |
| Punto de ebullicion | 1390 ° C (1663 K) |
| Solubilidad en agua | 111 g / 100 ml (20 ° C) |
| Basicidad (p K b) | -2.43 |
| Peligros | |
| MSDS | MSDS externa |
| NFPA 704 |  0 3 1 |
| Punto de inflamabilidad | No es inflamable. |
| Compuestos relacionados | |
| Conexo bases | El amoníaco , lima. |
| Excepto cuando se indique lo contrario, los datos se den materiales en su condiciones normales (25 ° C, 100 kPa) | |
| Exenciones y referencias | |
El hidróxido de sodio ( Na OH ), también conocido como lejía, sosa cáustica y (incorrectamente, según IUPAC de nomenclatura) hidrato de sodio, es una metálica cáustica base. La soda cáustica forma una fuerte solución alcalina cuando se disuelve en un disolvente tal como agua. Se utiliza en muchas industrias, principalmente como una fuerte química de base en la fabricación de pulpa y papel, textiles , agua potable , jabones y detergentes y como limpiador de cañerías. La producción mundial en 1998 fue de alrededor de 45 millones toneladas. El hidróxido de sodio es la base más utilizado en los laboratorios químicos.
Hidróxido de sodio puro es un sólido blanco; disponible en gránulos, copos, gránulos y como una solución saturada de 50%. Es delicuescente y fácilmente absorbe el dióxido de carbono del aire, por lo que se deben almacenar en un recipiente hermético. Es muy soluble en agua con liberación de calor. También se disuelve en etanol y metanol , aunque exhibe baja solubilidad en disolventes que estos hidróxido de potasio. Es insoluble en éter y otros disolventes no polares. Un hidróxido de sodio solución dejará una mancha amarilla en tela y papel.
Propiedades físicas
Δ H ° disolución acuosa diluida de -44,45 kJ / mol;
Desde soluciones acuosas a 12,3-61,8 ° C, se cristaliza en monohidrato, con un punto de fusión de 65,1 ° C y la densidad de 1,829 g / cm 3;
Δ H ° formulario -734,96 kJ / mol;
Monohidrato de -28 a -24 ° C;
Heptahidrato -24--17,7 ° C;
Pentahidratado -17,7--5,4 ° C;
Tetrahidrato (cambiado α-), a -5, 4-12,3 ° C También sabemos β- metaestable NaOH 4 * H 2 O. Qué anterior 61,8 ° C se cristalizan.
Propiedades químicas
El hidróxido de sodio es completamente iónica, que contiene iones de sodio y de hidróxido de iones. El ión hidróxido de hidróxido de sodio hace que una base fuerte que reacciona con ácidos para formar agua y las sales correspondientes, por ejemplo, con ácido clorhídrico , cloruro de sodio se forma:
En general, tales reacciones de neutralización están representados por una sencilla ecuación iónica neta:
- OH - (aq) + H 3 O + (aq) → 2H 2 O
Este tipo de reacción con un ácido fuerte, libera calor, y por lo tanto se conoce como exotérmica. Tales reacciones ácido-base también se pueden utilizar para titulaciones, que es un método común para determinar la concentración de ácidos. Otro tipo de reacción que el hidróxido de sodio está implicado en es con óxidos ácidos. La reacción de dióxido de carbono ya se ha mencionado, pero otros óxidos ácidos tales como dióxido de azufre (SO 2) también reaccionan completamente. Tales reacciones se utilizan a menudo para "fregar" gases ácidos dañinos (como SO 2 y H 2 S) y evitar su emisión a la atmósfera.
- 2NaOH + CO 2 → Na 2 CO 3 + H 2 O
El hidróxido de sodio reacciona lentamente con el vidrio para formar silicato de sodio, por lo juntas de vidrio y llaves de paso expuestos a NaOH tienen una tendencia a "congelar". Frascos y revestido de vidrio- reactores químicos son dañados por una larga exposición a hidróxido de sodio caliente, y el vidrio se convierte esmerilado. El hidróxido de sodio no ataca el hierro o el cobre , pero otros metales tales como aluminio , zinc y titanio son atacados rápidamente. En 1986 una lata de aluminio camión cisterna en el Reino Unido fue erróneamente utilizado para transportar una solución de hidróxido de sodio al 25%, provocando la presurización de los contenidos y daños a la cisterna. Por esta razón, las cacerolas de aluminio nunca se deben limpiar con hidróxido de sodio.
Muchos no metales también reaccionan con hidróxido de sodio, dando sales. Por ejemplo fósforo formas hipofosfito de sodio, mientras que el silicio da silicato de sodio.
A diferencia de NaOH, los hidróxidos de la mayoría de los metales son insolubles y, por tanto hidróxido de sodio pueden utilizarse para precipitar hidróxidos metálicos. Uno de estos es hidróxido hidróxido de aluminio, usado como gelatinosa flocular para filtrar partículas en tratamiento de aguas. El hidróxido de aluminio se prepara en la planta de tratamiento de sulfato de aluminio por reacción con NaOH:
- 6NaOH (aq) + Al 2 (SO 4) 3 (ac) → 2 Al (OH) 3 (s) + 3 Na 2 SO 4 (aq)
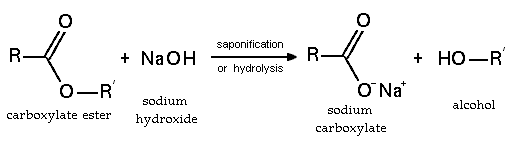
El hidróxido de sodio reacciona fácilmente con ácidos carboxílicos para formar sus sales y es aún una fuerte base suficiente para formar sales con fenoles . NaOH se puede utilizar para la base impulsado hidrólisis de ésteres (como en saponificación), amidas y haluros de alquilo. Sin embargo, la solubilidad limitada de NaOH en disolventes orgánicos significa que cuanto más soluble KOH se prefiere a menudo.
Manufactura
En 1998, la producción total mundial fue de alrededor de 45 millones toneladas. América del Norte y Asia contribuyeron colectivamente en torno a 14 millones de toneladas, mientras que Europa produce alrededor de 10 millones de toneladas.
Los métodos de producción
El hidróxido de sodio se produce (junto con el cloro y el hidrógeno ) a través de la proceso de cloro-álcali. Esto implica la electrólisis de una solución acuosa de cloruro de sodio . El hidróxido de sodio se acumula en el cátodo, donde el agua se reduce a gas hidrógeno y el hidróxido de iones:
- 2Na + + 2H 2 O + 2e - → H 2 + 2NaOH
Para producir NaOH es necesario para evitar la reacción del NaOH con el cloro . Esto se hace generalmente en una de tres maneras, de las cuales el procedimiento de la membrana es económicamente más viable.
- Proceso de celdas de mercurio (también llamado el Proceso de Castner-Kellner) - Los iones de sodio se reducen a sodio metálico , que forma una con una amalgama de mercurio cátodo; esta sodio se hace reaccionar con agua para producir NaOH. Ha habido preocupaciones sobre las emisiones de mercurio, aunque las plantas modernas dicen ser seguro en este sentido.
- Proceso de celda de diafragma - utiliza un cátodo de acero, y se evita la reacción de NaOH con Cl 2 usando un porosa diafragma, hace a menudo de las fibras de amianto. En el proceso de celda de diafragma de la zona del ánodo está separado del área del cátodo por una membrana permeable. La salmuera se introduce en el compartimiento del ánodo y fluye a través del diafragma hacia el compartimiento del cátodo. A salmuera cáustica diluida sale de la célula. La soda cáustica generalmente debe ser concentrada a 50% y la sal eliminado. Esto se hace usando un proceso evaporativo con aproximadamente tres toneladas de vapor por tonelada de sosa cáustica. La sal se separó de la salmuera cáustica se puede utilizar para saturar salmuera diluida. El cloro contiene oxígeno y se purifica por licuefacción y evaporación.
- Procedimiento de la membrana - similar al proceso de la pila de diafragma, con un Membrana de Nafion para separar las reacciones de cátodo y el ánodo. Solamente los iones de sodio y un poco de agua pasan a través de la membrana. Se produce una mayor calidad de NaOH. De los tres procesos, el proceso de la membrana celular requiere el menor consumo de energía eléctrica y la cantidad de vapor necesario para la concentración de la sosa cáustica es relativamente pequeño (menos de una tonelada por tonelada de sosa cáustica).
Un método más antiguo para la producción de hidróxido de sodio era el Proceso de LeBlanc, que produjo carbonato de sodio, seguido por calcinación para crear dióxido de carbono y óxido de sodio. Este método todavía se utiliza de vez en cuando. Ayudó a establecer el hidróxido de sodio como un importante producto químico.
El proceso LeBlanc fue reemplazado por el Proceso de Solvay en el siglo 19.
Los principales productores
En los Estados Unidos, el mayor productor de hidróxido de sodio es el Dow Chemical Company, que tiene una producción anual en torno a 3,7 millones de toneladas desde los sitios en Freeport, Texas, y Plaquemine, Louisiana. Otros grandes productores de Estados Unidos incluyen Oxychem, PPG, Olin, Pioneer Companies, Inc. (PIONA), y Formosa. Todas estas empresas utilizan el proceso de cloro-álcali.
Usos
Aplicaciones generales
El hidróxido de sodio es el principal fuerte base utilizada en la industria química. A granel es más a menudo tratada como una acuosa solución , ya que las soluciones son más baratos y más fáciles de manejar. Se utiliza para conducir reacciones químicas y también para el neutralización de materiales ácidos. Se puede utilizar también como un agente neutralizante en la refinación de petróleo. A veces se usa como un limpiador.
Quitapintura
Una solución de hidróxido de sodio en agua se utiliza tradicionalmente como el decapante de pintura más común en los objetos de madera. Debido a su corrosividad y el hecho de que puede dañar la superficie de la madera elevar el grano y la tinción del color, su uso se ha vuelto menos común.
Centavos oro
El hidróxido de sodio también se ha utilizado en combinación con zinc para la creación de la famosa "centavos oro" experimento. Cuando una centavo se hierve en una solución de NaOH junto con un poco de metal granular zinc ( clavos galvanizados son una fuente), el color de la moneda se convertirá plata en unos 45 segundos. El penique entonces se mantiene en la llama de un mechero durante unos segundos y se vuelve oro. La razón por la que esto sucede es que se disuelva granulares zinc en NaOH para formar Zn (OH) 4 2- (tetrahydroxozincate). Este ion zincate se reduce al zinc metálico en la superficie de un cobre centavo. El zinc y el cobre cuando se calienta en una forma de llama latón.
La producción de alúmina - Proceso Bayer
El hidróxido de sodio se utiliza en la refinación de alúmina del mineral que contiene ( bauxita) para producir alúmina (óxido de aluminio), que es la materia prima utilizada para producir aluminio de metal a través de la proceso de fundición.
El uso en análisis químico
En química analítica , soluciones de hidróxido de sodio a menudo se utilizan para medir la concentración de ácidos por titulación. Desde NaOH no es una patrón primario, soluciones primero debe normalizarse mediante valoración en contra de una norma de este tipo como KHP. Buretas expuestos a NaOH deben enjuagarse inmediatamente después de su uso para evitar el "congelamiento" de la llave de paso. El hidróxido de sodio se ha utilizado tradicionalmente para la prueba de cationes en Análisis cualitativo inorgánico, así como para proporcionar medios alcalinos para algunas reacciones que lo necesitan, como el Prueba Biuret.
La producción de jabón
El hidróxido de sodio se utiliza tradicionalmente en la fabricación de jabón ( jabón proceso en frío, saponificación). Los árabes comenzaron a producir el jabón de esta forma en el siglo séptimo, y el mismo proceso básico se utiliza hoy en día.
La fabricación de papel
Hidróxido de sodio también se utiliza ampliamente en la fabricación de papel. Con sulfuro de sodio, NaOH es un componente clave de la solución de licor blanco que se utiliza para separar lignina de celulosa fibras en el Proceso Kraft. También juega un papel clave en varias etapas posteriores del proceso de blanqueo de la pasta marrón resultante del proceso de fabricación de pasta. Estas etapas incluyen oxígeno deslignificación, extracción oxidativo, y la extracción simple, todo lo cual requiere un ambiente alcalino fuerte con un pH> 10,5 al final de las etapas.
Biodiesel
Para la fabricación de biodiesel , hidróxido de sodio se usa como un catalizador para la transesterificación de metanol y triglicéridos. Esto sólo funciona con hidróxido de sodio anhidro, porque el agua y la lejía se volvería la grasa en jabón que se corrompe con metanol . Se usa con más frecuencia que hidróxido de potasio porque es más barato y se necesita una cantidad más pequeña.
Grabado de aluminio
Bases fuertes atacan aluminio . Esto puede ser útil en el grabado a través de un resistir o en la conversión de una superficie pulida a un acabado satinado, pero sin mayor pasivación tales como anodización o allodizing la superficie puede corroerse, ya sea bajo un uso normal o en condiciones atmosféricas adversas.
Preparación de comida
Usos alimenticios de lejía incluyen el lavado o peeling químico de frutas y verduras , el chocolate y procesamiento de cacao, producción de caramelo de color, las aves de corral escaldado, refresco de procesamiento, y engrosamiento helado. Las aceitunas son a menudo empapados en lejía para ablandarlas, mientras pretzels y alemán rollos lejía están vidriosos con una solución de lejía antes de la cocción para que sean crujientes. Debido a la dificultad en la obtención de la lejía de grado alimenticio en pequeñas cantidades para uso doméstico, carbonato de sodio se utiliza a menudo en lugar de hidróxido de sodio.
Los alimentos específicos elaborados con lejía incluyen:
- La Delicadeza Scandinavian conocido como lutefisk (de lutfisk "lejía pescado").
- Hominy se seca de maíz (maíz) granos reconstituidos por remojo en agua con lejía. Éstos se agrandan considerablemente en tamaño y pueden ser procesados por fritura hacer frutos secos de maíz o mediante el secado y molienda para hacer sémola. Nixtamal es similar, pero utiliza hidróxido de calcio en vez de hidróxido de sodio.
- El hidróxido de sodio es también la sustancia química que produce la gelificación de las claras de huevo en la producción de Huevos de siglo.
- Alemán pretzels están escalfados en una solución de hidróxido de sodio hirviendo antes de la cocción, lo que contribuye a su corteza único.
- La mayoría de color amarillo Fideos chinos están hechos con agua de lejía, pero son comúnmente confundido contiene huevo
Los usos domésticos
El hidróxido de sodio se utiliza en el hogar como un agente de limpieza de drenaje para limpiar desagües tapados. Se distribuye como un cristal seco o como un gel líquido espeso. El mecanismo químico empleado es la conversión de la grasa a una forma de jabón. El jabón es soluble en agua, y puede ser disuelta por lavado con agua. Hidróxido de sodio también se descompone moléculas complejas tales como la proteína que compone cabello. Estos limpiadores de drenaje (y sus ácidos versiones) son altamente cáustico y debe manejarse con cuidado.
La lejía se ha utilizado como una relajante para alisar el cabello. Sin embargo, debido a la alta incidencia y la intensidad de las quemaduras químicas, los fabricantes relajante químico han cambiado ahora a otros productos químicos alcalinos, aunque relajantes lejía están todavía disponibles, utilizado sobre todo por los profesionales.
La digestión del tejido
Este es un proceso que se utilizó con animales de granja a la vez. Este proceso implica la colocación de una carcasa en una cámara sellada, que luego se pone la carcasa en una mezcla de lejía y agua, que rompe los enlaces químicos mantener el cuerpo intacto. Esto a la larga se convierte en el cuerpo en un líquido parecido al café, y los únicos restos sólidos son los cascos de los huesos, lo que podría ser aplastados entre uno de los dedos. También es de destacar que el hidróxido de sodio se utiliza con frecuencia en el proceso de descomposición roadkill vierten en los rellenos sanitarios por parte de contratistas de eliminación de animales.
Hidróxido de sodio también ha sido utilizado por los delincuentes y los asesinos en serie para deshacerse de los cuerpos de sus víctimas.
Drogas ilegales
El hidróxido de sodio es un reactivo clave en el proceso de hacer La metanfetamina y otras drogas ilegales. Contrariamente a los informes de medios populares, no es en realidad un "ingrediente" en estos medicamentos, sino simplemente una base fuerte utilizada para manipular el pH en varios puntos de una síntesis química.
También se puede utilizar para convertir GBL en GHB.
Agente de limpieza
El hidróxido de sodio se utiliza con frecuencia como un limpiador en cervecerías, en donde simplemente se llama "cáustico". Se agrega al agua, se calienta, y luego se usa para limpiar los grandes depósitos de acero inoxidable donde se elabora la cerveza, fermentados y almacena. Puede disolver aceites y depósitos a base de proteínas.
Seguridad
Hidróxido de sodio sólido o soluciones que contienen altas concentraciones de hidróxido de sodio puede causar quemaduras químicas, lesiones permanentes o cicatrices, y la ceguera .
La disolución de hidróxido de sodio es altamente exotérmica, y el calor resultante puede causar quemaduras de calor o encender cualquier material inflamable.
La combinación de aluminio e hidróxido de sodio da como resultado una gran producción de gas de hidrógeno:
2 Al ( s ) + 6NaOH (ac) → 3 H 2 ( g ) + 2Na 3 AlO 3 (ac).
La mezcla de estos dos en un recipiente cerrado es por lo tanto peligroso.

