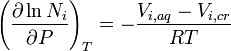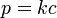Solubilidad
Sabías ...
Esta selección wikipedia ha sido elegido por los voluntarios que ayudan Infantil SOS de Wikipedia para esta Selección Wikipedia para las escuelas. Antes de decidir sobre el patrocinio de un niño, ¿por qué no aprender sobre diferentes obras de caridad de patrocinio primero ?
La solubilidad es una característica propiedad física se refiere a la capacidad de una sustancia determinada, el soluto , para disolver en un disolvente . Se mide en términos de la cantidad máxima de soluto disuelto en un disolvente en equilibrio . La solución resultante se llama saturado solución . Ciertos líquidos son solubles en todas las proporciones con un disolvente dado, tales como etanol en agua . Esta propiedad se conoce como miscibilidad. Además, el solubilidad en equilibrio se puede exceder en diversas condiciones para dar un denominado solución sobresaturada, que es metaestable.
En una solución, el disolvente es a menudo un líquido, que puede ser una sustancia pura o una mezcla. Las especies que se disuelve (el soluto) puede ser un gas, otro líquido, o un sólido. Las solubilidades varían ampliamente, desde infinitamente soluble, tal como etanol en agua , a poco soluble, tal como cloruro de plata en agua. El término insoluble se aplica a menudo a compuestos poco solubles, aunque estrictamente hablando son muy pocos los casos en los que no hay absolutamente ningún material disuelto.
Vista molecular
Solubilidad se produce en equilibrio dinámico. Esto significa que la solubilidad debe ser visto como un resultado de dos procesos simultáneos y opuestos: disolución y precipitación. El equilibrio de solubilidad se produce cuando los dos procesos proceden a la misma velocidad.
El equilibrio de solubilidad es relativamente sencillo para sustancias covalentes tal como etanol. Cuando el etanol se disuelve en agua, las moléculas de etanol se mantienen intactos, sino que forman nueva enlaces de hidrógeno con el agua. Sin embargo, cuando una compuesto iónico tales como cloruro de sodio (NaCl) se disuelve en agua, el cloruro de sodio enrejado se disocia en iones que son separados solvatada (envuelto) con una capa de moléculas de agua. Sin embargo, se dice NaCl para disolver en agua, porque la evaporación de los retornos de disolvente cristalino NaCl.
A veces el término "disolver" se aplica a un irreversible reacción química , como con hierro en ácido nítrico , pero en tal caso el concepto termodinámico de la solubilidad no se aplica.
Cuando se disuelve, un soluto puede formar varias especies en la solución. Por ejemplo, el agua por encima de los cristales de hidróxido ferroso, Fe (OH) 2, será, en el equilibrio, contienen Fe 2+, Fe (OH) +, Fe (OH) 2, Fe (OH) 3 - y, posiblemente, otros complejos. Por lo tanto, la solubilidad del hidróxido ferroso depende del pH. En general, la solubilidad en la fase de disolvente se puede dar sólo para un soluto específico que es termodinámicamente estable, y el valor de la solubilidad incluirá todas las especies en la solución (en el ejemplo anterior, todos los complejos que contienen hierro).
Factores que afectan la solubilidad
Solubilidad se define para específicas fases . Por ejemplo, la solubilidad de aragonito y calcita se espera en el agua a ser diferentes, a pesar de que ambos son la misma sustancia química ( carbonato de calcio ).
La solubilidad de una sustancia en otra disolución se determina por el equilibrio de fuerzas intermoleculares entre el disolvente y el soluto y la entropía cambio que acompaña a la solvatación. Factores tales como la temperatura y la presión alterar este equilibrio, cambiando así la solubilidad.
Solubilidad también puede depender en gran medida de la presencia de otras especies disueltas en el disolvente, por ejemplo, aniones formadores de complejos (- ligandos) en los líquidos. Solubilidad también dependerá del exceso (o deficiencia) de un ion común ( efecto de ion común) en la solución. En menor medida, la solubilidad dependerá de la fuerza iónica de soluciones líquidas. Los dos últimos efectos pueden cuantificarse usando la ecuación para equilibrio de solubilidad.
También hay un número de factores menos comunes que pueden afectar a la solubilidad. Solubilidad puede depender del tamaño del cristal (o gotitas) de la fase de soluto (por lo general, la solubilidad aumenta con el tamaño del cristal decreciente para cristales mucho más pequeños que 1 m). Para cristales altamente defectuosos, la solubilidad puede aumentar con el aumento del grado de desorden. Los dos últimos efectos, aunque de gran importancia práctica, no son efectos de solubilidad verdaderos porque la verdadera solubilidad se produce en equilbrium, que requiere un monocristal perfecto. Para las sustancias que disuelven en un reacción electroquímica, se espera que la solubilidad a depender del potencial de la fase de soluto.
Temperatura
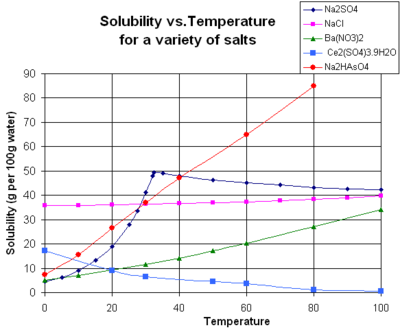
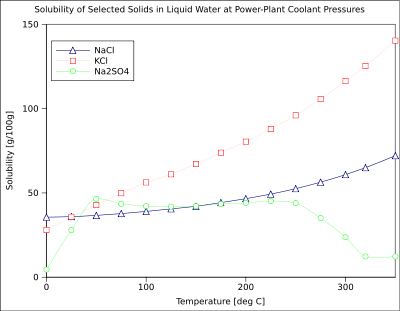
La solubilidad de un soluto dado en un disolvente dado depende típicamente de la temperatura. Por alrededor de 95% de sólidos solubles, la solubilidad aumenta con la temperatura, en el rango de temperatura desde aproximadamente la temperatura ambiente a 100 ° C. En el agua líquida a altas temperaturas, (por ejemplo, que se acerca el temperatura crítica), la solubilidad de los solutos iónicos tiende a disminuir debido al cambio de las propiedades y estructura del agua líquida (menor constante dieléctrica, menos de un disolvente polar ).
Gaseosos solutos presentan un comportamiento más complejo con la temperatura. A medida que la temperatura se eleva por lo general los gases a ser menos soluble en agua, pero más soluble en disolventes orgánicos.
El gráfico muestra las curvas de solubilidad para algunos inorgánicos típicos sales (todos los sólidos). Muchas sales se comportan como nitrato de bario y arseniato de hidrógeno disódico, y muestran un gran aumento de la solubilidad con la temperatura. Algunos solutos (por ejemplo NaCl en agua) solubilidad exhibición que es bastante independiente de la temperatura. Unos pocos, como de cerio (III) sulfato, se vuelven menos solubles en agua al aumentar la temperatura. Esto se refiere a veces como "retrograte" o solubilidad "inversa". Ocasionalmente, se observó un patrón más complejo, como con sulfato de sodio , donde el deca menos soluble cristal de hidrato pierde agua de cristalización a 32 ° C para formar una más soluble fase anhidro.
Los compuestos orgánicos casi siempre se vuelven solubles como la temperatura se eleva, en la mayoría de disolventes. La técnica de recristalización, utilizado para la purificación de sólidos, esto depende de las diferencias en la solubilidad en un disolvente caliente y fría. Hay algunas excepciones, como cierta ciclodextrinas.
Presión
Para las fases condensadas (sólidos y líquidos), la dependencia de la presión de solubilidad es generalmente débil y generalmente descuidado en la práctica. Suponiendo una solución ideal, la dependencia se puede cuantificar como:
donde N i es la fracción molar del componente i-ésimo en la solución, P es la presión, el índice T se refiere a temperatura constante, V i, aq es la volumen molar parcial del componente i-ésimo en la solución, V i, CR es el volumen molar parcial del componente i-ésimo en el sólido disolviendo, y R es el constante universal de los gases.
La ley de Henry establece que la solubilidad de un gas en un líquido es directamente proporcional a la presión parcial de este gas por encima del líquido, que puede ser escrita como:
donde k es una constante dependiente de la temperatura (por ejemplo, 769,2 L • atm / mol para dioxígeno (O 2) en agua a 298 K), p es la presión parcial (atm), y c es la concentración del gas disuelto en el líquido (mol / L).
Polaridad
Una populares aforismo utilizado para predecir la solubilidad es "semejante disuelve como" Esto indica que un soluto se disuelve mejor en un disolvente que tiene un parecido polaridad a sí mismo. Esta es una visión bastante simplista, ya que ignora muchas interacciones disolvente-soluto, pero es una regla empírica útil. Por ejemplo, un muy polar ( hidrófila) soluto tales como urea es altamente soluble en agua altamente polar, menos soluble en bastante polar metanol , y prácticamente insoluble en disolventes no polares tales como benceno . En contraste, un no-polar o soluto lipófilos tales como naftaleno es insoluble en agua, bastante soluble en metanol y muy soluble en benceno no polar.
Solubilidades líquidas también suelen seguir esta regla. Aceites vegetales lipofílicos, tales como aceite de oliva y aceite de palma, se disuelven en la gasolina no polar (gasolina), pero los líquidos polares como el agua no se mezclan con la gasolina.
Los químicos sintéticos a menudo utilizan las diferentes solubilidades de los compuestos para separar y purificar compuestos de mezclas de reacción.
Velocidad de disolución
Disolución no siempre es un proceso instantáneo. Es rápido cuando la sal y el azúcar se disuelven en agua, pero mucho más lento para un comprimido de aspirina o un gran cristal de hidratado (II) sulfato de cobre . La velocidad a la cual un sólido se disuelve puede depender de sus propiedades cristalinas (vs cristalinas amorfo, tamaño del cristal) y la presencia de polimorfismo. Esto es importante en muchos sistemas prácticos, por ejemplo en métodos de diseño para controlada administración de fármacos. Fundamentalmente, la velocidad de disolución depende de la presencia de la mezcla y otros factores que determinan el grado de undersaturation en la película disolvente líquido inmediatamente adyacente al cristal soluto sólido. En algunos casos, los equilibrios de solubilidad pueden tomar mucho tiempo para establecer (horas, días, meses o muchos años, dependiendo de la naturaleza del soluto y de otros factores). En la práctica, esto significa que la cantidad de soluto en una solución no siempre se determina por su solubilidad termodinámica, pero puede depender de la cinética de disolución (o precipitación).
La velocidad de disolución y la solubilidad no debe confundirse - son conceptos diferentes (cinéticos y termodinámicos, respectivamente).
La cuantificación de la solubilidad
La solubilidad se expresa comúnmente como una concentración, ya sea la concentración de masa (g de soluto por kilogramo de disolvente, g por 100 ml (dL) de disolvente), molaridad, molalidad, fracción molar u otras descripciones similares de concentración. La cantidad máxima de equilibrio del soluto que se puede disolver por cantidad de disolvente es la solubilidad del soluto que en ese disolvente bajo las condiciones especificadas. La ventaja de expresar la solubilidad de esta manera es su simplicidad, mientras que la desventaja es que puede depender en gran medida de la presencia de otras especies en el disolvente (por ejemplo, el efecto de ion común).
Constantes de solubilidad se utilizan para describir soluciones saturadas de compuestos iónicos de solubilidad relativamente baja (ver equilibrio de solubilidad). La constante de solubilidad es un caso especial de una constante de equilibrio. En él se describe el equilibrio entre los iones disueltos de la sal y la sal sin disolver. La constante de solubilidad es también "aplicable" (es decir, útil) la precipitación, a la inversa de la reacción de disolución. Como con otras constantes de equilibrio, la temperatura puede afectar el valor numérico de la constante de solubilidad. La constante de solubilidad es más complicada que la solubilidad. Sin embargo, el valor de esta constante es generalmente independiente de la presencia de otras especies en el disolvente.
La ley de Henry se utiliza para cuantificar la solubilidad de los gases en los líquidos como una función de la del gas presión parcial. Se trata de un caso especial de un equilibrio de solubilidad.
La Teoría solución de Flory-Huggins es un modelo teórico que describe la solubilidad de los polímeros. La Hansen Parámetros de solubilidad y la Parámetros de solubilidad de Hildebrand son métodos empíricos para la predicción de la solubilidad. También es posible predecir la solubilidad de otras constantes físicas tales como la entalpía de fusión.
La coeficiente de partición ( Log P) es una medida de la solubilidad diferencial de un compuesto en una disolvente hidrófobo ( octanol) y una disolvente hidrófilo ( agua ). El logaritmo de estos dos valores permite compuestos a su clasificación en términos de carácter hidrófilo (o hidrofobicidad).
Aplicaciones
La solubilidad es de fundamental importancia en un gran número de disciplinas científicas y aplicaciones prácticas, las más obvias son en ingeniería química, ciencia de los materiales, geología y ciencias ambientales.
La solubilidad se dice a menudo para ser una de las "propiedades características de una sustancia". Esto significa que la solubilidad se utiliza comúnmente para describir la sustancia, para arrojar luz sobre la naturaleza de la sustancia, para ayudar a distinguirlo de otras sustancias, y para guiar con una aplicación de la sustancia. Por ejemplo, índigo se describe como "insoluble en agua, alcohol o éter, pero soluble en cloroformo, nitrobenceno, o ácido sulfúrico concentrado".
Por ejemplo, la solubilidad de una sustancia es útil cuando la separación de mezclas. Por ejemplo, una mezcla de sal ( cloruro de sodio ) y sílice se puede separar por disolución de la sal en agua, y separando por filtración la sílice no disuelto. La síntesis de compuestos químicos, por el miligramo en un laboratorio, o por toneladas en la industria, tanto hacer uso de las solubilidades relativas de el producto deseado, así como los materiales de partida sin reaccionar, subproductos y productos secundarios para conseguir la separación.
Otro ejemplo de esto sería la síntesis de ácido benzoico a partir de bromuro de fenilmagnesio y hielo seco . El ácido benzoico es más soluble en un disolvente orgánico tal como diclorometano o éter dietílico, y cuando es sacudida con este disolvente orgánico en una embudo de separación, se disolverá preferentemente en la capa orgánica. Los otros productos de reacción, es decir, el bromuro de magnesio permanecerá en la capa acuosa, mostrando claramente que la separación se logra sobre la base de la solubilidad. (En una nota práctica, el ácido benzoico obtenido después de la evaporación del disolvente orgánico idealmente debe ser purificado por recristalización en agua caliente.)
La solubilidad de los compuestos iónicos en el agua
La solubilidad de una sal que se ioniza en agua se determina por la producto de solubilidad (sp K), que es una constante a una temperatura dada. El cloruro de plata es una sal relativamente insoluble en agua. Se ioniza:
- Ag + + Cl - ↔ AgCl (s)
El producto de solubilidad de AgCl, 1.8E-10 es también el constante de equilibrio de esta reacción que se calcula multiplicando las concentraciones de iones de plata y cloruro en una solución saturada, es decir, [Ag +] [Cl-]. Así, la concentración máxima de una solución pura de cloruro de plata es posible sqrt (1.8E-10) = 1,34 E-5 M. Sin embargo, si se añadieron allí iones cloruro, tal vez como una solución de cloruro de sodio, el equilibrio se desplazará según principio, y cloruro de plata de Le Chatelier precipitará de la solución.
| Soluble | Insoluble |
|---|---|
| Grupo I y NH 4 + compuestos | carbonatos (excepto el Grupo I , NH 4 + y compuestos de uranilo) |
| nitratos | sulfitos (excepto el Grupo I y NH 4 + compuestos) |
| acetatos (ethanoates) | fosfatos (excepto el Grupo I y NH 4 + compuestos) |
| cloruros, bromuros y yoduros (excepto Ag + , Pb 2+ , Cu + y Hg 2 2+ ) | hidróxidos y óxidos (excepto el Grupo I , NH 4 +, Ba2 + , Sr 2+ y Tl + ) |
| sulfatos (excepto Ag + , Pb 2+ , Ba 2+ , Sr 2+ y Ca 2+ ) | sulfuros (excepto el Grupo I , Grupo II y NH 4 + compuestos) |
Solubilidad de los compuestos orgánicos
El principio descrito anteriormente en la polaridad , que disuelve a lo semejante como, es la guía de costumbre a la solubilidad con los sistemas orgánicos. Por ejemplo, vaselina se disolverá en la gasolina; ambos de los cuales son lipofílicos. Esto es porque la jalea de petróleo consiste en largas cadenas de carbono, al igual que la gasolina. No será, por otro lado, se disuelve en alcohol o agua, ya que la polaridad de estos disolventes es demasiado alta. El azúcar no se disolverá en la gasolina, puesto que el azúcar es demasiado polar en comparación con la gasolina. Por lo tanto, una mezcla de gasolina y el azúcar puede ser separada por filtración, o extracción con agua.
Solubilidad Sólido
Este término se usa a menudo en el campo de la metalurgia para referirse a la medida en que una elemento de aleación se disolverá en el metal de base sin formar una fase separada. La línea de solubilidad (o curva) es la línea (o líneas) en una diagrama de fase que dan los límites de la adición de soluto. Es decir, las líneas muestran la cantidad máxima de un componente que se puede añadir a otro componente y todavía estar en solución sólida. En la fabricación microelectrónica, la solubilidad sólida se refiere a la concentración máxima de impurezas se puede colocar en el sustrato.
Disolución incongruente
Muchas sustancias se disuelven congruente, es decir, la composición del sólido y el partido estequiométricamente soluto disuelto. Sin embargo, algunas sustancias pueden disolver incongruente, lo que la composición del soluto en solución no coincide con la del sólido. Esto va acompañado por la alteración de la "primaria sólida" y, posiblemente, la formación de una fase sólida secundaria. Sin embargo, en general, un poco de sólido primaria también se mantiene y un complejo equilibrio de solubilidad establece. Por ejemplo, la disolución de albita puede resultar en la formación de gibsita.
- NaAlSi 3 O 8 (s) + H + + 7H 2 O = Na + + Al (OH) 3 (s) + 3H 4 SiO 4.
En este caso, se espera que la solubilidad de albita a depender de la relación de sólido a disolvente. Este tipo de solubilidad es de gran importancia en la geología, en el que resulta en la formación de rocas metamórficas .