
Isótopos estables
Antecedentes
Organizar una selección Wikipedia para las escuelas en el mundo en desarrollo sin acceso a Internet era una iniciativa de SOS Children. Visite el sitio web de Aldeas Infantiles SOS en http://www.soschildren.org/
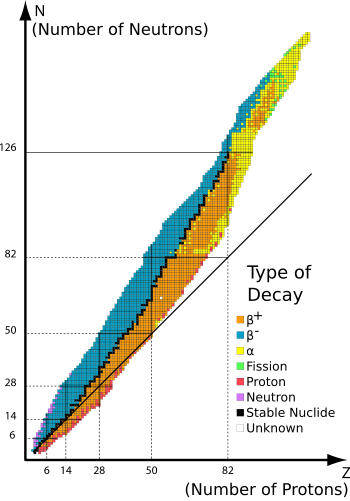
Los isótopos estables son químicos isótopos que no son radiactivos - es decir, que no se someten espontáneamente la desintegración radiactiva.
Sólo 90 nucleidos de los primeros 40 elementos son energéticamente estable a cualquier tipo de deterioro de ahorro la desintegración de protones, en teoría (véase lista de núclidos). Un adicional de 164 son teóricamente inestable para tipos conocidos de decadencia, pero nunca se ha observado ninguna evidencia de la decadencia, para un total de 254 nucleidos para los que no hay pruebas de radiactividad. Según esta definición, hay 254 nucleidos estables conocidas de los 80 elementos que tienen uno o más isótopos estables. Una lista de estos se da al final de este artículo.
De los 80 elementos con una o isótopos más estables, veintiséis sólo tienen un único isótopo estable, y por lo tanto se denominan monoisotópico, y el resto tienen más de un isótopo estable. Un elemento ( estaño ) tiene diez isótopos estables, el mayor número conocido para un elemento.
Estudio de isótopos estables
Sistemas de isótopos estables analizados más comunes incluyen los de oxígeno , carbono , nitrógeno , hidrógeno y azufre . Estos sistemas de isótopos de elementos más ligeros que exhiben más de una isótopo primordial para cada elemento, han estado bajo investigación durante muchos años con el fin de estudiar los procesos de fraccionamiento isotópico en los sistemas naturales. La larga historia del estudio de estos elementos es en parte debido a las proporciones de isótopos estables en estos elementos ligeros y volátiles es relativamente fácil de medir. Sin embargo, avances recientes en espectrometría de masas (es decir, de múltiples colector de espectrometría de masas con plasma acoplado inductivamente) permiten ahora a la medición de las relaciones de isótopos en los elementos más pesados estables, tales como hierro , cobre , zinc , molibdeno , etc.
Proporciones de isótopos estables se han utilizado en las investigaciones biológicas y botánicas de plantas durante muchos años, y los estudios cada vez más ecológicos y biológicos están encontrando isótopos estables (principalmente de carbono, nitrógeno y oxígeno) para ser extremadamente útil. Otros investigadores han utilizado las proporciones de isótopos de oxígeno para reconstruir las temperaturas atmosféricas históricas, lo que los instrumentos importantes para la investigación del clima. Las mediciones de las proporciones de uno de origen natural de isótopos estables a otro juegan un papel importante en datación radiométrica y geoquímica de isótopos, y también es útil para determinar los patrones de las precipitaciones y los movimientos de los elementos a través de los organismos vivos, para ayudar a resolver la dinámica de la red alimentaria en los ecosistemas.
Definición de la estabilidad, y la presencia natural isotópica
La mayoría se producen de forma natural nucleidos son estables (alrededor de 254; véase la lista al final de este artículo); y alrededor de 34 más (un total de 288) son conocidos radiactivos con suficientemente larga vida media (también conocida) que se produzca "primordialmente". Si la vida media de una nucleido es comparable a, o mayor que, la edad de la Tierra (4500 millones años), una cantidad significativa habrá sobrevivido desde la formación del Sistema Solar, y luego se dice que es primordial. A continuación, contribuir de ese modo a la composición isotópica natural de un elemento químico. Primordialmente presentes radioisótopos se detectan fácilmente con una vida media de tan sólo 700 millones años (por ejemplo, 235 U), aunque algunos isótopos primordiales se han detectado con vidas medias cortas como 80 millones de años (por ejemplo, 244 Pu). Sin embargo, este es el límite actual de detección, como el nucleido con la vida media más corta de próxima ( no se ha detectado todavía niobio-92 con una vida media 34700000 años) en la naturaleza.
Muchos radioisótopos de origen natural (otro 51 o así, para un total de alrededor de 339) presentan aún más cortas vidas medias de 80 millones de años, pero que están hechos recientemente, como productos hija de procesos de desintegración de nucleidos primordiales (por ejemplo, el radio de uranio) o a partir de reacciones energéticas en curso, como nucleidos cosmogénicos producidos por el actual bombardeo de la Tierra por los rayos cósmicos (por ejemplo, el carbono-14 hechas de nitrógeno).
Muchos isótopos que se clasifican como estable (es decir, sin la radiactividad se ha observado para ellos) se predice que tienen muy larga vida media (a veces tan altas como 10 18 años o más). Si la vida media predicha cae en un rango experimentalmente accesible, tales isótopos tienen la posibilidad de pasar de la lista de núclidos estables a la categoría radiactivo, una vez que se observa su actividad. Buenos ejemplos son el bismuto-209 y tungsteno-180 que anteriormente se clasifica como estable, pero que han sido recientemente (2003) encontró que alfa-activo. Sin embargo, los nucleidos no cambian su condición primordial cuando se encuentran para ser radiactivo.
Se cree que La mayoría de los isótopos estables en la tierra que se han formado en los procesos de nucleosíntesis, ya sea en el ' Big Bang ', o en generaciones de estrellas que precedieron a la formación del sistema solar. Sin embargo, algunos isótopos estables también muestran variaciones de abundancia en la tierra como resultado de la descomposición de los nucleidos radiactivos de larga vida. Estos decaimiento subproductos se denominan isótopos radiogénicos, para distinguirlos del grupo mucho mayor de isótopos "no radiogénicos.
Líneas de investigación
El llamado isla de estabilidad puede revelar un número de átomos de larga vida o incluso estables que son más pesados (y con más protones) que el plomo.
Isótopos por elemento
De los elementos químicos conocidos, 80 elementos tienen al menos un núclido estable. Estos comprenden los primeros 82 elementos de hidrógeno para conducir , con el dos excepciones, el tecnecio (elemento 43) y prometio (elemento 61), que no tiene ningún nucleidos estables. A diciembre de 2011, había un total de 254 nucleidos "estables" conocidos. En esta definición, "estable" significa un nucleido que nunca se ha observado que la decadencia en el contexto natural. Por lo tanto, estos elementos tienen una vida media muy larga para ser medida por cualquier medio, directa o indirecta.
Los isótopos estables:
- 1 elemento ( estaño ) tiene 10 isótopos estables
- 1 elemento ( xenón ) tiene 8 isótopos estables
- 4 elementos tienen 7 isótopos estables cada uno
- 8 elementos tienen 6 isótopos estables cada uno
- 10 elementos tienen 5 isótopos estables cada uno
- 9 elementos tienen 4 isótopos estables cada uno
- 5 elementos tienen 3 isótopos estables cada uno
- 16 elementos tienen 2 isótopos estables cada uno
- 26 elementos tienen 1 único isótopo estable.
Estos últimos 26 son por lo tanto llamados elementos monoisotopic. La media del número de isótopos estables para los elementos que tienen al menos un isótopo estable es 254/80 = 3,2.
"Números mágicos" y el recuento de par e impar de protones y neutrones
Estabilidad de los isótopos se ve afectada por la relación de protones a neutrones, y también por la presencia de ciertos "números mágicos" de neutrones o protones que representan cerradas y las cáscaras cuánticas llenos. Estas cáscaras cuánticos corresponden a un conjunto de niveles de energía dentro de la modelo de capas del núcleo; conchas rellenas, tales como la concha llena de 50 protones para el estaño, confiere estabilidad inusual en el nucleido. Como en el caso del estaño, un número mágico para Z, el número atómico, tiende a aumentar el número de isótopos estables para el elemento.
Así como en el caso de los electrones, que tienen el estado de energía más bajo cuando se producen en pares en un determinado orbitales, nucleones (protones y dos neutrones) presentan un estado de energía inferior cuando su número es par, en lugar de impar. Esta estabilidad tiende a impedir la desintegración beta (en dos pasos) de muchos nucleidos par-par en otro par-par nucleido de la misma masa pero de menor energía (y por supuesto con dos protones y dos más menos neutrones), porque procedimiento decaimiento uno paso a la vez tendría que pasar a través de un nucleido impar impar de mayor energía. Esto hace que para un mayor número de nucleidos estables par-par, hasta tres para algunos números de masa, y hasta siete para algunos (protones) números atómicos. Por el contrario, de los 254 nucleidos estables conocidas, sólo cinco tienen tanto un número impar de protones y número impar de neutrones: hidrógeno-2 ( deuterio), litio-6, de boro-10, nitrógeno-14, y tantalio-180m. Además, sólo cuatro de origen natural, radiactivos nucleidos odd-impares tienen una vida media más de un mil millones de años: potasio-40, vanadio-50, lantano-138, y lutecio-176. Impar impar nucleidos primordiales son raros porque los núcleos más extraño y pico son muy inestables con respecto a desintegración beta, ya que los productos de desintegración son par-par, y son por lo tanto más fuertemente unidos, debido a efectos de emparejamiento nucleares.
Sin embargo, otro efecto de la inestabilidad de un número impar de cualquier tipo de nucleones, es que los elementos impares tienden a tener menos isótopos estables. De los 26 elementos monoisotopic que sólo tienen un único isótopo estable, todos menos uno tienen un número atómico impar - la única excepción de las dos normas tienen como berilio. Todos estos elementos también tienen un número par de neutrones, siendo la única excepción de nuevo berilio.
Isómeros nucleares, incluyendo una "estable"
El recuento de 254 nucleidos estables conocidas incluye tantalio-180m, ya pesar de su decadencia y la inestabilidad se implica de forma automática por su notación de "metaestable", siendo esto aún no se ha observado. Todos los isótopos "estables" (estable por la observación, no de la teoría) son los estados fundamentales de los núcleos, con la excepción de tántalo-180m, que es una isómero nuclear o estado excitado (el estado fundamental de este núcleo es radiactivo con una vida media muy corta de 8 horas); pero la decadencia del isómero nuclear excitado es extremadamente fuerte prohibido por las reglas de selección spin-paridad. Se ha informado de experimentalmente mediante la observación directa de que la vida media de 180m Ta a la caries gamma debe ser más de 10 15 años. Nunca han sido observados también otros modos posibles de 180m Ta decaimiento (decaimiento beta, captura de electrones y de desintegración alfa).
Decaimiento Naturaleza no observado

Se espera que una cierta mejora continua de la sensibilidad experimental permitirá descubrimiento de la radiactividad muy suave (inestabilidad) de algunos isótopos que se consideran para ser estable en la actualidad. Para un ejemplo de un descubrimiento reciente, no fue hasta 2003 que bismuto-209 (sólo el isótopo natural de bismuto) ha demostrado ser muy ligeramente radiactivo. Sin embargo, también hubo predicciones teóricas de la física nuclear que el bismuto-209 decaería muy lentamente por emisión alfa. Estos cálculos fueron confirmados por las observaciones experimentales en 2003.
Muchos nucleidos "estables" son " en la medida en metaestable "tal como se les liberan energía si un decaimiento radiactivo fuera a ocurrir, y están, de hecho, espera para someterse a tipos muy raros de desintegración radiactiva, incluyendo emisión de doble beta.
Noventa nucleidos de los 40 elementos con números atómicos de una ( hidrógeno ) a través de 40 son teóricamente estable a cualquier tipo de decaimiento nuclear, a excepción de la posibilidad teórica de protones decadencia - que nunca se ha observado a pesar de las búsquedas exhaustivas para ello.
Los nucleidos a partir de con el isótopo de niobio-93 y se extienden a toda la mayor número de masa atómica, podría experimentar teóricamente fisión espontánea.
Para procesos distintos de la fisión espontánea, otras vías de desintegración teóricas de elementos más pesados incluyen:
- Alpha Decay - 70 pesada nucleidos (las dos más ligeros son cerio -142 y neodimio -143)
- decaimiento beta doble (incluyendo electrón-positrón conversión, y doble decaimiento de positrones) - 55 nucleidos
- la desintegración beta - tantalio -180m
- captura de electrones - telurio -123, tantalio-180m
- doble captura de electrones
- transición isomérica - tantalio-180m
- decaimiento cluster y fisión espontánea - los núclidos 56 pesados (de niobio -93 a disprosio -164)
Estos incluyen todos los nucleidos de masa 165 y mayores. Argón-36 es actualmente el nucleido más ligero conocido "estable", que es teóricamente inestable.
La positividad de la liberación de energía en estos procesos significa que se les permite cinemáticamente (que no violen la conservación de la energía) y, por lo tanto, en principio, puede ocurrir. Ellos no se observan debido a la supresión fuerte pero no absoluta, por las reglas de selección spin-paridad (para beta se desintegra y las transiciones isoméricas) o por el espesor de la barrera de potencial (por alfa y el grupo decae y la fisión espontánea).
Cuadro resumen de los números de cada clase de nucleidos
Se trata de un cuadro resumen de Lista de nucleidos. Tenga en cuenta que los números no son exactos y pueden variar ligeramente en el futuro, ya que se observan nucleidos a ser radiactivo, o nuevas vidas medias se determinan en cierta precisión. Tenga en cuenta que sólo el 254 tendrá ningún derecho a la estabilidad, pero que sólo 90 nucleidos de los primeros 40 elementos son teóricamente estable a cualquier proceso, pero la desintegración de protones.
| Tipo de nucleido por clase estabilidad. | Número de nucleidos en clase (número exacto puede cambiar). | Correr total de nucleidos en todas las clases a este punto. | Notas sobre el total acumulado. |
|---|---|---|---|
| Teóricamente estable para todos, pero la desintegración de protones. | 90 | 90 | Incluye 40 elementos primero. Aún no se observó la desintegración de protones. |
| Energéticamente inestable a uno o modos de desintegración más conocidos, pero hay decaimiento observadas hasta ahora. Se considera estable hasta que la radiactividad confirmó. | 164 | 254 | Fisión espontánea posible para nucleidos "estables"> niobio-93. Otros posibles mecanismos para los nucleidos más pesados. Total es la clásica nucleidos estables |
| Radioactivo nucleidos primordiales. | 34 | 288 | Primordiales totales incluyen Bi, U, Th, Pu, más todos los nucleidos estables. |
| Nonprimordial radiactivos, pero que ocurre naturalmente en la Tierra. | ~ 51 | ~ 339 | Nucleidos cosmogónicos de los rayos cósmicos; hijas de los primordiales radiactivos como el francio , etc. |
Lista de isótopos estables observacionalmente-
En la siguiente lista, 90 nucleidos no han predicho energéticamente posible modo de desintegración, salvar la desintegración de protones. Estos son sin marcar.
Otros predijeron (pero aún no observados) modos de desintegración radiactiva se indican como: A para la desintegración alfa, B para la desintegración beta, BB de doble desintegración beta, E para la captura de electrones, EE para doble captura de electrones, y de TI para la transición isomérica. Debido a la curva de energía de enlace, todos los nucleidos de Z = 41 (niobio) y más allá, son teóricamente inestable con respecto a la fisión espontánea SF (ver lista de núclidos para más detalles), y muchos de los núclidos más pesados son teóricamente inestable a otros procesos.
- El hidrógeno-1
- El hidrógeno-2
- El helio-3
- Helio-4
- Litio-6
- Litio-7
- Berilio-9
- El boro-10
- El boro-11
- El carbono-12
- El carbono-13
- Nitrógeno-14
- Nitrógeno-15
- Oxígeno-16
- Oxígeno-17
- Oxígeno-18
- Flúor-19
- Neon-20
- Neon-21
- Neon-22
- Sodio-23
- El magnesio-24
- El magnesio-25
- El magnesio-26
- Aluminio-27
- Silicio-28
- Silicio-29
- Silicio-30
- Fósforo-31
- Sulfur-32
- Sulfur-33
- Sulfur-34
- Sulfur-36
- Cloro-35
- Cloro-37
- Argón-36 (EE)
- Argón-38
- Argón-40
- El potasio-39
- El potasio-41
- Calcio-40 (EE)
- Calcio-42
- Calcio-43
- Calcio-44
- Calcio-46 (BB)
- Escandio-45
- Titanio-46
- Titanio-47
- Titanio-48
- Titanio-49
- Titanio-50
- El vanadio-51
- Cromo-50 (EE)
- Cromo-52
- El cromo-53
- Cromo-54
- Manganeso-55
- El hierro-54 (EE)
- Hierro-56
- Hierro-57
- Hierro-58
- Cobalto-59
- Níquel-58 (EE)
- Níquel-60
- Níquel-61
- Níquel-62
- Níquel-64
- Cobre-63
- Cobre-65
- Zinc-64 (EE)
- Zinc-66
- Zinc-67
- Zinc-68
- Zinc-70 (BB)
- Galio-69
- Galio-71
- Germanio-70
- Germanio-72
- Germanio-73
- Germanio-74
- Arsénico-75
- Selenio-74 (EE)
- Selenio-76
- Selenio-77
- Selenio-78
- Selenio-80 (BB)
- El bromo-79
- El bromo-81
- Krypton-78 (EE)
- Krypton-80
- Krypton-82
- Krypton-83
- Krypton-84
- Krypton-86 (BB)
- Rubidio-85
- El estroncio-84 (EE)
- El estroncio-86
- El estroncio-87
- El estroncio-88
- Itrio-89
- Circonio-90
- Circonio-91
- Circonio-92
- Circonio-94 (BB)
- Niobio-93 (SF)
- El molibdeno-92 (EE)
- El molibdeno-94 (SF)
- El molibdeno-95 (SF)
- El molibdeno-96 (SF)
- El molibdeno-97 (SF)
- El molibdeno-98 (BB)
- Tecnecio - No hay isótopos estables
- Rutenio-96 (EE)
- Rutenio-98 (SF)
- Rutenio-99 (SF)
- Rutenio-100 (SF)
- Rutenio-101 (SF)
- Rutenio-102 (SF)
- Rutenio-104 (BB)
- Rodio-103 (SF)
- El paladio-102 (EE)
- El paladio-104 (SF)
- El paladio-105 (SF)
- El paladio-106 (SF)
- El paladio-108 (SF)
- El paladio-110 (BB)
- Plata 107 (SF)
- Plata 109 (SF)
- El cadmio-106 (EE)
- El cadmio-108 (EE)
- El cadmio-110 (SF)
- El cadmio-111 (SF)
- El cadmio-112 (SF)
- El cadmio-114 (BB)
- Indio-113 (SF)
- Estaño-112 (EE)
- Estaño-114 (SF)
- Estaño-115 (SF)
- Estaño-116 (SF)
- Estaño-117 (SF)
- Estaño-118 (SF)
- Estaño-119 (SF)
- Estaño-120 (SF)
- Estaño-122 (BB)
- Estaño-124 (BB)
- El antimonio-121 (SF)
- El antimonio-123 (SF)
- Telurio-120 (EE)
- Telurio-122 (SF)
- Telurio-123 (E)
- Telurio-124 (SF)
- Telurio-125 (SF)
- Telurio-126 (SF)
- El yodo-127 (SF)
- Xenon-124 (EE)
- Xenon-126 (EE)
- Xenon-128 (SF)
- Xenon-129 (SF)
- Xenon-130 (SF)
- Xenon-131 (SF)
- Xenon-132 (SF)
- Xenon-134 (BB)
- El cesio-133 (SF)
- El bario-132 (EE)
- El bario-134 (SF)
- El bario-135 (SF)
- El bario-136 (SF)
- El bario-137 (SF)
- El bario-138 (SF)
- Lantano-139 (SF)
- Cerio-136 (EE)
- Cerio-138 (EE)
- Cerio-140 (SF)
- Cerio-142 (A, BB)
- El praseodimio-141 (SF)
- Neodimio-142 (SF)
- Neodimio-143 (A)
- Neodimio-145 (A)
- Neodimio-146 (A, BB)
- Neodimio-148 (A, BB)
- Prometio - No hay isótopos estables
- El samario-144 (EE)
- El samario-149 (A)
- El samario-150 (A)
- El samario-152 (A)
- El samario-154 (BB)
- Europio-153 (A)
- El gadolinio-154 (A)
- El gadolinio-155 (A)
- El gadolinio-156 (SF)
- El gadolinio-157 (SF)
- El gadolinio-158 (SF)
- El gadolinio-160 (BB)
- Terbio-159 (SF)
- Disprosio-156 (A, EE)
- Disprosio-158 (A, EE)
- Disprosio-160 (A)
- Disprosio-161 (A)
- Disprosio-162 (A)
- Disprosio-163 (SF)
- Disprosio-164 (SF)
- Holmium-165 (A)
- Erbio-162 (A, EE)
- Erbio-164 (A, EE)
- Erbium-166 (A)
- Erbium-167 (A)
- Erbium-168 (A)
- Erbio-170 (A, BB)
- Tulio-169 (A)
- Iterbio-168 (A, EE)
- Iterbio-170 (A)
- Iterbio-171 (A)
- Iterbio-172 (A)
- Iterbio-173 (A)
- Iterbio-174 (A)
- Iterbio-176 (A, BB)
- Lutecio-175 (A)
- El hafnio-176 (A)
- El hafnio-177 (A)
- El hafnio-178 (A)
- El hafnio-179 (A)
- El hafnio-180 (A)
- Tantalio-180m (A, B, E, IT) *
- Tantalio-181 (A)
- Tungsteno-182 (A)
- Tungsteno-183 (A)
- Tungsteno-184 (A)
- Tungsteno-186 (A, BB)
- El renio-185 (A)
- Osmio-184 (A, EE)
- Osmio-187 (A)
- Osmio-188 (A)
- Osmio-189 (A)
- Osmio-190 (A)
- Osmio-192 (A, BB)
- Iridium-191 (A)
- Iridium-193 (A)
- Platinum-192 (A)
- Platinum-194 (A)
- Platinum-195 (A)
- Platinum-196 (A)
- Platinum-198 (A, BB)
- Oro-197 (A)
- Mercurio-196 (A, EE)
- Mercurio-198 (A)
- Mercurio-199 (A)
- Mercurio-200 (A)
- Mercurio-201 (A)
- Mercurio-202 (A)
- Mercurio-204 (A, BB)
- El talio-203 (A)
- El talio-205 (A)
- Plomo-204 (A)
- Plomo-206 (A)
- Plomo-207 (A)
- Plomo-208 (A)
Abreviaturas:
Una de desintegración alfa, B para la desintegración beta, BB para el decaimiento beta doble, E para la captura de electrones, EE para la captura de electrones doble, TI para la transición isomérica.
* Tantalio-180m es un "isótopo metaestable" lo que significa que es un emocionado isómero nuclear de Ta-180. Ver isótopos de tantalio. Sin embargo, la vida media de este isómero nuclear es tan larga que nunca se ha observado a decaer, y por lo tanto se presenta como un "observacionalmente no radiactivo" nucleido primordial, como un isótopo menor de tantalio. Este es el único caso de un isómero nuclear que tiene una vida media tan larga que nunca se ha observado a decaer. Por lo tanto, se incluye en esta lista.


