
Tecnecio
Antecedentes
SOS Children hizo esta selección Wikipedia junto a otros recursos de escuelas . El apadrinamiento de niños ayuda a los niños uno por uno http://www.sponsor-a-child.org.uk/ .
| Tecnecio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
43 Tc | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
metal gris brillante  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades generales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | tecnecio, Tc, 43 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pronunciación | / t ɛ k n yo ʃ yo əm / tek- NEE -shee-əm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoría Elemento | metal de transición | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 7, 5, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atómico estándar | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Kr ] 4d 5 5s 2 2, 8, 18, 13, 2 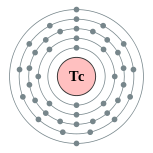 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Historia | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Predicción | Dmitri Mendeleev (1871) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Descubrimiento | Carlo Perrier y Emilio Segrè (1937) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Primer aislamiento | Carlo Perrier y Emilio Segrè (1937) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad (cerca rt) | 11 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusion | 2430 K , 2157 ° C, 3915 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullicion | 4538 K, 4265 ° C, 7709 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusión | 33.29 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| El calor de vaporización | 585.2 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidad calorífica molar | 24.27 J · mol -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión de vapor (extrapolado) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidación | 7, 6, 5, 4, 3, 2, 1, -1, -3 (Fuertemente ácida óxido) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 1,9 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energías de ionización | Primero: 702 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Segundo: 1470 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tercero: 2850 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico | 136 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 147 ± 19:00 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelánea | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | hexagonal compacta | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamiento magnético | Paramagnético | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 50,6 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido (varilla delgada) | (20 ° C) 16 200 m · s -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registro del CAS | 7440-26-8 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de tecnecio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El tecnecio es el elemento químico con número atómico 43 y símbolo Tc. Es el más bajo número atómico elemento sin isótopos estables ; toda forma de es radiactivo. Casi todos tecnecio se produce sintéticamente y sólo pequeñas cantidades se encuentran en la naturaleza. Tecnecio de origen natural se produce como espontánea productos de fisión en mineral de uranio o por captura de neutrones en molibdeno minerales. Las propiedades químicas de este gris plateado, cristalina metal de transición son intermedios entre el renio y el manganeso .
Muchas de las propiedades de tecnecio fueron predichas por Dmitri Mendeleev antes de descubrirse el elemento. Mendeleev observó una brecha en su tabla periódica y se entregó el elemento por descubrir el nombre provisional ekamanganese (Em). En 1937, el tecnecio (específicamente el tecnecio-97 isótopos) se convirtió en el primer elemento predominantemente artificial que se produce, de ahí su nombre (del griego τεχνητός, que significa "artificial").
Su corta vida gamma que emite rayos isomerización nuclear tecnecio-99m-se utiliza en medicina nuclear para una amplia variedad de pruebas de diagnóstico. Se utiliza tecnecio-99 como una fuente de rayos gamma libre de partículas beta. De larga vida isótopos de tecnecio producen comercialmente son subproductos de la fisión de de uranio-235 en reactores nucleares y se extraen de barras de combustible nuclear. Debido a que ningún isótopo del tecnecio tiene una vida media más larga de 4,2 millones de años ( tecnecio-98), su detección en 1952 en gigantes rojas , que son miles de millones de años de edad, ayudó a reforzar la teoría de que las estrellas pueden producir elementos más pesados.
Historia
Buscar elemento 43
Desde la década de 1860 hasta 1871, las formas tempranas de la tabla periódica propuesto por Dimitri Mendeleev contenían una brecha entre molibdeno (elemento 42) y de rutenio (elemento 44). En 1871, Mendeleev predijo este elemento faltante ocuparía el lugar vacío debajo de manganeso y por lo tanto tienen propiedades químicas similares. Mendeleev le dio el nombre provisional ekamanganese (de eka -, el sánscrito palabra para uno, porque el elemento predicho era un lugar abajo del elemento conocido de manganeso.)
Muchos investigadores tempranos, tanto antes como después de la publicación de la tabla periódica, estaban ansiosos por ser los primeros en descubrir y nombrar el elemento que falta; su ubicación en la tabla sugirió que debería ser más fácil de encontrar que otros elementos no descubiertos. Al principio se creía que se han encontrado en platino minerales en 1828 y se le dio el nombre polinium, pero resultó ser impuro iridio . Luego, en 1846, el elemento ilmenium se adujo que se ha descubierto, pero más tarde se determinó que era impuro niobio . Este error se repitió en 1847 con el "descubrimiento" de pelopium.
En 1877, el químico ruso Serge Kern informó descubrir el elemento que falta en el mineral de platino. Kern nombrado lo que él pensaba que era el nuevo elemento davyum (así por el químico Inglés señalado Sir Humphry Davy ), pero fue finalmente decidida a ser una mezcla de iridio , rodio y hierro . Otro candidato, lucium, seguido en 1896, pero se determinó que era de itrio . Luego, en 1908, el químico japonés Masataka Ogawa encontró evidencia en el mineral torianita, que dijo que había indicado la presencia de elemento 43. Ogawa nombrado el elemento nipponium , después de Japón (que es Nippon en japonés). En 2004, H. K Yoshihara utiliza "un registro de espectro de rayos X de la muestra nipponium de Ogawa desde torianita [que] estaba contenido en una placa fotográfica preservada por su familia. El espectro se leyó y se indica la ausencia del elemento 43 y el presencia del elemento 75 ( renio ) ".
Químicos alemanes Walter Noddack, Otto Berg, y Ida Tacke informó el descubrimiento del elemento 75 y el elemento 43 en 1925, y nombró elemento 43 masurio (después Masuria en el este Prusia, ahora en Polonia , la región donde se originó la familia de Walter Noddack). El grupo bombardeado columbita con un haz de electrones y deducida elemento 43 estaba presente mediante el examen Difracción de rayos X espectrogramas. La longitud de onda de los rayos X producidos está relacionado con el número atómico por una fórmula derivada por Henry Moseley en 1913. El equipo reclamó para detectar una señal de rayos X débiles de una longitud de onda producida por los elementos 43. experimentadores posteriores no pudo replicar el descubrimiento, y que fue despedido como un error durante muchos años. Aún así, en 1933, una serie de artículos sobre el descubrimiento de los elementos citó el nombre masurio para el elemento todavía existe 43. Debate sobre si el equipo de 1925 en realidad hizo descubrir elemento 43.
Descubrimiento oficial y la historia posterior
La descubrimiento del elemento 43 fue finalmente confirmada en un experimento de diciembre 1936 en el Universidad de Palermo en Sicilia realizado por Carlo Perrier y Emilio Segrè. A mediados de 1936, Segrè visitó los Estados Unidos, primero La Universidad de Columbia en Nueva York y luego el Laboratorio Nacional Lawrence Berkeley en California. Convenció inventor del ciclotrón Ernest Lawrence que le permitiera tomar de nuevo algunas partes descartadas del ciclotrón que se habían convertido radiactivo. Lawrence le envió una hoja de molibdeno que había sido parte del deflector en el ciclotrón.
Segrè alistó su colega Perrier intentar probar, a través de la química comparativa, que la actividad de molibdeno fue de hecho a partir de un elemento con Z = 43. Lograron aislar los isótopos tecnecio-95m y tecnecio-97. Universidad de funcionarios Palermo quería nombrar a su descubrimiento "panormium", después de la América nombre para Palermo, Panormus. En 1947 elemento 43 lleva el nombre del griego palabra τεχνητός, que significa "artificial", ya que fue el primer elemento a ser producido artificialmente. Segrè regresó a Berkeley y se reunió Glenn T. Seaborg. Ellos aislaron el isótopo metaestable tecnecio-99m, que ahora se utiliza en algunos diez millones de procedimientos de diagnóstico médico anualmente.
En 1952, el astrónomo Paul W. Merrill en California detectó el firma espectral del tecnecio (en particular, la luz con longitud de onda de 403,1 nm, 423,8 nm, 426,2 nm y 429,7 nm) a la luz de De tipo S gigantes rojas . Las estrellas estaban cerca del final de su vida, sin embargo, eran ricos en este elemento de corta duración, es decir, reacciones nucleares dentro de las estrellas deben ser producirlo. Se utilizó este evidencias para reforzar la teoría entonces no probada de que las estrellas están donde nucleosíntesis de los elementos más pesados se produce. Más recientemente, estas observaciones proporcionan evidencia de que los elementos estaban formados por captura de neutrones en el s-proceso.
Desde su descubrimiento, ha habido muchas búsquedas en materiales terrestres para las fuentes naturales de tecnecio. En 1962, el tecnecio-99 se aisló e identificó en pitchblende de la Congo Belga en cantidades extremadamente pequeñas (aproximadamente 0,2 ng / kg); allí se origina como una productos de fisión espontánea de de uranio-238. También hay evidencia de que el Oklo reactor de fisión nuclear natural producido cantidades significativas de tecnecio-99, que desde entonces ha decaído en rutenio-99.
Características
Propiedades físicas
Tecnecio radiactivo es un gris plateado de metal con una apariencia similar a la de platino . Se obtiene comúnmente como un polvo gris. La estructura cristalina del metal puro es hexagonal de empaquetamiento compacto. Tecnecio Atómica tiene característica líneas de emisión de estos longitudes de onda: 363,3 nm, 403,1 nm, 426,2 nm, 429,7 nm, y 485,3 nm.
La forma de metal es ligeramente paramagnético, es decir, su dipolos magnéticos se alinean con externo campos magnéticos, pero asumirán orientaciones aleatorias una vez que se elimina el campo. Pure, metálico, tecnecio-cristal único se convierte en una tipo II superconductor a temperaturas por debajo de 7,46 K . Por debajo de esta temperatura, el tecnecio tiene un muy alto profundidad de penetración magnética, el más grande entre los elementos aparte de niobio .
Propiedades químicas
El tecnecio se coloca en el séptimo grupo de la tabla periódica, entre renio y manganeso . Como se predijo por el ley periódica, sus propiedades químicas son, por tanto, intermedio entre esos dos elementos. De los dos, el tecnecio se asemeja más a renio, particularmente en su inercia química y su tendencia a formar enlaces covalentes. A diferencia de manganeso, tecnecio no forma fácilmente cationes ( iones con una carga neta positiva). Común estados de oxidación de tecnecio incluyen 4, 5, y 7. El tecnecio se disuelve en aqua regia, ácido nítrico , y concentrada de ácido sulfúrico , pero no es soluble en ácido clorhídrico de cualquier concentración.
Hidruro y óxidos
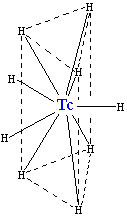
La reacción de tecnecio con hidrógeno produce la carga negativa hidruro TCH 2-
9 iónico, que tiene el mismo tipo de estructura cristalina como (es isoestructural con) ReH 2-
9. Se compone de un prisma trigonal con un átomo de tecnecio en el centro y seis átomos de hidrógeno en las esquinas. Tres más átomos de hidrógeno hacen un triángulo situado paralelamente a la base y cruzando el prisma en su centro. Aunque los átomos de hidrógeno no son equivalentes geométricamente, su estructura electrónica es casi la misma. Este complejo cuenta con un número de coordinación de 9 (lo que significa que el átomo de tecnecio tiene nueve vecinos), que es el más alto para un complejo de tecnecio. Dos átomos de hidrógeno en el complejo pueden ser sustituidos por de sodio (Na +) o iones de potasio (K +).
Tecnecio metálico lentamente empaña en el aire húmedo, y en forma de polvo, se quema en oxígeno . Dos Se han observado óxidos: TcO 2 y Tc 2 O 7. Bajo condiciones oxidantes, que tienden a despojar electrones de los átomos, tecnecio (VII) existirán como la pertecnetato de iones , TcO -
4.
A temperaturas de 400-450 ° C, el tecnecio se oxida para formar el color amarillo pálido heptóxido:
- 4 Tc + 7 O 2 → 2 Tc 2 O 7
Este compuesto adopta una estructura centrosimétrica con dos tipos de bonos Tc-O; sus longitudes de enlace son 167 y 184 de la tarde, y el ángulo O-Tc-O es de 180 °.
Heptóxido de tecnecio es el precursor de pertecnetato de sodio:
- Tc 2 O 7 + 2 NaOH → 2 NATCO 4 + H 2 O
Dióxido de tecnecio de color negro (TCO 2) puede ser producido por reducción de heptóxido con tecnecio o hidrógeno.
Ácido Pertechnetic (HTCO 4) se produce haciendo reaccionar Tc 2 O 7 con agua o ácidos oxidantes, tales como ácido nítrico , ácido sulfúrico concentrado, agua regia, o una mezcla de ácidos nítrico y clorhídrico. El color rojo oscuro resultante, higroscópico sustancia (absorción de agua) es un ácido fuerte y fácilmente dona protones. En concentrado ácido sulfúrico Tc (VII) anión tetraoxidotechnetate convierte en la forma octaédrica de technetic (VII) TcO ácido 3 (OH) (H 2 O) 2.
La pertecnato (tetroxidotechnetate) anión TcO -
4 consiste en un tetraedro con oxígenos en las esquinas y un átomo de tecnecio en el centro. Desemejante permanganato (MnO -
4), sólo es un agente oxidante débil. Pertecnato se utiliza a menudo como una conveniente fuente soluble en agua de isótopos de tecnecio, como 99m Tc, y como catalizador .
Sulfuros, seleniuros y telururos,
Formas de tecnecio diversos sulfuros. TcS 2 se obtiene por reacción directa de tecnecio y elemental de azufre , mientras que Tc 2 S 7 se forma a partir del ácido pertechnic como sigue:
- 2 HTCO 4 + 7 H 2 S → Tc 2 S 7 + 8 H2O
En esta reacción es tecnecio reducido a Tc (IV) mientras que las formas de azufre exceso de un ligando de disulfuro. El heptasulfuro de tecnecio producido tiene una estructura polimérica (Tc 3 (μ 3 -S) (S 2) 3 S 6) n con un núcleo similar a Mo 3 (μ 3 -S) (S 2) 6 2-.
Tras el calentamiento, heptasulfuro tecnecio se descompone en disulfuro y azufre elemental:
- Tc 2 S 7 → 2 TcS 2 + 3 S
Reacciones análogas se producen con selenio y teluro .
Carburo de tecnecio y la fase de metal tecnecio ortorrómbica
Cuando pequeñas cantidades de carbono están presentes en tecnecio metal, su ideales estructura cristalina hexagonal compacta se distorsiona a ortorrómbica estructura metálica tecnecio. Un mayor contenido de carbono (a partir de 15-17% a.) Proporcionan una conversión completa de tecnecio metálico para el carburo de tecnecio cúbica con composición aproximada de Tc6C. El aumento adicional en el contenido de carbono no proporciona ningún cambio en la estructura de carburo de tecnecio.
Clusters y complejos orgánicos
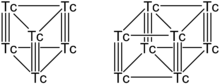
Varios grupos de tecnecio son conocidos, incluyendo Tc 4, Tc 6, 8 y Tc Tc 13. Las más estables Tc 6 y Tc 8 grupos tienen formas prismáticas donde pares verticales de átomos Tc están conectadas por enlaces triples y los átomos planas por enlaces simples. Cada átomo de tecnecio hace seis enlaces, y los electrones de valencia restantes puede ser saturada por uno axial y dos puente átomos de halógeno ligando tal como cloro o bromo .
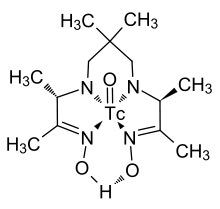
Formas de tecnecio numerosos complejos orgánicos, que están relativamente bien investigado debido a su importancia para la medicina nuclear. Carbonilo tecnecio (Tc 2 (CO) 10) es un sólido blanco. En esta molécula, dos átomos de tecnecio están débilmente unidos el uno al otro; cada átomo está rodeado por octaedros de cinco ligandos carbonilo. La longitud del enlace entre los átomos de tecnecio, 303 pm, es significativamente mayor que la distancia entre dos átomos en tecnecio metálico (272 pm). Similar carbonilos se forman por tecnecio de congéneres, manganeso y renio.
Un complejo de tecnecio con un ligando orgánico (que se muestra en la figura de la derecha) se utiliza comúnmente en la medicina nuclear. Tiene una única Tc-O grupo funcional (resto) orientado perpendicularmente al plano de la molécula, en el que el átomo de oxígeno puede ser sustituido por un átomo de nitrógeno.
Isótopos
El tecnecio, con número atómico (Z denotado) 43, es el elemento de número más bajo en la tabla periódica que es exclusivamente radiactivo. El segundo-más ligero, exclusivamente elemento radiactivo, prometio , tiene un número atómico de 61. Los núcleos atómicos con un número impar de protones son menos estables que aquellos con números pares, incluso cuando el número total de nucleones (protones + neutrones ) son pares. Por lo tanto, Odd elementos numerados tienen menos estables isótopos .
El más estable isótopos radiactivos son tecnecio-98 con una vida media de 4,2 millones de años ( Ma), el tecnecio-97 (vida media: 2,6 Ma) y tecnecio-99 (vida media: 211.000 años). Treinta otros radioisótopos se han caracterizado con números de masa que van desde 85 a 118. La mayoría de ellos tienen vidas medias que son menos de una hora; las excepciones son el tecnecio-93 (vida media: 2.73 horas), el tecnecio-94 (vida media: 4,88 horas), el tecnecio-95 (vida media: 20 horas), y el tecnecio-96 (vida media: 4,3 días ).
El primario modo de desintegración de los isótopos más ligeros que el tecnecio-98 (98 Tc) es captura de electrones, dando molibdeno (Z = 42). Para isótopos más pesados, el modo primario es emisión beta (la emisión de un electrón o de positrones), dando de rutenio (Z = 44), con la excepción de que el tecnecio-100 puede decaer tanto por la emisión beta y captura de electrones.
Tecnecio también tiene numerosas isómeros nucleares, que son isótopos con uno o más nucleones excitados. Tecnecio-97m (97m Tc; 'm' representa metaestabilidad) es la más estable, con una vida media de 91 días (0,0965 MeV). Esto es seguido por el tecnecio-95m (vida media: 61 días, 0.03 MeV), y el tecnecio-99m (vida media: 6,01 horas, 0,142 MeV). Tecnecio-99m sólo emite rayos gamma y decae a tecnecio-99.
Tecnecio-99 (99 Tc) es un importante producto de la fisión del uranio-235 (235 U), por lo que es el isótopo más común y más fácilmente disponible de tecnecio. Un gramo de tecnecio-99 produce 6,2 × 10 8 desintegraciones por segundo (es decir, 0,62 g Bq / g).
Ocurrencia y producción

Sólo los restos diminutos de forma natural en la Tierra corteza como un espontáneo productos de fisión en minerales de uranio. Un kilogramo de uranio contiene un estimado de 1 nanogramo (10 -9 g) de tecnecio. Algunos gigantes rojas estrellas con los tipos espectrales S, M, y N contienen una línea de absorción en su espectro indica la presencia de tecnecio. Estos gigantes rojas son conocidas informalmente como estrellas de tecnecio.
Producto de desecho de la fisión
En contraste con su rara ocurrencia natural, se producen grandes cantidades de tecnecio-99 cada año a partir de barras de combustible nuclear irradiado, que contienen varios productos de fisión. La fisión de un gramo de de uranio-235 en reactores nucleares rendimientos de 27 mg de tecnecio-99, dando un tecnecio fisión rendimiento del producto de 6,1%. Otro isótopos fisibles también producen rendimientos similares de tecnecio, como el 4,9% de uranio 233 y 6,21% a partir de plutonio-239. Acerca de 49.000 T Bq (78 toneladas métricas) de tecnecio se estima que se han producido en los reactores nucleares entre 1983 y 1994, lo que es, con mucho, la principal fuente de tecnecio terrestre. Sólo una fracción de la producción se utiliza comercialmente.
Tecnecio-99 se produce por la fisión nuclear tanto de uranio-235 y plutonio-239. Por lo tanto, está presente en residuos radiactivos y en el lluvia radiactiva de la bomba de fisión explosiones. Su decaimiento, medida en becquerel por cantidad de combustible gastado, es dominante después de aproximadamente 4 10-06 10 años después de la creación de los residuos nucleares. De 1945 a 1994, se estima que 160 T Bq (aproximadamente 250 kg) de tecnecio-99 se libera en el medio ambiente por atmosférica pruebas nucleares. La cantidad de tecnecio-99 de los reactores nucleares se libera en el medio ambiente hasta 1986 es del orden de 1000 TBq (aproximadamente 1.600 kg), principalmente por reprocesamiento de combustible nuclear; la mayor parte de este fue dado de alta en el mar. Métodos de preparación se han reducido las emisiones desde entonces, pero a partir de 2005 la liberación primaria de tecnecio-99 en el medio ambiente es por el Planta de Sellafield, que lanzó un estimado de 550 TBq (unos 900 kg) 1.995 a 1.999 en el Mar de Irlanda . A partir de 2000 la cantidad se ha visto limitado por la regulación a 90 TBq (unos 140 kg) por año. La descarga de tecnecio en el mar ha dado lugar a algunos pescados y mariscos que contienen cantidades minúsculas de este elemento. Por ejemplo, Bogavante y el pescado de oeste Cumbria contiene alrededor de 1 Bq / kg de tecnecio.
Productos de fisión para uso comercial
La isótopo metaestable de tecnecio-99m se produce continuamente como una fisión producto de la fisión del uranio o plutonio en reactores nucleares. Dado que el combustible utilizado se dejó en reposo durante varios años antes de la preparación, todo el molibdeno-99 y tecnecio-99m se han decaído en el momento en que los productos de fisión se separan de los principales actínidos en convencional reprocesamiento nuclear. El líquido que queda después de la extracción de plutonio-uranio ( PUREX) contiene una alta concentración de tecnecio como TcO -
4 pero casi todo esto es tecnecio-99, no tecnecio-99m.
La gran mayoría de la tecnecio-99m utilizado en el trabajo médico se produce irradiando dedicado altamente enriquecido blancos de uranio en un reactor, la extracción de molibdeno 99 a partir de los objetivos en las instalaciones de reprocesamiento, y recuperar en el centro de diagnóstico del tecnecio-99m que se produce en la descomposición de molibdeno-99. Molibdeno-99 en forma de molibdato MoO _ 2-
4 es adsorbido en alúmina ácido (Al 2 O 3) en una blindado cromatógrafo de columna dentro de una generador de tecnecio-99m ("vaca tecnecio", también de vez en cuando llama una "vaca de molibdeno"). Molibdeno-99 tiene una vida media de 67 horas, de modo de breve duración tecnecio-99m (vida media: 6 horas), que resulta de su decadencia, se está produciendo constantemente. La soluble pertecnato TcO -
4 a continuación, se puede extraer químicamente por elución utilizando una solución salina.
Por la irradiación de un objetivo de uranio altamente enriquecido para producir molibdeno-99, no hay necesidad de los pasos químicos complejos que serían necesarios para separar el molibdeno partir de una mezcla de productos de fisión. Un inconveniente de este procedimiento es que requiere objetivos que contengan uranio-235, que están sujetos a las medidas de seguridad de los materiales fisibles.
Casi dos tercios de la producción mundial proviene de dos reactores; la Investigación Nacional universal Reactor en Chalk River Laboratories en Ontario, Canadá, y la Reactor de alto flujo en Investigación Nuclear y Consultancy Group en Petten, Países Bajos. Todos los principales reactores de tecnecio-99m productoras se construyeron en los años 1960 y están cerca del final de su vida útil. Los dos nuevos canadiense Reactores MAPLE planificados y construidos para producir el 200% de la demanda de tecnecio-99m relevados todos los demás productores de la construcción de sus propios reactores. Con la cancelación de los reactores ya probadas en 2008 el futuro suministro de tecnecio-99m se volvió muy problemático.
Sin embargo, el reactor de Chalk River ha sido cerrado por mantenimiento desde agosto de 2009, con una reapertura prevista en abril de 2010, y el reactor de Petten tenido una parada de mantenimiento programado 6 meses que comienza el viernes 19 de febrero de 2010. Con millones de procedimientos que dependen de tecnecio-99m cada año, la baja oferta ha dejado un vacío, dejando a algunos médicos para volver a las técnicas que no se utilizan durante 20 años. Algo disipar esta cuestión está un anuncio de la polaca Reactor de investigación Maria que han desarrollado una técnica para aislar tecnecio. El reactor de Chalk River Laboratory reabrió en agosto de 2010 y el reactor de Petten reabrió septiembre de 2010.
Deposito de basura
La larga vida media de tecnecio-99 y su capacidad para formar un aniónicos especies hace que sea una de las principales preocupaciones para su eliminación a largo plazo de los residuos radiactivos. Muchos de los procesos diseñados para eliminar los productos de fisión en plantas de reprocesamiento tienen por objeto catiónicos especies como de cesio (por ejemplo, cesio-137) y estroncio (por ejemplo, estroncio-90). Por lo tanto el pertecnetato es capaz de escapar a través de estos procesos de tratamiento. Opciones de eliminación actuales favorecen entierro en roca continental, geológicamente estable. El principal peligro con un curso de este tipo es que los residuos es probable que entren en contacto con el agua, lo que podría filtrarse contaminación radiactiva en el medio ambiente. El pertecnetato aniónico y yoduro no adsorben bien sobre las superficies de los minerales, por lo que son propensos a ser lavados. En comparación plutonio , uranio , y cesio son mucho más capaces de unirse a las partículas del suelo. Tecnecio también podría ser inmovilizado por algunos entornos, tales como los sedimentos del fondo del lago, debido a la actividad microbiana; Por esta razón, la química ambiental de tecnecio es un área activa de investigación.
Un método alternativo disposición, transmutación, se ha demostrado en CERN para el tecnecio-99. Este proceso de transmutación es uno en el que el tecnecio (tecnecio-99 como un blanco de metal) es bombardeado con neutrones para formar la efímera tecnecio-100 (vida media = 16 segundos), que se desintegra por la desintegración beta de rutenio -100. Si la recuperación de rutenio utilizable es una meta, es necesario un objetivo tecnecio extremadamente pura; si los pequeños rastros de la actínidos menores, tales como el americio y el curio están presentes en la diana, que son propensos a experimentar la fisión y formar más productos de fisión que aumentan la radiactividad de la diana irradiado. La formación de rutenio-106 (vida media 374 días) a partir de la "fisión fresco 'es probable que aumente la actividad del metal de rutenio final, que luego requieren un tiempo de enfriamiento más largo después de la irradiación antes de que el rutenio se puede utilizar.
La separación real de tecnecio-99 a partir de combustible nuclear gastado es un proceso largo. Durante reprocesamiento de combustible, como aparece en el líquido de desecho, que es altamente radiactivo. Después de estar sentado durante varios años, la radioactividad cae a un punto donde la extracción de los isótopos de larga vida, incluyendo el tecnecio-99, se vuelve factible. Se utilizan a continuación, varios procesos de extracción químicos, produciendo tecnecio-99 de metal de alta pureza.
Activación de neutrones
Molibdeno-99 se puede formar por el neutrones activación de molibdeno-98. Otros isótopos de tecnecio no se producen en cantidades significativas por fisión; cuando sea necesario, se fabrican por irradiación de neutrones de isótopos padres (por ejemplo, tecnecio-97 puede ser hecha por irradiación de neutrones de rutenio-96).
Los aceleradores de partículas
La viabilidad de la producción de tecnecio-99m con el bombardeo de 22 MeV-protón de un blanco de molibdeno-100 en ciclotrones médicos después de la reacción 99m 100 Mo (p, 2n) Tc se demostró en 1971. Los últimos escasez de médicos tecnecio-99m reavivaron el interés en su producción mediante bombardeo de protones de isotópicamente enriquecido en (> 99,5%) de molibdeno-100 objetivos. Técnicas de producción de isótopos basadas en aceleradores de partículas Otros han sido investigados para obtener molibdeno-99 de molibdeno-100 a través de (n, 2n) o (γ, n) reacciones.
Aplicaciones
La medicina y la biología Nuclear
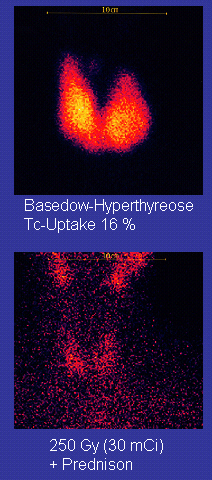
Tecnecio-99m ("m" indica que se trata de un isómero nuclear metaestable) se utiliza en isótopo radiactivo pruebas médicas, por ejemplo como una trazador radiactivo que el equipo médico puede detectar en el cuerpo humano. Es muy adecuado para el papel porque emite fácilmente detectable 140 keV rayos gamma, y su vida media es de 6.01 horas (lo que significa que alrededor del 94% de los que se descompone a tecnecio-99 en 24 horas). Hay por lo menos 31 de uso común radiofármacos basados en tecnecio-99m para formación de imágenes y estudios funcionales de la cerebro, miocardio, tiroides, pulmones, hígado, vesícula biliar, riñones , esqueleto, sangre , y tumores.
El isótopo tecnecio-95m-vida más larga, con una vida media de 61 días, se utiliza como una trazador radiactivo para estudiar el movimiento de tecnecio en el medio ambiente y en los sistemas de plantas y animales.
Industrial y química
Tecnecio-99 se desintegra casi en su totalidad por la desintegración beta, emitiendo partículas beta con energías bajas consistentes y no hay rayos gamma que se acompañan. Además, su larga vida media significa que esta emisión disminuye muy lentamente con el tiempo. También se puede extraer a una alta pureza química e isotópica de los residuos radiactivos. Por estas razones, es una Por lo tanto, el Instituto Nacional de Estándares y Tecnología (NIST) emisor beta estándar, y se utiliza para la calibración de equipos. Tecnecio-99 también ha sido propuesto para su uso en dispositivos optoelectrónicos y nanoescala baterías nucleares.
Como renio y paladio , el tecnecio puede servir como un catalizador . Para algunas reacciones, por ejemplo la deshidrogenación de alcohol isopropílico, que es un catalizador mucho más eficaz que cualquiera de renio o paladio. Sin embargo, su radiactividad es un problema importante en la búsqueda de aplicaciones catalíticas seguras.
Cuando el acero se sumerge en agua, añadiendo una pequeña concentración (55 ppm) de pertecnetato de potasio (VII) al agua protege el acero contra la corrosión, incluso si la temperatura se eleva a 250 ° C. Por esta razón, pertecnetato se ha utilizado como un posible anódica a la corrosión inhibidor para el acero, aunque la radiactividad del tecnecio plantea problemas que limitan esta aplicación para sistemas autónomos. Mientras que (por ejemplo) CrO 2-
4 también puede inhibir la corrosión, se requiere una concentración diez veces más alta. En un experimento, una muestra de acero al carbono se mantuvo en una solución acuosa de pertecnetato durante 20 años y seguía sin corrosión. El mecanismo por el cual pertecnetato previene la corrosión no se entiende bien, pero parece implicar la formación reversible de una capa superficial delgada. Una teoría sostiene que el pertecnetato reacciona con la superficie del acero para formar una capa de tecnecio dióxido de lo que impide aún más la corrosión; el mismo efecto se explica cómo polvo de hierro se puede utilizar para eliminar pertecnetato de agua. ( El carbón activado también se puede utilizar para el mismo efecto.) El efecto desaparece rápidamente si la concentración de pertecnetato cae por debajo de la concentración mínima o si se añade una concentración demasiado alta de otros iones.
Como se ha señalado, la naturaleza radiactiva de tecnecio (3 M Bq por litro en las concentraciones necesarias) hace que esta protección contra la corrosión impracticable en casi todas las situaciones. Sin embargo, se propuso protección contra la corrosión por los iones de pertecnetato (pero nunca adoptado) para su uso en reactores de agua hirviendo.
Precauciones
El tecnecio no juega ningún papel biológico natural y no se encuentra normalmente en el cuerpo humano. El tecnecio se produce en cantidad por la fisión nuclear, y se propaga más fácilmente que muchos radionucleidos. Parece que tiene baja toxicidad química. Por ejemplo, ningún cambio significativo en la fórmula de la sangre, el cuerpo y peso de los órganos, y el consumo de alimentos se pudo detectar para las ratas que ingirieron hasta 15 g de tecnecio-99 por gramo de alimento durante varias semanas. La toxicidad radiológica de tecnecio (por unidad de masa) es una función del compuesto, el tipo de radiación para el isótopo en cuestión, y la vida media del isótopo.
Todos los isótopos del tecnecio deben manejarse con cuidado. El isótopo más común, el tecnecio-99, es un emisor beta débil; tal radiación es detenido por las paredes de vidrio de laboratorio. El riesgo principal cuando se trabaja con tecnecio es la inhalación de polvo; tal contaminación radiactiva en los pulmones puede suponer un riesgo significativo de cáncer. Durante la mayor parte del trabajo, manejo cuidadoso en un campana de humos es suficiente; un No es necesaria la guantera.

