
Talio
Sabías ...
SOS Children han producido una selección de artículos de la Wikipedia para escuelas desde 2005. Haga clic aquí para obtener más información sobre SOS Children.
| Talio | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
81 Tl | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Apariencia | ||||||||||||||||||||||||||||
blanco plateado  | ||||||||||||||||||||||||||||
| Propiedades generales | ||||||||||||||||||||||||||||
| Nombre, símbolo, número | talio, Tl, 81 | |||||||||||||||||||||||||||
| Pronunciación | / θ æ l yo ə m / THAL -ee-əm | |||||||||||||||||||||||||||
| Categoría Elemento | metálica posterior a la transición | |||||||||||||||||||||||||||
| Grupo, período, bloque | 13, 6, p | |||||||||||||||||||||||||||
| Peso atómico estándar | 204,38 (1) | |||||||||||||||||||||||||||
| Configuración electrónica | [ Xe ] 4f 14 5d 10 6s 2 6p 1 2, 8, 18, 32, 18, 3 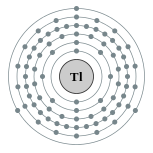 | |||||||||||||||||||||||||||
| Historia | ||||||||||||||||||||||||||||
| Descubrimiento | William Crookes (1861) | |||||||||||||||||||||||||||
| Primer aislamiento | Claude-Auguste Lamy (1862) | |||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||
| Fase | sólido | |||||||||||||||||||||||||||
| Densidad (cerca rt) | 11,85 g · cm -3 | |||||||||||||||||||||||||||
| Líquido densidad en mp | 11,22 g · cm -3 | |||||||||||||||||||||||||||
| Punto de fusion | 577 K , 304 ° C, 579 ° F | |||||||||||||||||||||||||||
| Punto de ebullicion | 1746 K, 1473 ° C, 2683 ° F | |||||||||||||||||||||||||||
| Calor de fusión | 4.14 kJ · mol -1 | |||||||||||||||||||||||||||
| El calor de vaporización | 165 kJ · mol -1 | |||||||||||||||||||||||||||
| Capacidad calorífica molar | 26.32 J · mol -1 · K -1 | |||||||||||||||||||||||||||
| Presión del vapor | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||
| Estados de oxidación | 3, 2, 1 (Levemente óxido básico) | |||||||||||||||||||||||||||
| Electronegatividad | 1,62 (escala de Pauling) | |||||||||||||||||||||||||||
| Energías de ionización | Primero: 589.4 kJ · mol -1 | |||||||||||||||||||||||||||
| Segundo: 1971 kJ · mol -1 | ||||||||||||||||||||||||||||
| Tercero: 2878 kJ · mol -1 | ||||||||||||||||||||||||||||
| Radio atómico | 170 pm | |||||||||||||||||||||||||||
| Radio covalente | 145 ± 19:00 | |||||||||||||||||||||||||||
| Van der Waals radio | 196 pm | |||||||||||||||||||||||||||
| Miscelánea | ||||||||||||||||||||||||||||
| Estructura cristalina | hexagonal compacta | |||||||||||||||||||||||||||
| Ordenamiento magnético | diamagnético | |||||||||||||||||||||||||||
| La resistividad eléctrica | (20 ° C) 0,18 μΩ · m | |||||||||||||||||||||||||||
| Conductividad térmica | 46.1 W · m -1 · K -1 | |||||||||||||||||||||||||||
| Expansión térmica | (25 ° C) 29,9 m · m -1 · K -1 | |||||||||||||||||||||||||||
| Velocidad del sonido (varilla delgada) | (20 ° C) 818 m · s -1 | |||||||||||||||||||||||||||
| El módulo de Young | 8 GPa | |||||||||||||||||||||||||||
| Módulo de corte | 2,8 GPa | |||||||||||||||||||||||||||
| Módulo de volumen | 43 GPa | |||||||||||||||||||||||||||
| Relación de Poisson | 0.45 | |||||||||||||||||||||||||||
| Dureza de Mohs | 1.2 | |||||||||||||||||||||||||||
| Dureza Brinell | 26,4 MPa | |||||||||||||||||||||||||||
| Número de registro del CAS | 7440-28-0 | |||||||||||||||||||||||||||
| La mayoría de los isótopos estables | ||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de talio | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
El talio es un elemento químico de símbolo Tl y número atómico 81. Es un gris suave de metal después de la transición no se encuentra libre en la naturaleza. Cuando se aisla, se asemeja a la lata , pero se decolora cuando se expone al aire. Los químicos William Crookes y Claude-Auguste Lamy descubrió talio forma independiente en 1861, en los residuos de ácido sulfúrico producción. Ambos utilizaron el método recientemente desarrollado de espectroscopia de llama, en el que el talio produce una línea espectral verde notable. Talio, de griego θαλλός, Thallos, que significa "un brote verde o ramita," fue nombrado por Crookes. Fue aislado por electrólisis un año después, por Lamy.
Talio tiende a oxidarse a las 3 y 1 estados de oxidación como sales iónicas. El estado 3 se asemeja a la de los otros elementos en el grupo de talio (boro, aluminio, galio, indio). Sin embargo, el estado 1, que es mucho más prominente en talio que los elementos por encima de ella, recuerda la química de los metales alcalinos y los iones de talio (I) se encuentran geológicamente principalmente en minerales a base de potasio, y (cuando se ingiere) se manejan en muchos aspectos, como los iones de potasio (K +) por medio de bombas de iones en las células vivas.
Comercialmente, sin embargo, talio no se produce a partir de minerales de potasio, sino como un subproducto de la refinación de minerales de sulfuro de metal pesado. Aproximadamente el 60-70% de la producción de talio se utiliza en el industria de la electrónica, y el resto se utiliza en la industria farmacéutica y en la fabricación de vidrio . También se utiliza en detectores de infrarrojos. Se utiliza el radioisótopo talio-201 (como el cloruro soluble TlCl) en pequeñas cantidades, no tóxicos como un agente en una escáner de medicina nuclear, durante un tipo de nuclear prueba de esfuerzo cardíaco.
Sales de talio solubles (muchos de los cuales son casi sin sabor) son altamente tóxico en la cantidad, y fueron utilizados históricamente en venenos para ratas y insecticidas. El uso de estos compuestos ha sido restringido o prohibido en muchos países, debido a su toxicidad no selectivo. Intoxicación por talio en particular resulta en la pérdida de cabello. Debido a su popularidad histórica como arma homicida, talio ha ganado notoriedad como "veneno del envenenador" y "polvo de la herencia" (junto con arsénico ).
Características
El talio es extremadamente suave, maleable y suficiente sectile a cortar con un cuchillo a temperatura ambiente. Tiene un brillo metálico que, cuando se expone al aire, empaña rápidamente a un tinte de color gris azulado, parecido a plomo. Puede ser preservada por inmersión en aceite. Una pesada capa de óxido se acumula en talio si se deja en el aire. En presencia de agua, talio hidróxido se forma. Sulfúrico y ácido nítrico disolver talio rápidamente para hacer la sulfato y sales de nitrato, mientras que el ácido clorhídrico forma un insoluble talio (I) capa de cloruro. Su potencial de electrodo estándar es de -0,34, ligeramente más alto que el potencial de hierro (a -0,44).
Isótopos
El talio tiene 25 isótopos que tienen masas atómicas que van desde 184 a 210. 203 Tl y 205 Tl son los únicos isótopos estables, y 204 Tl es la más estable radioisótopo, con una vida media de 3,78 años.
202 Tl (vida media 12,23 días) se puede hacer en una ciclotrón, mientras que 204 Tl es hecha por el activación de neutrones de talio estable en una reactor nuclear.
201 Tl (vida media de 73 horas), se desintegra por captura de electrones, que emite rayos X de Hg (~ 70 a 80 keV), y los fotones de 135 y 167 keV en un 10% la abundancia total; por lo que tiene buenas características de imagen sin dosis excesiva de radiación del paciente. Es el isótopo más popular utilizado para nuclear talio pruebas de esfuerzo cardiaco.
208 Tl (vida media 3,05 minutos) se genera en el origen natural cadena de desintegración del torio. Su prominente 2615 keV rayos gamma es la característica de alta energía dominante observado en naturales radiación de fondo.
Química
Los dos principales estados de oxidación de talio son 1 y 3. En el estado de oxidación 1 mayoría de los compuestos se parecen mucho a los correspondientes de potasio o plata compuestos (la radio iónico de talio (I) es 1,47 Å mientras que la de potasio es 1,33 Å y el de la plata es 1,26 Å), que fue la razón por talio se considera a veces ser un metal alcalino en Europa (pero no en Inglaterra ) en los años inmediatamente posteriores a su descubrimiento. Por ejemplo, el muy básico soluble en agua y talio (I) de hidróxido reacciona con el dióxido de carbono soluble en agua formador carbonato de talio. Este carbonato es el agua sólo soluble carbonato de metal pesado. La similitud con los compuestos de plata se observa con los compuestos haluro, óxido y sulfuro. Talio (I) es un compuesto bromuro de amarillo fotosensible muy similar a la bromuro de plata, mientras que el negro talio (I) y óxido de talio (I) sulfuro son muy similares a la óxido de plata y sulfuro de plata.
Los compuestos con estado de oxidación +3 se asemejan a la de aluminio (III) correspondientes compuestos. Son agentes oxidantes moderadamente fuertes, como lo ilustra el potencial de reducción de 0,72 voltios para Tl 3+ + 3 e - → Tl (s). El talio (III) de óxido es un sólido negro que se descompone por encima de 800 ° C, formando el talio (I) de óxido y oxígeno.
Historia
Talio ( griego θαλλός, Thallos, que significa "un brote verde o ramita") fue descubierto por espectroscopia de llama en 1861. El nombre proviene de la brillante talio espectral verde líneas de emisión.
Después de la publicación del método mejorado de la espectroscopia de llama por Robert Bunsen y Gustav Kirchhoff y el descubrimiento de cesio y rubidio en los años 1859-1860, la espectroscopia de llama se convirtió en un método aprobado para determinar la composición de minerales y productos químicos. William Crookes y Claude-Auguste Lamy tanto comenzó a utilizar el nuevo método. William Crookes utilizó para hacer determinaciones espectroscópicas de teluro en los compuestos de selenio depositados en el cámara de plomo de una planta de producción de ácido sulfúrico cerca Tilkerode en el Montañas de Harz. Había obtenido las muestras para su investigación sobre el cianuro de selenio Agosto Hofmann años anteriores. Por 1862, Crookes fue capaz de aislar pequeñas cantidades de el nuevo elemento y determinar las propiedades de unos pocos compuestos. Claude-Auguste Lamy utiliza un espectrómetro que era similar a Crookes 'para determinar la composición de una sustancia que contiene selenio que se depositó durante la producción de ácido sulfúrico a partir de pirita . También se dio cuenta de la nueva línea verde en los espectros y concluyó que un nuevo elemento estuvo presente. Lamy había recibido este material de la planta de ácido sulfúrico de su amigo Fréd Kuhlmann y este subproducto estaba disponible en grandes cantidades. Lamy comenzó a aislar el nuevo elemento de esa fuente. El hecho de que Lamy fue capaz de trabajar amplias cantidades de talio le permitió determinar las propiedades de varios compuestos y, además, se preparó un pequeño lingote de talio metálico que se preparó por refusión talio había obtenido por electrólisis de sales de talio.
Dado que tanto los científicos descubrieron talio independiente y una gran parte de la obra, sobre todo el aislamiento del talio metálico hecho por Lamy, Crookes trató de asegurar su prioridad en el trabajo. Lamy fue galardonado con una medalla en la Exposición Internacional de Londres de 1862: Por el descubrimiento de una nueva y abundante fuente de talio y después de la protesta pesada Crookes también recibió una medalla:. Talio, por el descubrimiento del nuevo elemento La controversia entre los científicos continuó a través de 1862 y 1863. La mayor parte de la discusión terminó después de Crookes fue elegido Fellow de la Royal Society en junio 1863.
El uso dominante de talio fue el uso como veneno para roedores. Después de varios accidentes, el uso como veneno fue prohibido en los Estados Unidos por la Orden Ejecutiva Presidencial 11643 en febrero de 1972. En los años posteriores varios otros países también prohibió el uso.
Ocurrencia y producción
Aunque talio es un elemento moderadamente abundante en la corteza terrestre, con una concentración estimada en alrededor de 0,7 mg / kg, sobre todo en asociación con potasio -basado minerales en arcillas , suelos y granitos , talio en general no es económicamente recuperable de estas fuentes. La principal fuente de talio para fines prácticos es la cantidad traza que se encuentra en cobre , plomo , zinc , y otros metal- pesada sulfuro minerales.

El talio se encuentra en los minerales crookesite TlCu 7 Aju 4, Hutchinsonita TlPbAs 5 9 S, y lorandite Tlass 2. Talio también se produce como elemento traza en pirita de hierro , y talio se extrae como un subproducto de asar este mineral para la producción de ácido sulfúrico .
Talio también puede obtenerse a partir de la fundición de plomo y zinc minerales. Los nódulos de manganeso que se encuentran en el fondo del océano también contiene algunos talio, pero la colección de estos nódulos ha sido y continúa siendo prohibitivamente caro. También existe la posibilidad de dañar el medio ambiente de los océanos. Además, varios otros minerales talio, que contienen 16% a 60% de talio, se producen en la naturaleza como complejos de sulfuros o selenuros que contienen principalmente de antimonio , arsénico , cobre, plomo, y / o plata . Sin embargo, estos minerales son poco frecuentes, y no han tenido importancia comercial como fuente de talio. La Allchar depósito en el sur de Macedonia era la única área donde talio fue alguna vez extraído activamente. Este depósito contiene todavía una estimados vagamente 500 toneladas de talio, y es una fuente de varios minerales de talio raros, por ejemplo, lorandite.
La Estados Unidos Geological Survey (USGS) estima que la producción anual mundial de talio es de aproximadamente 10 toneladas métricas como un subproducto de la fundición de cobre, zinc y minerales de plomo. El talio es bien extrae de los polvos de las chimeneas de la fundición o de residuos como escoria que se recogen al final del proceso de fundición. Las materias primas utilizadas para la producción de talio contienen grandes cantidades de otros materiales y por lo tanto una purificación es el primer paso. El talio se lixivia o bien por el uso de una base o ácido sulfúrico a partir del material. El talio es varias veces precipita de la solución y para eliminar impurezas adicionales. Al final se convierte en sulfato de talio y el talio se extrae por electrolisis en platino o placas de acero inoxidable. La producción de talio se redujo en un 33% en el período de 1995 a 2009 - de aproximadamente 15 métrico toneladas a alrededor de 10 toneladas. Puesto que hay varios depósitos pequeños o minerales con contenido relativamente alto de talio, sería posible aumentar la producción de la misma si una nueva aplicación, tal como un hipotéticos que contiene talio- superconductor de alta temperatura, se convierte en práctica para un uso extendido fuera del laboratorio.
Aplicaciones
Usos históricos
La inodoro y insípido sulfato de talio fue ampliamente utilizado como veneno para ratas y hormigas asesinas. Desde 1972 este uso ha sido prohibido en el Reino Unidos debido a preocupaciones de seguridad. Muchos otros países siguieron este ejemplo en los años siguientes. Sales de talio se utilizaron en el tratamiento de la tiña, otra infecciones de la piel y para reducir el sudoración nocturna de tuberculosis pacientes. Sin embargo, este uso se ha limitado debido a su estrecha índice terapéutico, y el desarrollo de medicamentos más avanzados para estas condiciones.
Óptica
El talio (I) y el bromuro de de talio (I) de yoduro de cristales se han utilizado como materiales ópticos infrarrojos, porque son más difíciles que otras óptica infrarroja comunes, y porque tienen la transmisión a longitudes de onda significativamente más largos. El nombre comercial KRS-5 se refiere a este material. Talio (I) de óxido se ha utilizado para la fabricación de vidrios que tienen un alto índice de refracción. Combinado con azufre o selenio y arsénico , talio se ha utilizado en la producción de alta densidad gafas que tienen bajos puntos de fusión en el rango de 125 y 150 ° C . Estas gafas tienen propiedades a temperatura ambiente que son similares a las gafas ordinarias y son duraderos, insoluble en agua y tienen única índices de refracción.
Electrónica

El talio (I) sulfuro de cambios de conductividad eléctrica con la exposición a Por lo tanto, la luz infrarroja haciendo de este compuesto útil en fotorresistores. Seleniuro de talio se ha utilizado en una bolómetro para la detección de infrarrojos. El dopaje de semiconductores de selenio con talio mejora su rendimiento, y por lo tanto se utiliza en cantidades traza en rectificadores de selenio. Otra aplicación de dopaje talio es el cristales de yoduro de sodio en dispositivos de detección de radiación gamma. En éstos, los cristales de yoduro de sodio se dopan con una pequeña cantidad de talio para mejorar su eficiencia como generadores de centelleo. Algunos de los electrodos en analizadores de oxígeno disuelto contienen talio.
Superconductividad de alta temperatura
La actividad de investigación con talio está en curso para desarrollar alta temperatura superconductores materiales para aplicaciones tales como imágenes por resonancia magnética, almacenamiento de energía magnética, propulsión magnética, y la generación de energía eléctrica y la transmisión. La investigación en aplicaciones comenzó después del descubrimiento de la primera talio calcio bario superconductor de óxido de cobre en 1988.
Médico
Antes de la aplicación generalizada de tecnecio-99m en la medicina nuclear, la isótopo radiactivo talio-201, con una vida media de 73 horas, era la principal sustancia para cardiografía nuclear. El nucleido todavía se utiliza para las pruebas de tensión para la estratificación del riesgo en pacientes con enfermedad de la arteria coronaria (CAD). Este isótopo de talio puede ser generado utilizando un generador transportable que es similar a la generador de tecnecio-99m. El generador contiene plomo-201 (vida media de 9,33 horas), que se desintegra captura de electrones para el talio-201. El plomo-201 se puede producir en una ciclotrón por el bombardeo de talio con protones o deuterones por la (p, 3n) y (d, 4N) reacciones.
Prueba de esfuerzo con talio
Una prueba de esfuerzo con talio es una forma de gammagrafía, donde la cantidad de talio en los tejidos se correlaciona con la irrigación sanguínea de los tejidos. Células cardíacas normales viables tienen Na bombas de intercambio iónico + / K +. El catión Tl + une el K + bombas y se transporta a las células. El ejercicio o induce dipiridamol (ensanchamiento vasodilatación) de las arterias coronarias normales. Esto produce robo coronario de las áreas donde las arterias se dilatan al máximo. Áreas de infarto o tejido isquémico seguirá siendo "frío". Talio pre y post-estrés puede indicar las áreas que se beneficiarán de infarto revascularización. Redistribución indica la existencia de robo coronario y la presencia de isquemia enfermedad de la arteria coronaria.
Otros usos
Una aleación de mercurio de talio, que forma una eutéctica en el 8,5% talio, se informó a congelar a -60 ° C, unos 20 ° C por debajo del punto de congelación del mercurio. Esta aleación se utiliza en termómetros e interruptores de baja temperatura. En la síntesis orgánica, talio (III) sales, como el trinitrato de talio o triacetato, son reactivos útiles que realizan diferentes transformaciones en compuestos aromáticos, cetonas, olefinas, entre otros. El talio es un constituyente de la aleación en el placas de ánodo en pilas de agua de mar de magnesio. Sales de talio solubles se añaden a baños de oro para aumentar la velocidad de las chapas y para reducir el tamaño de grano dentro de la capa de oro.
La solución saturada de partes iguales de talio (I) formiato de (Tl (CHO 2)) y talio (I) malonato de dietilo (Tl (C 3 H 3 O 4)) en agua se conoce como Solución Clerici. Es un líquido inodoro móvil cuya cambia de color a amarillo claro después de la reducción de la concentración de las sales de talio. Con la densidad de 4,25 g / cm 3 a 20 ° C la solución, Clerici es una de las soluciones acuosas más pesados conocidos. Fue utilizado en el siglo 20 para medir la densidad de minerales por el método de flotación, pero el uso se interrumpe debido a la alta toxicidad y corrosividad de la solución.
Yoduro de talio se utiliza como un aditivo para lámparas de halogenuros metálicos, a menudo junto con una o dos haluros de otros metales. Permite optimizar la temperatura de la lámpara y el color de representación, y desplazar la salida espectral de la región verde, que es útil para la iluminación bajo el agua.
Toxicidad
Talio y sus compuestos son extremadamente tóxicos y deben manejarse con mucho cuidado. Hay numerosos casos registrados de intoxicación mortal talio. Contacto con la piel es peligroso, y una ventilación adecuada debe ser proporcionada al derretirse este metal. De talio (I) compuestos tienen una solubilidad acuosa alta y son fácilmente absorbidos por la piel. La exposición a ellos no debe exceder de 0,1 mg por m 2 de la piel en un promedio ponderado de tiempo de 8 horas (la semana laboral de 40 horas). El talio es un presunto humana carcinógeno. Durante mucho tiempo, compuestos de talio eran fácilmente disponible como veneno para ratas. Este hecho y que es soluble en agua y casi sin sabor provocado intoxicaciones frecuentes causadas por accidente o intención criminal.
El tratamiento y descontaminación interna
Uno de los principales métodos de eliminación de talio (tanto radiactivo y normal) de los seres humanos es utilizar Azul de Prusia, un material que absorbe talio. Hasta 20 g por día de azul de Prusia se alimenta por la boca a la persona, y pasa a través de su sistema digestivo y sale en el heces. La hemodiálisis y la hemoperfusión también se utilizan para eliminar talio a partir del suero de la sangre. En más tarde etapa del tratamiento de potasio adicional se utiliza para movilizar talio del tejido.
Contaminación de talio
De acuerdo con la Agencia de Protección Ambiental de Estados Unidos (EPA), las fuentes artificiales de contaminación talio incluyen emisión gaseosa de fábricas de cemento, plantas de energía que queman carbón, y las alcantarillas de metal. La principal fuente de concentraciones elevadas de talio en el agua es la lixiviación de talio de las operaciones de procesamiento de mineral.


