
Metal de transición
Acerca de este escuelas selección Wikipedia
Los artículos de esta selección escuelas se han organizado por tema currículo gracias a voluntarios SOS. Haga clic aquí para obtener más información sobre SOS Children.
En química , el metal de transición plazo (a veces también llamado un elemento de transición) tiene dos significados posibles:
- Comúnmente se refiere a cualquier elemento de la d-bloque de la tabla periódica , incluyendo zinc , cadmio y mercurio . Esto corresponde a los grupos 3 a 12 en la tabla periódica .
- Más estrictamente, IUPAC define un metal de transición como "un elemento cuyo átomo tiene un d sub-shell incompleta, o que pueden dar lugar a cationes con un d sub-shell incompleta". Según esta definición, zinc , cadmio y mercurio están excluidos de los metales de transición, ya que tienen una configuración d 10. Subcapa se han formado sólo unas pocas especies transitorias de estos elementos que salen de iones con un d, parcialmente lleno, y el mercurio (I) sólo se produce como Hg 2 2+, que no forma estrictamente un ion solitario con una subcapa parcialmente lleno, y por lo tanto estos tres elementos son incompatibles con la última definición. Lo hacen de forma iones con un estado de oxidación 2+, pero éstos conservan la configuración de 4 d 10. El elemento 112 también puede ser excluido aunque es poco probable que se observa debido a sus propiedades de oxidación su naturaleza radiactiva. Esta definición corresponde a los grupos 3 a 11 de la tabla periódica.
La primera definición es simple y se ha utilizado tradicionalmente. Sin embargo, muchas de las propiedades interesantes de los elementos de transición como grupo son el resultado de sus subcapas d parcialmente llenos. Tendencias periódica en el bloque D (metales de transición) son menos prevalecientes que en el resto de la tabla periódica. Va a través de un período, la valencia no cambia, por lo que el electrón se añade a un átomo va a la carcasa interior, no cubierta exterior, el fortalecimiento del escudo.
Los (vagamente definidos) metales de transición son los elementos químicos 40 21 a 30, 39 a 48, 71 a 80, y 103 a 112. La transición nombre proviene de su posición en la tabla periódica de elementos. En cada uno de los cuatro períodos en los que ocurren, estos elementos representan la adición sucesiva de electrones a la d orbitales atómicos de los átomos. De esta manera, los metales de transición representan la transición entre los elementos del grupo 2 y grupo de 13 elementos.
| Grupo | 3 (III B) | 4 (IV B) | 5 (VB) | 6 (VI B) | 7 (VII B) | 8 (VIII B) | 9 (VIII B) | 10 (VIII B) | 11 (IB) | 12 (II B) |
|---|---|---|---|---|---|---|---|---|---|---|
| Periodo 4 | Sc 21 | Ti 22 | V 23 | Cr 24 | Mn 25 | Fe 26 | Co 27 | Ni 28 | Cu 29 | Zn 30 |
| Periodo 5 | Y 39 | Zr 40 | N ° 41 | Mo 42 | Tc 43 | Ru 44 | Rh 45 | Pd 46 | Ag 47 | Cd 48 |
| Período 6 | La 57 | Hf 72 | Ta 73 | W 74 | Re 75 | Os 76 | Ir 77 | Pt 78 | Au 79 | Hg 80 |
| Período 7 | Ac 89 | Rf 104 | Db 105 | Sg 106 | Bh 107 | Hs 108 | Mt 109 | Ds 110 | Rg 111 | Uub 112 |
Propiedades
Elementos de transición tienden a tener alta resistencia a la tracción, la densidad y de fusión y de ebullición puntos. Al igual que con muchas de las propiedades de los metales de transición, esto es debido a la capacidad electrones orbitales d 'a deslocalizar dentro de la retícula de metal. En sustancias metálicas, más electrones compartidos entre los núcleos, más fuerte es el metal.
Hay varias propiedades características comunes de elementos de transición:
- Con frecuencia forman colores compuestos.
- Ellos pueden tener una variedad de diferentes estados de oxidación .
- Al menos uno de sus compuestos tiene una subcapa d de electrones incompleta.
- A menudo son buenos catalizadores .
- Son plateado-azul a temperatura ambiente (excepto cobre y oro ).
- Ellos son sólidos a temperatura ambiente (excepto el mercurio ).
- Forman iones complejos (iones aqua incluidos).
- A menudo son paramagnético.
Estados de oxidación variables
A diferencia de grupo 1 y grupo 2 metales, iones de los elementos de transición pueden tener múltiples estados de oxidación estables, ya que pueden perder electrones d sin un alto pena energético. El manganeso, por ejemplo, tiene dos 4 s electrones y cinco electrones de 3 d, que se puede quitar. La pérdida de todos estos electrones conduce a un estado de oxidación +7. osmio y rutenio compuestos se encuentran comúnmente solo en 8 estados de oxidación estables, que se encuentra entre los más altos de compuestos aislables.
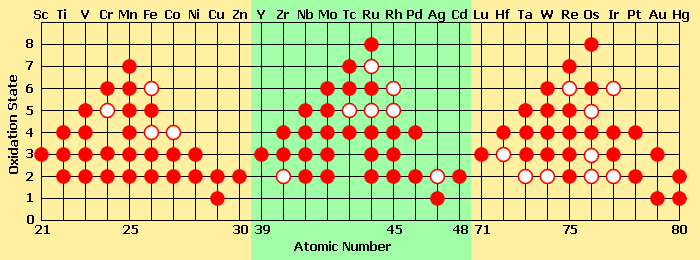
Un círculo sólido representa un estado de oxidación común, y un anillo representa un estado de oxidación inferior común (menos energéticamente favorable).
Ciertos patrones en estado de oxidación surgen en todo el período de los elementos de transición:
- El número de estados de oxidación de cada ion aumenta hasta Mn, después de lo cual disminuyen. Metales de transición posteriores tienen una atracción fuerte entre protones y electrones (ya que hay más de cada uno presente), que a su vez requeriría más energía para eliminar los electrones.
- Cuando los elementos están en estados de oxidación más bajos, se pueden encontrar como iones simples. Sin embargo, metales de transición en los estados de oxidación más altos son generalmente unidos covalentemente a elementos como el oxígeno electronegativo o flúor, formando iones poliatómicos como cromato, vanadato, o permanganato.
Otras propiedades con respecto a la estabilidad de los estados de oxidación:
- Los iones en estados de oxidación más altos tienden a tomar buenas agentes oxidantes, mientras que los elementos de los estados de oxidación bajos se convierten en agentes reductores.
- Los 2 + iones a través de la fase de puesta tan fuerte agentes reductores y ser más estable.
- Los 3+ iones comienzan estable y se vuelven más oxidante a través del período.
La actividad catalítica
Los metales de transición forman buena homogénea o catalizadores heterogéneos, por ejemplo hierro es el catalizador para la Proceso de Haber. El vanadio (V) de óxido se utiliza para la proceso de contacto, níquel se utiliza para hacer la margarina y el platino se utiliza para acelerar la fabricación de ácido nítrico . Esto es debido a que son capaces de formar numerosos estados de oxidación, y como tal, son capaces de formar nuevos compuestos durante una reacción de proporcionar una ruta alternativa con una energía de activación global menor.
Compuestos de colores
Observamos color que variando las frecuencias de la radiación electromagnética en la región visible del espectro electromagnético. Diferentes colores resultan de la nueva composición de la luz después de que haya sido reflejada, transmitida o absorbida después de golpear una sustancia. Debido a su estructura, los metales de transición forman muchos colores diferentes iones y complejos. Color incluso varía entre los diferentes iones de un único elemento de MnO - 4 - (Mn en estado de oxidación 7+) es un compuesto de color púrpura, mientras que Mn 2+ es de color rosa pálido.
Coordinación por ligandos pueden desempeñar un papel en la determinación del color en un compuesto de transición, debido a cambios en la energía de los orbitales d. Los ligandos suprimir la degeneración de los orbitales y los separaron en grupos de energía más altos y más bajos. La diferencia de energía entre los orbitales de energía más bajos y más altos determinará el color de la luz que se absorbe, como radiación electromagnética se absorbe sólo si tiene energía correspondiente a ese vacío. Cuando un ión ligado absorbe la luz, algunos de los electrones son promovidos a una energía superior orbital. Desde luz diferente frecuencia se absorbe, se observan diferentes colores.
El color de un complejo depende de:
- la naturaleza del ion metálico, específicamente el número de electrones en los orbitales d
- la disposición de los ligandos alrededor del ion metálico (por ejemplo, isómeros geométricos pueden mostrar diferentes colores)
- la naturaleza de los ligandos que rodean el ion metálico. Cuanto más fuerte los ligandos entonces mayor es la diferencia de energía entre la división de alta y baja 3 grupos d.
El ion complejo formado por el bloque d elemento zinc (aunque no es estrictamente un elemento de transición) es incoloro, porque los orbitales 3d están llenos - no hay electrones son capaces de ascender al grupo superior.



