
Ununoctium
Antecedentes
SOS Children, que corre cerca de 200 sos escuelas en el mundo en desarrollo, organizó esta selección. Haga clic aquí para obtener información sobre el apadrinamiento de niños.
| Ununoctium | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
118 Uuo | ||||||||||||||||
| ||||||||||||||||
| Apariencia | ||||||||||||||||
| desconocido | ||||||||||||||||
| Propiedades generales | ||||||||||||||||
| Nombre, símbolo, número | ununoctium, Uuo, 118 | |||||||||||||||
| Pronunciación | / U n . U n ɒ k t yo ə m / oon-oon- Aceptar -Tee-əm | |||||||||||||||
| Categoría metálico | desconocido | |||||||||||||||
| Grupo, período, bloque | 18 (gases nobles) , 7, p | |||||||||||||||
| Peso atómico estándar | [294] | |||||||||||||||
| Configuración electrónica | [ Rn ] 5f 14 6d 10 7s 2 7p 6 (Valor de referencia) 2, 8, 18, 32, 32, 18, 8 (valor de referencia) 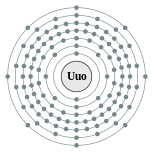 | |||||||||||||||
| Historia | ||||||||||||||||
| Descubrimiento | Instituto Conjunto de Investigación Nuclear y Laboratorio Nacional Lawrence Livermore (2002) | |||||||||||||||
| Propiedades físicas | ||||||||||||||||
| Fase | sólido (prevista) | |||||||||||||||
| Densidad (cerca rt) | (Prevista) 13,65 g · cm -3 | |||||||||||||||
| Punto de ebullicion | (Extrapolado) 350 ± 30 K, 80 ± 30 ° C, 170 ± 50 ° F | |||||||||||||||
| Punto crítico | (Extrapolado) 439 K, 6,8 MPa | |||||||||||||||
| Calor de fusión | (Extrapolado) 23.5 kJ · mol -1 | |||||||||||||||
| El calor de vaporización | (Extrapolado) 19,4 kJ · mol -1 | |||||||||||||||
| Propiedades atómicas | ||||||||||||||||
| Estados de oxidación | (Prevista) -1, 0, 1, 2, 4, 6 | |||||||||||||||
| Energías de ionización | Primero: (extrapolado) 839,4 kJ · mol -1 | |||||||||||||||
| 2: (extrapolado) 1450 kJ · mol -1 | ||||||||||||||||
| Radio atómico | (Valor de referencia) 152 pm | |||||||||||||||
| Radio covalente | (Prevista) 157 pm | |||||||||||||||
| Miscelánea | ||||||||||||||||
| Número de registro del CAS | 54144-19-3 | |||||||||||||||
| La mayoría de los isótopos estables | ||||||||||||||||
| Artículo principal: Los isótopos de ununoctium | ||||||||||||||||
| ||||||||||||||||
Ununoctium es el temporal IUPAC nombrar para el Transactínido tener el número atómico 118 y temporal símbolo del elemento Uuo. Es también conocido como eka-radón o elemento 118, y en el tabla periódica de los elementos es una elemento de p-bloque y el último de la Séptimo período. Ununoctium es actualmente el único miembro sintética del Grupo 18 . Cuenta con el número atómico más alto y más alto masa atómica de todos los elementos descubiertos hasta ahora.
La átomo ununoctium radiactivo es muy inestable, y desde 2002, se han detectado sólo tres o posiblemente cuatro átomos del isótopo 294 Uuo. Si bien esto permitió por muy poco caracterización experimental de sus propiedades y posibles compuestos , cálculos teóricos han dado lugar a muchas predicciones, incluyendo algunos inesperados. Por ejemplo, aunque ununoctium es un miembro del Grupo 18, que posiblemente puede no ser un gas noble , a diferencia de todos los demás Grupo 18 elementos. Antes se piensa que es un gas, pero ahora se prevé que sea un sólido bajo condiciones normales debido a efectos relativistas.
Historia
Intentos de síntesis sin éxito
A finales de 1998, el físico polaco Robert Smolańczuk publicó cálculos sobre la fusión de núcleos atómicos hacia la síntesis de átomos superpesados, incluyendo ununoctium. Sus cálculos sugieren que podría ser posible hacer ununoctium mediante la fusión de plomo con criptón bajo condiciones cuidadosamente controladas.
En 1999, investigadores de la Laboratorio Nacional Lawrence Berkeley hizo uso de estas predicciones y anunció el descubrimiento de livermorium y ununoctium, en un artículo publicado en Physical Review Letters, y muy poco después se informó de los resultados en Ciencia. Los investigadores reportaron haber realizado la reacción
- 86
36 Kr + 208
82 Pb → 293
118 Uuo + n .
Al año siguiente, publicaron una retractación después de investigadores de otros laboratorios fueron incapaces de duplicar los resultados y el laboratorio de Berkeley en sí no fue capaz de duplicar ellos también. En junio de 2002, el director del laboratorio anunció que la demanda original del descubrimiento de estos dos elementos se había basado en datos inventados por el autor principal Victor Ninov.
Informes Descubrimiento
Se observó la primera desintegración de átomos de ununoctium en el Instituto Conjunto de Investigación Nuclear (ICIN) por Yuri Oganessian y su grupo en Dubna, Rusia, en 2002. El 9 de octubre de 2006, los investigadores de ICIN y Laboratorio Nacional Lawrence Livermore de California, EE.UU., que trabaja en el ICIN en Dubna, anunciaron que habían detectado indirectamente un total de tres (posiblemente cuatro) núcleos de ununoctium-294 (uno o dos en 2002 y dos más en 2005), producido a través de las colisiones de californio -249 átomos y calcio-48 iones:
- 249
98 Cf + 48
20 Ca → 294
118 Uuo + 3 n .
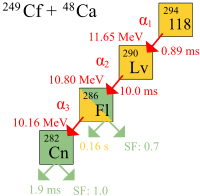
En 2011, IUPAC evaluó los resultados de la colaboración Dubna-Livermore 2006 y concluyó: "Los tres hechos denunciados por los Z = 118 isótopos tienen muy buena redundancia interna pero sin anclaje a los núcleos conocidos no cumplen los criterios para el descubrimiento".
Debido a la muy pequeña probabilidad reacción de fusión (la fusión sección transversal es de ~ 0,3-0,6 pb = (3/6) x 10 -41 m 2) el experimento se llevó 4 meses e involucró a una dosis de haz de 4 × 10 19 calcio iones que tenía que ser fusilado en el californio objetivo de producir el primer evento registrado cree que es el síntesis de ununoctium. Sin embargo, los investigadores están muy seguros de que los resultados no son una falso positivo, ya que la posibilidad de que las detecciones fueron sucesos aleatorios se estimó en menos de una parte en 100.000.
En los experimentos, se observó la desintegración alfa de tres átomos de ununoctium. Un cuarto decaimiento por directo También se propuso la fisión espontánea. Una vida media de 0,89 ms se calculó: 294 Uuo decae en 290 Lv por desintegración alfa. Ya que había sólo tres núcleos, la vida media derivada de vidas observados tiene una gran incertidumbre: 0.89 1.07
-0.31 Ms.
- 294
118 Uuo → 290
116 Lv + 4
2 Él
La identificación de los núcleos 294 Uuo se verificó mediante la creación de separado el putativo núcleo hijo 290 Lv directamente por medio de un bombardeo de 245 Cm con 48 iones de Ca,
- 245
96 Cm + 48
20 Ca → 290
116 Lv + 3 n ,
y la comprobación de que el 290 Lv decadencia hacía juego con el cadena de desintegración de los 294 núcleos Uuo. El núcleo hijo 290 Lv es muy inestable, en descomposición con una duración de 14 milisegundos en 286 Fl, que puede experimentar cualquiera fisión espontánea o Alpha Decay en 282 Cn, que serán sometidos a la fisión espontánea.
En un modelo cuántico-túnel, la vida media de desintegración alfa del 294 Uuo se predijo a ser 0,66 0,23
-0.18 Ms con la Q-valor experimental publicado en 2004. El cálculo con valores de Q teóricos del modelo macroscópico microscópica de Muntian-Hofman-Patyk-Sobiczewski da resultados un tanto bajas pero comparables.
Tras el éxito en la obtención de ununoctium, los descubridores han comenzado experimentos similares con la esperanza de crear Unbinilio (elemento 120) a partir de 58 Fe y 244 Pu. Los isótopos de Unbinilio se prevé contar con la desintegración alfa vidas medias del orden de microsegundos.
Naming
Hasta el ununoctium 1960 era conocido como eka-emanación (emanación es el antiguo nombre de radón ). En 1979, la IUPAC publicó recomendaciones según el cual el elemento debía ser llamado ununoctium, un nombre de elemento sistemático, como marcador de posición hasta que el descubrimiento del elemento se confirma y la IUPAC decide sobre un nombre.
Antes de la retirada en 2002, los investigadores de Berkeley tenían la intención de nombrar al ghiorsium elemento (Gh), después Albert Ghiorso (un destacado miembro del equipo de investigación).
Los descubridores rusas informaron de su síntesis en el año 2006. En 2007, el director del instituto de Rusia declaró que el equipo estuviera considerando dos nombres para el nuevo elemento: flyorium (AF), en honor a Gueorgui Fliórov, el fundador del laboratorio de investigación en Dubna; y moskovium (Mc), en reconocimiento de la Óblast de Moscú donde se encuentra Dubna. También afirmó que aunque el elemento fue descubierto como una colaboración estadounidense, que proporcionó el objetivo californio, el elemento debe ser correctamente nombrado en honor de Rusia desde el Laboratorio Flerov de Reacciones Nucleares en ICIN era la única instalación en el mundo que podría lograrlo resultado. Estos nombres fueron propuestos para su posterior elemento 114 (flerovium) y elemento 116 (moscovium). Sin embargo, el nombre final propuesto para el elemento 116 fue lugar livermorium.
Ningún nombre ha sugerido aún oficialmente para el elemento. De acuerdo con las directrices actuales de la IUPAC, el nombre definitivo para todos los nuevos elementos debe terminar en "-ium", lo que significa el nombre de ununoctium puede terminar en "-ium", no "-on", incluso si ununoctium resulta ser un gas noble , que tradicionalmente tienen nombres terminan en "-on" (con la excepción de helio , que no se sabe que es un gas noble cuando se descubrió).
Características
Estabilidad y isótopos Núcleo
La estabilidad de los núcleos disminuye en gran medida con el aumento de número atómico después de plutonio , el más pesado elemento primordial, por lo que todos los isótopos con un número atómico de arriba 101 decaer radiactivamente con una vida media en virtud de un día, con una excepción de dubnium -268. No hay elementos con números atómicos por encima de 82 (después de plomo ) tienen isótopos estables. Sin embargo, debido razones no muy bien entendidas aún, hay un ligero aumento de la estabilidad nuclear alrededor de números atómicos 110 - 114 , que conduce a la aparición de lo que se conoce en la física nuclear como la " isla de estabilidad ". Este concepto, propuesto por Universidad de profesor de California Glenn Seaborg, explica por qué elementos superpesados duran más de lo previsto. Ununoctium es radiactivo y tiene una vida media que parece ser menos que una milisegundo. Sin embargo, esto sigue siendo más largo que algunos valores previstos, dando así un mayor apoyo a la idea de esta "isla de estabilidad".
Cálculos realizados usando un modelo cuántico-túnel predicen la existencia de varios isótopos ricos en neutrones de ununoctium con alfa-decaimiento vidas medias cercanas a 1 ms.
Los cálculos teóricos realizados sobre las rutas sintéticas para, y la vida media de, otra isótopos han demostrado que algunos de ellos podrían ser ligeramente más estable que el sintetizado isótopo 294 Uuo, lo más probable Uuo 293, 295 Uuo, 296 Uuo, 297 Uuo, 298 Uuo, 300 y 302 Uuo Uuo. De estos, 297 Uuo podría proporcionar las mejores posibilidades de obtener núcleos de larga vida, por lo que podrían llegar a ser el foco del trabajo futuro con este elemento. Algunos isótopos con muchas más neutrones, como algunos ubicados alrededor de 313 Uuo también podrían proporcionar núcleos de vida más larga.
Propiedades atómicas y físicas calculadas
Ununoctium es miembro del grupo 18, los cero- valencia elementos. Los miembros de este grupo suelen ser inerte a las reacciones más comunes químicos (por ejemplo, la combustión), porque el exterior valencia shell está completamente lleno de ocho electrones. Esto produce una configuración estable de energía, mínimo en el que los electrones externos están estrechamente vinculados. Se cree que de manera similar, tiene una ununoctium capa de valencia exterior cerrado en el que su electrones de valencia están dispuestos en una 7s 2 7p 6 de configuración.
En consecuencia, algunos esperan ununoctium que tienen propiedades físicas y químicas similares a otros miembros de su grupo, que se asemeja más a la del gas noble por encima de ella en la tabla periódica, el radón . Siguiendo el tendencia periódica, ununoctium se espera que sea ligeramente más reactivo que el radón. Sin embargo, los cálculos teóricos han demostrado que podría ser muy reactiva, de modo que es probable que no se puede considerar un gas noble. Además de ser mucho más reactivo que el radón, ununoctium puede ser incluso más reactivos que los elementos flerovium y copernicium . La razón para la aparente aumento de la actividad química de ununoctium relativa al radón es una desestabilización energética y una expansión radial de la última ocupada 7p- subnivel. Más precisamente, considerable interacciones spin-órbita entre los 7p electrones con los 7s inertes 2 electrones, conducen efectivamente a un segundo cierre capa de valencia en flerovium , y una disminución significativa en la estabilización de la concha cerrada del elemento 118. También se ha calculado que ununoctium, a diferencia de otros gases nobles, se une un electrón con liberación de energía, o en otras palabras, exhibe positivo afinidad electronica.
Se espera Ununoctium tener por mucho, el más amplio polarizabilidad de todos los elementos anteriores a él en la tabla periódica, y casi el doble de radón. Por extrapolación de los otros gases nobles, se espera que ununoctium tiene un punto de ebullición entre 320 y 380 K. Esto es muy diferente de los valores estimados previamente de 263 K o 247 K. Incluso teniendo en cuenta las grandes incertidumbres de los cálculos, parece muy poco probable que ununoctium sería un gas bajo condiciones estándar, y como el rango de líquido de los otros gases es muy estrecha, entre 2 y 9 grados Kelvin, este elemento debe ser sólido en condiciones estándar. Si ununoctium forma un gas en condiciones estándar, sin embargo, sería una de las sustancias más densas gaseosos en condiciones estándar (incluso si es monoatómico como los otros gases nobles).
Debido a su enorme capacidad de polarización, se espera ununoctium tener un anormalmente bajo energía de ionización (similar a la de plomo que es 70% de la de radón y significativamente menor que el de flerovium) y un estado estándar de fase condensada .
Compuestos predichos
No hay compuestos de ununoctium se han sintetizado todavía, pero cálculos en se han realizado compuestos teóricos desde 1964. Se espera que si el energía de ionización del elemento es lo suficientemente alta, será difícil oxidar y, por tanto, el más común estado de oxidación será 0 (como para otros gases nobles).
Los cálculos sobre la dimérica molécula Uuo 2 mostró una unión interacción más o menos equivalente a la calculada para el Hg 2, y una energía de disociación de 6 kJ / mol, aproximadamente 4 veces de la de Rn 2. Pero lo más sorprendente es que se calcula que tiene una longitud de enlace más corto que en Rn 2 por 0,16 Å, lo que sería indicativo de una interacción significativa de unión. Por otra parte, el compuesto UuoH + exhibe una energía de disociación (en otras palabras afinidad protónica de Uuo) que es más pequeño que el de RNH +.
La unión entre ununoctium y de hidrógeno en UuoH se prevé que sea muy floja y puede considerarse como una pura interacción van der Waals en lugar de un verdadero enlace químico . Por otro lado, con elementos muy electronegativos, ununoctium parece formar compuestos más estables que, por ejemplo, copernicium o flerovium . Los estados de oxidación estables 2 y 4 han sido predicho a existir en el fluoruros UuoF 2 y 4 UuoF. Este es un resultado de las mismas interacciones spin-órbita que hacen ununoctium inusualmente reactiva. Por ejemplo, se demostró que la reacción de ununoctium con F 2 para formar el compuesto UuoF 2 liberaría una energía de 106 kcal / mol de los cuales aproximadamente 46 kcal / mol proceden de estas interacciones. Para la comparación, la interacción spin-órbita para la molécula de RNA similares 2 es de aproximadamente 10 kcal / mol de una energía de formación de 49 kcal / mol. La misma interacción estabiliza la tetraédrica configuración de T d para UuoF 4, a diferencia de la cuadrada plana D 4h uno de XeF 4 que también se espera RNF 4 tener. El vínculo Uuo-F, muy probablemente será iónica en lugar de covalente, haciendo que el UuoF n compuestos no volátil. UuoF 2 se prevé que sea parcialmente iónico debido a la alta del ununoctium electropositividad. A diferencia de los otros gases nobles, ununoctium se predijo a ser suficientemente electropositivo para formar un enlace Uuo-Cl con cloro .


