Vanadio
Antecedentes de las escuelas de Wikipedia
La organización de una selección de Wikipedia para escuelas en el mundo en desarrollo sin internet fue una iniciativa de SOS Children. Apadrina un niño para hacer una diferencia real.
| Vanadio | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
23 V | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Apariencia | ||||||||||||||||||||||||||||||||||
azul-plata-gris metalizado  | ||||||||||||||||||||||||||||||||||
| Propiedades generales | ||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | vanadio, V, 23 | |||||||||||||||||||||||||||||||||
| Pronunciación | / v ə n eɪ d yo ə m / və- NAY dee-əm | |||||||||||||||||||||||||||||||||
| Categoría metálico | metal de transición | |||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 5, 4, d | |||||||||||||||||||||||||||||||||
| Peso atómico estándar | 50,9415 (1) | |||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Ar ] 3d 3 4s 2 2, 8, 11, 2 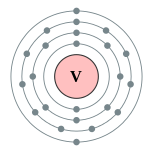 | |||||||||||||||||||||||||||||||||
| Historia | ||||||||||||||||||||||||||||||||||
| Descubrimiento | Andrés Manuel del Río (1801) | |||||||||||||||||||||||||||||||||
| Primer aislamiento | Nils Gabriel Sefström (1830) | |||||||||||||||||||||||||||||||||
| Nombrado por | Nils Gabriel Sefström (1830) | |||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||
| Fase | sólido | |||||||||||||||||||||||||||||||||
| Densidad (cerca rt) | 6.0 g · cm -3 | |||||||||||||||||||||||||||||||||
| Líquido densidad en mp | 5,5 g · cm -3 | |||||||||||||||||||||||||||||||||
| Punto de fusion | 2183 K , 1910 ° C, 3470 ° F | |||||||||||||||||||||||||||||||||
| Punto de ebullicion | 3680 K, 3407 ° C, 6165 ° F | |||||||||||||||||||||||||||||||||
| Calor de fusión | 21.5 kJ · mol -1 | |||||||||||||||||||||||||||||||||
| El calor de vaporización | 459 kJ · mol -1 | |||||||||||||||||||||||||||||||||
| Capacidad calorífica molar | 24.89 J · mol -1 · K -1 | |||||||||||||||||||||||||||||||||
| Presión del vapor | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||
| Estados de oxidación | 5, 4, 3, 2, 1, -1 ( óxido anfótero) | |||||||||||||||||||||||||||||||||
| Electronegatividad | 1,63 (escala de Pauling) | |||||||||||||||||||||||||||||||||
| Energías de ionización ( más) | Primero: 650.9 kJ · mol -1 | |||||||||||||||||||||||||||||||||
| Segundo: 1414 kJ · mol -1 | ||||||||||||||||||||||||||||||||||
| Tercero: 2830 kJ · mol -1 | ||||||||||||||||||||||||||||||||||
| Radio atómico | 134 pm | |||||||||||||||||||||||||||||||||
| Radio covalente | 153 ± 20:00 | |||||||||||||||||||||||||||||||||
| Miscelánea | ||||||||||||||||||||||||||||||||||
| Estructura cristalina | centrada en el cuerpo cúbico  | |||||||||||||||||||||||||||||||||
| Ordenamiento magnético | paramagnético | |||||||||||||||||||||||||||||||||
| La resistividad eléctrica | (20 ° C) 197 nΩ · m | |||||||||||||||||||||||||||||||||
| Conductividad térmica | 30.7 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||
| Expansión térmica | (25 ° C) 8,4 micras · m -1 · K -1 | |||||||||||||||||||||||||||||||||
| Velocidad del sonido (varilla delgada) | (20 ° C) 4560 m · s -1 | |||||||||||||||||||||||||||||||||
| El módulo de Young | 128 GPa | |||||||||||||||||||||||||||||||||
| Módulo de corte | 47 GPa | |||||||||||||||||||||||||||||||||
| Módulo de volumen | 160 GPa | |||||||||||||||||||||||||||||||||
| Relación de Poisson | 0.37 | |||||||||||||||||||||||||||||||||
| Dureza de Mohs | 6.7 | |||||||||||||||||||||||||||||||||
| Número de registro del CAS | 7440-62-2 | |||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | ||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de vanadio | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
El vanadio es un elemento químico con el símbolo V y número atómico 23. Es un duro, gris plateado, dúctil y maleable metal de transición . El elemento se encuentra sólo en forma combinada químicamente en la naturaleza, pero una vez aislado artificialmente, la formación de una capa de óxido estabiliza el metal libre un poco contra la oxidación adicional. Andrés Manuel del Río descubrió compuestos de vanadio en 1801 mediante el análisis de un nuevo mineral que contiene plomo que llamó "cable marrón", y presume de sus cualidades se deben a la presencia de un nuevo elemento, que él nombró erythronium (del griego, "rojo") ya que, al calentarse, la mayoría de sus sales de volver de su color inicial a rojo. Cuatro años más tarde, sin embargo, estaba convencido por otros científicos que erythronium era idéntico al cromo. Los cloruros de vanadio se generaron en 1830 por Nils Gabriel Sefström que con ello demostró que un nuevo elemento estaba implicado, a la que llamó "vanadio" después de la Diosa germánica de la belleza y la fertilidad, Vanadís ( Freyja). Ambos nombres fueron atribuidos a la amplia gama de colores que se encuentran en los compuestos de vanadio. Mineral de plomo de Del Río fue rebautizado más tarde vanadinita por su contenido de vanadio. Aunque Berzelius afirmó tener primero aislado vanadio en la década de 1830, en 1867 Henry Enfield Roscoe mostró que sólo había obtenido el óxido, y finalmente en 1869 Roscoe demostrado un método para obtener el elemento puro.
El vanadio se encuentra naturalmente en unos 65 diferentes minerales y combustibles fósiles depósitos. Se produce en China y Rusia a partir de fundición de acero escoria; otros países lo producen ya sea desde el polvo de combustión de aceite pesado, o como subproducto de la minería del uranio. Se utiliza principalmente para producir aceros especiales aleaciones tales como aceros para herramientas de alta velocidad. El compuesto de vanadio industrial más importante, El pentóxido de vanadio, se utiliza como un catalizador para la producción de ácido sulfúrico .
Grandes cantidades de iones de vanadio se encuentran en unos pocos organismos, posiblemente como una toxina. El óxido y algunas otras sales de vanadio tienen una toxicidad moderada. Particularmente en el océano, vanadio es utilizado por algunas formas de vida como un centro activo de las enzimas, tales como la vanadio bromoperoxidase de algunas algas del océano. El vanadio es probablemente una micronutrientes en los mamíferos, incluidos los humanos, pero su papel exacto en este sentido es desconocido.
Historia
El vanadio fue originalmente descubierto por Andrés Manuel del Río, un mineralogista mexicano de origen español, en 1801. Del Río extrae el elemento de una muestra de mineral mexicana "cable marrón", más tarde nombrado vanadinite. Él encontró que sus sales exhiben una amplia variedad de colores, y como resultado que llamó la panchromium elemento (griego: παγχρώμιο "todos los colores"). Más tarde, Del Río cambió el nombre del elemento erythronium (griego: ερυθρός "rojo"), como la mayoría de sus sales se puso roja al calentarse. En 1805, el químico francés Hippolyte Victor Collet-Descotils, respaldado por el amigo de Barón del Río Alexander von Humboldt, incorrectamente declaró que el nuevo elemento de Del Río fue sólo una muestra impura de cromo . Del Río aceptó declaración Collet-Descotils 'y se retractó de su afirmación.
En 1831, el químico sueco Nils Gabriel Sefström redescubrió el elemento de un nuevo óxido que encontró mientras trabajaba con minerales de hierro. Más tarde ese mismo año, Friedrich Wöhler confirmó el trabajo anterior de del Río. Sefstrom eligió un nombre que comienza con V, que no había sido asignado a cualquier elemento todavía. Llamó el elemento vanadio después Nórdico antiguo Vanadís (otro nombre para el nórdico VanR diosa Freyja, cuyas facetas incluir conexiones a la belleza y la fertilidad), debido a los muchos hermosos colores compuestos químicos que produce. En 1831, el geólogo George William Featherstonhaugh sugirió que el vanadio debería llamarse "rionium" después del Río, pero esta sugerencia no fue seguida.

El aislamiento de metal vanadio resultó difícil. En 1831, Berzelius informó la producción del metal, pero Henry Enfield Roscoe mostró que Berzelius tenía de hecho produjo el nitruro, nitruro de vanadio (VN). Roscoe produjo finalmente el metal en 1867 por la reducción de vanadio (II), cloruro de VCl 2, con hidrógeno . En 1927, el vanadio puro fue producido por la reducción pentóxido de vanadio con calcio . El primer uso industrial a gran escala de vanadio en aceros se encontró en el chasis de la Ford Modelo T, inspirado en los coches de carreras francesas. Vanadio permitió la reducción de peso al mismo tiempo aumentar resistencia a la tracción.
Características

El vanadio es un duro, dúctil, metal gris plateado. Algunas fuentes describen vanadio como "suave", tal vez porque es dúctil, maleable y no frágil. El vanadio es más difícil que la mayoría de los metales y aceros (ver Durezas de los elementos (página de datos) y de hierro ). Tiene una buena resistencia a la corrosión y es estable frente álcalis, sulfúrico y clorhídrico ácidos. Es oxidada en aire a aproximadamente 933 K (660 ° C, 1220 ° F), aunque se forma una capa de óxido incluso a temperatura ambiente.
Isótopos
Naturalmente vanadio ocurre se compone de una estable isótopo 51 V y un isótopo radiactivo 50 V. Este último tiene una vida media de 1,5 × 10 17 años y una abundancia natural 0,25%. 51 V tiene una spin nuclear de 7/2 que es útil para la espectroscopía de RMN . 24 artificial radioisótopos se han caracterizado, que van en número de masa de 40 a 65. El más estable de estos isótopos son 49 V con una vida media de 330 días, y 48 V, con una vida media de 16,0 días. Todos los restantes isótopos radiactivos tienen vidas medias más cortas de una hora, la mayoría de los cuales están por debajo de 10 segundos. Al menos 4 isótopos tienen estados excitados metaestables. La captura de electrones es la principal modo de desintegración de los isótopos más ligeros que el 51 V. Para los más pesados, el modo más común es desintegración beta. Las reacciones de captura de electrones conducen a la formación de los elementos 22 ( titanio ) isótopos, mientras que para la desintegración beta, que conduce a los elementos 24 ( cromo ) isótopos.
Química y compuestos

La química de vanadio es notable por la accesibilidad de los cuatro adyacentes estados de oxidación 2-5. En solución acuosa de los colores son lila V 2+ (aq), verde V 3+ (aq), azul VO 2+ (aq) y, a un pH alto, VO amarilla 4 2-. El vanadio (II) compuestos son agentes reductores y vanadio (V) Los compuestos son agentes oxidantes. El vanadio (IV) compuestos a menudo existe como derivados vanadilo que contienen centro del VO 2 +.
Vanadato de amonio (V) (NH 4 VO 3) se puede reducir sucesivamente con elemental de zinc para obtener los diferentes colores de vanadio en estos cuatro estados de oxidación. Estados de oxidación más bajos ocurren en compuestos tales como V (CO) 6, [V (CO) 6] - y sus derivados sustituidos.
La de la batería redox de vanadio utiliza los cuatro estados de oxidación; un electrodo utiliza el + 5 / + 4 par y el otro utiliza la pareja + 3 / + 2. La conversión de estos estados de oxidación se ilustra por la reducción de una solución fuertemente ácida de un compuesto de vanadio (V) con polvo de zinc o de amalgama. El característico color amarillo inicial del ion pervanadyl [VO 2 (H 2 O) 4] + se sustituye por el color azul de [VO (H 2 O) 5] 2+, seguido por el color verde de [V (H 2 O) 6] 3+ y luego el color violeta debido a [V (H 2 O) 6] 2+.
El compuesto más importante es comercialmente pentóxido de vanadio, que se utiliza como un catalizador para la producción de ácido sulfúrico. Este compuesto se oxida dióxido de azufre (SO 2) a la trióxido (SO3). En esto reacción redox, el azufre se oxida 4-6, y vanadio se reduce 5-3:
- V 2 O 5 + 2 SO2 → V 2 O 3 + 2 SO 3
El catalizador se regenera por oxidación con aire:
- V 2 O 3 + O 2 → V 2 O 5
Oxi-aniones y cationes
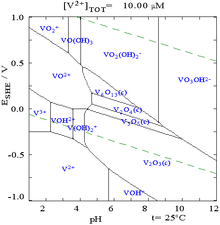
La química oxianión de vanadio (V) es complejo: la diagrama predominio de vanadatos en solución acuosa muestra al menos 11 especies a ser predominante en determinadas condiciones de pH y la concentración. El ion vanadato tetraédrica, VO 3-
4, es la principal especie presentes a pH 12-14. En la acidificación, el monómero [HVO 4] 2- y el dímero [V 2 O 7] - se forman, con el monómero predominante en la concentración de vanadio de menos de ca. 10 -2 M (pV> 2; pV es igual a menos el logaritmo de la concentración de vanadio Total / M). La formación del ion divanadate es análogo a la formación de la ion dicromato. A medida que el pH se reduce, aún más protonación y la polimerización de polyvanadates ocurren: a pH 4-6 [H 2 VO 4] - es predominante en pV mayor de ca. 4, mientras que a mayores concentraciones de trímeros y tetrámeros se forman. Entre pH 2-4 decavanadates predominan. En decavanadates hay un octaedro distorsionado de átomos de oxígeno alrededor de cada átomo de vanadio. Ácido vanádico, H 3 VO 4 tiene una concentración muy baja debido a la protonación de las especies tetraédricas de [H 2 VO 4] - resulta en la formación preferencial de la octaédrica [VO 2 (H 2 O) 4] + especies. En soluciones fuertemente ácidas, pH <2. [VO 2 (H 2 O) 4] + es la especie predominante, mientras que el óxido de V 2 O 5 precipita de la solución a altas concentraciones. El óxido es formalmente la anhídrido del ácido inorgánico vanádico. Las estructuras de muchos de estos y otros iones de vanadato se han determinado por cristalografía de rayos X de compuestos cristalinos.
Las constantes de disociación de ácido para la serie de vanadio y el fósforo son notablemente similares. Cadenas, anillos y grupos que implican vanadio tetraédrica, análogo al polifosfatos, se conocen. La correspondencia entre el vanadato y la química de fosfato se puede atribuir a la similitud en el tamaño y la carga de fósforo (V) y vanadio (V). Ortovanadato V O 3-
4 se utiliza en cristalografía de proteínas para estudiar la bioquímica de fosfato.
La Diagrama de Pourbaix para el vanadio en agua, que muestra la potenciales redox entre varias especies de vanadio en diferentes estados de oxidación también es compleja.
Vanadio (V) también forma varios complejos peroxo. La especie VO (O) 2 (H 2 O) 4 + está presente en soluciones ácidas. En las especies soluciones alcalinas con 2, 3 y 4 grupos peróxido están presentes; las últimas formas de cristales violetas M 3 V (O 2) 4 nH 2 O (M = Li, Na, K, NH 4 +), en la que el vanadio tiene un 8 coordenada estructura dodecaedro.
Compuestos calcogenuros y halogenuros
Vanadio forma una gran variedad de compuestos binarios con azufre, selenio y teluro, a menudo con estructuras complicadas. El tetraédrica sulfa-anión [VS 4] 3-, análoga a la de iones ortovanadato, es bien conocida, pero no hay tio-análogos de los polímeros oxo-vanadatos.
Los cuatro haluros son conocidos por los estados de oxidación 2 y 3, pero el yoduro no es conocido por V (IV) y VF 5 es el único haluro conocido por el estado de oxidación 5. VCl4 puede ser utilizado como un catalizador para la polimerización de dienos.
Ejemplos de oxihaluros incluyen.
- vanadio (V): VOF 3, VOX 3 y VO 2 X (X = F, Cl)
- vanadio (IV): VOX 2 (X = F, Cl, Br)
- vanadio (III): VOX, (X = Cl, Br)
Compuestos de coordinación
Las primeras posiciones de vanadio en el metal de transición serie conduce a tres características poco usuales de la química de coordinación del vanadio. En primer lugar, el vanadio metálico tiene la configuración electrónica [Ar] 3d 3 4s 2, por lo que los compuestos de vanadio son relativamente pobres en electrones. En consecuencia, la mayoría de los compuestos binarios son Ácidos de Lewis (par de electrones aceptantes); ejemplos son todos los haluros que forman aductos octaédricos con la fórmula VX n L 6- n (X = haluro; L = otro ligando). En segundo lugar, el ion de vanadio es bastante grande y puede alcanzar números de coordinación superiores a 6, como es el caso en [V (CN) 7] 4-. En tercer lugar, la iones de vanadio, el VO 2 +, se ofrece en muchos complejos de vanadio (IV) tales como vanadilo acetilacetonato (V (= O) 5 (C 5 H 7) 2). En este complejo, el vanadio es 5 coordenada, piramidal cuadrado, lo que significa que un sexto ligando, tal como piridina, puede estar unido, aunque la constante de asociación de este proceso es pequeña. Muchos complejos de 5-coordenadas de vanadilo tienen una geometría bypyramidal trigonal, tales como VOCl 2 (NMe 3) 2.
Los compuestos organometálicos
Química organometálica de vanadio está bien desarrollada, pero los compuestos organometálicos son de menor importancia comercial. Dicloruro de vanadoceno es un reactivo de partida versátil e incluso encuentra aplicaciones de menor importancia en la química orgánica. El vanadio carbonilo, V (CO) 6, es un raro ejemplo de un existe carbonilo de metal que contiene un electrón desapareado, pero que sin dimerización. La adición de un rendimientos de electrones V (CO) -
6 ( isoelectrónico con Cr (CO) 6), que puede reducirse aún más con sodio en amoníaco líquido para producir V (CO) 3-
6 (isoelectrónico con Fe (CO) 5).
Aparición
Vanadio metálico no se encuentra en la naturaleza, pero se sabe que existe en aproximadamente 65 diferentes minerales . Ejemplos económicamente significativas incluyen patronita (VS 4), vanadinite (Pb 5 (VO 4) 3 Cl), y carnotita (K 2 (UO 2) 2 (VO 4) 2 · 3 H 2 O). Gran parte de la producción de vanadio en el mundo se nutre de vanadio-cojinete magnetita se encuentra en ultramáfica cuerpos de gabro. El vanadio se extrae principalmente en Sudáfrica , en el noroeste de China , y el este de Rusia . En 2010 estos tres países extraen más del 98% de la 56000 toneladas de vanadio producido.
El vanadio también está presente en bauxita y en los combustibles fósiles , tales como depósitos de petróleo crudo , carbón , petróleo de esquisto bituminoso y arenas bituminosas. En petróleo crudo, se ha informado de concentraciones de hasta 1200 ppm. Cuando tales productos derivados del petróleo se queman, los rastros de vanadio pueden iniciar la corrosión en los motores y calderas. Se estima que 110.000 toneladas de vanadio por año se liberan en la atmósfera por la quema de combustibles fósiles. El vanadio también se ha detectado espectroscópicamente a la luz del sol y otras estrellas .
Producción
La mayoría de vanadio se utiliza como una aleación llamada ferrovanadio como un aditivo para mejorar los aceros . Ferrovanadio se produce directamente mediante la reducción de una mezcla de óxido de vanadio, óxidos de hierro y hierro en un horno eléctrico. Vanadio-cojinete mineral de hierro magnetita es la principal fuente para la producción de vanadio. El vanadio termina en arrabio producido a partir de la magnetita cojinete de vanadio. Durante la producción de acero, el oxígeno es soplado en el arrabio, la oxidación del carbono y la mayoría de las otras impurezas, formando escoria. Dependiendo del mineral utilizado, la escoria contiene hasta 25% de vanadio.
El vanadio metálico se obtiene a través de un proceso de múltiples etapas que comienza con la calcinación de mineral triturado con NaCl o Na 2 CO 3 a aproximadamente 850 ° C para dar metavanadato sódico (NaVO 3). Un extracto acuoso de este sólido se acidifica para dar "pastel rojo", una sal polyvanadate, que se reduce con el calcio metal. Como una alternativa para la producción a pequeña escala, pentóxido de vanadio se reduce con hidrógeno o de magnesio . Muchos otros métodos también están en uso, en todos los cuales el vanadio se produce como una subproducto de otros procesos. Purificación de vanadio es posible por el proceso de la barra de cristal desarrollado por Anton Eduard van Arkel y Jan Hendrik de Boer en 1925. Se trata de la formación del yoduro de metal, en este ejemplo yoduro de vanadio (III), y la posterior descomposición para producir metal puro.
- 2 V + 3 I 2
 2 VI 3
2 VI 3
Aplicaciones
Aleaciones
Aproximadamente el 85% de vanadio producido se utiliza como ferrovanadio o como un acero aditivo. El considerable aumento de la fuerza en acero que contenga pequeñas cantidades de vanadio fue descubierto en el comienzo del siglo 20a. Vanadio forma nitruros y carburos estables, resultando en un aumento significativo en la resistencia del acero. A partir de entonces vanadio se utilizan en aplicaciones de marcos ejes, bicicleta, cigüeñales, engranajes y otros componentes críticos. Hay dos grupos de vanadio que contienen grupos de aleaciones de acero. Vanadio aleaciones de acero de alto carbono contienen 0,15% a 0,25% de vanadio y aceros para herramientas de alta velocidad (HSS) tienen un contenido de vanadio de 1% a 5%. Para aceros para herramientas de alta velocidad, una dureza por encima de HRC 60 se puede lograr. Acero HSS se utiliza en instrumentos quirúrgicos y herramientas.
El vanadio se estabiliza la forma beta de titanio y aumenta la fuerza y la estabilidad de la temperatura de titanio. Mezclado con aluminio en titanio aleaciones se utiliza en motores a reacción , fuselajes de alta velocidad y implantes dentales. Una de las aleaciones comunes es Titanio 6Al-4V, una aleación de titanio con 6% de aluminio y 4% de vanadio.
Otros usos
El vanadio es compatible con hierro y titanio, por lo tanto, la hoja de vanadio se utiliza en revestimiento de titanio al acero. La moderada sección transversal de captura de neutrones térmicos y la corta vida media de los isótopos producidos por captura de neutrones hace vanadio un material adecuado para la estructura interna de una reactor de fusión. Varias aleaciones de vanadio muestran un comportamiento superconductor. La primera A15 fase superconductor era un compuesto de vanadio, V 3 Si, que fue descubierto en 1952. Cinta de vanadio-galio se utiliza en superconductores imanes (17,5 teslas o 175000 gauss). La estructura de la A15 fase superconductora de V 3 Ga es similar a la de los más comunes Nb 3 Sn y N ° 3 Ti.
El más común de óxido de vanadio, El pentóxido de vanadio V 2 O 5, se utiliza como catalizador en la fabricación de ácido sulfúrico por la proceso de contacto y como oxidante en producción de anhídrido maleico. El pentóxido de vanadio también se utiliza en la fabricación de cerámica. Otro óxido de vanadio, dióxido de vanadio VO 2, se utiliza en la producción de revestimientos de vidrio, que bloquea radiación infrarroja (y la luz no visible) a una temperatura específica. El óxido de vanadio se puede utilizar para inducir centros de color en corindón para crear simulado joyería de alejandrita, aunque alejandrita en la naturaleza es un crisoberilo. La posibilidad de utilizar pares redox de vanadio en ambos medio de las células, eliminando así el problema de la contaminación cruzada por difusión de iones a través de la membrana es la ventaja de vanadio redox baterías recargables. Vanadato se puede utilizar para proteger el acero contra la oxidación y la corrosión por revestimiento de conversión electroquímica. Óxido de vanadio de litio se ha propuesto para su uso como un ánodo de alta densidad de energía para las baterías de iones de litio, a 745 Wh / L cuando se combina con una cobalto de litio cátodo de óxido. Se ha propuesto por algunos investigadores que una pequeña cantidad, desde 40 hasta 270 ppm, de vanadio en Acero Wootz y acero de Damasco , mejora significativamente la resistencia del material, aunque no está claro cuál fue el origen del vanadio.
Papel biológico
Vanadio juega un papel muy limitado en la biología , y es más importante en los ambientes oceánicos que en tierra.
Bromoperoxidases en algas
Compuestos organobromados en un número de especies de marina algas son generados por la acción de un vanadio dependiente bromoperoxidase. Esto es un haloperoxidasa en las algas que requiere bromuro y es una enzima absolutamente vanadio-dependiente. La mayoría de los compuestos organobromados en el mar surgen en última instancia, a través de la acción de este vanadio bromoperoxidase.
Acumulación de vanadio en tunicados y ascidias
Químico alemán Martin Henze descubrió el vanadio en el células sanguíneas (o células celómicas) de Ascidiacea (ascidias) en 1911. Es esencial ascidias y tunicados, donde se almacena en la muy acidificada vacuolas de ciertos tipos de células sanguíneas, vanadocytes designados. Vanabins (proteínas de unión de vanadio) se han identificado en el citoplasma de dichas células. La concentración de vanadio en su sangre es de hasta 10 millones de veces mayor que la concentración de vanadio en el agua de mar alrededor de ellos. La función de este sistema de concentración de vanadio, y estas proteínas que contienen vanadio, es aún desconocido.
La fijación de nitrógeno
La nitrogenasa vanadio es utilizado por algunos fijadores de nitrógeno microorganismos, tales como Azotobacter. En este papel de vanadio reemplaza más común de molibdeno o de hierro , y da la nitrogenasa propiedades ligeramente diferentes.
Hongos
Varias especies de hongos macroscópicos, es decir, Amanita muscaria y especies relacionadas, se acumulan vanadio (hasta 500 mg / kg en peso seco). El vanadio está presente en el complejo de coordinación, amavadin, en cuerpos fructíferos de hongos. Sin embargo, la importancia biológica del proceso de acumulación se desconoce. Funciones toxina o funciones de la enzima peroxidasa se han sugerido.
Los mamíferos y aves
Las ratas y pollos también se sabe que requieren vanadio en cantidades muy pequeñas y deficiencias resultan en una disminución del crecimiento y deterioro reproducción. El vanadio es un relativamente controversial suplemento dietético, principalmente para aumentar la insulina y la sensibilidad body-building. Tanto si se trabaja para el último propósito no se ha probado, y hay alguna evidencia de que los atletas que lo toman simplemente están experimentando un efecto placebo. Sulfato de vanadio puede mejorar el control de la glucosa en personas con la diabetes tipo 2. Además, decavanadate y oxovanadates son especies que potencialmente tienen muchas actividades biológicas y que se han utilizado con éxito como herramientas en la comprensión de varios procesos bioquímicos.
Seguridad
Todos los compuestos de vanadio deben ser considerados tóxicos. Tetravalente VOSO 4 ha sido informado de que más de 5 veces más tóxico que trivalente V 2 O 3. La Administración de Seguridad y Salud Ocupacional (OSHA) ha establecido un límite de exposición de 0,05 mg / m3 para el polvo de pentóxido de vanadio y 0.1 mg / m3 para vapores de pentóxido de vanadio en el aire del trabajo durante una jornada de 8 horas, la semana laboral de 40 horas. La Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH) recomienda que 35 mg / m 3 de vanadio ser considerado un peligro inmediato para la vida y la salud. Este es el nivel de exposición de una sustancia química que es probable que cause problemas de salud permanentes o la muerte.
Compuestos de vanadio son mal absorbidos a través del sistema gastrointestinal. Las exposiciones por inhalación de vanadio y compuestos de vanadio son principalmente el resultado de los efectos adversos en el sistema respiratorio. Los datos cuantitativos son, sin embargo, insuficiente para derivar una dosis de referencia inhalación subcrónica o crónica. Otros efectos se han reportado después de la exposición oral o por inhalación en los parámetros sanguíneos, en el hígado, en el desarrollo neurológico en ratas y otros órganos.
Hay poca evidencia de que los compuestos de vanadio o vanadio son toxinas reproductivas o teratógenos. El pentóxido de vanadio se informó a ser cancerígenos en ratas macho y ratones machos y hembras por inhalación en un estudio de NTP, aunque la interpretación de los resultados recientemente se ha disputado. El vanadio no ha sido clasificado como cancerígeno por el Agencia de Protección Ambiental de los Estados Unidos.
Vanadio traza en combustibles diesel presentan un peligro de corrosión; que es el componente principal de combustible influir la corrosión a alta temperatura. Durante la combustión, se oxida y reacciona con el sodio y el azufre, produciendo compuestos de vanadato con puntos de fusión hacia abajo para 530 ° C, que atacan la capa de pasivación sobre el acero, haciéndolo susceptible a la corrosión. Los compuestos de vanadio sólidos también causan la abrasión de los componentes del motor.