
Iterbio
Sabías ...
SOS ofrecen una descarga completa de esta selección para las escuelas para su uso en escuelas intranets. patrocinio SOS Niño es cool!
| Iterbio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
70 Yb | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
blanco plateado  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades generales | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | iterbio, Yb, 70 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pronunciación | / ɨ t ɜr b yo ə m / i- TUR -bee-əm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoría metálico | lantánidos | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | n / a, 6, F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atómico estándar | 173.054 (5) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Xe ] 4f 14 6s 2 2, 8, 18, 32, 8, 2 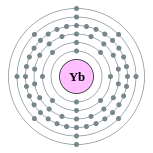 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Historia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Descubrimiento | Jean Charles Galissard de Marignac (1878) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Primer aislamiento | Georges Urbain (1907) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad (cerca rt) | 6,90 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líquido densidad en mp | 6,21 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusion | 1097 K , 824 ° C, 1515 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullicion | 1469 K, 1196 ° C, 2185 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusión | 7.66 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| El calor de vaporización | 159 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidad calorífica molar | 26.74 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión del vapor | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidación | 3, 2, 1 ( óxido básico) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | ? 1,1 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energías de ionización | Primero: 603.4 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Segundo: 1174,8 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tercero: 2417 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico | 176 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 187 ± 20:00 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelánea | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | cara cúbica centrada  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamiento magnético | paramagnético | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La resistividad eléctrica | ( rt) (β, poli) 0,250 μΩ · m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 38.5 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Expansión térmica | ( rt) (β, poli) 26,3 m / (m · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido (varilla delgada) | (20 ° C) 1590 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| El módulo de Young | (Forma β) 23,9 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de corte | (Forma β) 9,9 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de volumen | (Forma β) 30,5 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Relación de Poisson | (Forma β) 0,207 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Vickers | 206 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 343 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registro del CAS | 7440-64-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de iterbio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El iterbio es un elemento químico con el símbolo Yb y número atómico 70. Es el elemento decimocuarta y penúltima en el lantánido serie, o el último elemento de la f-bloque, que es la base de la estabilidad relativa de la 2 estado de oxidación . Sin embargo, como los otros lantánidos, el estado de oxidación más común es 3, visto en su óxido, haluros y otros compuestos. En solución acuosa, como compuestos de otros lantánidos finales, compuestos de iterbio solubles formar complejos con nueve moléculas de agua. Debido a su configuración electrónica cerrada-shell, sus puntos de densidad y de fusión y ebullición difieren de las de los otros lantánidos.
En 1878, el químico suizo Jean Charles de Marignac Galissard separa en la tierra "erbia" rara otro componente independiente, al que llamó "iterbia", para Ytterby, la aldea en Suecia , cerca de donde se encontró con el nuevo componente de erbio . Sospechaba que iterbia era un compuesto de un elemento nuevo que él llamó "iterbio" (en total, cuatro elementos fueron nombrados después de la aldea, los otros son itrio , terbio y erbio). En 1907, la nueva tierra "lutecia" se separó de iterbia, de la que el elemento "lutecio" (ahora lutecio ) se extrajo por Georges Urbain, Carl Auer von Welsbach, y Charles James. Tras un breve debate, el nombre "iterbio" de Marignac fue retenido. Una muestra relativamente pura del metal se obtuvo sólo en 1953. En la actualidad, iterbio se utiliza principalmente como una dopante de acero inoxidable o medios de láser activo, y menos a menudo como una fuente de rayos gamma.
Iterbio natural es una mezcla de siete isótopos estables, que en conjunto están presentes en concentraciones de 3 partes por millón. Este elemento se extrae en China, Estados Unidos, Brasil y la India en forma de los minerales monacita, euxenite, y xenotima. La concentración de iterbio es baja, debido a que el elemento se encuentra entre muchos otros elementos de tierras raras; además, es entre los menos abundantes. Una vez extraído y preparado, iterbio es un tanto peligroso como un irritante de los ojos y la piel. El metal es un peligro de incendio y explosión.
Características
Propiedades físicas
El iterbio es un suave, maleable y dúctil elemento químico que muestra un plateado brillante brillo cuando en su forma pura. Es un elemento de tierras raras, y se ataca y disuelve fácilmente por el fuerte ácidos minerales. Se reacciona lentamente con el frío del agua y oxida lentamente en el aire.
El iterbio tiene tres alótropos etiquetados por las letras griegas alfa, beta y gamma; sus temperaturas de transformación son -13 ° C y 795 ° C, aunque la temperatura exacta depende de la transformación presión y estrés. Existe el alótropo beta a temperatura ambiente, y tiene una cara cúbica centrada estructura cristalina. La gamma alótropo de alta temperatura tiene un centrada en el cuerpo estructura cristalina cúbica. El alótropo alfa tiene una estructura cristalina hexagonal y es estable a bajas temperaturas. Normalmente, el alótropo beta tiene un metálica conductividad eléctrica, pero se convierte en un semiconductor cuando se expone a una presión de aproximadamente 16.000 atmósferas (1,6 GPa). Su eléctrica resistividad aumenta diez veces durante la compresión a 39.000 atmósferas (3,9 GPa), pero luego cae a alrededor de 10% de su resistividad a temperatura ambiente a aproximadamente 40.000 atm (4,0 GPa).
En contraste con los otros metales de las tierras raras, que suelen tener antiferromagnético y / o propiedades ferromagnéticas a bajas temperaturas , iterbio es paramagnético a temperaturas superiores a 1,0 kelvin . Sin embargo, el alótropo alfa es diamagnético. Con un punto de fusión de 824 ° C y un punto de ebullición de 1196 ° C, iterbio tiene el rango de líquido más pequeño de todos los metales.
Iterbio tiene una densidad de 6,973 g / cm 3, que es significativamente menor que los de los lantánidos vecinos, tulio (9,32 g / cm 3) y lutecio (9,841 g / cm 3). Sus puntos de fusión y ebullición también son significativamente más bajos que los de tulio y lutecio. Esto es debido a la configuración cerrada-capa de electrones de iterbio ([Xe] 4f 14 6s 2), que hace que sólo los dos electrones 6s estén disponibles para enlace metálico (en contraste con los otros lantánidos donde tres electrones están disponibles) y reduce de iterbio radio metálico.
Propiedades químicas
Metales iterbio empaña lentamente en el aire. Iterbio finamente dispersa oxida fácilmente en el aire y bajo oxígeno. Las mezclas de polvo con iterbio politetrafluoroetileno o hexacloroetano arde con una llama verde esmeralda luminoso. Iterbio reacciona con hidrógeno para formar varios no estequiométrica hidruros. Iterbio se disuelve lentamente en el agua, pero rápidamente en ácidos, liberando gas de hidrógeno.
Iterbio es bastante electropositivo, y reacciona lentamente con el agua fría y bastante rápidamente con agua caliente para formar iterbio (III) de hidróxido de:
- 2 Yb (s) + 6 H2O (l) → 2 Yb (OH) 3 (ac) + 3 H 2 (g)
Iterbio reacciona con todos los halógenos :
- 2 Yb (s) + 3 F 2 (g) → 2 YBF 3 (s) [blanco]
- 2 Yb (s) + 3 Cl 2 (g) → 2 YbCl 3 (s) [blanco]
- 2 Yb (s) + 3 Br 2 (g) → 2 YbBr 3 (s) [blanco]
- 2 Yb (s) + 3 I 2 (g) → 2 YBI 3 (s) [blanco]
El ion de iterbio (III) absorbe la luz en el gama de longitudes de onda del infrarrojo cercano, pero no en la luz visible , por lo que el mineral iterbia, Yb 2 O 3, es de color blanco y las sales de iterbio son también incoloro. Iterbio se disuelve fácilmente en diluida de ácido sulfúrico para formar soluciones que contienen los Yb (III) iones incoloros, que existen como complejos de nonahidrato:
- 2 Yb (s) + 3 H 2 SO 4 (ac) → 2 [Yb (H 2 O) 9] 3+ (ac) + 3 SO 2-
4 (aq) + 3 H 2 (g)
Yb (II) vs. Yb (III)
Aunque por lo general trivalente, iterbio forma fácilmente compuestos divalentes. Este comportamiento es inusual para la mayoría de los lantánidos , que forman casi exclusivamente compuestos con un estado de oxidación de +3. El estado 2 tiene una valencia configuración electrónica de 4 f 14 porque el f -Shell completamente lleno da más estabilidad. El iterbio amarillo-verde de iones (II) es un muy fuerte agente reductor y se descompone el agua, liberando hidrógeno gas, y por lo tanto sólo el iterbio incoloro (III) se produce en ion solución acuosa. samario y tulio también se comportan de esta manera en el estado 2, pero europio (II) es estable en solución acuosa. Iterbio (II) se comporta de manera similar a europio (II) y los metales alcalinotérreos, disolviendo en amoníaco para formar azul sales electride.
Isótopos
Iterbio natural se compone de siete estables isótopos : 168 Yb, 170 Yb, 171 Yb, 172 Yb, 173 Yb, 174 Yb, y 176 Yb, con 174 Yb es el isótopo más abundante, al 31,8% de la abundancia natural). 27 Se han observado radioisótopos, con los más estables siendo 169 Yb con una vida media de 32,0 días, 175 Yb, con una vida media de 4,18 días, y 166 Yb, con una vida media de 56,7 horas. Toda su restante isótopos radiactivos tienen vidas medias que son menos de dos horas y la mayoría de ellos tienen vidas medias son menos de 20 minutos. Iterbio también tiene 12 estados de la meta, con el ser más estable 169m Yb (t ½ 46 segundos).
Los isótopos del rango de iterbio en peso atómico de 147.9674 unidad de masa atómica (u) para 148 Yb a 180,9562 u por 181 Yb. El primario modo de desintegración de isótopos de iterbio más ligero que el isótopo estable más abundante, 174 Yb, es captura de electrones, y el modo de decaimiento primario para aquellos más pesados que el 174 Yb es desintegración beta. El primario productos de desintegración de isótopos de iterbio más ligero que el 174 Yb son tulio isótopos, y los productos de desintegración de isótopos primarios iterbio con más pesado que el 174 Yb son lutecio isótopos.
Aparición

Iterbio se encuentra con otra elementos de tierras raras en varios raros minerales . Se recupera más a menudo comercialmente de arena monacita (0,03% de iterbio). El elemento también se encuentra en euxenite y xenotima. Las principales zonas mineras son de China , la de Estados Unidos , Brasil , India , Sri Lanka y Australia ; y las reservas de iterbio se estiman en un millón toneladas. Iterbio es normalmente difícil de separar de otras tierras raras, pero de intercambio iónico y técnicas de extracción de solventes desarrolladas a mediados y finales del siglo 20 han simplificado separación. Conocidos compuestos de iterbio son raros y aún no han sido bien caracterizados. La abundancia de iterbio en la corteza terrestre es de aproximadamente 3 mg / kg.
Como un lantánido de número par, de acuerdo con el Regla Oddo-Harkins, iterbio es significativamente más abundantes que sus vecinos inmediatos, tulio y lutecio , que se producen en el mismo concentrado a niveles de aproximadamente 0,5% cada uno. La producción mundial de iterbio es sólo alrededor de 50 toneladas por año, lo que refleja el hecho de que iterbio tiene pocos usos comerciales. Rastros microscópicos de iterbio se utilizan como una dopante en el Yb: YAG, un láser de estado sólido en el que iterbio es el elemento que sufre la emisión estimulada de radiación electromagnética .
Producción
Es algo difícil de iterbio separado de otros lantánidos debido a sus propiedades similares. Como resultado, el proceso es algo largo. En primer lugar, los minerales tales como monacita o xenotime se disuelven en diversos ácidos, tales como ácido sulfúrico . Iterbio puede entonces ser separado de otros lantánidos por intercambio iónico, como puede otros lantánidos. La solución se aplica luego a una resina, que diferentes lantánidos bonos en diferentes materias. Este se disuelve a continuación, utilizando agentes complejantes, y debido a los diferentes tipos de unión exhibida por los diferentes lantánidos, es posible aislar los compuestos.
Iterbio se separa de otras tierras raras ya sea por intercambio iónico o por reducción con amalgama de sodio. En este último método, una solución ácida tamponada de tierras raras trivalentes se trata con aleación de sodio-mercurio fundido, lo que reduce y se disuelve Yb 3+. La aleación se trata con ácido clorhídrico. El metal se extrae de la solución como oxalato y convierte en óxido por calentamiento. El óxido se reduce a metal calentando con lantano , aluminio , cerio o circonio en alto vacío. El metal se purifica por sublimación y se recoge sobre una placa condensada.
Compuestos

El comportamiento químico de iterbio es similar a la del resto de los lantánidos . La mayoría de los compuestos de iterbio se encuentran en el estado de oxidación +3 y sus sales en este estado de oxidación son casi incoloro. Como europio , samario , y tulio , los trihaluros de iterbio se pueden reducir mediante hidrógeno , zinc polvo, o por la adición de iterbio metálico a los dihaluros. El estado de oxidación +2 sólo ocurre en compuestos sólidos y reacciona de alguna manera similar a los de metales alcalinos compuestos; por ejemplo, de iterbio (II) óxido (YBO) muestra la misma estructura que óxido de calcio (CaO).
Haluros
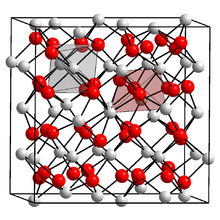
Formas de iterbio ambos dihaluros y trihaluros con la halógenos flúor , cloro , bromo , y yodo . Los dihaluros son susceptibles a la oxidación a los trihaluros a temperatura ambiente y desproporcionado con respecto a los trihaluros y de iterbio metálico a alta temperatura:
Algunos haluros de iterbio se utilizan como reactivos en síntesis orgánica. Por ejemplo, iterbio (III) cloruro (YbCl 3) es una Ácido de Lewis y se puede utilizar como un catalizador en el aldólica y Reacciones de Diels-Alder. Iterbio (II) yoduro (YBI 2) se puede utilizar, como samario (II) yoduro, como una agente reductor para reacciones de acoplamiento. Iterbio (III) de fluoruro (ybf 3) se utiliza como un material inerte y no tóxico llenado de dientes, ya que libera de forma continua iones de flúor, lo que es bueno para la salud dental, y también es una buena De rayos X agente de contraste.
Óxidos
Iterbio reacciona con el oxígeno para formar iterbio (III) óxido (Yb 2 O 3), que cristaliza en la estructura de "tierras raras de tipo C sesquióxido" que se relaciona con la estructura fluorita con una cuarta parte de los aniones retirados, lo que lleva a los átomos de iterbio en dos seis coordinar ambientes diferentes (no-octaédricos). Iterbio (III) de óxido puede ser reducido a iterbio (II) óxido (YBO) con iterbio elemental, que cristaliza en la misma estructura que el cloruro de sodio .
Historia

Iterbio era descubierto por el químico suizo Jean Charles de Marignac Galissard en el año 1878. Si bien el examen de muestras de gadolinita, Marignac encontró un nuevo componente en la tierra entonces conocida como erbia, y él lo nombró iterbia, para Ytterby, el sueco pueblo cerca de donde se encontró el nuevo componente de erbio. Marignac sospechaba que iterbia era un compuesto de un elemento nuevo que él llamó "iterbio".
En 1907, el químico francés Georges Urbain separó iterbia de Marignac en dos componentes: neoiterbia y lutecia. Neoiterbia más adelante se conocería como el elemento iterbio y lutecia más tarde sería conocido como el elemento lutecio . El químico austríaco Carl Auer von Welsbach aislado independiente estos elementos de iterbia o menos al mismo tiempo, pero él los llamaba aldebaranium y casiopeo; el químico estadounidense James Charles también aislado de forma independiente estos elementos en aproximadamente el mismo tiempo. Urbain y Welsbach se acusaron mutuamente de la publicación de resultados sobre la base de la otra parte. La Comisión de Masa Atómica, que consiste en Frank Wigglesworth Clarke, Wilhelm Ostwald, y Georges Urbain, que entonces era responsable de la atribución de nuevos nombres de elementos, se establecieron en la controversia en 1909 al conceder prioridad a Urbain y la adopción de sus nombres como las oficiales, basadas en el hecho de que la separación de lutecio del iterbio de Marignac fue primero descrito por Urbain; después fueron reconocidos nombres de Urbain, neoytterbium se revirtió a iterbio.
Las propiedades químicas y físicas de iterbio no se pudo determinar con precisión hasta 1953, cuando el primer metal iterbio casi puro fue producido por el uso procesos de intercambio iónico. El precio de iterbio se mantuvo relativamente estable entre 1953 y 1998 en cerca de US $ 1.000 / kg.
Aplicaciones
Dopaje de acero inoxidable
Iterbio también se puede utilizar como una dopante para ayudar a mejorar el refinamiento del grano, resistencia y otras propiedades mecánicas de acero inoxidable. Algunos de iterbio aleaciones rara vez han sido utilizados en odontología.
Otros
Metales iterbio aumenta su resistencia eléctrica cuando se somete a altas tensiones. Esta propiedad se utiliza en los indicadores de estrés para controlar las deformaciones del terreno de terremotos y explosiones.
Las ondas de luz vibran más rápido que las microondas, y por lo tanto relojes ópticos pueden ser más precisa que la de cesio relojes atómicos. El Physikalisch-Technische Bundesanstalt (PTB) está trabajando en varios relojes ópticos tales. El modelo con un ion de iterbio único capturado en una trampa de iones es muy precisa. El reloj óptico basado en él es exacta a 17 dígitos después del punto decimal.
Actualmente, iterbio está siendo investigado como un posible sustituto de magnesio en las cargas útiles de pirotecnia de alta densidad para cinemática bengalas señuelo infrarrojos. Como iterbio (III) de óxido tiene una significativamente mayor emisividad en el rango infrarrojo de óxido de magnesio, una mayor intensidad radiante se obtiene con cargas útiles a base de iterbio en comparación con los comúnmente basado en de magnesio / Teflon / Viton (MTV).
Precauciones
Aunque iterbio es bastante estable químicamente, se almacena en recipientes herméticos y en una atmósfera inerte, tal como una caja seca llena de nitrógeno para proteger el metal de aire y humedad. Todos los compuestos de iterbio se tratan como altamente tóxico, aunque los estudios iniciales parecen indicar que el peligro es mínimo. Compuestos de iterbio son, sin embargo, sabe que causan irritación en la piel humana y los ojos, y algunos podrían ser teratogénico. Polvo de iterbio metálico Pueden inflamarse espontáneamente, y los humos resultantes son peligrosos. Incendios Iterbio no puede extinguirse usando agua, y sólo la clase química seca D extintores de incendios pueden extinguir los incendios.


