
Atome
Renseignements généraux
Enfants SOS bénévoles ont aidé à choisir des articles et faites autre matériel de programme Parrainer un enfant de faire une réelle différence.
| atome d'hélium | ||||||||
|---|---|---|---|---|---|---|---|---|
 | ||||||||
| Une illustration de l' hélium atome, représentant le noyau (rose) et le la répartition des nuages d'électrons (noir). Le noyau (en haut à droite) est en réalité à symétrie sphérique, bien que pour les noyaux plus complexes ce ne est pas toujours le cas. La barre noire est une ångström, égale à 10 -10 m ou 100 000 fm. | ||||||||
| Classification | ||||||||
| ||||||||
| Propriétés | ||||||||
|
Un atome est la plus petite particule qui comprend un élément chimique . Un atome est constitué d'un nuage d'électrons dense qui entoure un noyau . Ce noyau contient positivement chargé protons électriquement neutres et les neutrons , alors que le nuage environnant est constitué d'chargés négativement électrons . Lorsque le nombre de protons dans le noyau est égal au nombre d'électrons, l'atome est électriquement neutre; sinon il est un ion et possède une charge nette positive ou négative. Un atome est classé en fonction de son nombre de protons et de neutrons: le nombre de protons détermine l' élément chimique et le nombre de neutrons détermine l' isotope de cet élément. Le concept de l'atome comme un élément indivisible de la matière a été proposée par les premiers indiens et grecs philosophes. Dans les 17e et 18e siècles, chimistes ont fourni une base physique pour cette idée en montrant que certaines substances ne pouvaient pas être décomposées par des méthodes chimiques. Au cours de la fin du 19e et le début du 20e siècles, les physiciens ont découvert des composants et la structure subatomiques intérieur de l'atome, démontrant ainsi que le "atome" ne était pas indivisible. Les principes de la mécanique quantique , y compris la dualité onde-particule de la matière, ont été utilisés avec succès modéliser l'atome.
Par rapport à l'expérience quotidienne, les atomes sont des objets minuscules avec des masses proportionnellement minuscules qui ne peuvent être observés individuellement à l'aide d'instruments spéciaux comme le microscope à effet tunnel. Plus de 99,9% de la masse d'un atome est concentrée dans le noyau, avec les protons et les neutrons ayant environ masse égale. Dans atomes avec trop ou trop peu de neutrons par rapport au nombre de protons, le noyau est instable et sujet à désintégration radioactive. Les électrons entourant le noyau occupent un ensemble de stable les niveaux d'énergie, ou orbitales, et ils peuvent transition entre ces états par l'absorption ou l'émission de photons qui correspondent aux différences d'énergie entre les niveaux. Les électrons déterminent les propriétés chimiques d'un élément, et influencent fortement d'un atome magnétique propriétés.
Histoire
Le concept selon lequel la matière est composée de unités discrètes et ne peut pas être divisé en quantités minuscules arbitraire a été autour depuis des millénaires, mais ces idées ont été fondée en résumé, le raisonnement philosophique plutôt que l'expérimentation et l'observation empirique. La nature des atomes dans la philosophie varié considérablement au fil du temps et entre les cultures et les écoles, et les éléments spirituels souvent eu. Néanmoins, l'idée de base de l'atome a été adopté par les scientifiques des milliers d'années plus tard, car il élégamment expliqué nouvelles découvertes dans le domaine de la chimie.
Les premières références à la notion d'atomes remontent à l'Inde ancienne au 6ème siècle BCE. Le Nyaya et Écoles Vaisheshika développés élaborée théories de comment les atomes combinés en plusieurs objets complexes (la première fois en paires, puis trios de paires). Les références à des atomes dans l'Occident un siècle plus tard émergé à partir Leucippe dont les étudiants, Démocrite, systématisé ses vues. Dans environ 450 BCE, Démocrite a inventé les átomos terme ( grec de ἄτομος), ce qui signifie quelque chose "insécable» ou «la plus petite particule indivisible de la matière", ce est à dire, qui ne peut pas être divisé. Bien que les concepts indiens et grecs de l'atome étaient fondées uniquement sur la philosophie, la science moderne a conservé le nom inventé par Démocrite.
Des progrès dans la compréhension des atomes ne se produit pas jusqu'à ce que la science de la chimie a commencé à se développer. En 1661, la physicien Robert Boyle publié Le sceptique Chymist dans lequel il affirmait que la matière est composée de différentes combinaisons de différents «corpuscules» ou atomes, plutôt que le éléments classiques de l'air, la terre, le feu et l'eau. En 1789, l'élément de terme a été défini par le noble français et chercheur scientifique Antoine Lavoisier désigne les substances de base qui ne pouvait pas être décomposées par les méthodes de la chimie.
En 1803, l'Anglais John Dalton , un instructeur et philosophe de la nature, a utilisé le concept d'atomes d'expliquer pourquoi éléments toujours réagi dans un rapport de petits nombres entiers -la loi de plusieurs proportions, et pourquoi certains gaz dissous dans l'eau de mieux que d'autres. Il a proposé que chaque élément est constitué d'atomes d'un seul type unique, et que ces atomes peuvent adhérer les unes aux autres, pour former des composés chimiques.
Une validation supplémentaire de la théorie des particules (et par extension théorie atomique) se est produite en 1827 lorsque botaniste Robert Brown a utilisé un microscope pour examiner les grains de poussière flottant dans l'eau et a découvert qu'ils se déplaçaient de manière erratique-un phénomène qui est devenu connu comme " Mouvement brownien ». J. Desaulx suggéré en 1877 que le phénomène a été causé par le mouvement thermique des molécules d'eau, et en 1905 Albert Einstein a produit la première analyse mathématique de la motion, confirmant ainsi l'hypothèse.
Le physicien JJ Thomson , à travers son travail sur rayons cathodiques en 1897, a découvert l'électron et sa nature subatomique, qui a détruit la notion d'atomes comme étant des unités indivisibles. Thomson pense que les électrons ont été distribués dans tout l'atome, avec leur charge équilibrée par la présence d'une mer uniforme de charge positive (la modèle de plum-pudding).
Cependant, en 1909, les chercheurs sous la direction du physicien Ernest Rutherford bombardés une feuille de papier d'or avec des ions d'hélium et ont découvert qu'un petit pourcentage ont été dévié par beaucoup plus que ce qui était prédit angles en utilisant la proposition de Thomson. Rutherford a interprété la expérience de feuille d'or comme signifiant que la charge positive de l'atome et la plupart de sa masse a été concentré dans un noyau au centre de l'atome (le Modèle de Rutherford), avec les électrons en orbite autour il comme les planètes autour d'un soleil. Ions d'hélium chargés positivement passant près de ce noyau dense seraient alors déviés angles loin à beaucoup plus nettes.
En expérimentant avec les produits de désintégration radioactive, en 1913 radiochimiste Frederick Soddy découvert qu'il semblait y avoir plus d'un type d'atome à chaque position sur le tableau périodique. Le terme isotope a été inventé par Margaret Todd comme un nom adapté à différents atomes qui appartiennent à un même élément. JJ Thomson a créé une technique de séparation des types d'atomes grâce à son travail sur les gaz ionisés, qui a ensuite conduit à la découverte des isotopes stables.
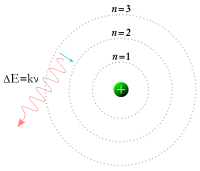
Pendant ce temps, en 1913, le physicien Niels Bohr a révisé le modèle de Rutherford en suggérant que les électrons ont été confinés dans des orbites clairement définis, et pourraient sauter entre eux, mais ne pouvaient pas librement spirale vers l'intérieur ou vers l'extérieur dans des états intermédiaires. Un électron doit absorber ou émettre des quantités spécifiques d'énergie de transition entre ces orbites fixes. Lorsque la lumière à partir d'un matériau chauffé est passé à travers un prisme, il produit un multicolore spectre. L'apparition de fixe lignes dans ce spectre a été expliqué avec succès par les transitions orbitales.
En 1926, Erwin Schrödinger, en utilisant 1924 proposition de Louis de Broglie que les particules se comportent dans une certaine mesure comme des vagues, a développé un modèle mathématique de l'atome qui décrit les électrons en trois dimensions les formes d'onde, au lieu de particules ponctuelles. Une conséquence de l'utilisation de formes d'onde pour désigner des électrons est qu'il est mathématiquement impossible d'obtenir des valeurs précises à la fois pour la position et impulsion d'une particule en même temps; ce est devenu connu comme le principe d'incertitude. Dans ce concept, pour chaque mesure d'une position on ne pouvait obtenir une gamme de valeurs probables de l'élan, et vice versa. Bien que ce modèle était difficile à conceptualiser visuellement, il était en mesure d'expliquer les observations du comportement atomique que les modèles précédents ne pouvait pas, comme certains structurelle et des motifs d'atomes spectrales supérieures à hydrogène. Ainsi, le modèle planétaire de l'atome a été écartée en faveur de celui qui décrit zones orbitales autour du noyau où un électron donné est le plus susceptible d'exister.

Le développement de la spectrométrie de masse a permis à la masse exacte des atomes à mesurer. L'appareil utilise un aimant de plier la trajectoire d'un faisceau d'ions, et la quantité de déviation est déterminée par le rapport entre la masse d'un atome de sa charge. Le chimiste Francis William Aston utilisé cet instrument pour démontrer que les isotopes ont des masses différentes. La masse de ces isotopes variation des montants entiers, appelé toute règle de numéro. L'explication de ces différents isotopes atomiques attendait la découverte du neutron , une particule neutre chargée d'une masse similaire à protons , par le physicien James Chadwick en 1932. isotopes ont ensuite expliqué que des éléments avec le même nombre de protons, mais un nombre différent de neutrons dans le noyau.
Dans les années 1950, le développement de l'amélioration un accélérateur de particules et détecteurs de particules a permis aux scientifiques d'étudier les impacts des atomes en mouvement à haute énergie. Neutrons et les protons ont été jugés hadrons, ou composites de particules plus petites appelées quarks . Les modèles standard de la physique nucléaire ont été développés qui expliquait avec succès les propriétés du noyau en fonction de ces particules sub-atomiques et les forces qui régissent leurs interactions.
Autour de 1985, Steven Chu et collègues à Bell Labs a développé une technique pour abaisser les températures d'atomes à l'aide de lasers . Dans la même année, une équipe dirigée par William D. Phillips a réussi à contenir des atomes de sodium dans un piège magnétique. La combinaison de ces deux techniques et une méthode basée sur la effet Doppler, développé par Claude Cohen-Tannoudji et son groupe, permet aux petits nombres d'atomes à refroidir à plusieurs microkelvin . Ceci permet aux atomes à étudier avec une grande précision, et par la suite conduit à la découverte de Condensation de Bose-Einstein.
Historiquement, les atomes simples ont été trop petite pour les applications scientifiques. Récemment, des dispositifs ont été construits qui utilisent un seul atome de métal organique relié par ligands pour construire un transistor à électron unique. Des expériences ont été menées par le piégeage et le ralentissement des atomes uniques en utilisant refroidissement par laser dans une cavité d'acquérir une meilleure compréhension de la physique de la matière.
Composants
Particules subatomiques
Bien que le mot atome origine noté une particule qui ne peut pas être coupé en particules plus petites, dans l'usage scientifique moderne de l'atome est composé de divers particules subatomiques. Les particules constitutives sont constitués d'un atome de l' électron , le proton et par des atomes autres que l'hydrogène-1 , le neutron .
L'électron est de loin la moins massive de ces particules à 9,11 × 10 -28 g, avec un négatif charge électrique et une taille qui est trop petite pour être mesurée en utilisant des techniques disponibles. Les protons ont une charge positive et une masse 1836 fois celle de l'électron, à 1,6726 × 10 -24 g, même si cela peut être réduite par des changements à l'atomique énergie de liaison. Les neutrons ne ont aucune charge électrique et avoir une masse libre de 1839 fois la masse des électrons, ou 1,6929 × 10 -24 g. Neutrons et les protons ont des dimensions-de l'ordre de 2,5 × 10 -15 comparables m-bien que la «surface» de ces particules ne est pas nettement définie.
Dans le modèle standard de la physique, les deux protons et les neutrons sont constitués de particules élémentaires appelées quarks . Le quark est un type de fermion, l'un des deux constituants de base de la matière, l'autre étant le lepton, dont l'électron est un exemple. Il ya six types de quarks, et chacun a une charge électrique fractionnaire de +2/3 ou -1/3 soit. Les protons sont composés de deux quarks up et une quark down, tout un neutron se compose d'un quark et deux quarks down. Cette distinction représente la différence de masse et la charge entre les deux particules. Les quarks sont maintenus ensemble par le force nucléaire forte, qui est médiée par gluons. Le gluon est un membre de la famille de bosons, qui sont des particules élémentaires qui interviennent physiques forces .
Noyau
Toutes les protons et les neutrons liés à un atome forment un petit noyau atomique , et sont collectivement appelés nucléons. Le rayon du noyau est approximativement égale à ![\ Begin {} smallmatrix 1,07 \ cdot \ sqrt [3] {A} \ end {} smallmatrix](../../images/170/17089.png) fm, où A est le nombre total de nucléons. Cela est beaucoup plus petit que le rayon de l'atome, qui est de l'ordre de 10 5 fm. Les nucléons sont liés ensemble par un potentiel attractif à courte portée appelée force forte résiduelle. À des distances inférieures à 2,5 fm, cette force est beaucoup plus puissante que la force électrostatique qui provoque chargé positivement protons se repoussent mutuellement.
fm, où A est le nombre total de nucléons. Cela est beaucoup plus petit que le rayon de l'atome, qui est de l'ordre de 10 5 fm. Les nucléons sont liés ensemble par un potentiel attractif à courte portée appelée force forte résiduelle. À des distances inférieures à 2,5 fm, cette force est beaucoup plus puissante que la force électrostatique qui provoque chargé positivement protons se repoussent mutuellement.
Les atomes d'un même élément possèdent le même nombre de protons, appelé le numéro atomique . Au sein d'un seul élément, le nombre de neutrons peut varier, la détermination de l' isotope de cet élément. Le nombre de neutrons par rapport aux protons détermine la stabilité du noyau, avec certains isotopes subir désintégration radioactive.
Le neutron et le proton sont les différents types de fermions. Le Principe d'exclusion de Pauli est une mécanique quantique effet qui interdit fermions identiques (comme plusieurs protons) d'occuper le même état quantique en même temps. Ainsi tous les protons dans le noyau doit occuper un état différent, avec son propre niveau d'énergie, et la même règle se applique à tous les neutrons. (Cette interdiction ne se applique pas à un proton et le neutron occupant le même état quantique.)
Un noyau qui a un nombre différent de neutrons que de protons peut potentiellement tomber à un état d'énergie inférieure par une désintégration radioactive qui provoque le nombre de protons et de neutrons pour mieux l'adapter. En conséquence, les atomes avec nombre de protons et de neutrons correspondant sont plus stables contre la carie. Cependant, avec l'augmentation de nombre atomique, la répulsion mutuelle des protons exige une proportion croissante de neutrons pour maintenir la stabilité du noyau, ce qui modifie légèrement la tendance d'un nombre égal de protons à neutrons.
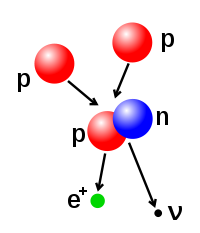
Le nombre de protons et de neutrons du noyau atomique peut être modifié, même si cela peut nécessiter de très hautes énergies en raison de la force forte. La fusion nucléaire se produit lorsque plusieurs particules atomiques se joignent pour former un noyau plus lourd, tel que par la collision de deux noyaux énergique. Au cœur du Soleil, protons exigent énergies de 3-10 keV à surmonter leur répulsion mutuelle-le Coulomb obstacle et fusionnent en un seul noyau. La fission nucléaire est le processus inverse, provoquant un noyau de se scinder en deux noyaux plus petits-général par décroissance radioactive. Le noyau peut aussi être modifié par le bombardement par des particules subatomiques haute énergie ou des photons. Dans de tels procédés qui modifient le nombre de protons dans le noyau, l'atome devient un atome d'un élément chimique différent.
La masse du noyau suivant une réaction de fusion est inférieur à la somme des masses des particules séparées. La différence entre ces deux valeurs est émise sous forme d'énergie, tel que décrit par Albert Einstein de l ' formule d'équivalence masse-énergie, E = mc², où m est la perte de masse et c la vitesse de la lumière . Ce déficit est le énergie du noyau de liaison.
La fusion de deux noyaux qui ont des numéros atomiques inférieurs de fer et de nickel est un procédé exothermique qui libère plus d'énergie que nécessaire pour les réunir. Ce est ce processus libérant de l'énergie qui fait en fusion nucléaire étoiles une réaction auto-entretenue. Pour les noyaux plus lourds, l'énergie de liaison totale commence à diminuer. Cela signifie que les processus de fusion avec des noyaux atomiques qui ont des numéros plus élevés est un processus endothermique. Ces noyaux plus massives ne peuvent pas subir une réaction de fusion de production d'énergie qui peut soutenir la équilibre hydrostatique d'une étoile.
Electron cloud
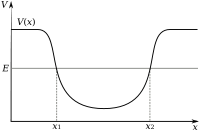
Les électrons dans un atome sont attirés par les protons dans le noyau par la force électromagnétique . Cette force oblige les électrons à l'intérieur d'un électrostatique puits de potentiel entourant le noyau plus petit, ce qui signifie que d'une source externe d'énergie est nécessaire pour que les électrons de se échapper. Le plus proche est un électron dans le noyau, plus la force d'attraction. Ainsi électrons liés à proximité du centre du puits de potentiel nécessitent plus d'énergie pour échapper à ceux à l'extérieur.
Les électrons, comme les autres particules, ont des propriétés à la fois une particule et une onde. Le nuage d'électrons est une région à l'intérieur du puits de potentiel où chaque électron forme un type de tridimensionnel une onde debout forme d'onde qui ne bouge pas par rapport au noyau. Ce comportement est défini par une orbitale atomique, une fonction mathématique qui caractérise la probabilité qu'un électron semblera être dans un emplacement particulier lorsque sa position est mesurée. Seule une discrète (ou quantifié) ensemble de ces orbitales existe autour du noyau, que d'autres modèles possibles d'ondes se décomposeront rapidement en une forme plus stable. Orbitales peuvent avoir une ou plusieurs structures cycliques ou noeuds, et ils diffèrent l'une de l'autre en taille, forme et orientation.

Chacune correspond orbitales atomiques à un particulier niveau de l'électron d'énergie. L'électron peut changer son état à un niveau d'énergie plus élevé par absorption d'un photon avec une énergie suffisante pour stimuler dans le nouvel état quantique. De même, par l'intermédiaire émission spontanée, un électron dans un état d'énergie supérieur peut tomber à un état d'énergie plus faible tout en rayonnant l'énergie excédentaire comme un photon. Ces valeurs d'énergie caractéristiques, définies par les différences entre les énergies des états quantiques, sont responsables de lignes spectrales atomiques .
La quantité d'énergie nécessaire pour supprimer ou ajouter un électron (la électronique de l'énergie de liaison) est beaucoup moins que le l'énergie de liaison des nucléons. Par exemple, il nécessite seulement 13,6 eV pour dépouiller un état fondamental électronique à partir d'un atome d'hydrogène. Atomes sont électriquement neutres si elles ont un nombre égal de protons et d'électrons. Atomes qui ont un déficit ou un excédent d'électrons sont appelés ions . Les électrons qui sont les plus éloignés du noyau peuvent être transférés à d'autres atomes proximité ou partagés entre les atomes. Par ce mécanisme, les atomes sont capables de se lier à des molécules et d'autres types de composés chimiques tels que ionique et réseau covalente cristaux.
Propriétés
Par définition, tous les deux atomes avec un nombre identique de protons dans leur noyau appartiennent au même élément chimique . Les atomes ayant le même nombre de protons mais un nombre différent de neutrons sont différents isotopes du même élément. Les atomes d'hydrogène, par exemple, ont toujours un seul proton, mais isotopes existent sans neutrons ( hydrogène-1, parfois appelé protium, de loin la forme la plus courante), un neutron ( deutérium) et deux neutrons ( tritium). Les éléments connus forment une plage continue de numéros atomiques de l'hydrogène avec un proton à l'élément 118-proton ununoctium . Tous les isotopes connus d'éléments ayant un numéro atomique supérieur à 82 sont radioactifs.
Masse
Étant donné que la grande majorité de la masse d'un atome provient des protons et des neutrons, le nombre total de ces particules dans un atome est appelé le nombre de masse. Le masse d'un atome au repos est souvent exprimée en utilisant le unité unifiée de masse atomique (u), qui est également appelé Dalton (Da). Cet appareil est défini comme un douzième de la masse d'un atome neutre exempt de qui est d'environ 1,66 × 10 -24 g de carbone-12,. hydrogène-1, le plus léger isotope de l'hydrogène et l'atome avec la masse la plus basse, a une masse atomique de 1,007825 u. Un atome a une masse approximativement égale à la fois de nombre de masse de l'unité de masse atomique. Le plus lourd atome stable est le plomb-208, avec une masse de 207,9766521 u.
Étant donné que même les atomes les plus massives sont beaucoup trop léger pour travailler avec directement, les chimistes utilisent plutôt l'unité de taupes. La taupe est défini de telle sorte que d'une mole d'un élément aura toujours le même nombre d'atomes (environ 6,022 x 10 23 ). Ce nombre a été choisi de sorte que si un élément a une masse atomique de 1 u, une mole d'atomes de cet élément aura une masse de 1 g. de carbone , par exemple, a une masse atomique de 12 u, de sorte qu'une mole de carbone atomes pèse 12 g.
Taille
Atomes ne ont pas de limite extérieure bien définie, de sorte que les dimensions sont généralement décrits en termes de distances entre deux noyaux lorsque les deux atomes sont assemblés dans une liaison chimique . Le rayon varie en fonction de l'emplacement d'un atome atomique sur la carte, le type de liaison chimique, le nombre d'atomes voisins ( nombre de coordination) et une mécanique quantique propriété connue comme essorage. Sur le tableau périodique des éléments, la taille de l'atome a tendance à augmenter lorsque l'on descend colonnes, mais diminuer lorsque se déplaçant à travers les lignes (de gauche à droite). Par conséquent, le plus petit atome est de l'hélium avec un rayon de 32 h, tandis que l'un des plus importants est le césium à 225 h. Ces dimensions sont des milliers de fois plus petites que les longueurs d'onde de la lumière (400-700 nm) de sorte qu'ils ne peuvent pas être visualisés à l'aide d'un microscope optique . Cependant, les atomes individuels peuvent être observés à l'aide d'un microscope à effet tunnel.
Quelques exemples montreront la minutie de l'atome. Un cheveu humain typique est d'environ 1 million d'atomes de carbone dans la largeur. Une seule goutte d'eau contient environ 2 sextillion (2 × 10 21 atomes d'oxygène), et deux fois le nombre d'atomes d'hydrogène. Un seul carats de diamant avec une masse de 0,2 g contient environ 10 sextillion atomes de carbone . Si une pomme a été agrandie à la taille de la Terre, alors les atomes dans la pomme seraient approximativement de la taille de la pomme d'origine.
La décroissance radioactive
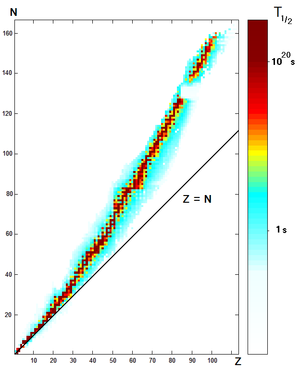
Chaque élément a une ou plusieurs isotopes qui ont des noyaux instables qui sont soumis à la désintégration radioactive, ce qui provoque le noyau pour émettre des particules ou des rayonnements électromagnétiques. La radioactivité peut se produire lorsque le rayon d'un noyau est grand par rapport au rayon de la force forte, qui ne agit que sur des distances de l'ordre de 1 fm.
Il existe trois principales formes de désintégration radioactive:
- Les désintégrations alpha est provoquée lorsque le noyau émet une particule alpha, qui est un noyau d'hélium constitué de deux protons et deux neutrons. Le résultat de l'émission est un nouvel élément avec un faible numéro atomique .
- Désintégration bêta est régie par la force faible, et résulte d'une transformation d'un neutron en proton, ou un proton en neutron. La première se accompagne de l'émission d'un électron et un antineutrino, tandis que la deuxième provoque l'émission d'un un positron et neutrino. Les émissions d'électrons ou des positrons sont appelés particules bêta. Désintégration bêta augmente ou diminue le nombre atomique du noyau par une.
- Gamma décroissance résulte d'un changement dans le niveau d'énergie du noyau à un état bas, ce qui entraîne l'émission d'un rayonnement électromagnétique. Ceci peut se produire suite à l'émission d'un alpha ou une particule bêta à partir de la désintégration radioactive.
Chaque isotope radioactif a une période de temps de décroissance, la caractéristique de demi-vie , ce est-déterminée par la quantité de temps nécessaire pour que la moitié d'un échantillon à la pourriture. Il se agit d'un processus de décroissance exponentielle qui diminue progressivement la proportion des isotopes restants de 50% toutes les demi-vie. Ainsi après deux demi-vies ont passé seulement 25% de l'isotope sera présent, et ainsi de suite.
Moment magnétique
Les particules élémentaires possèdent une propriété mécanique quantique intrinsèque connu sous le nom essorage. Ce est analogue à la vitesse angulaire d'un objet qui tourne autour de son centre de masse , bien que strictement parlant ces particules sont soupçonnés d'être ponctuel et ne peuvent pas être dites rotation. Spin est mesuré en unités de la réduction La constante de Planck ( 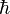 ), Avec les électrons, les protons et les neutrons ayant tous de spin ½
), Avec les électrons, les protons et les neutrons ayant tous de spin ½ 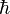 , Ou "spin-½". Dans un atome, les électrons en mouvement autour du noyau possèdent moment angulaire orbital en plus de leur rotation, tandis que le noyau lui-même possède moment cinétique en raison de son spin nucléaire.
, Ou "spin-½". Dans un atome, les électrons en mouvement autour du noyau possèdent moment angulaire orbital en plus de leur rotation, tandis que le noyau lui-même possède moment cinétique en raison de son spin nucléaire.
Le champ magnétique produit par un atome de son instant-est magnétique déterminée par ces diverses formes de moment angulaire, tout comme un objet chargé rotation classique produit un champ magnétique. Toutefois, la contribution la plus dominante vient de rotation. En raison de la nature des électrons à obéir à la Principe d'exclusion de Pauli, dans lequel pas deux électrons se trouvent dans le même état quantique, les électrons liés paire avec l'autre, avec un membre de chaque paire dans un état de spin et l'autre dans le sens opposé, ralentit Etat. Ainsi, ces tours se annulent mutuellement, réduisant le moment magnétique total dipôle à zéro dans certains atomes à nombre pair d'électrons.
En éléments ferromagnétiques comme le fer, un nombre impair d'électrons conduit à un électron non apparié et un moment magnétique global net. Les orbitales des atomes voisins se chevauchent et un état d'énergie plus faible est obtenue lorsque les spins des électrons non appariés sont alignés les uns avec les autres, un procédé est connu en tant que interaction d'échange. Lorsque les moments magnétiques des atomes ferromagnétiques sont alignés, le matériau peut produire un champ macroscopique mesurable. Les matériaux paramagnétiques ont des atomes avec des moments magnétiques qui se alignent dans des directions aléatoires lorsque aucun champ magnétique ne est présente, mais les moments magnétiques des atomes individuels se alignent en présence d'un champ.
Le noyau d'un atome peut aussi avoir un spin net. Normalement, ces noyaux sont alignés dans des directions aléatoires en raison de équilibre thermique. Toutefois, pour certains éléments (tels que le xénon-129 ) il est possible de polariser une partie importante des états de spin nucléaire de sorte qu'ils sont alignés dans la direction-même une condition appelée hyperpolarisation. Cela a des applications importantes en imagerie par résonance magnétique.
Les niveaux d'énergie
Lorsqu'un électron est lié à un atome, il a un l'énergie potentielle qui est inversement proportionnelle à sa distance à partir du noyau. Elle est mesurée par la quantité d'énergie nécessaire pour annuler la liaison d'un électron de l'atome, et est habituellement exprimée en unités de électronvolts (eV). Dans le modèle de la mécanique quantique, un électron lié ne peut occuper un ensemble d'états centrés sur le noyau, et chaque état correspond à un niveau d'énergie spécifique. L'état de plus basse énergie d'un électron lié est appelé l'état du sol, tout en un électron à un niveau d'énergie plus élevé est dans un état excité.
Pour un électron à la transition entre deux états différents, il doit absorber ou émettre un photon avec une énergie correspondant à la différence de l'énergie potentielle de ces niveaux. L'énergie d'un photon émis est proportionnel à sa la fréquence, de sorte que ces niveaux d'énergie spécifiques apparaissent sous forme de bandes distinctes dans le spectre électromagnétique. Chaque élément a un spectre caractéristique qui peut dépendre de la charge nucléaire, sous-couches rempli par des électrons, les interactions électromagnétiques entre les électrons et d'autres facteurs.
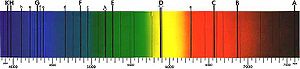
Quand un spectre continu de l'énergie est transmise à travers un gaz ou un plasma, une partie des photons sont absorbés par des atomes, ce qui provoque des électrons pour changer leur niveau d'énergie. Ces électrons excités qui restent liés à leur atome spontanément émettre cette énergie comme un photon, voyageant dans une direction aléatoire, et ainsi de retomber à des niveaux d'énergie plus faible. Ainsi, les atomes se comportent comme un filtre qui forme une série de sombres bandes d'absorption dans la production d'énergie. (Un observateur de visualiser les atomes d'une direction différente, qui ne inclut pas le spectre continu en arrière-plan, sera plutôt voir une série de raies d'émission des photons émis par les atomes.) spectroscopiques des mesures de la force et de la largeur de raies spectrales permettent la composition et les propriétés physiques d'une substance à déterminer.
Un examen attentif des raies spectrales révèle que certaines affichage un structure fine division. Cela est dû à couplage spin-orbite, qui est une interaction entre le spin et le mouvement de l'électron ultrapériphérique. Lorsqu'un atome est dans un champ magnétique extérieur, les lignes spectrales deviennent divisé en trois composants ou plus; un phénomène appelé le Effet Zeeman. Cela est dû à l'interaction du champ magnétique avec le moment magnétique de l'atome et de ses électrons. Certains atomes peuvent avoir plusieurs configurations d'électrons avec le même niveau d'énergie, qui apparaissent donc comme une seule ligne spectrale. L'interaction du champ magnétique avec l'atome décale ces configurations d'électrons des niveaux d'énergie à légèrement différentes, ce qui entraîne de multiples raies spectrales. La présence d'un extérieur champ électrique peut provoquer un éclatement et le déplacement des raies spectrales comparable en modifiant les niveaux d'énergie d'électrons, un phénomène appelé le Effet Stark.
Si un électron lié est dans un état excité, un photon interaction avec l'énergie appropriée peut causer l'émission stimulée d'un photon avec un niveau d'énergie correspondant. Pour ce faire, l'électron doit tomber à un état d'énergie plus faible qui a une différence d'énergie correspondant à l'énergie du photon interaction. Le photon émis et le photon interagissant ensuite se éloigner en parallèle et avec des phases correspondant. Autrement dit, les motifs d'ondes des deux photons seront synchronisés. Cette propriété physique est utilisé pour fabriquer des lasers , qui peuvent émettre un faisceau cohérent de l'énergie lumineuse dans une bande de fréquence étroite.
Valence
La coque extérieure d'électrons d'un atome dans son état non combiné est connu comme la couche de valence, et les électrons dans cette coquille sont appelés électrons de valence. Le nombre d'électrons de valence détermine la liaison avec le comportement d'autres atomes. Les atomes ont tendance à réagir chimiquement les uns avec les autres d'une manière qui va remplir (ou vide) leurs couches de valence extérieures.
Les éléments chimiques sont souvent affichées dans un tableau périodique qui est disposé pour afficher les propriétés chimiques récurrentes, et des éléments ayant le même nombre d'électrons de valence forment un groupe qui est alignée dans la même colonne de la table. (Les lignes horizontales correspondent au remplissage d'une coquille de quantum des électrons.) Les éléments à l'extrême droite de la table ont leur enveloppe extérieure complètement rempli avec des électrons, ce qui se traduit dans les éléments inertes chimiquement connus que les gaz nobles .
Unis

Les quantités d'atomes se trouvent dans différents états de la matière qui dépendent des conditions physiques telles que la température et pression. En faisant varier les conditions, les matériaux peuvent passer entre des solides , des liquides , des gaz et des plasmas . Dans un état, un matériau peut également exister dans différentes phases. Un exemple de ceci est le carbone solide, qui peut exister sous forme de graphite ou de diamant .
À des températures proches du zéro absolu , les atomes peuvent former un condensat de Bose-Einstein, à quel point quantique des effets mécaniques, qui ne sont normalement observées à l'échelle atomique, deviennent apparents à l'échelle macroscopique. Cette collection d'atomes super-refroidi se comporte alors comme un seul super Atom, ce qui peut permettre des contrôles fondamentaux du comportement mécanique quantique.
Identification

Le microscope à effet tunnel est un dispositif de visualisation de surfaces à l'échelle atomique. Il utilise le phénomène d'effet tunnel quantique, ce qui permet aux particules de passer à travers une barrière qui serait normalement insurmontable. Les électrons tunnel à travers le vide entre deux électrodes métalliques planes, sur chacune desquelles est un atome adsorbé, en fournissant une densité de courant d'effet tunnel qui peut être mesurée. Numérisation un atome (pris comme la pointe) comme il se déplace passé l'autre (l'échantillon) permet le traçage de la pointe déplacement fonction de la séparation latérale pour un courant constant. Le calcul montre dans quelle mesure les images à balayage à effet tunnel, microscopes d'un atome individuel sont visibles. Il confirme que pour une faible polarisation, les images au microscope les dimensions spatiales moyenne des orbitales d'électrons à travers les niveaux-la d'énergie serrées niveau de Fermi densité locale d'états.
Un atome peut être ionisé en supprimant une de ses électrons. La charge électrique provoque la trajectoire d'un atome de plier quand il passe à travers un champ magnétique. Le rayon par lequel la trajectoire d'un ion mobile est tourné par le champ magnétique est déterminée par la masse de l'atome. Le spectromètre de masse utilise ce principe pour mesurer le rapport de masse sur charge des ions. Si un échantillon contient des isotopes multiples, le spectromètre de masse permet de déterminer la proportion de chaque isotope dans l'échantillon en mesurant l'intensité des différents faisceaux d'ions. Techniques pour vaporiser atomes comprennent plasma à couplage inductif spectroscopie d'émission atomique et à couplage inductif spectrométrie de masse à plasma, qui tous deux utilisent un plasma pour vaporiser des échantillons pour analyse.
Procédé de zone sélective plus estla spectroscopie de perte d'énergie d'électrons, qui mesure la perte d'énergie d'unfaisceau d'électrons dans unmicroscope électronique à transmission quand il interagit avec une portion d'un échantillon. Le atome-sonde tomographe a la résolution sous-nanométrique en 3-D et chimiquement peut identifier atomes individuels en utilisant la spectrométrie de masse à temps de vol.
Spectra des états excités peut être utilisé pour analyser la composition atomique de lointaines étoiles . Lumière spécifiques longueurs d'onde contenues dans la lumière observée des étoiles peuvent être séparés et liés aux transitions quantifiées dans les atomes de gaz libre. Ces couleurs peuvent être reproduites à l'aide d'une lampe à décharge contenant le même élément. Helium a été découvert de cette manière dans le spectre du Soleil 23 ans avant il a été trouvé sur la Terre.
Origine et état actuel
Les atomes forment environ 4% de la densité totale de masse de l'observable univers , avec une densité moyenne d'environ 0,25 atomes / m 3 . Dans une galaxie comme la Voie Lactée , les atomes ont une concentration beaucoup plus élevée, la densité de matière dans le milieu interstellaire (ISM) allant de 10 5 à 10 9 atomes / m 3 . Le Soleil est considéré comme l'intérieur de la bulle locale, une région de gaz fortement ionisé, donc la densité dans le voisinage solaire est seulement environ 10 3 atomes / m 3 . Les étoiles se forment à partir de nuages denses dans l'ISM, et les processus évolutifs des étoiles se traduisent par l'enrichissement constant de l'ISM avec des éléments plus massives que l'hydrogène et l'hélium. Jusqu'à 95% des atomes de la Voie Lactée sont concentrés dans les étoiles et la masse totale d'atomes forme environ 10% de la masse de la galaxie. (Le reste de la masse est une inconnue de la matière noire .)
Nucléosynthèse
Protons et d'électrons stables apparu une seconde après le Big Bang . Pendant les trois minutes qui suivent, Big Bang nucléosynthèse produit la plupart des hélium , lithium , et des atomes de deutérium dans l'univers, et peut-être une partie de la béryllium et le bore . Les premiers atomes (complets avec électrons liés) ont été créés en théorie 380000 années après le Big Bang-une époque appelé recombinaison, lorsque l'univers en expansion suffisamment refroidi pour permettre aux électrons de se joint à noyaux. Depuis lors, les noyaux atomiques ont été combinées en étoiles à travers le processus de fusion nucléaire pour produire des éléments jusqu'à fer.
Isotopes tels que le lithium-6 sont générés dans l'espace grâce cosmique spallation ray. Cela se produit lorsque un proton à haute énergie frappe un noyau atomique, provoquant un grand nombre de nucléons à être éjecté. Éléments plus lourds que le fer ont été produites en supernovae à travers le processus r et dans des étoiles AGB à travers le processus s, les deux qui impliquent la capture de neutrons par des noyaux atomiques. Des éléments tels que le plomb formées en grande partie par la désintégration radioactive des éléments plus lourds.
Terre
La plupart des atomes qui composent la Terre et ses habitants étaient présents dans leur forme actuelle dans la nébuleuse qui effondré sur un nuage moléculaire pour former le système solaire. Les autres sont le résultat de la désintégration radioactive, et leur proportion relative peut être utilisée pour déterminer la âge de la Terre à travers la datation radiométrique. La plupart de l' hélium dans la croûte de la terre (environ 99% de l'hélium à partir de puits de gaz, comme représenté par sa faible abondance de l'hélium-3) est un produit de la désintégration alpha.
Il ya quelques atomes de traces sur la Terre qui ne sont pas présents au début (c.-à-pas "primordial"), ni les résultats de la désintégration radioactive. carbone-14 est continu généré par les rayons cosmiques dans l'atmosphère. Certains atomes sur Terre ont été générés artificiellement, délibérément ou sous-produits de réacteurs ou des explosions nucléaires. Parmi les éléments transuraniens-les avec un numéro atomique supérieur à 92 seulement plutonium et du neptunium présents naturellement sur la Terre. Transuraniens ont des durées de vie plus courtes que radioactives l'âge actuel de la Terre et les quantités ainsi identifiables de ces éléments ont depuis longtemps cariées, à l'exception des traces de plutonium-244 éventuellement déposés par la poussière cosmique. Dépôts naturels de plutonium et du neptunium sont produites par capture de neutrons dans le minerai d'uranium.
La Terre contient environ 1,33 × 10 50 atomes. Dans l'atmosphère de la planète, un petit nombre d'atomes indépendants existent pour les gaz nobles tels que l'argon et le néon . Les 99% restants de l'atmosphère est liée à la forme de molécules, y compris le dioxyde de carbone et diatomique oxygène et l'azote . A la surface de la Terre, les atomes se combinent pour former divers composés, y compris l'eau , le sel, les silicates et les oxydes. Atomes peuvent également se combiner pour créer des matériaux qui ne sont pas constitués de molécules discrètes, y compris les cristaux liquides ou solides et des métaux . Cette matière atomique forme arrangements réseau qui manquent le type particulier de petite échelle afin de interrompu associé avec la matière moléculaire.
Formes rares et théoriques
Bien que les isotopes ayant les numéros atomiques plus élevés que le plomb (82) sont connus pour être radioactif, une " îlot de stabilité "a été proposé pour certains éléments ayant les numéros atomiques ci-dessus 103. Ces éléments super-lourds peuvent avoir un noyau qui est relativement stable par rapport à la désintégration radioactive. Le candidat le plus probable pour un atome superlourd stable, unbihexium, dispose de 126 protons et neutrons 184.
Chaque particule de matière a une correspondante particule d'antimatière avec la charge électrique opposée. Ainsi, la positron est une antielectron chargé positivement et l'antiproton est un équivalent chargé négativement d'un proton. Pour des raisons inconnues, des particules d'antimatière sont rares dans l'univers, donc, pas d'atomes d'antimatière ont été découverts. antihydrogène, l'homologue d'antimatière de l'hydrogène, a été produit au laboratoire CERN à Genève en 1996.
Autre atomes exotiques ont été créés par le remplacement de l'un des protons, de neutrons ou d'électrons avec d'autres particules qui ont la même charge. Par exemple, un électron peut être remplacé par un plus massive muon, formant un atome muonique. Ces types d'atomes peuvent être utilisés pour tester les prédictions fondamentales de la physique.


