
Calcium
Contexte des écoles Wikipédia
Cette sélection écoles a été choisi par SOS Enfants pour les écoles dans le monde en développement ne ont pas accès à Internet. Il est disponible en téléchargement intranet. Tous les enfants disponibles pour le parrainage de SOS Enfants des enfants sont pris en charge dans une maison de famille près de la charité. Lire la suite ...
| Calcium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
20 Ca | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
gris mat, argent  Raies spectrales de calcium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | calcium, Ca, 20 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / k æ l s Je ə m / -Əm de KAL | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Catégorie Metallic | métal alcalino-terreux | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | 2 (métaux alcalino-terreux) , 4, s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 40,078 (4) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Ar ] 4s 2 2, 8, 8, 2 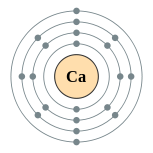 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Découverte | Humphry Davy (1808) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | Humphry Davy (1808) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 1,55 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densité au mp | 1,378 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 1115 K , 842 ° C, 1548 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 1757 K, 1484 ° C, 2703 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 8,54 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 154,7 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 25,929 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 2, 1 (Fortement oxyde de base) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | 1,00 (échelle de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation ( plus) | 1er: 589,8 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2ème: 1145,4 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3ème: 4912,4 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 197 h | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 176 ± 22 heures | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de Van der Waals | 231 h | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | cubique à faces centrées  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magnétique | diamagnétique | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Résistivité électrique | (20 ° C) 33,6 nΩ · m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 201 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | (25 ° C) 22,3 um · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ° C) 3,810 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | 20 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 7,4 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | 17 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,31 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Mohs | 1,75 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Brinell | 167 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-70-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes de calcium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Le calcium est l' élément chimique avec le symbole de Ca et de numéro atomique 20. Le calcium est un doux gris métal alcalino-terreux , et est le cinquième élément le plus abondante en masse dans la Terre de la croûte . Le calcium est également l'ion dissous cinquième plus abondant dans l'eau de mer à la fois par molarité et de masse, après sodium , chlorure, magnésium et sulfate .
Le calcium est essentiel pour la vie des organismes , en particulier dans la cellule physiologie, où le mouvement de l'ion calcium Ca2 + dans et hors de la cytoplasme fonctions en tant que signal pour de nombreux processus cellulaires. En tant que matériau principal utilisé dans la minéralisation des os, dents et coquilles, de calcium est le plus abondant métal en masse dans de nombreux animaux .
Caractéristiques notables

En termes chimiques, de calcium réactif et souple pour un métal (bien plus dur que le plomb, il peut être coupé avec un couteau avec difficulté). Ce est un élément métallique argenté qui doit être extrait par électrolyse à partir d'un condensé sel comme le chlorure de calcium . Une fois produit, il forme rapidement un gris-blanc oxyde et revêtement nitrure lorsqu'il est exposé à l'air. En vrac (généralement sous forme de copeaux ou «tournures»), le métal est un peu difficile à enflammer, plus encore que copeaux de magnésium; mais, lorsqu'il est allumé, le métal brûle dans l'air avec une haute intensité rouge-orange lumière brillante. Le calcium métal réagit avec l'eau , en générant de l'hydrogène gazeux à une vitesse suffisamment rapide pour être visible, mais pas assez vite à la température ambiante pour produire de chaleur, ce qui est utile pour produire de l'hydrogène. Sous forme de poudre, toutefois, la réaction avec l'eau est extrêmement rapide, comme l'augmentation de la surface de la poudre accélère la réaction avec l'eau. Une partie de la lenteur de la réaction conduit calcium dans l'eau du métal étant partiellement protégée par blanc insoluble l'hydroxyde de calcium. Dans des solutions aqueuses d'acides, où ce sel est soluble, le calcium réagit vigoureusement.
Le calcium, avec une densité de 1,55 g / cm 3, est le plus léger des métaux alcalino-terreux; magnésium ( densité 1,74) et le béryllium (1,84) sont plus denses, bien plus léger en masse atomique. De strontium avant, les métaux alcalino-terreux deviennent plus dense avec l'augmentation de masse atomique.
Il dispose de deux allotropes .
Le calcium a une résistivité électrique plus élevée que le cuivre ou l'aluminium , pour l'instant poids-poids, en raison de sa densité beaucoup plus faible, ce est un meilleur conducteur que plutôt navigateur. Cependant, son utilisation dans des applications terrestres est généralement limitée par sa grande réactivité avec l'air.
Les sels de calcium sont incolores à partir de toute contribution du calcium, et les solutions ioniques de calcium (Ca 2+) sont incolores ainsi. Comme dans le cas du magnésium et d'autres sels les sels de métaux alcalino-terreux, les sels de calcium sont souvent très soluble dans l'eau. Les exceptions notables incluent le hydroxyde, le sulfate (inhabituel pour les sels de sulfate), le carbonate et le phosphates. A l'exception du sulfate, même les insolubles ceux énumérés ci sont en général plus solubles que les métaux de transition homologues. Lorsque en solution, l'ion calcium au goût humaine varie remarquablement, étant signalé que légèrement salé, aigre, «minéral comme» ou même «apaisante». Il est évident que de nombreux animaux peuvent goûter, ou de développer un goût, pour le calcium, et d'utiliser ce sens pour détecter le minéral blocs de sel ou d'autres sources. En nutrition humaine, les sels de calcium solubles peuvent être ajoutés à tarte jus sans beaucoup d'effet au palais moyenne.
Le calcium est le cinquième élément le plus abondante en masse dans le corps humain, où il est un messager ionique cellulaire commun avec de nombreuses fonctions, et sert également comme un élément structurel dans l'os. Ce est le calcium relativement haute numéro atomique dans le squelette qui provoque os à être radio-opaque. Des composants solides du corps humain après le séchage et le brûlage des matières organiques (comme par exemple, après crémation), environ un tiers de la masse restante "minérale" totale, est le d'environ un kilogramme de calcium qui compose le squelette moyenne (le reste étant surtout du phosphore et de l'oxygène).
H et K lignes
Spectres visible de nombreuses stars, dont le Sun , présentent une forte raies d'absorption du calcium ionisé. Au premier rang de ceux-ci sont l'H-ligne à 3968,5 Å et la ligne K à 3933,7 Å du calcium ionisé, ou Ca II. Pour le Soleil et les étoiles avec des températures basses, l'importance des lignes H et K peut être une indication de l'activité magnétique intense dans le chromosphère. Mesure des variations périodiques de ces régions actives peut également être utilisé pour déduire les périodes de ces étoiles de rotation.
Composés
Calcium, combiné avec phosphate pour former hydroxyapatite, est la partie minérale des os et des dents humaines et animales. La partie minérale de certains coraux peuvent également être transformés en hydroxyapatite.
L'hydroxyde de calcium (chaux éteinte) est utilisé dans de nombreux procédés de raffinage chimique et est effectué par chauffage calcaire à haute température (au-dessus de 825 ° C), puis en ajoutant avec précaution de l'eau à elle. Lorsque la chaux est mélangée avec du sable, il durcit dans un mortier et est transformé en plâtre par du dioxyde de carbone absorption. Mélangé avec d'autres composés, la chaux constitue une partie importante de Ciment Portland.
Le carbonate de calcium (de CaCO 3) est l'un des composés communs de calcium. Elle est chauffée pour former de la chaux vive (CaO), qui est ensuite ajouté à l'eau (H 2 O). Cela constitue un autre matériau connu sous le nom de chaux éteinte (Ca (OH) 2), qui est un matériau de base peu coûteux utilisés dans l'industrie chimique. Chalk, le marbre et le calcaire sont toutes les formes de carbonate de calcium.
Lorsque l'eau se infiltre dans calcaire ou d'autres solubles carbonate rochers, il se dissout partiellement le rock et provoque la formation de la grotte et caractéristique stalactites et stalagmites et aussi des formes l'eau dure. D'autres composés de calcium sont importants le nitrate de calcium, sulfure de calcium, le chlorure de calcium , le carbure de calcium, la cyanamide calcique et l'hypochlorite de calcium.
Quelques composés de calcium dans l'état d'oxydation 1 ont également été étudiés récemment.
Isotopes
Le calcium a quatre stables isotopes (40 Ca, Ca 42, 43 et 44 Ca Ca), plus deux isotopes plus (46 Ca et Ca 48) qui ont une telle longue demi-vie, à toutes fins pratiques, ils peuvent aussi être considérée comme stable. La gamme de 20% en masse par rapport parmi les isotopes d'origine naturelle de calcium est supérieur à ne importe quel élément à l'exception de l'hydrogène et l'hélium. Le calcium a également un isotopes cosmogéniques, 41 Ca radioactif, qui a une demi-vie de 103.000 années. Contrairement à isotopes cosmogéniques qui sont produites dans l' atmosphère , 41 Ca est produit par neutrons activation de 40 Ca. La plupart de sa production est dans le premier mètre ou deux de la colonne de sol, où le flux de neutrons cosmogénique est encore suffisamment forte. 41 Ca a reçu beaucoup d'attention dans les études stellaires parce qu'il se désintègre à 41 K, un indicateur essentiel des anomalies du système solaire .
Quatre-vingt-sept pour cent du calcium naturel est sous la forme de 40 Ca. Ca 40 est l'un des produits de filiation de 40 K décroissance, avec 40 Ar. Tandis que Datation K-Ar a été largement utilisé dans les géologiques sciences, la prévalence de 40 Ca dans la nature a empêché son utilisation dans les fréquentations. Les techniques utilisant la spectrométrie de masse et un double pic dilution des isotopes ont été utilisées pour K -Ca datation.
L'isotope le plus abondant, 40 Ca, possède un noyau de 20 protons et 20 neutrons . Ce est le plus lourd isotope stable de tout élément qui a le même nombre de protons et de neutrons. Dans explosions de supernovae, de calcium est formé à partir de la réaction du carbone avec divers nombres de particules alpha (noyaux d'hélium), jusqu'à ce que l'isotope de calcium les plus courantes (contenant 10 des noyaux d'hélium) a été synthétisé.
Fractionnement isotopique
Comme avec les isotopes d'autres éléments, une variété de processus fractionner, ou de modifier l'abondance relative des isotopes de calcium. Le mieux étudié de ces processus est la masse dépend fractionnement des isotopes de calcium qui accompagne la précipitation de minéraux de calcium, telles que calcite , aragonite et apatite, de la solution. Isotopes de calcium lumière est préférentiellement incorporé dans les minéraux, laissant la solution à partir de laquelle le minéral précipité enrichi en calcium isotope lourd. A température ambiante l'ampleur de ce fractionnement est d'environ 0,25 ‰ (0,025%) par unité de masse atomique (UMA). différences de masse dépendant de la composition isotopique de calcium conventionnelle sont exprimés le rapport de deux isotopes (généralement 44 Ca / 40 Ca) dans un échantillon par rapport à la même ratio dans un matériau de référence standard. 44 Ca / 40 Ca varie d'environ 1% chez commune matériaux géologiques.
Calcium fractionnement isotopique lors de la formation minérale a conduit à plusieurs applications des isotopes de calcium. En particulier, l'observation 1997 par Skulan et DePaolo que les minéraux de calcium sont isotope plus léger que les solutions à partir de laquelle les minéraux précipitent est la base des demandes analogues en médecine et dans paléoocéanographie. Chez les animaux avec des squelettes minéralisées en calcium de la composition isotopique de calcium des tissus mous par rapport reflète le taux de formation et la dissolution du minéral osseux. Chez l'être humain a été démontré que des changements dans la composition isotopique de calcium de l'urine à être liée à des changements dans l'équilibre minéral de l'os. Lorsque le taux de formation osseuse est supérieur au taux de résorption osseuse, les tissus mous 44 Ca / Ca 40 augmente. Tissus mous 44 Ca / Ca 40 tombe lorsque la résorption osseuse dépasse la formation osseuse. En raison de cette relation, mesures isotopiques de calcium d'urine ou de sang peuvent être utiles dans la détection précoce des maladies osseuses métaboliques telles que l'ostéoporose.
Un système similaire existe dans l'océan, où l'eau de mer 44 Ca / 40 Ca a tendance à augmenter lorsque le taux d'élimination de Ca 2+ de l'eau de mer par précipitation minérale dépasse l'entrée de la nouvelle calcium dans l'océan, et à l'automne lorsque l'entrée de calcium dépasse les précipitations minérale . Il se ensuit que la hausse de 44 Ca / 40 Ca correspond à la baisse de l'eau de mer concentration de Ca2 +, et de tomber 44 Ca / 40 Ca correspond à l'augmentation de l'eau de mer concentration de Ca2 +. En 1997 Skulan et DePaolo présenté la première preuve de changement de l'eau de mer 44 Ca / 40 Ca cours des temps géologiques, avec une explication théorique de ces changements. Des travaux plus récents ont confirmé cette observation, ce qui démontre que l'eau de mer Ca 2+ concentration ne est pas constante, et que l'océan probablement jamais est en «état stable» par rapport à son entrée et la sortie de calcium. Ceci a des implications importantes climatologiques, que le cycle de calcium marin est étroitement liée à la cycle du carbone (voir ci-dessous).
Cycle géochimique
Calcium fournit un lien important entre tectonique, climatique et de la cycle du carbone. En termes simples, le soulèvement des montagnes expose roches Ca portant à l'altération chimique et libère Ca 2+ dans les eaux de surface. Cette Ca 2+ est finalement transporté vers l'océan où il réagit avec le CO 2 dissous pour former calcaire. Une partie de ce calcaire se dépose au fond de la mer où il est incorporé dans de nouveaux roches. CO 2 dissous, avec du carbonate et des ions bicarbonate, sont appelés carbone inorganique dissous (DIC).

La réaction proprement dite est plus complexe et fait intervenir l'ion bicarbonate (HCO 3 -) qui se forme lorsque le CO 2 réagit avec l'eau à l'eau de mer pH:
- Ca2 + HCO 2 -
3 → CaCO 3 (calcaire) + CO 2 + H 2 O
Notez que le pH des océans à la plupart du CO 2 produit dans cette réaction est immédiatement reconverti en HCO -
3. Les résultats de la réaction dans un transport net d'une molécule de CO 2 de l'océan / atmosphère dans le lithosphère.
Le résultat est que chaque ion Ca2 + libéré par l'altération chimique supprime finalement une molécule de CO 2 du système de surface (atmosphère, les océans, les sols et les organismes vivants), le stocker dans des roches carbonatées où il est susceptible de rester pour des centaines de millions de années. L'altération du calcium à partir de roches ainsi gommages CO 2 de l'océan et l'atmosphère, en exerçant un fort effet à long terme sur le climat. Cycles analogues impliquant le magnésium, et dans une moindre mesure le strontium et le baryum beaucoup plus petite, a le même effet.
Comme l'altération de calcaire (CaCO3) libère des quantités équimolaires de Ca 2+ et de CO 2, il n'a aucun effet net sur la teneur en CO 2 de l'atmosphère et l'océan. L'altération des roches silicatées comme le granit , d'autre part, est un filet puits de CO 2, car elle produit Ca 2+ abondante mais très peu de CO 2.
Histoire
Lime comme matériau de construction a été utilisé depuis les temps préhistoriques remontant aussi loin que 7000 à 14000 av. Le premier en date du Dates de four à chaux de retour à 2500 avant JC et a été trouvé dans Khafadje Mésopotamie . Calcium (du latin chaux, calcis génitif, qui signifie «chaux») était connu dès le premier siècle, quand les Romains préparé chaux oxyde de calcium. Littérature datant de 975 notes d'annonce qui Plâtre de Paris (sulfate de calcium), est utile pour régler les os brisés. Il n'a pas été isolé jusqu'en 1808 en Angleterre lorsque Sir Humphry Davy électrolysée un mélange de chaux et de l'oxyde mercurique. Davy essayait d'isoler calcium; quand il apprit que chimiste suédois Jöns Jakob Berzelius et Pontin préparés amalgame de calcium par électrolyse chaux dans le mercure, il a essayé lui-même. Il a travaillé avec l'électrolyse au long de sa vie et aussi découvert / isolée de sodium , de potassium , de magnésium , de bore et de baryum . Calcium-métal ne était pas disponible à grande échelle jusqu'à ce que le début du 20e siècle.
Occurrence
Calcium ne est pas naturellement présent dans l'état élémentaire. Calcium se produit le plus souvent dans des roches sédimentaires dans les minéraux de calcite , dolomite et de gypse . Il se produit également dans ignées et métamorphiques principalement dans le silicates: plagioclases, amphiboles, pyroxènes et grenats.
Applications
Le calcium est utilisé
- comme un agent réducteur dans l'extraction d'autres métaux, tels que l'uranium , le zirconium et le thorium .
- comme désoxydant, de désulfuration, ou décalaminant pour divers métaux ferreux et non ferreux alliages.
- comme agent d'alliage utilisé dans la production d' aluminium , de béryllium , de cuivre , de plomb et de magnésium des alliages.
- dans la fabrication de ciments et mortiers à être utilisés dans construction.
- dans la fabrication du fromage , où calcium ions influencent l'activité de rénine dans la réalisation de la la coagulation du lait.
Les composés de calcium
- Le carbonate de calcium (CaCO 3) est utilisé dans la fabrication ciment et de mortier, citron vert, calcaire (généralement utilisé dans l'industrie de l'acier) et aide à la production dans l'industrie du verre. Il a également des utilisations chimiques et optiques que les spécimens de minéraux dans dentifrices, par exemple.
- une solution d'hydroxyde de calcium (Ca (OH) 2) (également connu sous le nom eau de chaux) est utilisé pour détecter la présence de dioxyde de carbone par barbotage dans une solution. Il devient trouble où le CO 2 est présent.
- l'arséniate de calcium (Ca 3 (AsO 4) 2) est utilisé en insecticides.
- Le carbure de calcium (CaC 2) est utilisé pour faire de l'acétylène gaz (pour une utilisation dans l'acétylène torches de soudage ) et dans la fabrication de matières plastiques .
- Le chlorure de calcium (CaCl 2) est utilisé dans la glace et l'élimination contrôle de la poussière sur les routes de terre, dans le conditionneur pour béton, en tant qu'additif dans conserve les tomates, et de fournir des corps pour l'automobile pneus.
- Calcium cyclamate (Ca (C 6 H 11 NHSO 3) 2) a été utilisé comme agent édulcorant, mais ne est plus autorisée pour une utilisation en raison des propriétés présumés cancérigènes.
- Le gluconate de calcium (Ca (C 6 H 11 O 7) 2) est utilisé en tant que additif alimentaire et vitamines pilules.
- L'hypochlorite de calcium (Ca (OCl) 2) est utilisé en tant que piscine désinfectant, en tant que Agent de blanchiment, en tant qu'ingrédient dans déodorant, et algicide et fongicide.
- permanganate de calcium (Ca (MnO 4) 2) est utilisé en propergol liquide, textile production, comme un agent de stérilisation de l'eau et dans des interventions dentaires.
- Le phosphate de calcium (Ca 3 (PO 4 2)) est utilisé en tant que supplément pour animaux aliments pour animaux, des engrais , dans la production commerciale de pâte et la levure des produits, dans la fabrication de verre , et dans les produits de soins dentaires.
- Phosphure de calcium (Ca 3 P 2) est utilisé dans feux d'artifice, rodenticide, torpilles et fusées.
- le stéarate de calcium (Ca (C 18 H 35 O 2) 2) est utilisé dans la fabrication de cire crayons, ciments, certains types de plastiques et cosmétiques, en tant que Additif alimentaire pour la production de matériaux résistant à l'eau et à la production de les peintures.
- Le sulfate de calcium (CaSO 4 · 2H 2 O) est utilisé comme craie commune, ainsi que, dans sa forme hémihydrate mieux connu sous le plâtre de Paris.
- Tungstate de calcium (CaWO 4) est utilisé dans lumineux peintures, lampes fluorescentes et Études aux rayons X.
- L'hydroxyapatite (Ca 5 (PO 4) 3 (OH), mais est habituellement écrit Ca 10 (PO 4) 6 (OH) 2) représente soixante dix pour cent de osseuse. Aussi gazéifiée-calcium hydroxyapatite déficiente est le principal minéral dont l'émail dentaire et dentine sont constitués.
Nutrition
| Âge | Calcium (mg / jour) |
|---|---|
| 0-6 mois | 200 |
| 7-12 mois | 260 |
| 13 ans | 700 |
| 4-8 ans | 1000 |
| 9-18 ans | 1300 |
| 19-50 ans | 1000 |
| 51-70 ans (mâle) | 1000 |
| 51-70 ans (femelle) | 1200 |
| 71+ années | 1200 |
Le calcium est un élément important d'une alimentation saine et un minéraux nécessaires à la vie. Le National Osteoporosis Foundation dit: «Le calcium joue un rôle important dans la construction de forts, des os plus denses tôt dans la vie et de garder des os solides et en bonne santé plus tard dans la vie." Environ 99 pour cent du calcium de l'organisme est stocké dans les os et les dents. Le reste du calcium dans l'organisme a d'autres utilisations importantes, telles que certaines exocytose, en particulier la libération de neurotransmetteurs , et la contraction musculaire. Dans le système de conduction électrique du coeur, le calcium remplace sodium comme le minéral qui dépolarise la cellule, la prolifération du potentiel d'action. Dans le muscle cardiaque, l'influx de sodium commence un potentiel d'action, mais au cours de l'efflux de potassium, le myocyte cardiaque subit l'influx de calcium, de prolonger le potentiel d'action et la création d'une phase de plateau d'équilibre dynamique. Long terme carence en calcium peut conduire au rachitisme et une mauvaise coagulation du sang et en cas d'une femme ménopausée, elle peut conduire à l'ostéoporose, dans laquelle l'os se détériore et il existe un risque accru de fractures. Alors que le déficit continue peut affecter formation des os et des dents, trop peut causer la rétention hypercalcémie (taux de calcium élevé dans le sang), une insuffisance rénale et une diminution de l'absorption d'autres minéraux. Plusieurs sources suggèrent une corrélation entre l'apport élevé en calcium (2000 mg par jour, ou deux fois les Etats-Unis recommandé indemnité journalière, l'équivalent de six ou plusieurs verres de lait par jour) et cancer de la prostate. Apport élevé de calcium ou absorption élevée de calcium étaient auparavant considérés comme contribuant au développement de calculs rénaux. Cependant, un apport élevé de calcium a été associée à un risque plus faible pour des calculs rénaux dans la recherche plus récente. La vitamine D est nécessaire pour absorber le calcium.
Les produits laitiers tels que le lait et le fromage, sont une source bien connue de calcium. Certaines personnes sont allergiques aux produits laitiers et même plus de gens, en particulier ceux d'origine non indo-européenne, sont intolérants au lactose, qui les empêche de consommer des produits laitiers non fermentés dans des quantités supérieures à environ un demi-litre par portion. D'autres, comme végétaliens, éviter les produits laitiers pour des raisons éthiques et de santé.
Beaucoup de bonnes sources végétales de calcium existent, y compris les algues telles que varech, wakame et hijiki; noix et les graines comme les amandes , noisettes, sésame , pistache; Blackstrap mélasse; haricots (en particulier les haricots de soja ); figues; quinoa; gombo; rutabaga; ; le brocoli pissenlit feuilles; le chou frisé. En outre, pour certaines boissons (comme lait de soja ou de jus d'orange), il est typique pour enrichi de calcium.
De nombreux légumes, notamment épinards, blettes et la rhubarbe ont une teneur élevée en calcium, mais ils peuvent également contenir des quantités variables de l'acide oxalique qui se lie calcium et réduit son absorption. Le même problème peut affecter un degré de l'absorption du calcium à partir de amarante, chou vert, greens de chicorée. Ce procédé peut également être liée à la production de oxalate de calcium.
Une source négligée de calcium est la coquille, qui peut être broyé en une poudre et mélangé à de la nourriture ou un verre d'eau.
La teneur en calcium de la plupart des aliments peut être trouvée dans la base de données de l'USDA National des éléments nutritifs.
Suppléments de calcium alimentaire

Les suppléments de calcium sont utilisés pour prévenir et traiter les carences en calcium. La plupart des experts recommandent que les suppléments être prises avec de la nourriture et que pas plus de 600 mg devraient être prises à la fois parce que le pour cent de calcium absorbée diminue à mesure que la quantité de calcium dans les suppléments augmente. Il est recommandé d'étaler doses tout au long de la journée. L'apport quotidien recommandé en calcium pour les adultes varie de 1000 à 1500 mg. Il est recommandé de prendre des suppléments avec de la nourriture pour aider à l'absorption.
La vitamine D est ajouté à des suppléments de calcium. Une bonne statut de la vitamine D est importante parce que la vitamine D est convertie en une hormone dans l'organisme, ce qui induit alors la synthèse des protéines responsables de l'absorption intestinale de calcium.
- L'absorption du calcium de la plupart des aliments et des suppléments alimentaires couramment utilisés est très similaire. Ceci est contraire à ce que beaucoup de fabricants de suppléments de calcium affirment dans leur matériel promotionnel.
- Lait est une excellente source de calcium alimentaire pour ceux dont les corps tolérer parce qu'il a une forte concentration de calcium et de calcium dans le lait est très bien absorbée.
- Lait de soja et autres laits végétaux sont habituellement vendus avec le calcium ajoutée de sorte que la concentration de calcium est aussi élevé que dans le lait.
- Aussi différents types de jus dopé avec du calcium sont largement disponibles.
- Le carbonate de calcium est le supplément de calcium la plus courante et la moins coûteuse. Il doit être pris avec de la nourriture. Cela dépend de faibles niveaux de pH pour une bonne absorption dans l'intestin. Certaines études suggèrent que l'absorption du calcium à partir de carbonate de calcium est similaire à l'absorption du calcium de lait. Alors que la plupart des gens digèrent le carbonate de calcium très bien, certains pourraient développer des malaises gastro-intestinaux ou de gaz. Prenant magnésium avec elle peut aider à éviter la constipation. Le carbonate de calcium est de 40% de calcium élémentaire. 1000 mg fournira 400 mg de calcium. Cependant, les étiquettes des suppléments seront généralement indiquent la quantité de calcium est présent dans chaque portion, pas combien de carbonate de calcium est présent.
- Les antiacides contiennent souvent du carbonate de calcium, et sont, d'un supplément de calcium peu coûteux couramment utilisé.
- Le calcium de corail est un sel de calcium provenant de récifs coralliens fossilisés. Le calcium de corail est composé de carbonate de calcium et des oligo-éléments.
- Le citrate de calcium peut être prise sans nourriture et est le supplément de choix pour les personnes atteintes d'achlorhydrie ou qui prennent histamine-2 bloquants ou les inhibiteurs de la pompe à protons. Le citrate de calcium est d'environ 21% de calcium élémentaire. 1000 mg fournira 210 mg de calcium. Il est plus cher que le carbonate de calcium et de plus il doit être pris pour obtenir la même quantité de calcium.
- Le phosphate de calcium est plus coûteux que le carbonate de calcium, mais inférieure citrate de calcium. Hydroxyapatite microcristalline (MH) est une de plusieurs formes de phosphate de calcium utilisé en tant que complément alimentaire. L'hydroxyapatite est d'environ 40% de calcium.
- Le lactate de calcium présente une absorption similaire à celle du carbonate de calcium, mais il est plus coûteux. le lactate de calcium et le gluconate de calcium sont des formes moins concentrées de calcium et des suppléments oraux ne sont pas pratiques.
- Calcium sont des composés chélates de calcium synthétiques, avec le calcium lié à une molécule organique, tel que le malate, un aspartate, un ou fumarate. Ces formes de calcium peuvent être mieux absorbés sur un estomac vide. Cependant, en général, ils sont absorbés de manière similaire à du carbonate de calcium et d'autres suppléments de calcium commun lorsqu'il est pris avec de la nourriture. Les imite "chélate" l'action qui effectue d'aliments naturels en gardant soluble dans l'intestin de calcium. Ainsi, sur un estomac vide, chez certains individus, chélates pourraient, en théorie, être absorbés mieux.
Une étude portant sur les effets de l'utilisation de suppléments de calcium personnelle sur le risque cardiovasculaire dans Initiative sur la santé de calcium des femmes / vitamine D Étude supplémentation (WHI étude CAO) a trouvé un risque légèrement accru d'événements cardiovasculaires, notamment l'infarctus du myocarde chez les femmes ménopausées. Un large recommandation du calcium / vitamine D suppléments ne est donc pas justifiée.
Prévention des fractures dues à l'ostéoporose
Ces études ne sont souvent pas tester calcium seul, mais plutôt une combinaison de calcium et de vitamine D. Des essais contrôlés randomisés ont trouvé des effets à la fois positifs et négatifs. Les différents résultats peuvent se expliquer par des doses de calcium et des taux sous-jacents de la supplémentation en calcium dans les groupes de contrôle. Toutefois, il est clair que l'augmentation de l'apport en calcium favorise le dépôt de calcium dans les os, où il est plus bénéfique dans la prévention des fractures de compression résultant de l'amincissement de la ostéoporotique Web dendritique des corps des vertèbres, que ce est à la prévention de la plus grave fractures osseuses corticales qui se produisent à la hanche et du poignet.
La prévention du cancer possible
Un méta-analyse par l'international Cochrane Collaboration de deux essais contrôlés randomisés ont trouvé que le calcium "pourrait contribuer à un degré modéré à la prévention des adénomateuse polypes du côlon ».
Des études plus récentes ont été contradictoires, et qui a été positif pour l'effet (Lappe, et al.) A fait commande d'un possible effet anti-cancérogène de la vitamine D , qui se est avéré être une influence positive indépendante de calcium seul sur le risque de cancer ( voir deuxième étude ci-dessous).
- Un essai contrôlé randomisé constaté que 1 000 mg de calcium élémentaire et 400 UI de vitamine D 3 ont eu aucun effet sur le cancer colorectal.
- Un essai contrôlé randomisé a constaté que 1400-1500 mg de calcium supplémentaire et 1100 UI de vitamine D 3 réduits cancers agrégées avec un risque relatif de 0,402.
- Une observation cohorte trouvé qu'un apport élevé en calcium et en vitamine D a été associée à «faible risque de développer un cancer du sein avant la ménopause."
Risques et de la toxicité
En comparaison avec d'autres métaux, l'ion calcium et la plupart des composés de calcium présentent une faible toxicité. Ce ne est pas surprenant étant donné l'abondance naturelle très élevée de composés de calcium dans l'environnement et dans les organismes. Calcium pose peu de problèmes environnementaux graves, à des calculs rénaux effet secondaire le plus commun dans les études cliniques. Intoxication aiguë de calcium est rare et difficile à réaliser à moins que les composés de calcium sont administrés par voie intraveineuse. Par exemple, la voie orale dose létale moyenne (DL 50) chez le rat pour le carbonate de calcium et le chlorure de calcium sont 6,45 et 1,4 g / kg, respectivement.
Calcium métal est dangereux en raison de ses réactions parfois violentes avec de l'eau et les acides. Calcium métal est présent dans certains produits de débouchage, où elle fonctionne à générer de la chaleur et l'hydroxyde de calcium que saponifie les graisses et liquéfie les protéines (par exemple, les cheveux) qui bloquent les drains. Lorsque le métal d'ingestion de calcium a le même effet sur la bouche, de l'œsophage et de l'estomac, et peut être mortelle.
Une consommation excessive de carbonate de calcium antiacides / compléments alimentaires (tels que Tums) sur une période de plusieurs semaines ou mois peut causer lait-alcali syndrome, avec des symptômes allant de hypercalcémie peuvent être potentiellement mortelles insuffisance rénale. Ce qui constitue la consommation «excessive» ne est pas bien connu et, il est présumé, varie beaucoup d'une personne à. Personnes consommant plus de 10 grammes / jour de CaCO 3 (= 4 g Ca) sont à risque de développer un syndrome de lait-alcali, mais l'état a été signalée dans au moins une personne qui consomme seulement 2,5 grammes / jour de CaCO 3 (= 1 g Ca), un montant généralement considéré comme modéré et sûr.
Des suppléments de calcium diminuent l'absorption orale de thyroxine lorsqu'elle est utilisée dans quatre à six heures de l'autre. Ainsi, les personnes qui prennent la fois du calcium et de la thyroxine courent le risque d'insuffisance de remplacement de l'hormone thyroïdienne et de là hypothyroïdie se ils prennent simultanément ou quasi-simultanément.


