
Cobalt
Renseignements généraux
Cette sélection Wikipedia est déconnecté disponibles à partir enfants SOS pour la distribution dans le monde en développement. Le parrainage d'enfants aide les enfants un par un http://www.sponsor-a-child.org.uk/ .
| Cobalt | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
27 Co | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||
métal dur bleu brillant  | |||||||||||||||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | cobalt, Co, 27 | ||||||||||||||||||||||||||||||||||||
| Prononciation | / k oʊ b ɒ l t / KOH -bolt | ||||||||||||||||||||||||||||||||||||
| Élément Catégorie | métal de transition | ||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | 9, 4, ré | ||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 58.933195 (5) | ||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Ar ] 4s 3d 2 7 2, 8, 15, 2 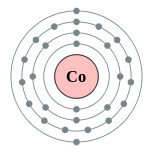 | ||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||
| Découverte | Georg Brandt (1732) | ||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||
| Couleur | gris métallique | ||||||||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 8,90 g · cm -3 | ||||||||||||||||||||||||||||||||||||
| Liquid densité au mp | 7,75 g · cm -3 | ||||||||||||||||||||||||||||||||||||
| Point de fusion | 1768 K , 1495 ° C, 2723 ° F | ||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 3200 K, 2927 ° C, 5301 ° F | ||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 16,06 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 377 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 24,81 J · mol -1 .K -1 | ||||||||||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||||||||||||||
| États d'oxydation | 5, 4, 3, 2, 1, -1 ( l'oxyde amphotère) | ||||||||||||||||||||||||||||||||||||
| Électronégativité | 1,88 (échelle de Pauling) | ||||||||||||||||||||||||||||||||||||
| énergies d'ionisation ( plus) | 1er: 760,4 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||
| 2ème: 1648 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||
| 3ème: 3232 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||
| Rayon atomique | 125 h | ||||||||||||||||||||||||||||||||||||
| Rayon covalente | 126 ± 3 (bas spin), 150 ± 7 (haut spin) h | ||||||||||||||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||||||||||||||
| Crystal structure | hexagonale compacte | ||||||||||||||||||||||||||||||||||||
| Ordre magnétique | ferromagnétique | ||||||||||||||||||||||||||||||||||||
| Résistivité électrique | (20 ° C) 62,4 nΩ · m | ||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 100 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||
| Dilatation thermique | (25 ° C) 13,0 um · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ° C) 4,720 m · s -1 | ||||||||||||||||||||||||||||||||||||
| Le module d'Young | 209 GPa | ||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 75 GPa | ||||||||||||||||||||||||||||||||||||
| Module Bulk | 180 GPa | ||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,31 | ||||||||||||||||||||||||||||||||||||
| Dureté Mohs | 5.0 | ||||||||||||||||||||||||||||||||||||
| Dureté Vickers | 1043 MPa | ||||||||||||||||||||||||||||||||||||
| Dureté Brinell | 700 MPa | ||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-48-4 | ||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes de cobalt | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
Le cobalt est un élément chimique avec le symbole Co et de numéro atomique 27. Ce est naturellement que sous forme combinée chimiquement. L'élément libre, produite par fusion réductrice, est un, brillant, gris argenté disque métallique .
Pigments bleus à base de cobalt ( bleu de cobalt) ont été utilisés depuis l'antiquité pour des bijoux et des peintures, et à conférer une teinte bleue distinctive au verre, mais la couleur a été pensé plus tard par les alchimistes être due à du métal connu de bismuth . Les mineurs ont longtemps utilisé le nom kobold minerai (en allemand pour le minerai de gobelin) pour une partie de la production de minéraux bleu pigment; ils ont été nommés parce qu'ils étaient pauvres en métaux connus et ont donné toxiques d'arsenic contenant fumées sur la fusion. En 1735, ces minerais ont été trouvés à être réductible à un nouveau métal (le premier découvert depuis les temps anciens), et cela a finalement été nommés pour le kobold.
Aujourd'hui, peu de cobalt est produit spécifiquement de divers minerais métalliques-lustré, par exemple cobaltite (CoAsS), mais la source principale de l'élément est aussi un sous-produit de cuivre et de nickel minière. La ceinture de cuivre dans la République démocratique du Congo et la Zambie donne plus du métal de cobalt extrait dans le monde entier.
Le cobalt est utilisé dans la préparation de magnétique , résistant à l'usure et à haute résistance alliages. silicate de Cobalt et de cobalt (II) aluminate (charbon 2 O 4, bleu de cobalt) donnent une couleur bleu foncé distinctive à verre , smalt, la céramique, les encres, peintures et vernis. Cobalt produit naturellement comme un seul isotope stable, le cobalt-59. Le cobalt 60 est un radio-isotope d'importance commerciale, utilisée comme traceur radioactif et dans la production de les rayons gamma.
Le cobalt est le centre actif de coenzymes appelés cobalamines, l'exemple le plus commun de ce qui est de la vitamine B 12 . Comme telle, elle est un oligo- minéral alimentaire pour tous les animaux. Cobalt sous forme inorganique est également un nutriment actif pour les bactéries, les algues et les champignons .
Caractéristiques

Le cobalt est un avec un métal ferromagnétique densité de 8,9. Cobalt pur ne est pas trouvé dans la nature, mais les composés de cobalt sont communs. De petites quantités on en trouve dans la plupart des roches, le sol, les plantes et les animaux. Le Température de Curie est 1115 ° C et le moment magnétique est 1.6 à 1.7 Bohr magnétons par atome . Dans la nature, il est fréquemment associé avec le nickel, et les deux sont des composants mineurs caractéristiques de fer météorique. Le cobalt a un perméabilité relative des deux tiers que de fer . métallique cobalt se produit que deux structures cristallographiques: hcp et fcc. La température de transition idéale entre le HCP et les structures de la FCC est de 450 ° C, mais dans la pratique, la différence d'énergie est si faible que enchevêtrement aléatoire des deux est commune.
Le cobalt est un métal réducteur qui est faiblement protégée de l'oxydation par un un film d'oxyde de passivation. Il est attaqué par des halogènes et du soufre. Chauffage en oxygène produit Co 3 O 4 qui perd de l'oxygène à 900 ° C pour donner le monoxyde CoO. Le métal réagit avec F 2 à 520 K pour donner CoF3, avec Cl 2, Br 2 et I 2, les halogénures binaires correspondants ont été formé. Il n'a pas de réaction avec H 2 et N 2 , même lorsqu'il est chauffé, mais il ne réagit avec le bore , le carbone , le phosphore , l'arsenic et le soufre . A la température ordinaire, il réagit lentement avec des acides minéraux, et très lentement avec humide, mais pas l'air sec.
Composés
Communes états d'oxydation de cobalt comprennent 2 et 3, bien que des composés ayant des états d'oxydation allant de -3 à 4 sont également connus. Un état d'oxydation commun pour les composés simples est deux. Cobalt (II) forment des sels du rouge-rose [Co (H 2 O) 6] 2+ complexe en solution aqueuse. Ajout de chlorure donne le bleu intense [CoCl
4] 2-
.
composés d'oxygène et chalcogènes
Plusieurs oxydes de cobalt sont connus. Vert oxyde de cobalt (II) (COO) a Structure sel gemme. Il est facilement oxydé avec de l'eau et de l'oxygène au brun cobalt (III) hydroxyde (Co (OH) 3). À des températures de 600 à 700 ° C, CoO oxyde pour le bleu de cobalt (II, III) de l'oxyde (Co 3 O 4), qui a un structure de spinelle. Noir cobalt (III) de l'oxyde (Co 2 O 3) est également connue. oxydes de cobalt sont antiferromagnétique à basse température : CoO ( Température de Néel 291 K) et de Co 3 O 4 (température de Néel: 40 K), qui est analogue à la magnétite (Fe 3 O 4), avec un mélange de 2 et 3 états d'oxydation.
Le principal chalcogénures de cobalt comprennent le noir cobalt (II), sulfures CoS 2, qui adopte une pyrite la structure, et -comme Co 2 S 3. Pentlandite (Co 9 S 8) est riche en métaux.
Halogénures

Quatre dihalogénures de cobalt (II) sont connus: cobalt fluorure (II) (COF 2, rose), chlorure de cobalt (II) (CoCl 2, bleu), le bromure de cobalt (II) (de CoBr 2, vert), cobalt (II) d'iodure (CoI2, bleu-noir). Ces halogénures existent sous des formes anhydres et hydratées. Alors que le dichlorure anhydre est bleu, l'hydrate est rouge.
Le potentiel de réduction de la réaction
- Co 3+
+ E - → Co 2+
est 1,92 V, au-delà de chlore en chlorure, 1,36 V. En conséquence de cobalt (III) et le chlorure entraînerait le cobalt (III) étant réduite au cobalt (II). Parce que le potentiel de réduction pour le fluor au fluorure est si élevé, 2,87 V, le cobalt (III) fluorure est l'un des rares composés de cobalt stable (III) simples. Cobalt (III) fluorure, qui est utilisé dans des réactions de fluoration, réagit vigoureusement avec de l'eau.
composés de coordination
Comme pour tous les métaux, composés moléculaires de cobalt sont classés comme des complexes de coordination, ce est-molécules ou des ions qui contiennent du cobalt lié à plusieurs ligands. Les principes de électronégativité et dureté, la douceur d'une série de ligands peut être utilisée pour expliquer l'état d'oxydation du cobalt habituel. Par exemple Co trois complexes ont tendance à avoir ligands ammines. Comme le phosphore est plus doux que l'azote, des ligands de phosphine ont tendance à offrir la Co 2+ et plus doux Co +, un exemple étant le tris (triphénylphosphine) cobalt (I) chlorure ((P (C 6 H 5) 3) 3 COCl). L'oxyde et de fluorure plus électronégatif (et difficile) peuvent stabiliser Co 4+ et 5+ Co dérivés, par exemple, césium hexafluorocobaltate (Cs 2 CoF 6) et percobaltate de potassium (K 3 CoO 4).
Alfred Werner, un prix Nobel pionnier dans chimie de coordination, a travaillé avec des composés de formule empirique CoCl 3 (NH 3) 6. Un des isomères déterminés était cobalt (III) de chlorure de hexammine. Ce complexe de coordination, un «type» de type Werner complexe, est constitué d'un atome central de cobalt coordonnés par six ammine ligands orthogonaux les uns aux autres et trois contre-anions chlorures. Utilisation chélateur ligands d'éthylènediamine en place d'ammoniac donne tris (éthylènediamine) cobalt (III) chlorure ([Co (en) 3] Cl 3), qui était l'un des premiers des complexes de coordination qui a été résolu dans isomères optiques. Le complexe existe sous deux formes, soit la droite ou à gauchers d'une "hélice tripale". Ce complexe a été isolé par Werner que le jaune-or cristaux en forme d'aiguille.
Composés organométalliques
Cobaltocène est un analogue structural de ferrocène, où le cobalt substitue pour le fer. Cobaltocène est sensible à l'oxydation, beaucoup plus que ferrocène. Le cobalt carbonyle (Co 2 (CO 8)) est un catalyseur à des réactions de carbonylation. La vitamine B 12 (voir ci-dessous ) est un composé organométallique présent dans la nature et est la seule vitamine contenir un atome de métal.
Isotopes
59 Co est le seul cobalt stable isotope et le seul isotope d'exister dans la nature. 22 radio-isotopes ont été caractérisés avec plus stable étant de 60 Co avec une la demi-vie de 5,2714 années, 57 Co avec une demi-vie de 271,79 jours, 56 Co avec une demi-vie de 77,27 jours, et 58 Co avec une demi-vie de 70,86 jours. Tout le reste isotopes radioactifs ont des demi-vies plus courtes que 18 heures, et la majorité d'entre eux sont plus courtes que 1 seconde. Cet élément a aussi 4 États Meta, qui ont tous des demi-vies plus courtes que 15 minutes.
Les isotopes de gamme de cobalt dans poids atomique de 50 u (50 Co) à 73 u (73 Co). Le primaire mode de désintégration d'isotopes avec unité de masse atomique inférieure à celle des valeurs de l'isotope stable le plus abondant, 59 Co, est capture d'électrons et le principal mode de décroissance pour ceux de plus de 59 unités de masse atomique est désintégration bêta. Le primaire produits de désintégration avant 59 Co sont des éléments 26 ( fer ) et les isotopes produits primaires après 28 éléments (nickel) sont isotopes.
Histoire

composés de cobalt ont été utilisés pendant des siècles pour donner une riche couleur bleu pour le verre , émaux et céramiques. Cobalt a été détecté dans la sculpture égyptienne et des bijoux Persique du troisième millénaire avant JC, dans les ruines de Pompéi (détruit en 79 après JC), et en Chine datant de la dynastie des Tang (618-907) et de la dynastie des Ming (1368-1644 AD).
Cobalt a été utilisé pour colorer le verre depuis le Âge du Bronze . L'excavation de la Uluburun naufrage a donné un lingot de verre bleu, qui a été coulé pendant le 14ème siècle BC. Articles de verre bleu d'Egypte sont colorés avec le cuivre, le fer ou le cobalt. Le plus ancien verre de cobalt de couleur était à partir du moment de la XVIIIe dynastie en Egypte (1550-1292 avant JC). L'endroit où ont été obtenus les composés de cobalt est inconnue.
Le mot de cobalt est dérivé de l'allemand kobalt, de kobold sens "lutin", un terme utilisé pour la superstitieuse le minerai de cobalt par des mineurs. Les premières tentatives de fusion de ces minerais pour produire des métaux tels que le cuivre ou le nickel ont échoué, ce qui donne tout simplement la poudre (cobalt (II) oxyde) à la place. Aussi, parce que les minerais de cobalt primaire contiennent toujours l'arsenic, la fonte du minerai oxydé la teneur en arsenic dans le très toxique et volatile l'oxyde d'arsenic, qui a également diminué la réputation du minerai pour les mineurs.
Chimiste suédois Georg Brandt (1694-1768) est crédité de découvrir cobalt circa 1735, montrant qu'il se agit d'un nouvel élément jusqu'ici inconnu différente de bismuth et d'autres métaux traditionnels, et de l'appeler une nouvelle "semi-métal." Il a pu montrer que les composés de métal de cobalt ont été la source de la couleur bleue dans le verre, qui avait déjà été attribué au bismuth trouvé avec le cobalt. Cobalt est devenu le premier métal à découvert depuis la période pré-historique, au cours de laquelle tous les métaux connus (fer, cuivre, argent, or, zinc, mercure, étain, de plomb et de bismuth) ne avaient pas de découvreurs enregistrées.
Pendant le 19ème siècle, une partie importante de la production mondiale de bleu de cobalt (un colorant à base de composés de cobalt et alumine) et smalt ( verre de cobalt en poudre pour utilisation à des fins de pigment dans la peinture et la céramique) a été réalisée à la Norvège Blaafarveværket. Les premières mines pour la production de smalt dans le 16ème au 18ème siècle étaient situées en Norvège, en Suède , Saxe et la Hongrie. Avec la découverte de minerai de cobalt dans Nouvelle-Calédonie en 1864 l'extraction de cobalt en Europe a diminué. Avec la découverte de gisements de minerai de Ontario, Canada en 1904 et la découverte de gisements encore plus dans le La province du Katanga dans le Congo en 1914 les opérations minières déplacé à nouveau. Avec le Shaba conflits à partir de 1978, la principale source de cobalt, les mines de cuivre de la province du Katanga, presque arrêté leur production. L'impact sur l'économie mondiale de cobalt de ce conflit a toutefois été plus faible que prévu. Cobalt est un rare et le pigment étant hautement toxique, l'industrie avait déjà établi des moyens efficaces pour le recyclage des matériaux de cobalt et dans certains cas a été en mesure de passer à des alternatives sans cobalt.
En 1938, John et Livingood Glenn T. Seaborg découvert le cobalt-60. Cet isotope a été célèbre utilisé à Université de Columbia dans les années 1950 pour établir violation de la parité dans radioactifs désintégration bêta.
Après la Seconde Guerre mondiale, les États-Unis voulions être sûr que ce était jamais à court de minerai nécessaire pour le cobalt comme les Allemands étaient allés explorer et pour un approvisionnement au sein de la frontière américaine. Un bon approvisionnement du minerai nécessaire a été trouvé dans l'Idaho près Canyon Blackbird dans le flanc d'une montagne. La firme Calera Mining Company a commencé la production sur le site.
Occurrence
La forme stable de cobalt est créé en supernovae via le r-processus. Il comprend 0,0029% de la croûte de la Terre et est l'un des premiers métal de transition série.
Le cobalt se produit dans cuivre et de nickel et de minéraux, en combinaison avec du soufre et de l'arsenic dans la sulfuré cobaltite (CoAsS), safflorite (CoA 2) et skutterudite (CoA 3) minéraux. Le minéral cattierite est similaire à la pyrite et se produit avec vaesite dans les gisements de cuivre de la province du Katanga. Lors du contact avec l'atmosphère, altération se produit et les minéraux sulfurés oxyder pour former rose érythrite («regard de cobalt": Co 3 (AsO 4) 2 · 8H 2 O) et spherocobaltite (CoCO 3).
Le cobalt ne est pas trouvé en tant que métal natif, mais il est principalement obtenu sous forme d'un sous-produit de nickel et de cuivre activités minières. Les principaux minerais de cobalt sont cobaltite, érythrite, glaucodot et skutterudite.
Production

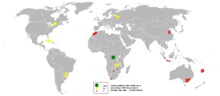
En 2005, les dépôts de cuivre dans la province du Katanga (ancien province de Shaba) de la République démocratique du Congo ont été le premier producteur de cobalt avec près de 40% de part de monde, rapporte le British Geological Survey. La situation politique au Congo influe sur le prix du cobalt de manière significative.
Le Projet Mukondo Mountain, exploité par la Central African Mining and Exploration Company au Katanga, peuvent être la réserve de cobalt les plus riches dans le monde. On estime être en mesure de produire environ un tiers de la production mondiale totale de cobalt en 2008. En Juillet 2009 CAMEC a annoncé un accord à long terme en vertu duquel CAMEC serait livrer la totalité de sa production annuelle de concentré de cobalt dans Mukondo Mountain Zhejiang Galico Cobalt & Nickel Matériaux de Chine.
Plusieurs méthodes existent pour la séparation du cobalt à partir de cuivre et de nickel. Elles dépendent de la concentration de cobalt et la composition exacte du minerai utilisé. Une étape de séparation comprend flottation, dans lequel tensioactifs lient aux différentes composantes de minerai, conduisant à un enrichissement de minerais de cobalt. Ultérieur grillage des minerais convertit au le sulfate de cobalt, tandis que le cuivre et le fer sont oxydés en l'oxyde. Le lixiviation avec de l'eau extrait le sulfate avec le arséniates. Les résidus sont ensuite lixiviés avec de l'acide sulfurique donnant une solution de sulfate de cuivre. Le cobalt peut aussi être lessivé à partir de la scorie de la fonderie de cuivre.
Les produits des procédés mentionnés ci-dessus sont transformés en de l'oxyde de cobalt (Co 3 O 4). Cet oxyde est réduit en métal par le réaction aluminothermique réduction ou avec du carbone dans un haut-fourneau.
Applications
L'application principale de cobalt est le métal dans les alliages.
Alliages
À base de cobalt- superalliages consomment la plupart du cobalt produit. La stabilité thermique de ces alliages les rend appropriés pour une utilisation dans des aubes de turbine à gaz turbines et jet aéronef si à base de nickel moteurs, alliages monocristallins surpassent eux à cet égard. Alliages à base de cobalt sont également à la corrosion et résistant à l'usure. Cela les rend utiles dans le domaine médical, où le cobalt est souvent utilisé (avec le titane ) pour orthopédique implants qui ne se usent au fil du temps. Le développement des alliages de cobalt résistant à l'usure a commencé dans la première décennie du 19ème siècle avec le stellite alliages, qui sont des alliages de cobalt-chrome et de tungstène en faisant varier la teneur en carbone. La formation de chrome et carbures de tungstène rend très dur et résistant à l'usure. Cobalt-chrome spéciales molybdène alliages comme Vitallium sont utilisés pour les pièces prothétiques tels que la hanche et du genou. Les alliages de cobalt sont également utilisés pour les prothèses dentaires, où elles sont utiles pour éviter les allergies au nickel. Certains forets en acier haute vitesse utilisent aussi du cobalt pour augmenter la chaleur et résistance à l'usure. Les alliages spéciaux d'aluminium, de nickel, de cobalt et de fer, connus en tant que Alnico, et de samarium et de cobalt ( aimant samarium-cobalt) sont utilisés dans des aimants permanents . Il est également allié avec 95% de platine à des fins de bijoux, ce qui donne un alliage qui est approprié pour bien coulée détaillée et est également légèrement magnétique.
Batteries
Oxyde de lithium et de cobalt (LiCoO2) est largement utilisé dans lithium cathodes de batteries ion. Le matériau est composé de couches d'oxyde de cobalt, dans lequel le lithium est intercalé. Pendant la décharge du lithium intercalé entre les couches est libéré sous forme d'ions de lithium. Nickel-cadmium (NiCd) et piles à hydrure métallique de nickel (NiMH) contiennent également des quantités importantes de cobalt; le cobalt permet d'améliorer les capacités d'oxydation de nickel dans la batterie.
Catalyse
Plusieurs composés de cobalt sont utilisés dans des réactions chimiques en tant que catalyseurs d'oxydation. L'acétate de cobalt est utilisé pour la conversion de xylène à l'acide téréphtalique, le précurseur du polymère en masse polyéthylène téréphtalate. Des catalyseurs typiques sont le cobalt carboxylates (connus sous le nom savons de cobalt). Ils sont également utilisés dans les peintures, les vernis, les encres et les «agents de séchage» par l'oxydation de les huiles siccatives. Les mêmes carboxylates sont utilisés pour améliorer l'adhérence de l'acier caoutchouc des pneus radiaux ceinturés d'acier.
Les catalyseurs à base de cobalt sont également importants dans des réactions impliquant du monoxyde de carbone . Reformage à la vapeur, utile dans la production d'hydrogène, utilise des catalyseurs oxyde de cobalt-base. Le cobalt est également un catalyseur dans le Procédé de Fischer-Tropsch utilisé dans la hydrogénation du monoxyde de carbone dans les combustibles liquides. Le hydroformylation des alcènes comptent souvent sur octacarbonyle de cobalt comme catalyseur, bien que ces procédés ont été partiellement déplacé par des catalyseurs à base de rhodium et d'iridium plus efficaces, par exemple, le Procédé Cativa.
Le hydrodésulfuration de pétrole utilise un catalyseur dérivé de cobalt et de molybdène. Ce procédé permet de débarrasser de pétrole impuretés soufrées qui interfèrent avec le raffinage des combustibles liquides.
Pigments et colorants


Avant le 19ème siècle, l'utilisation prédominante de cobalt était comme pigment. Depuis le Moyen Age, il a été impliqué dans la production de smalt, un verre de couleur bleue. Smalt est produit par fusion d'un mélange du minerai grillé smaltite, quartz et carbonate de potassium, ce qui donne un bleu verre de silicate sombre qui est constant après la production. Smalt a été largement utilisé pour la coloration du verre et comme pigment pour peintures. En 1780, Sven Rinman découvert vert de cobalt et en 1802 Louis Jacques Thénard découvert bleu cobalt. Les deux variétés de bleu de cobalt, d'aluminate de cobalt et le vert de cobalt (un mélange de oxyde de cobalt (II) et l'oxyde de zinc), ont été utilisés comme pigments pour peintures en raison de leur stabilité supérieure.
Les radio-isotopes
Le cobalt 60 (Co-60 ou 60 Co) est utile en tant que source de rayons gamma, car il peut être produit en quantité élevée prévisible et l'activité en bombardant cobalt avec des neutrons . Il produit des deux rayons gamma avec des énergies de 1,17 et 1,33 MeV.
Ses utilisations incluent radiothérapie externe, la stérilisation des fournitures médicales et les déchets médicaux, des traitements de radiothérapie de des aliments pour la stérilisation à froid ( pasteurisation), industriels radiographie (par exemple soudure radiographies d'intégrité), des mesures de densité (par exemple des mesures concrètes de densité) et les commutateurs de hauteur réservoir de remplissage. Le métal a la fâcheuse habitude de produire une fine poussière, provoquant des problèmes avec radioprotection. Cobalt de machines de radiothérapie a été un grave danger lorsqu'il ne est pas éliminé correctement, et l'un des pires accidents de contamination de rayonnement en Amérique du Nord se est produit en 1984, après une unité de radiothérapie au rebut contenant du cobalt-60 a été à tort démonté dans un dépotoir à Juarez, au Mexique.
Cobalt-60 a une demi-vie radioactive de 5,27 années. Cette diminution de l'activité nécessite un remplacement périodique des sources utilisées en radiothérapie et est une des raisons pourquoi les machines de cobalt ont été largement remplacés par Les accélérateurs linéaires de radiothérapie moderne.
Cobalt-57 (Co-57 ou 57 Co) est un radio-isotope de cobalt le plus souvent utilisé dans des tests médicaux, comme un radiomarqueur pour l'absorption de la vitamine B 12, et de la Schilling test. Cobalt-57 est utilisé comme une source de Spectroscopie Mössbauer et est l'un de plusieurs sources possibles Dispositifs de fluorescence X-ray.
Modèles d'armes nucléaires pourraient intentionnellement incorporer 59 Co, dont certains seraient activée dans un explosion nucléaire pour produire 60 Co. Le 60 Co, dispersé sous forme de retombées nucléaires, crée ce qu'on appelle parfois un bombe au cobalt.
D'autres utilisations
D'autres utilisations de cobalt sont en galvanoplastie, en raison de son aspect attrayant, la dureté et la résistance à oxydation, et comme couches de fond pour porcelaine émaux.
Rôle biologique
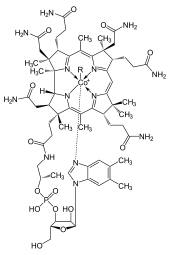
Cobalt est essentiel à tous les animaux . Ce est un constituant essentiel de la cobalamine, également connu sous le nom de vitamine B 12, qui est le réservoir biologique primaire de cobalt comme élément "ultratrace". Les bactéries présentes dans les entrailles de ruminants convertissent les sels de cobalt en vitamine B 12, un composé qui ne peut être produite par des bactéries ou des archéobactéries. La présence minimum de cobalt dans les sols améliore donc sensiblement la santé de pâturage des animaux, et une absorption de 0,20 mg / kg par jour est recommandée pour eux, car ils peuvent obtenir de la vitamine B 12 d'aucune autre manière. Au début du 20e siècle, pendant le développement pour l'agriculture de la Île du Nord Plateau Volcanique de la Nouvelle-Zélande, le bétail a souffert de ce qu'on a appelé la «maladie de brousse». Il a été découvert que les sols volcaniques manquaient des sels de cobalt, ce qui était nécessaire pour les bovins. La maladie a été durci par l'addition de petites quantités de cobalt aux engrais.
Dans les années 1930, la «maladie de la côte" de moutons dans la Ninety Mile désert du Sud-est de Australie du Sud a été jugée en raison de carences en éléments nutritifs de l'oligo-éléments cobalt et le cuivre. La carence en cobalt a été résolu par le développement de "balles" de cobalt, de pastilles denses de l'oxyde de cobalt mélangé à de l'argile, qui sont insérés par voie orale à loger dans le rumen de l'animal.
Herbivores non ruminants produisent la vitamine B 12 de bactéries dans leurs colons qui font à nouveau la vitamine de sels de cobalt simples. Toutefois, la vitamine ne peut être absorbé dans le côlon, et donc non-ruminants doivent ingérer excréments d'obtenir l'élément nutritif. Les animaux qui ne suivent pas ces méthodes d'obtenir la vitamine B 12 de leurs propres bactéries gastro-intestinales ou celui des autres animaux, doivent obtenir l'vitamine pré-faites dans d'autres produits d'origine animale dans leur alimentation, et ils ne peuvent pas bénéficier de l'ingestion de sels de cobalt simples.
Les protéines à base de cobalamine utilisent Corrin pour tenir le cobalt. Coenzyme B12 dispose d'un C-Co liaison réactive, qui participe à ses réactions. Chez les humains, 12 B existe deux types de groupes alkyle ligand: méthyle et adénosyl. MeB 12 favorise méthyle (-CH 3) les transferts de groupe. La version adénosyl de B 12 catalyse réarrangements dans lequel un atome d'hydrogène est transféré directement entre deux atomes adjacents avec échange concomitante du second substituant, X, qui peut être un atome de carbone avec des substituants, un atome d'oxygène d'un alcool ou une amine. Méthylmalonyl coenzyme A mutase (MUT) convertis MMl-CoA à Su-CoA, une étape importante dans l'extraction d'énergie à partir de protéines et de graisses.
Bien que beaucoup moins fréquentes que d'autres métalloprotéines (par exemple ceux du zinc et de fer), cobaltoproteins sont connus en dehors de B 12. Ces protéines comprennent méthionine aminopeptidase deux une enzyme qui se produit chez les humains et d'autres mammifères qui ne utilisent pas le noyau corrine de B 12, mais se lie directement cobalt. Une autre enzyme de cobalt non-corrine est nitrile hydratase, une enzyme dans des bactéries qui sont capables de métaboliser nitriles.
Précautions
Cobalt est un élément essentiel pour la vie en quantités infimes. Le DL 50 pour les sels de cobalt solubles a été estimée à entre 150 et 500 mg / kg. Ainsi, pour une personne de 100 kg de la DL 50 serait d'environ 20 grammes.
Après le nickel et le chrome, le cobalt est une cause majeure de la dermatite de contact. En 1966, l'addition de cobalt à stabiliser les composés mousse de la bière au Canada a mené à cardiomyopathie, qui est venu à être connu comme la cardiomyopathie de buveur de bière.


