
Cuivre
Saviez-vous ...
Les articles de cette sélection écoles ont été organisés par sujet du programme d'études grâce aux bénévoles d'enfants SOS. Parrainage d'enfants aide les enfants du monde en développement à apprendre aussi.
| Cuivre | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
29 Cu | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||||||||
lustre métallique rouge-orange  Cuivre natif (~ 4 cm de taille) | ||||||||||||||||||||||||||||||||||
| Propriétés générales | ||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | cuivre, Cu, 29 | |||||||||||||||||||||||||||||||||
| Prononciation | / k ɒ p ər / KOP -ər | |||||||||||||||||||||||||||||||||
| Catégorie Metallic | métal de transition | |||||||||||||||||||||||||||||||||
| Groupe, période, bloc | 11, 4, ré | |||||||||||||||||||||||||||||||||
| Poids atomique standard | 63,546 (3) | |||||||||||||||||||||||||||||||||
| Configuration électronique | [ Ar ] 3d 10 4s 1 2, 8, 18, 1 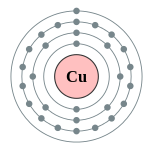 | |||||||||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||||||||
| Découverte | Moyen-Orientaux ( 9000 BC) | |||||||||||||||||||||||||||||||||
| Propriétés physiques | ||||||||||||||||||||||||||||||||||
| Phase | solide | |||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 8,96 g · cm -3 | |||||||||||||||||||||||||||||||||
| Liquid densité au mp | 8,02 g · cm -3 | |||||||||||||||||||||||||||||||||
| Point de fusion | 1357,77 K , 1084,62 ° C, 1984,32 ° F | |||||||||||||||||||||||||||||||||
| Point d'ébullition | 2835 K, 2562 ° C, 4643 ° F | |||||||||||||||||||||||||||||||||
| La chaleur de fusion | 13,26 kJ · mol -1 | |||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 300,4 kJ · mol -1 | |||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 24,440 J · mol -1 .K -1 | |||||||||||||||||||||||||||||||||
| La pression de vapeur | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Propriétés atomiques | ||||||||||||||||||||||||||||||||||
| États d'oxydation | 1, 2, 3, 4 (Légèrement oxyde de base) | |||||||||||||||||||||||||||||||||
| Électronégativité | 1,90 (échelle de Pauling) | |||||||||||||||||||||||||||||||||
| énergies d'ionisation ( plus) | 1er: 745,5 kJ · mol -1 | |||||||||||||||||||||||||||||||||
| 2ème: 1957,9 kJ · mol -1 | ||||||||||||||||||||||||||||||||||
| 3ème: 3555 kJ · mol -1 | ||||||||||||||||||||||||||||||||||
| Rayon atomique | 128 h | |||||||||||||||||||||||||||||||||
| Rayon covalente | 132 ± 16 heures | |||||||||||||||||||||||||||||||||
| Rayon de Van der Waals | 140 h | |||||||||||||||||||||||||||||||||
| Miscellanées | ||||||||||||||||||||||||||||||||||
| Crystal structure | cubique à faces centrées  | |||||||||||||||||||||||||||||||||
| Ordre magnétique | diamagnétique | |||||||||||||||||||||||||||||||||
| Résistivité électrique | (20 ° C) 16,78 nΩ · m | |||||||||||||||||||||||||||||||||
| Conductivité thermique | 401 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||
| Dilatation thermique | (25 ° C) 16,5 um · m -1 · K -1 | |||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | ( rt) (recuit) 3810 m · s -1 | |||||||||||||||||||||||||||||||||
| Le module d'Young | 110-128 GPa | |||||||||||||||||||||||||||||||||
| Module de cisaillement | 48 GPa | |||||||||||||||||||||||||||||||||
| Module Bulk | 140 GPa | |||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,34 | |||||||||||||||||||||||||||||||||
| Dureté Mohs | 3.0 | |||||||||||||||||||||||||||||||||
| Dureté Vickers | 369 MPa | |||||||||||||||||||||||||||||||||
| Dureté Brinell | 874 MPa | |||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-50-8 | |||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes du cuivre | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
Le cuivre est un élément chimique avec le symbole Cu (de latin : cuprum) et de numéro atomique 29. C'est un métal ductile à très haute thermique et conductivité électrique. Le cuivre pur est mou et malléable; une surface fraîchement exposée a une couleur rouge-orange. Il est utilisé en tant que conducteur de la chaleur et de l'électricité, un matériau de construction, et un constituant de divers métaux alliages.
Le métal et ses alliages ont été utilisés depuis des milliers d'années. A l'époque romaine, le cuivre a été principalement exploité sur Chypre , d'où l'origine du nom du métal que сyprium (métal de Chypre), plus tard réduite à сuprum. Ses composés sont couramment rencontrés en tant que sels de cuivre (II), qui confèrent souvent des couleurs bleues ou vertes minéraux tels que azurite et turquoise et ont été largement utilisés historiquement comme pigments. Structures architecturales construites avec corroder de cuivre pour donner verte vert de gris (ou patine). Art décoratif figure en bonne place le cuivre, à la fois par lui-même et dans le cadre de pigments.
Le cuivre est essentiel pour tous les organismes vivants comme une trace minéral alimentaire car il est un constituant essentiel du complexe enzymatique respiratoire cytochrome c oxydase. En mollusques et crustacés cuivre est un constituant du pigment de sang l'hémocyanine, qui est remplacé par le fer complexé hémoglobine chez les poissons et d'autres vertébrés. Les principaux domaines où le cuivre se trouve chez les animaux vertébrés sont le foie, les muscles et les os. En concentration suffisante, des composés de cuivre sont toxiques pour les organismes supérieurs et sont utilisés comme substances bactériostatiques, fongicides, et de préservation du bois.
Caractéristiques
Physique


Le cuivre, l'argent et l'or sont en groupe 11 du tableau périodique, et ils partagent certaines caractéristiques: ils ont un électron s-orbital au-dessus d'un d- rempli couche électronique et se caractérisent par une grande ductilité et conductivité électrique. D-coquilles remplies de ces éléments ne contribuent pas beaucoup aux interactions entre atomes, qui sont dominés par les s-électrons à travers liaisons métalliques. Contrairement aux métaux avec le D-coquilles incomplètes, liaisons métalliques en cuivre manquent un covalente caractère et sont relativement faibles. Ceci explique la faible dureté et de haute ductilité des monocristaux de cuivre. A l'échelle macroscopique, l'introduction de défauts étendus vers le réseau cristallin, tels que des joints de grains, empêche l'écoulement du matériau sous contrainte appliquée augmente sa dureté. Pour cette raison, le cuivre est généralement fourni dans un grain fin forme polycristalline, qui a plus de force que formes monocristallines.
La faible dureté du cuivre explique en partie sa conductivité électrique élevée (59,6 × 10 6 S / m) et ainsi également une conductivité thermique élevée, qui sont les deuxième plus élevé parmi les métaux purs à température ambiante. En effet, la résistivité de transport des électrons dans les métaux à température ambiante provient principalement de la diffusion des électrons sur les vibrations thermiques du réseau, qui sont relativement faibles pour un métal mou. La densité de courant maximale admissible de cuivre à l'air libre est d'environ 3,1 x 10 6 A / m 2 de surface de section transversale, au-delà duquel il commence à chauffer de manière excessive. Comme avec d'autres métaux, si le cuivre est placée contre un autre métal, corrosion galvanique se produit.
Avec le césium et l'or (à la fois jaune), et l'osmium (bleuâtre), le cuivre est l'un des quatre métaux élémentaires avec une couleur naturelle autre que gris ou argent. Le cuivre pur est orange-rouge et acquiert une teinte rougeâtre ternir lorsqu'il est exposé à l'air. La couleur caractéristique de résultats de cuivre à partir des transitions électroniques entre le 3 et coquilles atomiques rempli à moitié vides 4s - la différence d'énergie entre ces coquilles est telle qu'elle correspond à une lumière orange. Représente le même mécanisme pour la couleur jaune d'or et le césium.
Chimique


Cuivre forme une riche variété de composés avec des états d'oxydation 1 et 2, qui sont souvent appelés cuivreux et de cuivre, respectivement. Il ne réagit pas avec l'eau, mais il réagit lentement avec l'oxygène de l'air à former une couche d'oxyde de cuivre brun-noir. Contrairement à l'oxydation du fer par l'air humide, cette couche d'oxyde arrête la poursuite, à la corrosion en vrac. Une couche verte de vert de gris (carbonate de cuivre) peut souvent être vu sur les vieilles constructions de cuivre, tels que la Statue de la Liberté, la plus grande statue de cuivre dans le monde construit en utilisant Repoussé. Cuivre ternit lorsqu'il est exposé à les sulfures d'hydrogène et d'autres sulfures qui réagissent avec elle pour former divers sulfures de cuivre à la surface. Des solutions d'ammoniac contenant de l'oxygène donnent des complexes hydrosolubles avec le cuivre, de même que de l'oxygène et de l'acide chlorhydrique pour former des chlorures de cuivre et on acidifie le peroxyde d'hydrogène pour former des sels de cuivre (II). Cuivre (II) et le chlorure de cuivre comproportionate pour former de cuivre (I) de chlorure.
Isotopes
Il ya 29 isotopes de cuivre 63 Cu et 65 Cu sont stables, avec 63 Cu comprenant environ 69% de cuivre naturel. ils ont tous deux un spin de 3/2. Les autres isotopes sont radioactif, avec le plus stable étant 67 Cu avec une demi-vie de 61,83 heures. Sept isotopes métastables ont été caractérisés, avec 68m Cu la plus longue durée avec une demi-vie de 3,8 minutes. Les isotopes avec un nombre de masse supérieur à 64 désintégration par β -, tandis que ceux avec un nombre de masse 64 ci-dessous par la pourriture β +. 64 Cu, qui a une demi-vie de 12,7 heures, se désintègre dans les deux sens.
62 Cu et 64 Cu ont des applications importantes. 64 Cu est un agent de contraste radiologique pour l'imagerie de rayons X, et complexé avec un chelate peut être utilisé pour le traitement du cancer. 62 Cu est utilisé dans 62 Cu-PTSM qui est un traceur radioactif pour la tomographie par émission de positons.
Occurrence
Le cuivre est synthétisé dans les étoiles massives et est présent dans la croûte de la Terre à une concentration d'environ 50 parties par million (ppm), où il se produit comme cuivre natif ou en minéraux tels que les sulfures de cuivre chalcopyrite et chalcocite, carbonates de cuivre azurite et et la malachite cuivre (I) d'oxyde minéral cuprite. La plus grande masse de cuivre élémentaire découvert pesait 420 tonnes et a été trouvé en 1857 sur le Péninsule de Keweenaw dans Michigan, États-Unis. Cuivre natif est un polycristallin, avec le plus grand monocristal décrit mesure 4,4 x 3,2 x 3,2 cm.
Production

La plupart cuivre est extrait ou extrait sous forme de sulfures de cuivre de grande mines à ciel ouvert dans dépôts de cuivre porphyrique qui contiennent de 0,4 à 1,0% de cuivre. Des exemples comprennent Chuquicamata au Chili , Bingham mine Canyon dans l'Utah, aux États-Unis et La mine El Chino au Nouveau-Mexique, États-Unis. Selon le British Geological Survey, en 2005, le Chili était le premier producteur de la mine de cuivre avec au moins un tiers part du monde suivie par les États-Unis, l'Indonésie et le Pérou. Le cuivre peut aussi être récupéré à travers le Processus de lixiviation in situ. Plusieurs sites de l'État de l'Arizona sont les premiers candidats considérés pour cette méthode. La quantité de cuivre dans l'utilisation augmente et la quantité disponible est à peine suffisant pour permettre à tous les pays développés d'atteindre des niveaux mondiaux d'utilisation.
Réserves
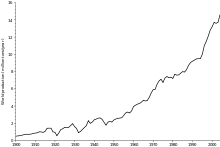
Le cuivre a été utilisé au moins dix mille années, mais plus de 95% de tout le cuivre et jamais extrait fondus a été extraite depuis 1900. Comme de nombreuses ressources naturelles, la quantité totale de cuivre sur Terre est vaste (environ 10 14 tonnes seulement dans le kilomètre supérieure de la croûte de la Terre, soit environ 5.000.000 années valeur au rythme actuel d'extraction). Cependant, seule une petite fraction de ces réserves est économiquement viable, compte tenu des prix et des technologies actuelles. Diverses estimations de réserves de cuivre existantes disponibles pour l'exploitation minière varient de 25 à 60 ans, selon les hypothèses de base tels que le taux de croissance. Le recyclage est une source importante de cuivre dans le monde moderne. En raison de ces facteurs et d'autres, l'avenir de la production de cuivre et de l'offre est l'objet de nombreux débats, y compris le concept de Cuivre Peak, analogue à Peak Oil.
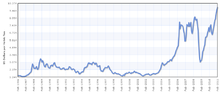
Le prix du cuivre a toujours été instable, et il quintuplé par rapport au creux de 60 ans de 0,60 $ US / lb (1,32 US $ / kg) en Juin 1999 à US $ 3,75 par livre (8,27 US $ / kg) en mai 2006. Il est tombé à US $ 2,40 / lb (5,29 US $ / kg) en Février 2007, puis a rebondi à US $ 3,50 / lb (7,71 US $ / kg) en Avril 2007. En Février 2009, l'affaiblissement de la demande mondiale et une forte baisse des prix des matières premières depuis les sommets de l'année précédente laissé prix du cuivre à US $ 1,51 / lb.
Méthodes
La concentration de cuivre dans les minerais moyennes de seulement 0,6%, et la plupart des minerais de sulfures sont commerciaux, en particulier la chalcopyrite (CuFeS 2) et à un degré moindre chalcocite (Cu 2 S). Ces minéraux sont concentrées à partir de minerais broyés au niveau de 10 à 15% de cuivre par mousse de flottation ou biolixiviation. Le chauffage de cette matière avec de la silice en fusion éclair enlève une grande partie du fer que le laitier. Le procédé exploite la plus grande facilité de convertir des sulfures de fer dans ses oxydes, qui à leur tour réagissent avec la silice pour former la scorie de silicate, qui flotte au-dessus de la masse chauffée. La matte de cuivre résultant constitué de Cu 2 S est alors rôti de convertir tous les sulfures en oxydes:
- 2 Cu 2 S + 3 O 2 → 2 Cu 2 O + 2 SO 2
L'oxyde cuivreux est converti en cuivre brut lors du chauffage:
- 2 Cu 2 O 4 → Cu 2 O +
Le Sudbury Procédé mat convertie seulement à la moitié de l'oxyde et sulfure ensuite utilisé cet oxyde pour éliminer le reste du soufre sous forme d'oxyde. Ce est alors électrolytique raffiné et la boue d'anode exploitée pour le platine et l'or qu'il contenait. Cette étape exploite la réduction relativement facile d'oxydes de cuivre en cuivre métallique. Le gaz naturel est soufflé à travers le blister pour enlever la plupart de l'oxygène restant et électroraffinage est effectué sur le matériau résultant pour produire du cuivre pur:
- Cu 2+ + 2 e - → Cu
Recyclage
Cuivre, comme l'aluminium, est recyclable à 100% sans aucune perte de qualité si à l'état brut ou contenues dans un produit manufacturé. En volume, le cuivre est le troisième métal le plus recyclé après le fer et l'aluminium. On estime que 80% du cuivre jamais extrait est encore en usage aujourd'hui. Selon le International des ressources du Groupe spécial Stocks de métaux dans les rapport de la Société, par habitant stock mondial de cuivre en usage dans la société est de 35 à 55 kg. Beaucoup de ceci est dans les pays les plus développés (140-300 kg par habitant) plutôt que les pays moins développés (30-40 kg par habitant).
Le processus de recyclage du cuivre suit à peu près les mêmes étapes que est utilisé pour extraire le cuivre, mais nécessite moins d'étapes. Cuivre de haute pureté ferraille est fondue dans un four et ensuite réduite et jeté dans billettes et lingots; déchets de faible pureté est affinée par électrodéposition dans un bain d'acide sulfurique.
Alliages
Nombreux alliages de cuivre existent, la plupart avec des utilisations importantes. Le laiton est un alliage de cuivre et de zinc . Bronze se réfère généralement à cuivre étain alliages, mais peut se référer à tout alliage de cuivre tels que bronze d'aluminium. Le cuivre est l'un des constituants les plus importants de carats argent et alliages d'or et carat soudures utilisés dans l'industrie des bijoux, modifier le point des alliages résultant couleur, la dureté et la fusion.
L'alliage de cuivre et de nickel, appelée cupronickel, est utilisé dans faible dénomination statuaire pièces , souvent pour le revêtement extérieur. Les États-Unis pièce de 5 cents appelé nickel se compose de 75% de cuivre et 25% de nickel et a une composition homogène. Le cuivre / 10% d'alliage de nickel à 90% est remarquable par sa résistance à la corrosion et est utilisé dans diverses parties étant exposé à l'eau de mer. Alliages de cuivre à l'aluminium (environ 7%) ont une couleur dorée agréable et sont utilisés dans les décorations. alliages de cuivre avec l'étain font partie de soudures sans plomb.
Composés

Composés binaires
Comme pour les autres éléments, les composés les plus simples de cuivre sont composés binaires, ce est à dire ceux contenant seulement deux éléments. Les principaux sont les oxydes, les sulfures et halogénures. Les deux cuivreux et oxydes cuivriques sont connus. Parmi les nombreux sulfures de cuivre, des exemples importants comprennent cuivre (I) sulfure et cuivre (II) sulfure.
Les halogénures cuivreux avec du chlore , le brome, et l'iode est connue, comme le sont les halogénures cuivriques avec le fluor, le chlore , et brome. Les tentatives pour préparer cuivre (II) donnent iodure et l'iode de l'iodure cuivreux.
- 2 Cu 2+ + 4 I - → 2 + I 2 Cul
La chimie de coordination

Cuivre, comme tous les métaux, formes des complexes de coordination avec ligands. En solution aqueuse, le cuivre (II) existe sous la forme [Cu (H 2 O) 6] 2+. Ce complexe présente le plus fort taux de change de l'eau (vitesse de ligands d'eau attacher et détacher) pour toute transition aquo complexe métallique. Ajout aqueuse d'hydroxyde de sodium provoque la précipitation d'un solide bleu clair cuivre (II) de l'hydroxyde. Une équation simplifiée est:
- Cu 2+ + 2 OH - → Cu (OH) 2
Résultats de l'ammoniaque aqueuse dans le même précipité. Après addition d'un excès d'ammoniac, le précipité se dissout, formant tetraamminecopper (II):
- Cu (H 2 O) 4 (OH) 2 + 4 NH 3 → [Cu (H 2 O) 2 (NH 3) 4] 2+ + H 2 O 2 + 2 OH -
Beaucoup d'autres oxyanions forment des complexes; il se agit notamment cuivre (II) acétate, le cuivre (II) nitrate , et cuivre (II) carbonate. cuivre (II) sulfate forme un penta cristalline bleu hydrate, qui est composé de cuivre les plus connus dans le laboratoire. Il est utilisé dans un fongicide appelé le Bouillie bordelaise.
Des polyols, des composés contenant plus d'un alcool groupe fonctionnel, généralement interagir avec des sels cuivriques. Par exemple, les sels de cuivre sont utilisés pour tester sucres réducteurs. Plus précisément, en utilisant Réactif de Benedict et Liqueur de Fehling la présence du sucre est signalée par un changement de couleur du bleu Cu (II) à rougeâtre cuivre (I) oxyde. Réactifs et connexes les complexes de Schweizer avec l'éthylènediamine et d'autres amines dissoudre la cellulose. Les acides aminés forment des complexes chelates très stables avec le cuivre (II). De nombreux tests chimiques humides pour les ions de cuivre existent, impliquant une ferrocyanure de potassium, ce qui donne un précipité brun avec des sels de cuivre (II).
Organocuivre chimie
Les composés qui contiennent une liaison carbone-cuivre sont connus en tant que composés organiques de. Ils sont très réactifs à l'égard de l'oxygène pour former de cuivre (I) et l'oxyde avoir de nombreuses utilisations en chimie. Ils sont synthétisés par traitement de cuivre (I) avec des composés Réactifs de Grignard, le terminal ou alcynes des réactifs d'organolithium; en particulier, la dernière réaction décrit un produit Réactif Gilman. Ceux-ci peuvent subir substitution avec des halogénures d'alkyle pour former produits de couplage; en tant que tels, ils sont importants dans le domaine de synthèse organique. Le cuivre (I) acétylure est très sensible aux chocs mais est un intermédiaire dans des réactions telles que la Cadiot-accouplement et la Chodkiewicz Couplage de Sonogashira. Outre conjugué à énones et carbocupration d'alcynes peut également être obtenu avec des composés organiques de. Le cuivre (I) forme une variété de complexes faibles avec des alcènes et de monoxyde de carbone , en particulier en présence de ligands de type amine.
Cuivre (III) et le cuivre (IV)
Cuivre (III) est le plus typiquement trouvé dans oxydes. Un exemple simple est le potassium cuprate, KCuO 2, un solide bleu-noir. Les meilleurs cuivre étudié composés (III) sont les supraconducteurs cuprates. Yttrium oxyde de cuivre de baryum (YBa 2 Cu 3 O 7) est constituée à la fois de Cu (II) et Cu (III) des centres. Comme oxyde, fluorure est un anion fortement basique et est connue pour stabiliser les ions métalliques dans les états d'oxydation élevés. En effet, à la fois de cuivre (III), et même de cuivre (IV) sont connus fluorures, K 3 CuF 6 et Cs 2 CuF 6, respectivement.
Certaines protéines de cuivre forment complexes oxo, qui disposent également du cuivre (III). Avec di- et tri peptides, de cuivre de couleur pourpre (III) sont stabilisées par la déprotoné ligands amide.
Complexes de cuivre (III) sont également observées comme intermédiaires dans des réactions de composés organo.
Histoire
Âge du cuivre

Cuivre produit naturellement comme le cuivre natif et était connu pour certaines des plus anciennes civilisations au dossier. Il a une histoire de l'utilisation qui est âgé d'au moins dix mille années, et les estimations de sa découverte placent au 9000 BC dans le Moyen-Orient; un pendentif en cuivre a été trouvé dans le nord de l'Irak qui remonte à 8700 avant JC. Il existe des preuves que l'or et fer météorique (mais pas la fusion de fer) ont été les seuls métaux utilisés par les humains avant cuivre. L'histoire de la métallurgie du cuivre est supposé avoir suivi la séquence suivante: 1) travail à froid des cuivre natif, 2) recuit, 3) fusion, et 4) la méthode de la cire perdue. Dans le sud de l'Anatolie, tous les quatre de ces techniques métallurgiques semble plus ou moins simultanément au début du néolithique c. 7500 BC. Cependant, tout comme l'agriculture a été inventé indépendamment dans plusieurs régions du monde (y compris le Pakistan, la Chine et les Amériques) fonderie de cuivre a été inventé localement dans plusieurs endroits différents. Il a probablement été découvert indépendamment en Chine avant 2800 BC, en Amérique centrale peut-être autour de 600 après JC, et en Afrique de l'Ouest au sujet de la 9e ou 10e siècle de notre ère. Coulée de a été inventé en 4500-4000 avant JC en Asie du Sud-Est et datation au carbone a établi minière au Alderley Edge dans Cheshire, Royaume-Uni à 2280-1890 BC. Ötzi, un homme datant de 3300-3200 avant JC, a été trouvé avec une hache avec une tête de cuivre de 99,7% pure; des niveaux élevés de l'arsenic dans ses cheveux suggèrent son implication dans la fonte du cuivre. Expérience avec le cuivre a contribué à l'élaboration d'autres métaux; en particulier, la fonte du cuivre a conduit à la découverte de la fonte du fer. La production dans le Complexe de cuivre vieille de Michigan et Wisconsin est datée entre 6000 et 3000 avant JC. Bronze naturel, un type de cuivre fabriqués à partir de minerais riches en silicium, l'arsenic et (rarement) l'étain, est entré en usage général dans les Balkans autour de 5500 BC. Auparavant, le seul outil en cuivre avait été le poinçon, utilisé pour trous dans le cuir de poing et arracher les chevilles des trous pour rejoindre le bois. Toutefois, l'introduction d'une forme plus robuste du cuivre a conduit à la généralisation, et la production à grande échelle des outils de métaux lourds, y compris les axes, herminettes, et Ax-herminettes.
Âge De Bronze
Alliage de cuivre avec de l'étain pour fabriquer du bronze était d'abord pratiqué environ 4000 ans après la découverte de la fonte de cuivre, et environ 2000 années après "bronze naturel» étaient entrés en usage général. Bronze artefacts de sumériens et villes égyptiennes artefacts de cuivre et les alliages de bronze datent de 3000 av. L' âge du bronze a commencé en Europe du Sud autour de 3700 - 3300 BC, au nord-ouest l'Europe environ 2500 BC. Elle a pris fin avec le début de l'âge du fer, 2000-1000 BC dans le Proche-Orient, 600 BC en Europe du Nord. La transition entre la Néolithique et de l'âge du bronze était autrefois appelée Chalcolithique (cuivre-pierre), avec des outils de cuivre étant utilisé avec des outils de pierre. Ce terme se est progressivement tombé en disgrâce parce que dans certaines parties du monde, la Calcholithic et du néolithique sont coïncidents aux deux extrémités. Laiton, un alliage de cuivre et de zinc, est d'origine beaucoup plus récente. Il était connu des Grecs, mais il est devenu un complément important pour le bronze lors de l'Empire romain.
Antiquité et Moyen Âge


En Grèce, le cuivre a été connu sous le nom chalkos (χαλκός). Ce est une ressource importante pour les Romains, les Grecs et les autres peuples anciens. A l'époque romaine, il était connu comme aes Cyprium, aes étant le terme latin générique pour les alliages de cuivre et Cyprium de Chypre , où une grande partie de cuivre a été exploité. La phrase a été simplifiée pour cuprum, d'où le cuivre anglais. Aphrodite et Venus représenté cuivre dans la mythologie et l'alchimie, à cause de sa beauté brillante, son utilisation ancienne dans les miroirs de production, et son association avec Chypre, qui était sacré pour la déesse. Les sept corps célestes connus des anciens ont été associés avec les sept métaux connus dans l'antiquité, et Vénus a été affecté au cuivre.
La première utilisation de la Grande-Bretagne se est produite en laiton autour du 3ème au 2ème siècle avant JC. En Amérique du Nord, les mines de cuivre a commencé avec fonctionnement marginaux par les Amérindiens. Cuivre natif est connu pour avoir été extraite de sites sur Isle Royale avec des outils de pierre primitifs entre 800 et 1600. métallurgie du cuivre a été florissante en Amérique du Sud, en particulier au Pérou vers l'an 1000; il a procédé à un rythme beaucoup plus lent sur d'autres continents. Cuivre plantes ornementales funéraires du 15e siècle ont été découverts, mais la production commerciale de métal n'a pas commencé avant le début du 20e siècle.
Le rôle culturel du cuivre a joué un rôle important, en particulier dans la monnaie. Romains dans la 6ème à la 3ème siècle avant JC utilisé des morceaux de cuivre que l'argent. Dans un premier temps, le cuivre se est apprécié, mais peu à peu la forme et l'apparence du cuivre est devenu plus important. Jules César avait ses propres pièces en laiton, tandis que Octavien Auguste César pièces s 'ont été faites à partir d'alliages Cu-Pb-Sn. Avec une production annuelle estimée à environ 15 000 t, Activités minières et des fonderies de cuivre romaine atteint une échelle inégalée jusqu'à ce que le moment de la révolution industrielle ; les provinces les plus intensément exploitées étaient ceux de Hispania, Chypre et en Europe centrale.
Les portes de la Temple de Jérusalem utilisé Bronze corinthien faite par l'épuisement dorure. Ce était le plus répandu dans Alexandrie, où l'alchimie est supposé avoir commencé. Dans l'Inde ancienne, le cuivre a été utilisé dans la science médicale holistique Ayurveda pour les instruments chirurgicaux et autres équipements médicaux. Les anciens Egyptiens (~ 2400 BC) ont utilisé le cuivre pour stériliser les plaies et l'eau potable, et plus tard pour les maux de tête, des brûlures et des démangeaisons. Le Bagdad batterie, avec des cylindres de cuivre soudées au plomb, remonte à 248 av JC à 226 et ressemble à une cellule galvanique, conduisant les gens à croire que ce était la première batterie; la demande n'a pas été vérifiée.
Période Moderne

Le Grande Copper Mountain était une mine à Falun, en Suède, qui opérait à partir du 10ème siècle à 1992. Il a produit deux tiers de la demande de cuivre de l'Europe au 17ème siècle et a aidé à financer un grand nombre de guerres de la Suède pendant cette période. Il a été désigné comme le trésor de la nation; La Suède avait une cuivre devise soutenue.
Les usages du cuivre dans l'art ne se limitaient pas à la monnaie: il a été utilisé par la Renaissance sculpteurs, dans la technologie photographique connu sous le nom daguerréotype, et de la Statue de la Liberté. placage de cuivre et gaine de cuivre pour les coques de navires a été généralisée; les navires de Christophe Colomb étaient parmi les premiers à avoir cette fonction. Le Norddeutsche Affinerie à Hambourg était le premier moderne galvanoplastie usine à partir de sa production en 1876. Le scientifique allemand Gottfried Osann inventé métallurgie des poudres en 1830 lors de la détermination de la masse atomique du métal; autour puis il a été découvert que la quantité et le type de l'élément d'alliage (par exemple, l'étain) au cuivre affecteraient tons de sonnerie. La fusion flash a été développé par Outokumpu en Finlande et de la première application Harjavalta en 1949; explique le processus à haut rendement énergétique pour 50% de la production de cuivre primaire du monde.
Le Conseil intergouvernemental des pays exportateurs de cuivre, formés en 1967 avec le Chili, le Pérou, le Zaïre et la Zambie, a joué un rôle similaire pour le cuivre que OPEP fait pour le pétrole. Il n'a jamais atteint la même influence, en particulier parce que le deuxième producteur, aux États-Unis, n'a jamais été membre; elle a été dissoute en 1988.
Applications

Les principales applications de cuivre sont dans les fils électriques (60%), la toiture et de plomberie (20%) et les machines industrielles (15%). Le cuivre est souvent utilisé en tant que métal, mais quand une dureté plus élevée est requis, il est combiné avec d'autres éléments pour faire un alliage (5% de la consommation totale) de telle sorte que laiton et bronze. Une petite partie de l'approvisionnement en cuivre est utilisé dans la production de composés pour les suppléments nutritionnels et les fongicides dans l'agriculture. Usinage de cuivre est possible, mais il est généralement nécessaire d'utiliser un alliage de pièces complexes pour obtenir de bonnes caractéristiques d'usinabilité.
Fils et câbles
Malgré la concurrence des autres matériaux, le cuivre reste le préféré conducteur électrique dans presque toutes les catégories de câblage électrique avec la principale exception étant les frais généraux transmission d'énergie électrique où l'aluminium est souvent préféré. Le fil de cuivre est utilisé dans la production d'énergie, transmission de puissance, distribution d'énergie, les télécommunications , l'électronique circuit, et d'innombrables types de équipement électrique. Le câblage électrique est le marché le plus important pour l'industrie du cuivre. Cela inclut fils de bâtiment, câble de communication, câble de distribution d'alimentation, le câble de l'appareil, les fils et câbles pour l'automobile, et de fil de bobinage. Environ la moitié de tous cuivre extrait est utilisé pour la fabrication de fils et câbles conducteurs électriques. De nombreux appareils électriques se appuient sur le câblage de cuivre en raison de sa multitude de propriétés bénéfiques inhérentes, comme sa haute conductivité électrique, résistance à la traction, ductilité, fluage (déformation) la résistance, la corrosion résistance, faible dilatation thermique, haute conductivité thermique, soudabilité, et facilité d'installation.

Les circuits intégrés et cartes de circuits imprimés disposent de plus en plus du cuivre à la place de l'aluminium en raison de sa conductivité électrique supérieure (voir interconnexion de cuivre pour l'article principal); dissipateurs de chaleur et échangeurs de chaleur utilisent cuivre en raison de sa capacité supérieure de dissipation de chaleur à l'aluminium. Les électro-aimants, tubes à vide, tubes cathodiques, et magnétrons dans les fours à micro-ondes utilisent le cuivre, comme le font guides d'ondes pour le rayonnement de micro-ondes.
Moteurs électriques
La plus grande de cuivre conductivité par rapport à d'autres matériaux métalliques améliore l'efficacité de l'énergie électrique de moteurs. Ce est important parce que les moteurs et les systèmes motorisés représentent 43% -46% de la consommation mondiale d'électricité et 69% de toute l'électricité utilisée par l'industrie. L'augmentation de la section de masse et de croix de cuivre dans un bobine augmente l'efficacité de l'énergie électrique du moteur. rotors de moteurs de cuivre, une nouvelle technologie conçue pour les applications automobiles où les économies d'énergie sont les premiers objectifs de conception, permettent à usage général moteurs à induction pour satisfaire et dépasser Electrical Manufacturers Association nationale (NEMA) normes d'efficacité prime.
Architecture


Le cuivre a été utilisé depuis l'antiquité comme une solution durable, résistant à la corrosion et aux intempéries matériau architectural. Toits, solins, gouttières, descentes pluviales, dômes, clochers, voûtes, et portes ont été fabriqués à partir de cuivre pour des centaines ou des milliers d'années. Usage architectural de cuivre a été élargi dans les temps modernes d'inclure intérieur et extérieur revêtement de mur, bâtiment joints de dilatation, fréquence radio blindage, et produits d'intérieur antimicrobiens, tels que les mains courantes attractifs, les sanitaires, et les comptoirs. Certains des autres avantages importants de cuivre comme matériau architectural comprennent sa faible mouvement thermique, poids léger, protection contre la foudre , et sa recyclabilité.
Vert naturel distinctif de la métal patine a longtemps été convoité par les architectes et les designers. La patine finale est une couche particulièrement résistante qui est hautement résistant à la corrosion atmosphérique, ce qui protège le métal sous-jacent contre les intempéries plus. Il peut être un mélange de composés de carbonate et de sulfate en diverses quantités, en fonction des conditions environnementales telles que l'acide contenant du soufre pluie. Architectural cuivre et ses alliages peuvent également être «Terminé» pour lancer un look particulier, sentir, et / ou couleur. Finitions comprennent les traitements mécaniques de surface, colorant chimique, et des revêtements.
Le cuivre a une excellente brasage et propriétés de soudage et peuvent être soudés ; les meilleurs résultats sont obtenus avec soudage à l'arc métallique sous gaz .
Applications Antibiofouling
Le cuivre est utilisé depuis longtemps en tant que surface biostatique à des parties de la ligne de navires pour se protéger contre les bernacles et moules. Il a été initialement utilisé pur, mais a depuis été remplacé par Métal Muntz. Les bactéries ne se développent sur une surface de cuivre, car il est biostatique. De même, comme décrit dans alliages de cuivre dans l'aquaculture, les alliages de cuivre sont devenus des matériaux de compensation importants dans le industrie de l'aquaculture en raison du fait qu'ils sont antimicrobien et prévenir encrassement biologique, même dans des conditions extrêmes et avoir de solides structurelles et résistant à la corrosion propriétés dans les milieux marins.
Applications antimicrobiennes
De nombreuses études d'efficacité antimicrobiens ont été menées au cours des 10 dernières années en ce qui concerne l'efficacité du cuivre pour détruire un large éventail de bactéries, ainsi que virus influenza A, l'adénovirus, et les champignons .
Surfaces tactiles alliage de cuivre ont des propriétés intrinsèques naturelles pour détruire un large éventail de les micro-organismes (par exemple, E. coli O157: H7, résistant à la méthicilline Staphylococcus aureus ( SARM), Staphylococcus, Clostridium difficile, virus influenza A, adénovirus et champignons ). Quelques 355 alliages de cuivre ont été prouvés pour tuer plus de 99,9% des bactéries pathogènes en seulement deux heures lorsqu'ils sont nettoyés régulièrement. Le Environmental Protection Agency des États-Unis (EPA) a approuvé les inscriptions de ces alliages de cuivre comme " matériaux antimicrobiens avec les prestations de santé publique », qui permet aux fabricants de faire légalement revendications quant aux avantages de produits fabriqués avec des alliages de cuivre antimicrobiens enregistrés de santé publique positifs. En outre, l'EPA a approuvé une longue liste de produits de cuivre antimicrobiens fabriqués à partir de ces alliages, tels que les ridelles, rampes, tables plus-lit, éviers, robinets, poignées de porte, matériel de toilette, claviers d'ordinateur, équipement de club de santé, commerciaux poignées de panier, etc. (pour une liste complète de produits, voir: En alliage de cuivre antimicrobien tactiles # surfaces de produits approuvés). poignées de porte en cuivre sont utilisés par les hôpitaux pour réduire la transmission de maladies, et La maladie du légionnaire est supprimé par un tube de cuivre dans les systèmes de plomberie. Produits en alliage de cuivre antimicrobiens sont maintenant installés dans les établissements de soins de santé au Royaume-Uni, l'Irlande, le Japon, la Corée, la France, le Danemark et le Brésil et dans le système de transit de métro à Santiago, au Chili, lorsque les mains courantes en alliage de cuivre-zinc seront installés dans certains 30 stations entre 2011-2014.
D'autres utilisations
Les composés de cuivre sous forme liquide sont utilisés comme agent de conservation du bois, en particulier dans le traitement de partie originale de structures lors de la restauration des dommages dus à pourriture sèche. Ensemble de zinc, des fils de cuivre peut être placé sur les matériaux de couverture non conducteurs pour décourager la croissance de la mousse. Fibres textiles utilisent cuivre pour créer des tissus de protection antimicrobiens, comme le font glaçures céramiques, vitraux et instruments de musique . Galvanoplastie utilise couramment cuivre comme une base pour d'autres métaux comme le nickel.
Le cuivre est l'un des trois métaux, le long de plomb et d'argent, utilisé dans une procédure d'essai de matériaux de musée appelé le test de Oddy. Dans ce procédé, le cuivre est utilisé pour détecter des chlorures, des oxydes et composés sulfurés.
Le cuivre est également souvent dans les bijoux, et le folklore dit que des bracelets de cuivre soulagerles symptômes de l'arthrite, même si cela a été montré pour être incorrect.
L'oxyde de cuivre et le carbonate est utilisé dansla fabrication du verreetémaux céramiques pour conférer des couleurs vertes et brunes.
Rôle biologique

les protéines de cuivre ont divers rôles dans le transport d'électrons et le transport biologique de l'oxygène, procédés qui exploitent l'interconversion facile de Cu (I) et Cu (II). Le rôle biologique pour le cuivre a commencé avec l'apparition de l'oxygène dans l'atmosphère de la terre. La protéine de patelle est le transporteur d'oxygène dans la plupart des mollusques et certains arthropodes comme la limule ( Limulus polyphemus ). Parce hemocyanin est bleu, ces organismes ont le sang bleu, pas le sang rouge trouvé dans les organismes qui comptent sur l'hémoglobine à cet effet. Structurellement liés à hemocyanin sont les laccases et tyrosinases. Au lieu de façon réversible l'oxygène de liaison, ces protéines substrats hydroxyler, illustrée par leur rôle dans la formation de laques.
Le cuivre est également un composant d'autres protéines associées à la transformation de l'oxygène. En cytochrome c oxydase, qui est nécessaire pour aérobie respiration, le cuivre et le fer coopérer dans la réduction de l'oxygène. Le cuivre est également présent dans de nombreuses superoxyde dismutases, des protéines qui catalysent la décomposition des superoxydes, en le convertissant (par dismutation) de l'oxygène et du peroxyde d'hydrogène :
- 2 HO2→ H2O2+ O2
Plusieurs protéines de cuivre, tels que les protéines de cuivre "bleu", ne pas interagir directement avec des substrats, par conséquent, ils ne sont pas des enzymes. Ces protéines relais électrons par le processus appelé transfert d'électrons.
Les besoins nutritionnels
Le cuivre est un élément essentiel oligo-éléments dans les plantes et les animaux, mais pas certains micro-organismes. Le corps humain contient du cuivre à un niveau d'environ 1,4 à 2,1 mg par kg de masse corporelle. Autrement dit, la RDA pour le cuivre chez les adultes en bonne santé normaux est cité comme 0,97 mg / jour et de 3,0 mg / jour. Le cuivre est absorbé dans l'intestin, puis transporté vers le foie lié à l'albumine. Après le traitement dans le foie, le cuivre est distribué à d'autres tissus dans une seconde phase. le transport de cuivre ici implique la protéine céruloplasmine, qui transporte la majeure partie de cuivre dans le sang. Céruloplasmine porte également du cuivre qui est excrété dans le lait, et est particulièrement bien absorbé comme une source de cuivre. Le cuivre dans le corps subit normalement la circulation entéro-hépatique (environ 5 mg par jour, par rapport à environ 1 mg par jour dans le régime alimentaire absorbé et excrété par le corps), et le corps est capable d'excréter un certain excès de cuivre, le cas échéant, par l'intermédiaire de la bile, du cuivre qui porte sur le foie qui ne sont pas alors réabsorbé par l'intestin.
Troubles à base de cuivre-
En raison de son rôle en facilitant l'absorption du fer,carence en cuivre peut produirel'anémiedes symptômes semblables,neutropénie, des anomalies osseuses, hypopigmentation, troubles de la croissance, augmentation de l'incidence des infections, l'ostéoporose, l'hyperthyroïdie, et des anomalies dans le métabolisme du glucose et de cholestérol. Inversement, La maladie de Wilson provoque une accumulation du cuivre dans les tissus du corps.
Une carence grave peut être trouvé en testant pour de faibles niveaux de superoxyde dismutase des globules rouges niveaux sériques de cuivre à faible plasma ou à faible céruloplasmine, et; ceux-ci ne sont pas sensibles à l'état de cuivre marginal. Le «activité c oxydase cytochrome de leucocytes et des plaquettes" a été déclaré comme un autre facteur dans le déficit, mais les résultats ont pas été confirmée par la réplication.
| NFPA 704 |
|---|
 0 2
0 |
| diamant feu pour le métal de cuivre |
des quantités de gramme de divers sels de cuivre ont été prises dans les tentatives de suicide et produit la toxicité du cuivre aiguë chez l'homme, peut-être due à un cycle de redox et la génération d' espèces réactives de l'oxygène qui endommagent l'ADN . Montants correspondants des sels de cuivre (30 mg / kg) sont toxiques pour les animaux. Une valeur alimentaire minimum pour une croissance saine dans les lapins a été signalé à être d'au moins 3 ppm dans le régime alimentaire. Cependant, des concentrations plus élevées de cuivre (à 100 ppm, 200 ppm ou 500 ppm) dans l'alimentation des lapins peuvent influencer favorablement efficacité de conversion alimentaire, taux de croissance, et les pourcentages carcasse de chambre.
Toxicité chronique au cuivre ne se produit pas normalement chez l'homme en raison de systèmes de transport qui régulent l'absorption et l'excrétion. Mutations autosomiques récessives dans les protéines de transport de cuivre peuvent désactiver ces systèmes, conduisant à la maladie de Wilson avec une accumulation de cuivre et de la cirrhose du foie chez les personnes qui ont hérité de deux gènes défectueux.


