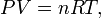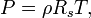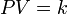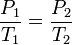Gaz
À propos de ce écoles sélection Wikipedia
Ce contenu de Wikipedia a été sélectionné par SOS Enfants d'aptitude dans les écoles à travers le monde. Cliquez ici pour en savoir plus sur le parrainage d'enfants.
| Mécanique des milieux continus |
|---|
 |
Lois
|
Mécanique des solides
|
|
Rhéologie
|
Le gaz est l'un des les quatre états fondamentaux de la matière (les autres étant solide , liquide et plasma ). Un gaz pur peut être constitué d'atomes individuels (par exemple, un gaz noble ou de gaz atomique comme le néon ), élémentaires des molécules composées d'un type d'atome (par exemple l'oxygène ), ou composés des molécules composées d'une variété d'atomes (par exemple le dioxyde de carbone ). Un gaz mélange contiendrait une variété de gaz purs tout comme l' air . Ce qui distingue un gaz à partir de matières liquides et solides est la grande séparation des particules individuelles de gaz. Cette séparation permet généralement un gaz incolore invisible à l'observateur humain. L'interaction de particules de gaz en présence d'électrique et champs gravitationnels sont considérées comme négligeables, comme indiqué par les vecteurs de vitesse constante de l'image.
L'état gazeux de la matière se trouve entre les états liquides et de plasma, dont la dernière fournit la limite supérieure de température pour les gaz. Délimitant l'extrémité inférieure des température mensonge dégénératives gaz quantiques à grande échelle qui gagnent une attention croissante. Haute densité gaz atomique super-refroidi à très basse température sont classés par leur comportement statistique soit comme un Gaz de Bose ou d'un Gaz de Fermi. Pour une liste complète de ces états exotiques de la matière voir liste des états de la matière.
Étymologie
Le gaz de mot est un néologisme utilisé d'abord par le début du 17ème siècle Flamand chimiste JB Van Helmont. La parole de Van Helmont semble avoir été tout simplement une transcription phonétique du grec mot χάος Chaos - la g en néerlandais étant prononcé comme le ch anglais - dans ce cas, Van Helmont a simplement suivi l'établie alchimique utilisation abord attesté dans les œuvres de Paracelse. Selon la terminologie de Paracelse, le chaos signifie quelque chose comme "l'eau ultra-raréfié".
Caractéristiques physiques

Comme la plupart des gaz sont difficiles à observer directement, ils sont décrits à l'aide de quatre propriétés physiques ou caractéristiques macroscopiques: la pression, le volume, nombre de particules (groupe de chimistes eux par mole) et de la température . Ces quatre caractéristiques ont été observé à plusieurs reprises par des scientifiques tels que Robert Boyle , Jacques Charles, John Dalton , Joseph Gay-Lussac et Amedeo Avogadro pour une variété de gaz dans divers contextes. Leurs études détaillées ont finalement abouti à une relation mathématique entre ces propriétés exprimées par le loi des gaz parfaits (voir la section des modèles simplifiés ci-dessous).
des particules de gaz sont largement séparés les uns des autres, et ont par conséquent des liaisons intermoléculaires faibles que liquides ou solides. Ces résultent des forces intermoléculaires des interactions électrostatiques entre les particules du gaz. Comme chargée zones de différentes particules de gaz repoussent, tandis que les régions de charge opposée de différentes particules de gaz se attirent; gaz qui contiennent chargées de façon permanente ions sont connus comme les plasmas . Composés gazeux avec liaisons covalentes polaires contiennent déséquilibres de charge permanents et les forces intermoléculaires donc l'expérience relativement fortes, bien que la molécule tandis charge nette du composé reste neutre. Charges transitoires, au hasard induites existent à travers non polaire des liaisons covalentes des molécules et des interactions électrostatiques provoquées par les sont appelées forces de Van der Waals . L'interaction de ces forces intermoléculaires varie dans une substance qui détermine la plupart des propriétés physiques uniques de chaque gaz. Une comparaison des points d'ébullition pour les composés formés par des liaisons ioniques et covalentes nous conduit à cette conclusion. Les particules de fumée à la dérive dans l'image permet d'entrevoir le comportement de gaz à basse pression.
Comparativement aux autres états de la matière, gaz ont une faible densité et viscosité. La pression et la température influencent les particules dans un certain volume. Cette variation de la séparation des particules et de vitesse est appelé compressibilité. Cette séparation des particules de taille et influence les propriétés optiques des gaz comme peuvent être trouvées dans ce qui suit liste des indices de réfraction. Enfin, les particules de gaz ou écartées diffuser afin de se répartir de façon homogène dans tout récipient.
Macroscopique
En observant un gaz, il est typique de préciser un cadre de référence ou échelle de longueur. Une échelle de longueur plus grande correspond à une point de vue macroscopique du gaz ou mondial. Cette région (appelée volume) doit être de taille suffisante pour contenir un grand échantillon de particules de gaz. L'analyse statistique résultant de cet échantillon produit le comportement «moyen» (c.-à-vitesse, de température ou de pression) de toutes les particules de gaz dans la région. En revanche, une échelle de longueur plus petite correspond à une point de vue microscopique ou de particules.
Macroscopiquement, les caractéristiques du gaz sont mesurées soit en termes de particules de gaz lui-même (vitesse, pression, température ou) ou leur environnement (en volume). Par exemple, Robert Boyle a étudié la chimie pneumatique pour une petite partie de sa carrière. Un de ses expériences liées Les propriétés macroscopiques de pression et le volume d'un gaz. Son expérience a utilisé un tube en J manomètre qui ressemble à un tube à essai dans la forme de la lettre J. Boyle piégé un gaz inerte dans l'extrémité fermée du tube à essai avec une colonne de mercure , ce qui rend le nombre de particules et la température constante. Il a observé que lorsque la pression a été augmentée dans le gaz, en ajoutant plus de mercure à la colonne, le «volume de gaz piégé a diminué (ce qui est connu comme un relation inverse). En outre, lorsque multiplié Boyle la pression et le volume de chaque observation, la produit était constante. Cette relation se est tenue pour chaque gaz qui Boyle observé conduisant à la loi, (PV = k), nommé pour honorer son travail dans ce domaine.
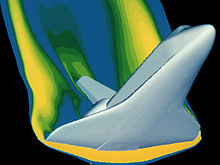
Il existe de nombreux outils mathématiques disponibles pour analyser les propriétés de gaz. Comme gaz sont soumis à des conditions extrêmes, ces outils deviennent un peu plus complexe, de la Équations d'Euler pour l'écoulement non visqueux aux équations de Navier-Stokes qui représentent pleinement les effets visqueux. Ces équations sont adaptées aux conditions de l'installation de gaz en question. L'équipement de laboratoire de Boyle a permis l'utilisation de l'algèbre pour obtenir ses résultats analytiques. Ses résultats ont été possibles parce qu'il étudiait gaz dans des situations relativement basse pression où ils se sont comportés d'une manière «idéale». Ces relations se appliquent au idéal calculs de sécurité pour une variété de conditions de vol sur les matériaux utilisés. L'équipement de haute technologie en usage aujourd'hui a été conçu pour nous aider à explorer en toute sécurité les environnements d'exploitation plus exotiques où les gaz se comportent plus de manière «idéale». Ce mathématiques avancées, y compris des statistiques et Fonction de plusieurs variables, rend possible la solution à ces situations complexes et dynamiques que la rentrée de véhicule spatial. Un exemple est l'analyse de la rentrée de la navette spatiale photo pour assurer les propriétés du matériau sous cette condition de chargement sont appropriées. Dans ce régime de vol, le gaz ne est plus comporte idéalement.
Pression
Le symbole utilisé pour représenter la pression dans les équations est "p" ou "P" avec les unités SI de pascals.
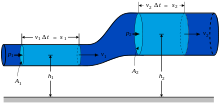
Lors de la description d'un conteneur de gaz, le terme pression (ou la pression absolue) se réfère à la force moyenne par unité de surface que le gaz exerce sur la surface du récipient. Dans ce volume, il est parfois plus facile de visualiser les particules de gaz se déplaçant en ligne droite jusqu'à ce qu'ils entrent en collision avec le récipient (voir le schéma en haut de l'article). La force appliquée par une particule de gaz dans le récipient au cours de cette collision correspond à la variation dynamique de la particule. Lors d'une collision seulement la (géométrie) composante normale de changements de vitesse. Une particule se déplaçant parallèlement à la paroi ne change pas son élan. Par conséquent, la force moyenne sur une surface doit être la variation moyenne de la quantité de mouvement de l'ensemble de ces collisions de particules de gaz.
La pression est la somme de tous les composants normaux de force exercée par les particules en contact les parois du récipient divisé par l'aire de surface de la paroi.
Température

Le symbole utilisé pour représenter la température dans les équations est T avec des unités SI de kelvins .
La vitesse d'une particule de gaz est proportionnelle à sa température absolue . Le volume de la bulle dans la vidéo se rétrécit lorsque les particules de gaz piégé ralentissent avec l'addition d'azote extrêmement froid. La température de toute système physique est liée aux mouvements des particules (molécules et les atomes) qui composent le système [de gaz]. Dans la mécanique statistique , la température est la mesure de l'énergie cinétique moyenne stockée dans une particule. Les méthodes de stockage de cette énergie sont dictées par le degrés de liberté de la particule elle-même ( modes d'énergie). L'énergie cinétique ajoutée ( processus endothermique) à des particules de gaz par voie de collisions produit linéaire, de rotation et le mouvement vibratoire. En revanche, dans une molécule d'une substance solide ne peut accroître ses modes de vibration avec l'ajout de chaleur que la structure de réseau cristallin linéaire et empêche à la fois des mouvements de rotation. Ces molécules de gaz chauffés ont une grande plage de vitesse qui varie constamment en raison de collisions avec d'autres particules constants. La plage de vitesse peut être décrit par la Distribution de Maxwell-Boltzmann. L'utilisation de cette distribution suppose gaz parfaits près équilibre thermodynamique pour le système de particules à l'étude.
Volume spécifique
Le symbole utilisé pour représenter volume spécifique dans les équations est "v" avec les unités SI de mètres cubes par kilogramme.
Le symbole utilisé pour représenter le volume dans les équations est "V" avec les unités SI de mètres cubes.
Lors d'une thermodynamique analyse, il est typique de la parole propriétés intensives et extensives. Propriétés qui dépendent de la quantité de gaz (soit par masse ou volume) sont appelés vastes propriétés, tandis que les propriétés qui ne dépendent pas de la quantité de gaz sont appelés propriétés intensives. Volume spécifique est un exemple d'une propriété intensive parce que ce est le rapport du volume occupé par une unité de masse d'un gaz qui est identique dans l'ensemble d'un système à l'équilibre. 1000 atomes d'un gaz occupent le même espace que les autres 1 000 atomes pour ne importe quelle température et une pression données. Ce concept est plus facile à visualiser pour des solides tels que le fer , qui sont incompressible par rapport aux gaz. Etant donné qu'un gaz remplit le contenant dans lequel il est placé, le volume est une propriété très étendue.
Densité
Le symbole utilisé pour représenter la densité dans les équations est ρ (rho) avec les unités SI de kilogrammes par mètre cube. Ce terme est le réciproque de volume spécifique.
Comme les molécules de gaz peuvent se déplacer librement dans un conteneur, leur masse est normalement caractérisée par la densité. La densité est la quantité de masse par unité de volume d'une substance, ou l'inverse du volume spécifique. Pour les gaz, la densité peut varier sur une large gamme, car les particules sont libres de se rapprocher lorsque contraint par la pression ou de volume. Cette variation de densité est appelée compressibilité. Comme la pression et la température, la densité est un variable d'état d'un gaz et le changement de densité lors de tout processus est régi par les lois de la thermodynamique. Pour un gaz statique, la densité est la même dans l'ensemble du conteneur. Densité est donc un quantité scalaire. Il peut être démontré par la théorie cinétique que la densité est inversement proportionnelle à la taille du récipient dans lequel une masse fixe de gaz est confiné. Dans ce cas, d'une masse fixe, la densité diminue à mesure que le volume augmente.
Microscopique
Si l'on pouvait observer un gaz sous un puissant microscope, on verrait un ensemble de particules (molécules, atomes, ions, électrons, etc.) sans aucune forme définie ou le volume qui sont en mouvement plus ou moins aléatoire. Ces particules de gaz neutre ne changent de direction lorsqu'ils entrent en collision avec une autre particule ou avec les côtés du conteneur. Dans un gaz parfait, ces collisions sont parfaitement élastique. Cette particule ou vue microscopique d'un gaz est décrit par la Théorie cinétique moléculaire. Les hypothèses derrière cette théorie peuvent être trouvés dans la section des postulats Théorie cinétique.
Théorie cinétique
Théorie cinétique permet de mieux comprendre les propriétés macroscopiques des gaz en tenant compte de leur composition moléculaire et le mouvement. En commençant par les définitions de l'élan et de l'énergie cinétique , on peut utiliser le conservation de l'impulsion et les relations géométriques d'un cube de relier les propriétés macroscopiques du système de température et de pression à la propriété microscopique de l'énergie cinétique par molécule. La théorie fournit des valeurs pour ces deux propriétés en moyenne.
La théorie explique également comment le système de gaz répond à changer. Par exemple, sous forme de gaz est chauffé à partir de zéro absolu, quand il est (en théorie) parfaitement immobile, son énergie interne (température) est augmentée. Comme un gaz est chauffé, les particules accélèrent et sa température augmente. Il en résulte un plus grand nombre de collisions avec le conteneur de temps par unité en raison des vitesses de particules plus élevés associés à des températures élevées. La pression augmente en proportion du nombre de collisions par unité de temps.
Mouvement brownien
Le mouvement brownien est le modèle mathématique utilisé pour décrire le mouvement aléatoire des particules en suspension dans un fluide. L'animation de particules de gaz, utilisant des particules vertes rose et, illustre comment ce comportement résultats dans l'étalement de gaz ( entropie ). Ces événements sont aussi décrits par la théorie des particules.
Comme il est à la limite de (ou au-delà) la technologie actuelle pour observer des particules individuelles de gaz (atomes ou molécules), seuls calculs théoriques donnent des suggestions sur la façon dont ils se déplacent, mais leur mouvement est différent du mouvement brownien parce que le mouvement brownien implique un glisser en douceur en raison à la force de frottement de nombreuses molécules de gaz, ponctuée par de violentes collisions d'un individu (ou plusieurs) molécule (s) de gaz avec la particule. La particule (généralement de millions ou de milliards d'atomes) se déplace ainsi à un cours en dents de scie, pourtant pas si déchiquetée comme on pouvait s'y attendre si une molécule de gaz individuel ont été examinés.
Forces intermoléculaires
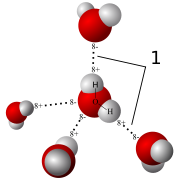
Comme indiqué précédemment, les attractions momentanées (ou répulsions entre particules) ont un effet sur la dynamique des gaz. En chimie physique, le nom donné à ces forces intermoléculaires est force de van der Waals. Ces forces jouent un rôle clé dans la détermination propriétés physiques d'un gaz tel que viscosité et taux (voir la section caractéristiques physiques) couler. Ignorer ces forces dans certaines conditions (voir Théorie cinétique moléculaire) permet à un gaz réel d'être traité comme un gaz idéal. Cette hypothèse permet l'utilisation de lois des gaz parfaits qui simplifie grandement les calculs.
L'utilisation correcte de ces relations de gaz nécessite l' Théorie cinétique moléculaire (KMT). Lorsque des particules de gaz possèdent une charge magnétique ou Ils influencent la force intermoléculaire progressivement une autre que l'espacement entre eux est réduite (le modèle de liaison hydrogène illustre un exemple). En l'absence de toute accusation, à un moment donné lorsque l'espacement entre les particules de gaz est fortement réduite qu'ils ne peuvent plus éviter les collisions entre eux à des températures de gaz normales. Un autre cas d'augmentation des collisions entre particules de gaz comprendrait un volume fixe de gaz, qui, par chauffage serait contenir des particules très rapides. Cela signifie que ces équations idéales fournissent des résultats raisonnables sauf pour très haute pression (compressible) ou de surchauffe (ionisés). Notez que toutes ces conditions exceptées permettre le transfert de l'énergie à prendre place dans le système de gaz. L'absence de ces transferts internes est ce qu'on appelle conditions idéales dans lesquelles l'échange d'énergie ne se produit qu'au limites du système. Gaz véritable expérience de certains de ces collisions et les forces intermoléculaires. Lorsque ces collisions sont statistiquement négligeable (incompressible), les résultats de ces équations idéales sont encore significative. Si les particules de gaz sont compressés en proximité ils se comportent plus comme un liquide (voir la dynamique des fluides).
Des modèles simplifiés
Une équation d'état (pour les gaz) est un modèle mathématique utilisé pour à peu près décrire ou de prédire les propriétés de l'état d'un gaz. À l'heure actuelle, il n'y a pas une seule équation d'état qui prédit avec précision les propriétés de tous les gaz dans toutes les conditions. Par conséquent, un certain nombre d'équations beaucoup plus précise de l'état ont été développés pour les gaz dans des gammes spécifiques de température et de pression. Les «modèles à gaz" qui sont les plus débattus sont «gaz parfait», «gaz parfait» et «gaz réel". Chacun de ces modèles a son propre ensemble d'hypothèses pour faciliter l'analyse d'un système thermodynamique donné. Chaque modèle successive élargit la gamme de température de la couverture à laquelle il se applique.
Modèles de gaz idéal et parfait
Le équation d'état pour un gaz idéal ou parfait est le loi des gaz parfaits et lit
où P est la pression, V est le volume, n est la quantité de gaz (exprimée en unités molaires), R est le constante universelle des gaz, 8,314 J / (mol K), et T est la température. Écrit de cette façon, il est parfois appelé la «version de chimiste", car il met l'accent sur le nombre de molécules n. Il peut aussi se écrire
où 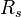 est la constante de gaz spécifique pour un gaz particulier, dans les unités J / (kg K), et ρ = m / V est la densité. Cette notation est la version du «gaz dynamicien", ce qui est plus pratique dans la modélisation des flux de gaz impliquant l'accélération sans réactions chimiques.
est la constante de gaz spécifique pour un gaz particulier, dans les unités J / (kg K), et ρ = m / V est la densité. Cette notation est la version du «gaz dynamicien", ce qui est plus pratique dans la modélisation des flux de gaz impliquant l'accélération sans réactions chimiques.
La loi des gaz parfaits ne fait pas une hypothèse sur la chaleur spécifique d'un gaz. Dans le cas le plus général, la chaleur spécifique est une fonction à la fois de température et de pression. Si la pression est négligée dépendance (et éventuellement la température et la dépendance) dans une application particulière, le gaz est parfois dit être un gaz parfait, bien que les hypothèses exactes peuvent varier en fonction de l'auteur et / ou domaine de la science.
Pour un gaz parfait, la loi des gaz parfaits se applique sans restrictions sur la chaleur spécifique. Un gaz parfait est un "gaz réel" simplifiée avec l'hypothèse que le facteur de compressibilité Z est réglé sur une signification que ce rapport reste constant pneumatique. Un facteur de compressibilité de l'un exige également les variables quatre de l'Etat de suivre le loi des gaz parfaits.
Cette approximation est plus approprié pour des applications en génie bien que les modèles plus simples peuvent être utilisés pour produire une "boule-parc" plage de l'endroit où la vraie solution doit mentir. Un exemple où le "rapprochement des gaz parfaits» serait approprié serait à l'intérieur d'une chambre de combustion d'un moteur à réaction . Il peut également être utile de garder les réactions élémentaires et dissociations chimiques pour le calcul émissions.
Gaz réel

Chacun des hypothèses ci-dessous l'ajoute à la complexité de la solution du problème. Comme la densité d'un gaz augmente avec la pression augmente, les forces intermoléculaires jouent un rôle plus important dans le comportement de gaz qui se traduit dans la loi des gaz parfaits ne plus fournir les résultats "raisonnables". A l'extrémité supérieure de la plage de température du moteur (sections de chambre de combustion, par exemple - 1300 K), les particules de combustible complexes absorbent l'énergie au moyen de rotations et des vibrations qui provoquent leurs chaleurs spécifiques de différentes de celles des molécules diatomiques et les gaz nobles. En plus du double de cette température, l'excitation électronique et la dissociation des particules de gaz commence à se produire, entraînant la pression de se adapter à un grand nombre de particules (passage de gaz de plasma ). Enfin, l'ensemble des processus thermodynamiques ont été présumés décrire gaz uniformes dont les vitesses varient selon une répartition déterminée. Utilisation d'une situation de non-équilibre implique le champ d'écoulement doit être caractérisé d'une manière quelconque afin de permettre une solution. Une des premières tentatives d'élargir les limites de la loi des gaz parfaits était d'inclure une couverture pour différents processus thermodynamiques en ajustant l'équation de lire pV n = constante et ensuite varier le n par des valeurs différentes comme le rapport de chaleur spécifique, γ.
Effets de gaz réel comprennent les ajustements effectués pour tenir compte d'un plus grand éventail de comportements de gaz:
- les effets de compressibilité (Z autorisé à varier de 1,0)
- Variable capacité thermique (chaleurs spécifiques varient en fonction de la température)
- Van der Waals (liés à la compressibilité, peuvent substituer d'autres équations d'état)
- Effets thermodynamiques non-équilibre
- Problèmes avec moléculaire dissociation et réactions élémentaires avec composition variable.
Pour la plupart des applications, une telle analyse détaillée est excessive. Exemples où "effets de gaz réel» aurait un impact significatif sur le seraient Navette Spatiale rentrée où les températures et pressions extrêmement élevées sont présents ou les gaz produits lors d'événements géologiques que dans l'image de l'éruption de 1990 Mont Redoubt.
Synthèse historique
La loi de Boyle
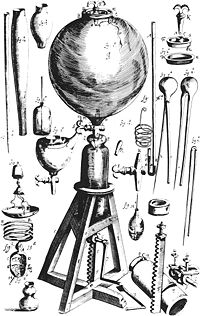
La loi de Boyle était peut-être la première expression d'une équation d'état. En 1662, Robert Boyle a effectué une série d'expériences utilisant un tube de verre en forme de J, qui a été scellée à une extrémité. Le mercure a été introduit dans le tube, le piégeage d'une quantité fixe d'air à court, extrémité scellée du tube. Ensuite, le volume de gaz a été soigneusement mesurée comme le mercure supplémentaire a été ajouté au tube. La pression du gaz peut être déterminée par la différence entre le niveau de mercure dans l'extrémité courte du tube et qu'à la longue, l'extrémité ouverte. L'image de l'équipement de Boyle montre certains des outils exotiques utilisés par Boyle lors de son étude des gaz.
Grâce à ces expériences, Boyle noter que la pression exercée par un gaz maintenu à une température constante varie inversement avec le volume du gaz. Par exemple, si le volume est réduit de moitié, la pression est doublé; et si le volume est doublé, la pression est réduite de moitié. Étant donné la relation inverse entre la pression et le volume, le produit de la pression (P) et le volume (V) est une constante (k) pour une masse donnée de gaz confiné dans la mesure où la température est constante. Déclaré comme une formule, est donc:
Étant donné que l'avant et après les volumes et les pressions de la quantité fixe de gaz, où les températures avant et après sont les mêmes à la fois la constante k égale, ils peuvent être liés par l'équation:
La loi de Charles
En 1787, le physicien français et le ballon pionnier, Jacques Charles, a constaté que l'oxygène, l'azote, hydrogène, dioxyde de carbone, l'air et l'expansion de la même manière sur le même intervalle de 80 Kelvin. Il a noté que, pour un gaz parfait à pression constante, le volume est directement proportionnelle à sa température:
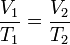
Loi de Gay-Lussac
En 1802, Louis Joseph Gay-Lussac a publié les résultats d'expériences similaires, quoique plus vastes. Gay-Lussac crédité travaux antérieurs de Charle en nommant la loi en son honneur. Gay-Lussac se est crédité de la pression décrivant de la loi, qu'il a trouvé en 1809. Il affirme que la pression exercée sur les côtés d'un conteneur par un gaz idéal est proportionnelle à sa température.
La loi d'Avogadro
En 1811, Amedeo Avogadro vérifié que des volumes égaux de gaz purs contiennent le même nombre de particules. Sa théorie ne était pas généralement accepté jusqu'en 1858 quand un autre chimiste italien Stanislao Cannizzaro était en mesure d'expliquer les exceptions non idéales. Pour son travail avec des gaz d'un siècle avant, le nombre qui porte son nom de la constante d'Avogadro représente le nombre d'atomes trouvés dans 12 grammes de carbone élémentaire-12 (6,022 × 10 23 mol -1). Ce nombre précis de particules de gaz, à température et pression normales (loi des gaz parfaits) occupe 22,40 litres, ce qui est considéré comme le volume molaire.
La loi d'Avogadro indique que le volume occupé par un gaz idéal est proportionnelle au nombre de moles (ou molécules) présents dans le conteneur. Cela donne lieu à la volume molaire d'un gaz qui, à STP est de 22,4 dm 3 (ou litres). La relation est donnée par
où n est égal au nombre de moles de gaz (le nombre de molécules divisé par le nombre d'Avogadro ).
La loi de Dalton

En 1801, John Dalton a publié la loi des pressions partielles de son travail avec relation idéale de la loi de gaz: La pression d'un mélange de gaz est égale à la somme des pressions de tous les seuls gaz constitutifs. Mathématiquement, cela peut être représenté pour n espèce que:
Pression totale = Pression 1 + 2 + pression + ... Pression n
L'image du journal de Dalton représente symbologie il a utilisé comme raccourci pour enregistrer le chemin qu'il a suivi. Parmi ses observations de revues clés lors du mélange "fluides compressibles" non réactifs (gaz) ont été les suivants:
- Contrairement liquides, gaz plus lourds ne ont pas la dérive vers le bas lors du mélange.
- l'identité des particules de gaz n'a joué aucun rôle dans la détermination de la pression finale (ils se sont comportés comme si leur taille est négligeable).
Thèmes spéciaux
Compressibilité

Thermodynamiciens utilisent ce facteur (Z) de modifier l'équation des gaz parfaits pour tenir compte des effets de compressibilité de gaz réels. Ce facteur représente le rapport réel à des volumes spécifiques idéales. Il est parfois considéré comme un "facteur fudge" ou la correction d'élargir la gamme utile de la loi des gaz parfaits à des fins de conception. Habituellement, cette valeur Z est très proche de l'unité. L'image de facteur de compressibilité Z illustre la manière dont varie dans une plage de températures très basses.
Nombre de Reynolds
En mécanique des fluides, le nombre de Reynolds est le rapport des forces d'inertie (v s) de ρ aux forces visqueux (μ / L). Il est l'un des nombres sans dimension les plus importants de la dynamique des fluides et est utilisé, le plus souvent avec d'autres nombres sans dimension, de fournir un critère pour déterminer la similitude dynamique. En tant que tel, le nombre de Reynolds fournit le lien entre les résultats de la modélisation (conception) et les conditions réelles à grande échelle. Il peut également être utilisé pour caractériser l'écoulement.
Viscosité
Viscosité, une propriété physique, est une mesure de la façon dont les molécules adjacentes adhèrent les unes aux autres. Un solide peut résister à une force de cisaillement en raison de la force de ces forces intermoléculaires collantes. Un fluide se déformer lorsqu'il est soumis en continu à une charge similaire. Tandis qu'un gaz a une valeur inférieure de la viscosité d'un liquide, il est encore une propriété observable. Si les gaz ne avaient pas la viscosité, alors ils ne se en tenir à la surface d'une aile et former une couche limite. Une étude de la aile delta dans le Schlieren l'image révèle que les particules de gaz en tenir à une autre (voir rubrique de la couche limite).
Turbulence

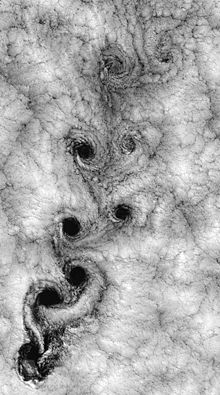
Dans la dynamique des fluides, la turbulence ou un écoulement turbulent est un régime d'écoulement caractérisé par chaotiques, les changements de propriété stochastiques. Cela comprend faible diffusion de l'élan, haute convection de l'élan, et la variation rapide de la pression et de la vitesse dans l'espace et le temps. La vue satellite de la météo autour de Robinson Crusoe îles illustre juste un exemple.
Couche limite
Les particules, en effet, «coller» à la surface d'un objet en mouvement à travers elle. Cette couche de particules est appelée la couche limite. A la surface de l'objet, ce est essentiellement statique due au frottement de la surface. L'objet, avec sa couche limite est effectivement la nouvelle forme de l'objet que le reste des molécules «voir» à l'approche de l'objet. Cette couche limite peut se séparer de la surface, créant ainsi essentiellement une nouvelle surface et changer complètement le trajet d'écoulement. L'exemple classique de ce est un décrochage aérodynamique. L'image d'aile delta montre clairement la couche épaississement frontière comme le gaz se écoule de droite à gauche le long de la pointe.
Principe de l'entropie maximale
Comme le nombre total de degrés de liberté tend vers l'infini, le système se trouve dans le macroscopique qui correspond à la plus élevée la multiplicité. Afin d'illustrer ce principe, observer la température de la peau d'une barre de métal gelé. Utilisation d'une image thermique de la température de la peau, notez la distribution de température sur la surface. Cette observation initiale de la température représente un " microscopique. "À un certain moment futur, une seconde observation de la température de la peau produit un second micro-état. En continuant ce processus d'observation, il est possible de produire une série de micro-qui illustrent l'histoire thermique de la surface de la barre. La caractérisation de cette série historique des micro-est possible en choisissant la macro-ce que tous classe avec succès en un seul groupement.
Équilibre thermodynamique
Lorsque le transfert d'énergie à partir d'un système cesse, cette condition est appelée à l'équilibre thermodynamique aussi. Habituellement, cette condition implique le système et alentours sont à la même température afin que la chaleur transfère plus entre eux. Il implique également que les forces externes sont équilibrés (volume ne change pas), et toutes les réactions chimiques à l'intérieur du système sont complets. La chronologie de ces événements varie selon le système en question. Conteneur de glace a permis de faire fondre à la température ambiante prend des heures, tandis que dans les semi-conducteurs de transfert de chaleur qui se produit dans le dispositif de transition d'un état bloqué à pourrait être de l'ordre de quelques nanosecondes.