
Ion
Renseignements généraux
Arrangeant une sélection Wikipedia pour les écoles dans le monde en développement sans internet était une initiative de SOS Enfants. SOS Children travaille dans 45 pays africains; pouvez-vous aider un enfant en Afrique ?
Un ion est un atome ou molécule dans laquelle le nombre total d' électrons ne est pas égal au nombre total de protons , ce qui donne l'atome une nette positive ou négative charge électrique .
Les ions peuvent être créés à la fois par des moyens chimiques et physiques. En termes chimiques, si un atome neutre perd un ou plusieurs électrons, il a une charge nette positive et est connu en tant que cation . Si un atome gagne des électrons, il a une charge nette négative et est connu comme un anion . Un ion constitué d'un seul atome est un atome ou ion monoatomique; se il est constitué de deux ou plusieurs atomes, ce est une moléculaire ou ion polyatomique.
Dans le cas de l'ionisation d'un support physique, tel qu'un gaz, ce qu'on appelle des "paires ioniques" sont créées par l'impact d'ions, et chaque paire est constituée d'un électron libre et un ion positif.
Anions et cations
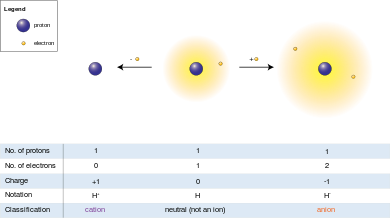
Etant donné que la charge électrique sur un proton est égale en amplitude à la charge d'un électron, la charge électrique nette de l'ion est égal au nombre de protons dans l'ion moins le nombre d'électrons.
Un anion (-) (pron .: / æ n . aɪ . ən / UN-eye-ən), du mot ἄνω grec (ONA), ce qui signifie «haut», est un ion avec plus d'électrons que de protons, ce qui lui donne une charge négative nette (depuis électrons sont chargés négativement et les protons sont chargés positivement).
Un cation (+) (pron .: / k æ t . aɪ . ən / KAT-eye-ən), du mot grec κατά (kata), ce qui signifie "bas", est un ion avec moins d'électrons que de protons, ce qui lui donne une charge positive.
Il ya des noms supplémentaires utilisés pour les ions avec de multiples accusations. Par exemple, un ion avec une charge est -2 connu comme un dianion et un ion avec une charge 2 est connu comme un dication. Un zwitterion est une molécule neutre avec des charges positives et négatives à différents endroits au sein de cette molécule.
Histoire de la découverte
Le mot d'ions est le ιον grec (aller), le participe présent du ιεναι, ienai, "aller". Ce terme a été introduit par le physicien et chimiste anglais Michael Faraday en 1834 pour les espèces alors inconnues qui va d'un électrode à l'autre à travers un milieu aqueux. Faraday ne connaissait pas la nature de ces espèces, mais il savait que, depuis métaux dissous dans la solution et sont entrés à une électrode, et nouveau métal sortit de solution à l'autre électrode, que certains type de substance déplacé à travers la solution dans un courant, transporter la matière d'un endroit à l'autre.
Faraday a également introduit l'anion de mots pour un ion chargé négativement, et pour un cation chargé positivement une. Dans la nomenclature de Faraday, cations ont été nommés parce qu'ils ont été attirés par la cathode dans un dispositif galvanique et anions ont été nommés en raison de leur attirance pour le anode.
Caractéristiques
Ions dans leur état comme gaz sont très réactifs, et ne se produisent pas en grandes quantités sur Terre, sauf dans les flammes, la foudre, les étincelles électriques, et autres plasmas . Ces ions comme gaz interagissent rapidement avec des ions de charge opposée à donner molécules neutres ou des sels ioniques. Ions sont également produites à l'état liquide ou solide lorsque des sels interagissent avec des solvants (par exemple, l'eau) pour produire "ions solvatées," qui sont plus stables, pour des raisons impliquant une combinaison de l'énergie et de l'entropie changements que les ions se éloignent les unes autre pour interagir avec le liquide. Ces espèces stabilisés sont plus fréquemment trouvés dans l'environnement à basse température. Un exemple courant est les ions présents dans l'eau de mer, qui sont dérivés de sels dissous.
Tous les ions sont facturés, ce qui signifie que, comme tous les objets chargés qu'ils sont:
- attirés par des charges opposées électriques (positif au négatif, et vice-versa),
- repoussés par des charges comme
- lors du déplacement, voyager dans les trajectoires qui sont déviés par un champ magnétique.
Les électrons, en raison de leur faible masse et donc de plus grandes propriétés de remplissage d'espace que ondes de matière, déterminent la taille des atomes et des molécules qui possèdent des électrons du tout. Ainsi, des anions (ions chargés négativement) sont plus grandes que la molécule mère ou atome, que l'excès d'électrons (s) repoussent l'un l'autre, et ajouter à la taille physique de l'ion, car sa taille est déterminée par sa nuage d'électrons. En tant que tel, de façon générale, les cations sont plus petites que l'atome ou de la molécule mère correspondante en raison de la petite taille de son nuage d'électrons. Un cation particulier (celui de l'hydrogène) ne contient pas des électrons, et est donc beaucoup plus petit que le parent atome d'hydrogène.
Occurrences naturelles
Ions sont omniprésents dans la nature et sont responsables de divers phénomènes de la luminescence du Soleil à l'existence de la Terre ionosphère. Atomes dans leur état ionique peuvent avoir une couleur différente de atomes neutres, et l'absorption ainsi en lumière par des ions métalliques donne la couleur de pierres précieuses. Dans les deux chimie organique et inorganique (y compris la biochimie), l'interaction de l'eau et des ions est extrêmement important; un exemple est l'énergie qui entraîne ventilation de l'adénosine triphosphate ( ATP ). Les sections suivantes décrivent les contextes dans lesquels des ions sont à l'honneur; ceux-ci sont disposés à diminuer échelle de longueur physique, de l'astronomie à l'microscopique.
Astronomique

Une collection de non- ions comme gaz aqueuses, ou même un gaz contenant une proportion de particules chargées, se appelle un plasma. Plus de 99,9% de la matière visible dans l'Univers peut être sous la forme de plasmas . Il se agit notamment de notre Soleil et d'autres étoiles et de la l'espace entre les planètes, ainsi que la espace entre les étoiles. Plasmas sont souvent appelés le quatrième état de la matière parce que leurs propriétés sont sensiblement différentes de celles des solides , liquides et gaz . Plasmas astrophysiques contiennent principalement un mélange d'électrons et de protons (hydrogène ionisé).
Technologies connexes
Les ions peuvent être non chimiquement préparés en utilisant divers sources d'ions, impliquant généralement élevé électrique ou thermique. Ils sont utilisés dans une multitude de dispositifs tels que des spectromètres de masse , spectromètres d'émission optique, accélérateurs de particules, implantation ionique, et moteurs ioniques.
Comme particules chargées réactifs, ils sont également utilisés dans purification de l'air par des microbes perturbateurs, et des articles ménagers tels que des détecteurs de fumée.
Comme signalisation et le métabolisme dans les organismes sont contrôlés par un gradient ionique à travers précise membranes, la rupture de ce gradient contribue à la mort cellulaire. Il se agit d'un mécanisme commun exploité par naturelle et artificielle des biocides, y compris la les canaux ioniques gramicidine et amphotéricine (a fongicide).
Ions dissous inorganiques sont un composant de les solides dissous totaux, un indicateur de qualité de l'eau dans le monde.
La détection des rayonnements ionisants
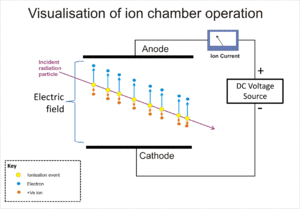
L'effet d'un rayonnement ionisant sur un gaz est largement utilisé pour la détection de rayonnement tel que alpha, bêta, gamma et Les rayons X. L'événement d'ionisation initiale dans ces instruments se traduit par la formation d'une "paire d'ions"; un ion positif et un électron libre, par l'impact d'ions par le rayonnement sur les molécules de gaz. Le Chambre d'ionisation est la plus simple de ces détecteurs, et recueille toutes les charges créées par ionisation dans le gaz directement par l'application d'un champ électrique.
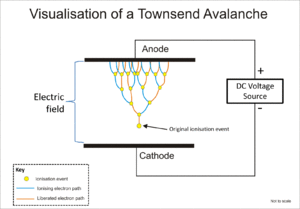
Le Geiger-Müller tube et le compteur proportionnel utilisent tous les deux un phénomène connu en tant que Townsend avalanche de multiplier l'effet de l'événement d'ionisation initiale par un effet de cascade de sorte que les électrons libres sont donnés suffisamment d'énergie par le champ électrique pour libérer des électrons en outre par l'impact d'ions.
Chimie
Notation
En désignant l'état chargé
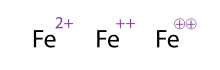
Lors de l'écriture de la formule chimique pour un ion, sa charge nette est écrit en exposant immédiatement après la structure chimique de la molécule / atome. La charge nette est écrit avec l'ampleur avant le signe; dire un cation doublement chargé est indiqué comme 2+ au lieu de deux. Toutefois, l'ampleur de la charge est omis pour une seule charge molécules / atomes; par exemple, le sodium est indiqué comme cation Na + et Na 1+ pas.
Une alternative (et acceptable) façon de montrer une molécule / atome d'accusations multiples est en se appuyant sur les signes à plusieurs reprises; Cela se voit souvent avec des métaux de transition. Les chimistes encerclent parfois le signe; il se agit simplement d'ornement et ne modifie pas le sens chimique. Tous les trois représentations de Fe 2+ représentés sur la figure sont donc équivalentes.
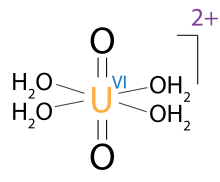
Ions monoatomiques sont parfois désignées par des chiffres romains; par exemple, l'exemple du Fe vu ci-dessus est parfois appelée Fe (II) ou Fe II. Le chiffre romain désigne la formelle état d'oxydation d'un élément, alors que les chiffres en exposant désigne la charge nette. Les deux notations sont, par conséquent, échangeables contre des ions monoatomiques, mais les chiffres romains ne peuvent pas être appliquées à ions polyatomiques. Cependant, il est possible de mélanger les notations pour le centre métallique individu avec un complexe polyatomique, comme le montre l'exemple d'ions uranyle.
Sous-classes
Si un ion contient électrons non appariés, il est appelé ion radical. Tout comme les radicaux non chargées, ions radicaux sont très réactifs. Des ions polyatomiques contenant de l'oxygène tels que le carbonate et le sulfate, sont appelés oxyanions. Ion moléculaire qui contiennent au moins une liaison carbone-hydrogène sont appelés des ions organiques. Si la charge dans un ion organique est formellement centré sur un carbone, il est appelé carbocation (si chargé positivement) ou carbanion (si chargé négativement).
Formation
Formation d'ions monoatomiques
Ions monoatomiques sont formés par le gain ou la perte d'électrons à la shell valence (l'enveloppe extérieure la plus électronique) dans un atome. Les coques intérieures d'un atome sont remplis avec des électrons qui sont étroitement liés à la chargée positivement noyau atomique , et ainsi de ne pas participer à ce genre d'interaction chimique. Le processus de gagner ou de perdre des électrons d'un atome ou une molécule neutre est appelé ionisation.
Atomes peuvent être ionisés par bombardement avec rayonnement, mais le procédé le plus courant d'ionisation rencontré dans la chimie est le transfert d'électrons entre les atomes ou les molécules. Ce transfert est généralement entraîné par la réalisation de la stabilité ("shell fermé") des configurations électroniques. Atomes vont gagner ou perdre des électrons selon lequel l'action prend le moins d'énergie.
Par exemple, un sodium atome, Na, a un seul électron dans son enveloppe de valence, entourant deux stables, remplis de coques intérieure 2 et 8 électrons. Étant donné que ces coques remplies sont très stables, un atome de sodium a tendance à perdre son électron supplémentaire et atteindre cette configuration stable, de devenir un cation de sodium dans le procédé
- → Na Na + + e -
D'autre part, un chlore atome, Cl, a 7 électrons dans sa couche de valence, qui est un de moins que la stabilité, la coquille remplie de 8 électrons. Ainsi, un atome de chlore tend à gagner un électron supplémentaire et atteindre une configuration stable à 8 électrons, de devenir un anion chlorure dans le procédé:
- Cl + e - → Cl -
Cette force d'entraînement est la cause de sodium et du chlore à subir une réaction chimique, dans lequel l'électron "extra" est transféré du sodium au chlore, formant des cations sodium et des anions chlorure. Étant chargée de façon opposée, ces cations et anions forment des liaisons ioniques et se combinent pour former du chlorure de sodium , NaCl, plus communément connu sous le nom sel gemme.
- Na + + Cl - → NaCl
Formation d'ions polyatomiques et moléculaires
3). La coque trois dimensions représente un seul arbitraire isopotentiel.
Polyatomique et des ions moléculaires sont souvent formés par le gain ou la perte d'ions élémentaires tels que H + dans les molécules neutres. Par exemple, lorsque de l'ammoniac , NH 3, accepte un proton H +, il forme le ion ammonium, NH +
4. L'ammoniac et ammonium ont le même nombre d'électrons dans essentiellement la même configuration électronique, mais ammonium a un proton supplémentaire qui lui donne une charge positive nette.
L'ammoniac peut aussi perdre un électron d'acquérir une charge positive, formant l'ion · NH +
3. Toutefois, cet ion est instable, car elle a un incomplète valence shell autour de l'atome d'azote, ce qui en fait un très réactif ion radical.
En raison de l'instabilité des ions radicaux, ions polyatomiques et moléculaires sont généralement formés par gagner ou de perdre des ions élémentaires tels que H +, plutôt que de gagner ou de perdre des électrons. Cela permet à la molécule à préserver sa configuration électronique stable tout en acquérant une charge électrique.
le potentiel d'ionisation
L' énergie requise pour détacher un électron dans son état d'énergie le plus bas d'un atome ou d'une molécule d'un gaz avec moins de charge électrique nette est appelé le potentiel d'ionisation, ou de l'énergie d'ionisation. La n-ième énergie d'ionisation d'un atome est l'énergie requise pour détacher la n ième électrons après la première n - 1 électrons ont déjà été détaché.
Chaque énergie d'ionisation successives est nettement supérieure à la dernière. En particulier, de grandes augmentations se produisent après tout bloc donné de orbitales atomiques est épuisé d'électrons. Pour cette raison, les ions ont tendance à former de façon à les laisser orbitaux avec des blocs complets. Par exemple, le sodium a une valence électrons sur sa couche périphérique, donc sous forme ionisée il est communément trouvé avec un électron perdu, que Na +. De l'autre côté de la table périodique, de chlore a sept électrons de valence, de sorte que sous forme ionisée il est généralement trouvé avec une électronique acquise, comme Cl -. Le césium a le plus faible énergie d'ionisation mesuré de tous les éléments et de l'hélium a la plus grande. En général, l'énergie d'ionisation de métaux est bien inférieure à l'énergie d'ionisation de non-métaux, ce est pourquoi, en général, les métaux vont perdre des électrons pour former des ions chargés positivement non-métaux et se gagner des électrons pour former des ions chargés négativement.
Liaison ionique
Liaison ionique est une sorte de liaison chimique qui résulte de l'attraction mutuelle des ions de charges opposées. Ions de charge comme se repoussent mutuellement, et les ions de charge opposée se attirent mutuellement. Par conséquent ions ne existent pas habituellement sur leur propre, mais se lier avec des ions de charge opposée pour former un réseau cristallin. Le composé résultant est appelé un composé ionique, et l'on dit être maintenues ensemble par liaison ionique. Dans les composés ioniques surgissent distances caractéristiques entre voisins d'ions à partir de laquelle l'extension spatiale et de la rayon ionique d'ions individuels peut être dérivé.
Le type le plus commun de la liaison ionique est vu dans les composés de métaux et non-métaux (à l'exception des gaz nobles , qui font rarement composés chimiques). Les métaux sont caractérisés par un petit nombre d'électrons en excès d'une configuration électronique stable, fermé-coquille. Comme tels, ils ont tendance à perdre ces électrons supplémentaires pour atteindre une configuration stable. Cette propriété est connue sous le nom électropositivité. Non-métaux, d'autre part, sont caractérisés par une configuration d'électrons quelques courts électrons d'une configuration stable. Comme tels, ils ont tendance à avoir plus d'électrons de manière à obtenir une configuration stable. Cette tendance est connu comme électronégativité. Quand un métal hautement électropositif est combiné avec un non-métal fortement électronégatif, les électrons supplémentaires provenant des atomes métalliques sont transférés aux atomes non métalliques déficients en électrons. Cette réaction produit des cations métalliques et des anions non-métalliques, qui sont attirés les uns aux autres pour former un sel .
applications chimiques
Chaque énergie d'ionisation successives est nettement supérieure à la dernière. En particulier, de grandes augmentations se produisent après tout bloc donné de orbitales atomiques est épuisé d'électrons. Pour cette raison, les ions ont tendance à former de façon à les laisser orbitaux avec des blocs complets. Par exemple, le sodium a une valence électrons sur sa couche périphérique, donc sous forme ionisée il est communément trouvé avec un électron perdu, que Na +. De l'autre côté de la table périodique, de chlore a sept électrons de valence, de sorte que sous forme ionisée il est généralement trouvé avec une électronique acquise, comme Cl -. Le césium a le plus faible énergie d'ionisation mesuré de tous les éléments et de l'hélium a la plus grande. En général, l'énergie d'ionisation de métaux est bien inférieure à l'énergie d'ionisation de non-métaux, ce est pourquoi, en général, les métaux vont perdre des électrons pour former des ions chargés positivement non-métaux et se gagner des électrons pour former des ions chargés négativement.
Ions communs
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


