
Fer
À propos de ce écoles sélection Wikipedia
SOS Enfants produite ce site pour les écoles ainsi que ce site de vidéo sur l'Afrique . Avec enfants SOS vous pouvez choisir de parrainer des enfants dans plus de cent pays
| Fer | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
26 Fe | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||||||||||||||
métallique brillante avec une teinte grisâtre  Raies spectrales de fer | |||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | fer, Fe, 26 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / aɪ . ər n / | ||||||||||||||||||||||||||||||||||||||||||||||||
| Élément Catégorie | métal de transition | ||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | 8, 4, ré | ||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 55,845 (2) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Ar ] 3d 6 4s 2 2, 8, 14, 2 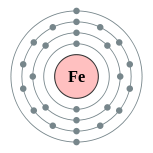 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||||||||||||||
| Découverte | avant 5000 BC | ||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 7,874 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densité au mp | 6,98 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 1811 K , 1538 ° C, 2800 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 3134 K, 2862 ° C, 5182 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 13,81 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 340 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 25,10 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 6, 5, 4, 3, 2, 1, -1, -2 ( l'oxyde amphotère) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | 1,83 (échelle de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation ( plus) | 1er: 762,5 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2ème: 1561,9 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| 3ème: 2957 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 126 h | ||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 132 ± 3 (bas spin), 152 ± 6 (haut spin) h | ||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | cubique centré  a = 286,65 h; | ||||||||||||||||||||||||||||||||||||||||||||||||
cubique à faces centrées  entre 1185-1667 K | |||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magnétique | ferromagnétique | ||||||||||||||||||||||||||||||||||||||||||||||||
| 1043 K | |||||||||||||||||||||||||||||||||||||||||||||||||
| Résistivité électrique | (20 ° C) 96,1 nΩ · m | ||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 80,4 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | (25 ° C) 11,8 um · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | ( rt) (électrolytique) 5120 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | 211 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 82 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | 170 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,29 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Mohs | 4 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Vickers | 608 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Brinell | 490 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7439-89-6 | ||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes de fer | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
Le fer est un élément chimique avec le symbole Fe (du latin : Ferrum) et de numéro atomique 26. Il se agit d'un métal dans la première série de transition . Ce est l'élément le plus commun (en masse) formant la planète Terre dans son ensemble, formant une grande partie de la Terre et externe noyau interne. Ce est la quatrième plus commune élément de la croûte terrestre. Présence très fréquente de fer dans planètes rocheuses comme la Terre est due à sa production abondante en raison de la fusion dans les étoiles de masse élevée, où la production de nickel-56 (qui se désintègre en l'isotope le plus commun de fer) est le dernier réaction de fusion nucléaire, qui est exothermique. Cela provoque nickel radioactifs pour devenir le dernier élément à être produite avant l'effondrement d'un supernova conduit aux événements explosifs qui dispersent cette précurseur radionucléide du fer en abondance dans l'espace.
Comme les autres groupe 8 éléments, le fer existe dans une large gamme de états d'oxydation , de -2 à 6, bien que 2 et 3 sont les plus communs. Fer élémentaire se produit dans les météorites et autres environnements pauvres en oxygène, mais est réactif à l'oxygène et de l'eau. Surfaces de fer frais apparaissent brillant gris argenté, mais se oxydent à l'air normal de donner hydraté les oxydes de fer, communément appelée rouille. Contrairement à de nombreux autres métaux qui forment passivation des couches d'oxyde, des oxydes de fer occupent un volume plus important que le métal de fer et des oxydes de fer ainsi se écailler et exposer des surfaces fraîches pour la corrosion.
Métal fer a été utilisé depuis l'antiquité, mais les alliages de cuivre, qui ont des températures de fusion plus bas, ont été utilisés première dans l'histoire. Fer pur est mou (plus doux que l'aluminium ), mais est impossible à obtenir par la fusion. Le matériau est sensiblement durci et renforcé par des impuretés provenant du procédé de fusion, tels que le carbone . Une certaine proportion de carbone (entre 0,002% et 2,1%) produit en acier , qui peut être jusqu'à 1000 fois plus dur que le fer pur. Métal de fer brut est produit en hauts fourneaux, où le minerai est réduit par à coke la fonte brute, qui a une teneur élevée en carbone. D'autres améliorations avec de l'oxygène réduit la teneur en carbone à la proportion appropriée pour fabriquer de l'acier. Aciers et faible teneur en fer de carbone alliages avec d'autres métaux ( aciers alliés) sont de loin les métaux les plus communs dans l'utilisation industrielle, en raison de leur grande variété de propriétés souhaitables et l'abondance de fer.
Composés chimiques fer, qui comprennent des composés ferreux et ferriques, ont de nombreux usages. L'oxyde de fer mélangé avec de la poudre d'aluminium peut être allumé pour créer une réaction aluminothermique, utilisé dans la soudure et de purification des minerais. Il forme des composés binaires avec les halogènes et le chalcogènes. Parmi les composés organométalliques est ferrocène, le premier Composé sandwich découvert.
Le fer joue un rôle important en biologie , en formant des complexes avec l'oxygène moléculaire en hémoglobine et myoglobine; Ces deux composés sont communs transport de l'oxygène des protéines chez les vertébrés. Le fer est également le métal utilisé dans le site actif de nombreuses et importantes enzymes redox traitant la respiration cellulaire et de l'oxydation et de réduction dans les plantes et les animaux.
Caractéristiques
Propriétés mécaniques
| Matériel | TS (MPa) | BH ( Brinell) |
|---|---|---|
| moustaches de fer | 11000 | |
| Ausformed (durci) acier | 2930 | 850-1200 |
| Acier martensitique | 2070 | 600 |
| Acier bainitique | 1380 | 400 |
| Acier perlitique | 1200 | 350 |
| Fer écroui | 690 | 200 |
| Fer à petits grains | 340 | 100 |
| Fer contenant du carbone- | 140 | 40 |
| Pur, monocristallin fer | 10 | 3 |
Les propriétés mécaniques du fer et de ses alliages peuvent être évaluées en utilisant une variété de tests, y compris la Essai Brinell, Rockwell test et le Essai de dureté Vickers. Les données sur le fer est si cohérente qu'elle est souvent utilisée pour calibrer les mesures ou pour comparer les tests. Cependant, les propriétés mécaniques de fer sont significativement affectée par la pureté de l'échantillon: la recherche pure à usage monocristaux de fer sont en fait plus doux que l'aluminium et le fer produit industriellement pur (99,99%) a une dureté de 20-30 Brinell. Une augmentation de la teneur en carbone du fer initialement causer une augmentation correspondante importante de la dureté du fer et de résistance à la traction. Dureté maximale de la R 65 c est obtenue avec une teneur en carbone de 0,6%, bien que cela produit un métal ayant une faible résistance à la traction.
Diagramme et allotropes phase
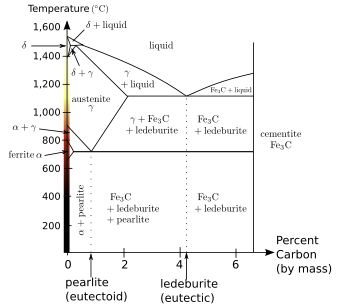
Fer représente un exemple de allotropie dans un métal. Il existe au moins quatre formes allotropiques de fer, appelés α, γ, δ, et ε; à des pressions très élevées, des preuves expérimentales controversée existe pour une phase β stable à très hautes pressions et températures.
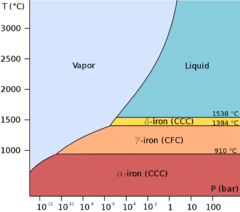
Comme le fer en fusion se refroidit, il cristallise à 1538 ° C dans sa forme allotropique de δ, qui a un cubique centré (bcc) structure cristalline. Comme il se refroidit davantage son structure cristalline se transforme en cubique à faces centrées (cfc) à 1394 ° C, quand on sait que γ-fer, ou austénite. A 912 ° C la structure cristalline cubique centrée redevient comme α-fer, ou ferrite, est formé, et au 770 ° C (la Point de Curie, T c) fer devient magnétique . Comme le fer passe par la température de Curie n'y a pas de changement dans la structure cristalline, mais il ya un changement dans "Structure de domaine", où chaque domaine contient des atomes de fer avec un spin électronique particulier. Dans fer non magnétisé, tous les spins électroniques des atomes à l'intérieur d'un domaine sont dans la même direction; les domaines voisins pointent dans des directions différentes et donc annulent. Dans le fer aimanté, les spins électroniques de tous les domaines sont alignés, de sorte que les effets magnétiques des domaines voisins renforcent mutuellement. Bien que chaque domaine contient des milliards d'atomes, ils sont très petits, environ 10 micromètres de diamètre. A des pressions supérieures à environ 10 GPa et des températures de quelques centaines de kelvin ou moins, modifications α-fer dans un (hcp) structure hexagonale emballés gros, qui est également connu comme fer ε; la plus haute température γ phase change également en fer ε, mais le fait à une pression plus élevée. Le β phase, si elle existe, semblent à des pressions d'au moins 50 GPa et des températures d'au moins 1 500 K; il a été pensé pour avoir un orthorhombique ou une structure à double hcp.
Le fer est de plus grande importance lorsqu'il est mélangé avec certains autres métaux et avec le carbone pour former des aciers. Il existe de nombreux types d'aciers, le tout avec des propriétés différentes, et une compréhension des propriétés de la allotropes de fer est essentiel à la fabrication d'aciers de qualité bonne.
α-fer, également connu sous le nom de ferrite, est la forme la plus stable de fer à des températures normales. Ce est un métal assez mou qui peut dissoudre seulement une petite concentration de carbone (pas plus de 0,021% en masse à 910 ° C).
Au-dessus de 912 ° C et jusqu'à 1400 ° α-fer subit un C transition de phase de la configuration de bcc fcc de γ-fer, appelée aussi austénite. Ce est tout aussi douce et métallique, mais peut dissoudre beaucoup plus de carbone (autant que 2,04% en masse à 1 146 ° C). Cette forme de fer est utilisé dans le type de en acier inoxydable utilisé pour la fabrication des équipements couverts, et de l'hôpital et des services alimentaires.
Les phases de haute pression de fer sont importantes en tant que modèles termes extrêmes pour les parties solides de noyaux planétaires. Le noyau interne de la Terre est généralement supposée être constituée essentiellement d'un fer nickel allier avec ε (ou β) structure.
Le point de fusion du fer est expérimentalement bien défini pour des pressions jusqu'à environ 50 GPa. Pour des pressions plus élevées, différentes études ont placé le γ-ε-liquide Triple Point à des pressions différentes par des dizaines de gigapascals et donné des différences de plus de 1000 K pour le point de fusion. En général, simulations dynamiques moléculaires informatiques des expériences de fusion de fer et d'ondes de choc indiquent des points de fusion plus élevés et une pente plus raide de la courbe de fusion que des expériences effectuées dans statiques cellules à enclumes de diamant.
Isotopes
Fer naturel se compose de quatre stables isotopes : 5,845% de 54 Fe, 91,754% des 56 Fe, 2,119% de 57 Fe et 0,282% de 58 Fe. Parmi ces isotopes stables, seulement 57 Fe a un nucléaire spin (-1/2). Le nucléide 54 Fe est prévu de subir la double désintégration bêta, mais ce processus ne avait jamais été observé expérimentalement pour ces noyaux, et seule la limite inférieure de la demi-vie a été établie: t 1/2> 3,1 × 10 22 ans.
60 Fe est un radionucléide éteint de longue demi-vie (2,6 millions d'années). Il ne est pas trouvé sur la Terre, mais son produit de désintégration ultime est le nucléide stable nickel-60.
Une grande partie des travaux antérieurs sur la mesure de la composition isotopique de Fe a mis l'accent sur la détermination de 60 Fe variations dues à des processus d'accompagnement nucléosynthèse (c.-à- études météorites) et la formation des minerais. En revanche de la dernière décennie, les progrès de la spectrométrie de masse de la technologie ont permis la détection et la quantification des minutes, les variations dans les rapports des naturelle des isotopes stables de fer. Une grande partie de ce travail a été entraînée par le Terre et communautés scientifiques planétaires, bien que les applications aux systèmes biologiques et industrielles commencent à émerger.
L'isotope le plus abondant de fer 56 Fe est d'un intérêt particulier pour les scientifiques nucléaires, car elle représente le paramètre le plus commun de la nucléosynthèse. Il est souvent cité, à tort, que l'isotope de la plus haute énergie de liaison, une distinction qui appartient en fait à nickel-62. Depuis 56 Ni est facilement produit à partir de noyaux plus légers dans le processus d'alpha dans réactions nucléaires dans les supernovae (voir processus de gravure de silicium), le nickel-56 (14 des particules alpha) est le point de terminaison de chaînes de fusion à l'intérieur étoiles extrêmement massives, depuis plus d'une autre particule alpha entraînerait zinc-60, ce qui nécessite beaucoup plus d'énergie. Ce nickel-56, qui a une demi-vie d'environ six jours, se fait donc en quantité dans ces étoiles, mais se désintègre rapidement par deux les émissions de positrons successives à l'intérieur des produits de désintégration supernova dans le reste de supernova nuage de gaz, d'abord pour le cobalt-56 radioactif, puis stable fer-56. Ce dernier nucléide est donc commune dans l'univers, stable par rapport aux autres métaux ayant approximativement la même poids atomique.
Dans les phases des météorites Semarkona et Kut Chervony une corrélation entre la concentration de 60 Ni, le produit de filiation de 60 Fe, et l'abondance des isotopes stables de fer n'a pu être trouvée, qui est la preuve de l'existence de 60 Fe au moment de la formation du système solaire. Peut-être l'énergie libérée par la désintégration de 60 Fe a contribué, avec l'énergie libérée par la désintégration du radionucléide 26 Al, à la refonte et différenciation des astéroïdes après leur formation il ya 4,6 milliards d'années. L'abondance de 60 Ni présent dans matériau extraterrestre peut également fournir d'autres renseignements sur l'origine du système solaire et de son histoire au début.
Noyaux des atomes de fer ont certains des énergies de liaison plus élevées par nucléon, dépassé seulement par le isotope de nickel Ni 62. Ce est formée par la fusion nucléaire dans les étoiles. Bien qu'un gain supplémentaire d'énergie minuscule pourrait être extrait en synthétisant 62 Ni, les conditions dans les étoiles ne sont pas adaptés pour ce processus à privilégier. Distribution des éléments sur la Terre favorise grandement fer sur le nickel, et aussi sans doute dans la production de l'élément supernova.
Fer-56 est le plus lourd isotope stable produit par le procédé en alpha nucléosynthèse stellaire; éléments plus lourds que le fer et le nickel nécessitent une supernova pour leur formation. Le fer est l'élément le plus abondant dans le cœur de géantes rouges , et est le métal le plus abondant dans météorites de fer et dans le métal dense noyaux des planètes telles que la Terre .
Nucléosynthèse
Fer est créé par une très grande extrêmement chaud (plus de 2,5 milliards kelvin), les étoiles à travers le processus de gravure de silicium. Ce est l'élément le plus lourd stable pour être produit de cette manière. Le processus commence par le deuxième noyau stable créée par la combustion de silicium, qui est le calcium. Un noyau stable de calcium fusionne avec un noyau d'hélium, créant titane instable. Avant de se désintègre le titane, il peut fusionner avec un autre noyau d'hélium, la création de chrome instable. Avant de se désintègre chrome, il peut fusionner avec un autre noyau d'hélium, créant fer instable. Avant de se désintègre le fer, il peut fusionner avec un autre noyau d'hélium, créant instable nickel-56. Toute autre fusion de nickel-56 consomme de l'énergie au lieu de produire de l'énergie, donc après la production de nickel-56, l'étoile ne produit pas l'énergie nécessaire pour maintenir le noyau de se effondrer. Finalement, le nickel-56 se désintègre en instables cobalt-56, qui à son tour se désintègre à stable fer-56. Lorsque le noyau de l'étoile se effondre, il crée une supernova . Supernovae créent aussi d'autres formes de fer stable via le r-processus.
Occurrence
Occurrence planétaire

Le fer est le sixième plus élément abondant dans le Univers , et le plus commun Elément réfractaire. Il est formé en tant que la dernière étape exothermique de nucléosynthèse stellaire, par fusion de silicium dans les étoiles massives.
Métallique ou fer natif est rarement trouvé sur la surface de la Terre car il a tendance à se oxyder, mais ses oxydes sont omniprésentes et représentent les minerais primaires. Se il représente environ 5% de la croûte terrestre , à la fois celle de la Terre intérieure et noyau externe sont jugées largement constitué d'un fer nickel alliage constituant 35% de la masse de la Terre dans son ensemble. Fer est donc l'élément le plus abondant sur Terre, mais seulement le quatrième élément le plus abondant dans la croûte terrestre. La majeure partie du fer dans la croûte se trouve combiné avec de l'oxygène en tant que minerais d'oxyde de fer tels que hématite et magnétite. Les grands gisements de fer se trouvent dans formations de fer rubanées. Ces formations géologiques sont un type de roche constituée de couches minces répétées de les oxydes de fer, soit la magnétite (Fe 3 O 4) ou hématite (Fe 2 O 3), en alternance avec des bandes de pauvre en fer schiste et chert. Les formations de fer rubanées ont été fixées dans le temps entre 3700 il ya des millions d'années et 1800 il ya des millions d'années
Environ 1 20 météorites sont composés des minéraux uniques fer-nickel taenite (35-80% de fer) et kamacite (90-95% de fer). Bien que rare, météorites de fer sont la principale forme de fer métallique naturelle sur la surface de la Terre. Il a été prouvé par Spectroscopie Mössbauer que la couleur rouge de la surface de Mars est dérivé d'un oxyde de fer riche régolite.
Stocks en usage dans la société
Selon le International des ressources du Groupe spécial Stocks de métaux dans les rapport de la Société, par habitant stock mondial du fer en usage dans la société est de 2200 kg. Beaucoup de ceci est dans les pays les plus développés (de 7000 à 14000 kg par habitant) plutôt que les pays les moins avancés (2000 kg par habitant).
Chimie et composés
| Oxydation état | Composé représentatif |
|---|---|
| -2 | Tetracarbonylferrate disodique (réactif de Collman) |
| -1 | |
| 0 | Pentacarbonyle de fer |
| 1 | Cyclopentadiénylfer dicarbonyle dimère ("Fp 2") |
| 2 | Sulfate ferreux, ferrocène |
| 3 | Chlorure ferrique , ferrocénium tétrafluoroborate |
| 4 | Baryum ferrate (IV) |
| 5 | |
| 6 | Ferrate de potassium |
Fer forme des composés principalement dans les deux et trois états d'oxydation . Traditionnellement, les composés de fer (II) sont appelés ferreux, le fer et les composés (III) ferrique. Fer se produit également dans des états d'oxydation plus élevés, un exemple étant la pourpre ferrate de potassium (K 2 FeO 4) qui contient du fer à l'état d'oxydation +6. Fer à repasser (IV) est un intermédiaire commun dans de nombreuses réactions d'oxydation biochimique. Nombreux composés organométalliques contiennent les états d'oxydation formels de 1, 0, -1, -2 ou même. Les états d'oxydation et d'autres propriétés de liaison sont souvent évalués en utilisant la technique de Spectroscopie Mössbauer. Il ya aussi beaucoup composés de valence mixtes contenant à la fois du fer (II) et de fer (III), tels que des centres magnétite et Bleu de Prusse (Fe 4 (Fe [CN] 6) 3). Celui-ci est utilisé comme traditionnel "bleu" dans les plans.

Les composés de fer produites sur la plus grande échelle dans l'industrie sont sulfate de fer (II) (FeSO 4 · 7 H 2 O) et de fer (III) chlorure (FeCl 3). Le premier est l'une des sources de fer (II) les plus facilement accessibles, mais est moins stable à l'oxydation aérienne de Le sel de Mohr ((NH 4) 2 Fe (SO 4) 2 · 6H 2 O). De fer (II) les composés ont tendance à être oxydé en fer (III) des composés dans l'air.
Contrairement à de nombreux autres métaux, le fer ne fait pas les amalgames au mercure. En conséquence, le mercure est négocié sur 76 flacons normalisés de livres (34 kg) en fer.
Composés binaires
Fer réagit avec l'oxygène dans l'air pour former divers des composés d'oxyde et hydroxyde; les plus courants sont fer (, III II) oxyde (Fe 3 O 4), et fer (III) oxyde (Fe 2 O 3). Fer (II) oxyde existe également, mais il est instable à température ambiante. Ces oxydes sont les principaux minerais pour la production de fer (voir bloomery et du haut fourneau). Ils sont également utilisés dans la production de ferrites, utile supports magnétiques de stockage dans les ordinateurs, et des pigments. Le sulfure le plus connu est la pyrite de fer (FeS 2), aussi connu comme l'or des fous en raison de son lustre doré.
Les halogénures ferreux et ferriques binaires sont bien connus, à l'exception de l'iodure ferrique. Les halogénures ferreux se présentent typiquement de traitement des métaux de fer avec l'acide halogène binaire correspondant pour donner les sels hydratés correspondants.
- Fe 2 + HX → FeX 2 + H 2
Fer réagit avec le fluor, le chlore, le brome et de donner les halogénures ferriques correspondants, le chlorure ferrique étant les plus courantes:
- 2 Fe + 3 X 2 → 2 FeX 3 (X = F, Cl, Br)
composés de coordination et organométalliques
Plusieurs complexes de cyanure sont connus. L'exemple le plus célèbre est Bleu de Prusse, (Fe 4 (Fe [CN] 6 3)). Ferricyanure de potassium et ferrocyanure de potassium sont également connus; la formation du bleu de Prusse lors de la réaction avec le fer (II) et de fer (III) forme respectivement la base d'un test «humide» chimique. Bleu de Prusse est aussi utilisé comme un antidote pour le thallium radioactif et le césium empoisonnement. Bleu de Prusse peut être utilisée dans une buanderie bleuissement de corriger la teinte jaunâtre laissé par les sels ferreux dans l'eau.
Plusieurs composés carbonyles de fer sont connues. Le fer de premier (0) composé est pentacarbonyle de fer, Fe (CO) 5, qui est utilisé pour produire poudre de fer carbonyle, une forme hautement réactive de fer métallique. Thermolyse de pentacarbonyle de fer donne le cluster trinucléaire, dodécacarbonyle trifer. Le réactif de Collman, tetracarbonylferrate disodique, est un réactif utile pour la chimie organique; il contient du fer à l'état d'oxydation -2. Cyclopentadiénylfer dicarbonyle dimère contient du fer à l'état d'oxydation +1 rare.
Ferrocene est un complexe extrêmement stable. La première composé sandwich, il contient un fer (II) centre de deux ligands cyclopentadiényle liés par les dix atomes de carbone. Cet arrangement était une nouveauté choquant quand il a été découvert, mais la découverte de ferrocène a conduit à une nouvelle branche de la chimie organométallique. Ferrocene lui-même peut être utilisé comme l'épine dorsale d'un ligand, par exemple, dppf. Ferrocene lui-même peut être oxydé en le cation ferrocénium (Fc +); le couple ferrocène / ferrocénium est souvent utilisé comme une référence en électrochimie.
Histoire
Fer forgé

Les objets en fer de grand âge sont beaucoup plus rares que les objets en or ou en argent en raison de la facilité de la corrosion du fer. Perles en fulgurante fer dans BC 3500 ou plus tôt ont été trouvés dans Gerzah, Egypte par GA Wainwright. Les perles contiennent 7,5% de nickel, qui est une signature d'origine météorique depuis fer trouvé dans la croûte de la Terre a très peu ou pas de teneur en nickel. Fer météorique a été très apprécié en raison de son origine dans les cieux et a été souvent utilisé pour forger des armes et des outils ou des spécimens entiers placés dans les églises. Articles qui ont été susceptibles de fer par les Egyptiens datent de 2500 à 3000 av. Fer avait un net avantage sur le bronze en instruments de guerre. Ce était beaucoup plus difficile et plus durable que le bronze, bien que sensible à la rouille. Cependant, ce est contestée. Hittitologue Trevor Bryce fait valoir que, avant les techniques de travail du fer avancées ont été développés en Inde , les armes de fer météoritiques utilisés par les premiers mésopotamiens armées avaient tendance à se briser en combat, en raison de leur haute teneur en carbone.
La première production de fer a débuté en l' Age du Bronze Moyen , mais il a fallu plusieurs siècles avant fer déplacées bronze. Des échantillons de fer fondu de Asmar, la Mésopotamie et Tall Chagar Bazar dans le nord de la Syrie ont été faites autrefois entre 2700 et 3000 avant JC. Le Hittites semblent être le premier à comprendre la production de fer de ses minerais et considèrent qu'il est très dans leur société. Ils ont commencé à fondre le fer entre 1500 et 1200 avant JC et la pratique propagation au reste du Proche-Orient après leur empire est tombé en 1180 en Colombie-Britannique. La période suivante est appelé Age du Fer . la fonte du fer, et donc l'âge du fer, atteint Europe à deux cent ans plus tard et sont arrivés dans le Zimbabwe , l'Afrique par le 8ème siècle. En Chine, le fer ne apparaît que vers 700-500 av. la fonte du fer peut avoir été introduit en Chine par l'Asie centrale. La première preuve de l'utilisation d'un haut-fourneau en Chine remonte au 1er siècle de notre ère, et cubilots ont été utilisés dès dès le Période des Royaumes combattants (403-221 avant JC). Utilisation de l'explosion et cubilot est restée généralisée pendant les chansons et Tang dynasties .
Artefacts de fer fondu se produisent dans L'Inde de 1800 à 1200 avant JC, et dans le Levant d'environ 1500 avant JC (suggérant fusion dans Anatolie ou de la Caucase).
Le Livre de la Genèse, quatrième chapitre, verset 22 contient la première mention de fer dans l' Ancien Testament de la Bible ; "Tubal-Caïn, un instructeur de chaque airain et de fer." D'autres versets font allusion à l'exploitation du fer (Job 28: 2), le fer utilisé comme un stylet (Job 19:24), four (Deutéronome 04:20), chars (Josué 17:16), ongles (I Chron. 22: 3) , scies et axes (II Sam 12:31.), et ustensiles de cuisine (Ezéchiel 4: 3). Le métal est également mentionné dans le Nouveau Testament , par exemple dans Actes chapitre 12 verset 10, «[Peter passé à travers] la porte de fer qui mène à la ville" d'Antioche.
Fer travail a été présenté à la Grèce à la fin du 11e siècle av. La propagation de la sidérurgie en Europe centrale et de l'Ouest est associée à L'expansion celtique. Selon Pline le, l'utilisation de fer Elder était commune dans le Roman époque. La production annuelle de fer de l' Empire romain est estimé à 84 750 t, tandis que le similaire peuplé Han Chine a produit environ 5000 t.
Au cours de la révolution industrielle en Grande-Bretagne, Henry Cort a commencé affiner fer de fonte à fer forgé (ou barre de fer) en utilisant les systèmes de production innovants. En 1783, il fait breveter le processus de raffinage du minerai de fer la formation de flaques. Il a ensuite été amélioré par d'autres, y compris Joseph Hall.
Fonte
Fonte a été la première fois en Chine au cours 5ème siècle avant JC, mais ne était guère en Europe jusqu'à la période médiévale. Le plus tôt objets en fonte ont été découverts par les archéologues dans ce qui est maintenant moderne Luhe County, Jiangsu en Chine. Fonte a été utilisée dans la Chine ancienne à la guerre, de l'agriculture, et de l'architecture. Au cours de la médiévale période, des moyens ont été trouvés en Europe de produire du fer forgé en fonte (dans ce contexte appelé fonte) à l'aide parure forge. Pour tous ces processus, charbon a été nécessaire comme combustible.

Médiéval hauts fourneaux étaient environ 10 pieds (3,0 m) de haut et fait de briques réfractaires; air forcé est généralement fourni par un soufflet à main. Hauts fourneaux modernes ont augmenté beaucoup plus grand.
En 1709, Abraham Darby a établi un coke de haut fourneau pour produire fonte. La disponibilité du fer qui a suivi peu coûteux était l'un des facteurs conduisant à la révolution industrielle. Vers la fin du 18ème siècle, la fonte a commencé à remplacer fer forgé à certaines fins, parce que ce était moins cher. La teneur en carbone en fer n'a pas été impliqué comme la raison des différences dans les propriétés de fer forgé, fonte et acier jusqu'à ce que le 18ème siècle.
Comme le fer devenait moins cher et plus abondant, il est également devenu un matériau structurel majeur suite à la construction de la innovante premier pont de fer en 1778.
Acier
Steel (avec teneur en carbone plus faible que la fonte brute, mais plus de fer forgé) a été produit dans l'Antiquité en utilisant un bloomery. Forgerons dans Luristan dans l'ouest de l'Iran ont été en bonne acier en 1000 av. Puis versions améliorées, Wootz par l'Inde et l'acier de Damas par la Chine ont été développés autour de 300 avant JC et 500 après JC, respectivement. Ces méthodes ont été spécialisés, et ainsi de l'acier ne est pas devenu un produit important jusqu'à ce que les années 1850.
Nouvelles méthodes de production par barres de carburation du fer dans le processus de cimentation ont été conçues dans le 17e siècle de notre ère. Dans la révolution industrielle , de nouvelles méthodes de production de fer en barre sans charbon ont été conçus et ceux-ci ont ensuite été appliqués à produire de l'acier. À la fin des années 1850, Henry Bessemer a inventé un nouveau procédé de fabrication de l'acier, impliquant souffler de l'air grâce à la fonte liquide, pour produire de l'acier doux. Cet acier fait beaucoup plus économique, ce qui conduit à en fer forgé ne est plus produite.
Fondements de la chimie moderne
Antoine Lavoisier utilisé la réaction de la vapeur d'eau avec du fer métallique à l'intérieur d'un tube de fer incandescence pour produire de l'hydrogène dans ses expériences menant à la démonstration de la conservation de la masse. Oxydation anaérobie de fer à haute température peut être schématiquement représentée par les réactions suivantes:
- Fe + H 2 O → FeO + H 2
- 2 Fe + 3 H 2 O → Fe 2 O 3 + 3 H 2
- 3 Fe + 4 H 2 O → Fe 3 O 4 + 4 H 2
La production industrielle
La production de fer ou d'acier est un procédé comprenant deux étapes principales, à moins que le produit désiré est en fonte. La première étape est de produire de la fonte dans un haut-fourneau. En variante, il peut être directement réduit. La seconde est de faire en fer forgé ou en acier de fonte par un autre processus.

Pour quelques fins limitées comme noyaux d'électro-aimants, le fer pur est produit par électrolyse d'une une solution de sulfate ferreux
Haut fourneau
Quatre-vingt dix pour cent de toutes les mines de métal minerais est pour l'extraction du fer. Industriellement, la production de fer implique minerais de fer, principalement hématite (nominalement Fe 2 O 3) et la magnétite (Fe 3 O 4) dans un réaction carbothermique (réduction avec du carbone) dans un haut fourneau à des températures d'environ 2000 ° C. Dans un haut fourneau, le minerai de fer, de carbone sous forme de coke, et un flux tel que calcaire (qui est utilisé pour éliminer les impuretés de dioxyde de silicium dans le minerai qui autrement obstruer le four avec un matériau solide) sont introduits dans la partie supérieure du four, tandis qu'une explosion massive de chauffe de l'air , à environ 4 tonnes par tonne de fer, est forcée dans le four en bas.
Dans le four, le coke réagit avec l'oxygène dans le jet d'air pour produire du monoxyde de carbone :
- 2 C + O 2 → 2 CO
Le monoxyde de carbone réduit le minerai de fer (dans le équation chimique ci-dessous, hématite) de fer en fusion, devient du dioxyde de carbone dans le procédé:
- Fe 2 O 3 + CO 3 → 2 Fe + 3 CO 2
Certains fer dans la région de haute température inférieure du four réagit directement avec le coke:
- 2 Fe 2 O 3 + 3 C → 4 Fe + 3 CO 2
Le flux est présente pour faire fondre les impuretés dans le minerai, principalement du dioxyde de silicium sable et autres silicates. Flux communs incluent le calcaire (principalement de carbonate de calcium ) et dolomie (carbonate de calcium et de magnésium). D'autres flux peuvent être utilisés en fonction des impuretés qui doivent être présente dans le minerai. Dans la chaleur du four du flux de calcaire se décompose pour oxyde de calcium (également connu sous le nom de chaux vive):
- CaCO 3 → CaO + CO 2
Ensuite, l'oxyde de calcium se combine avec du dioxyde de silicium pour former un liquide scories.
- SiO 2 + CaO → CaSiO3
Le laitier fondu dans la chaleur du four. Dans le fond du four, le laitier fondu flotte à la surface du fer fondu plus dense, et des ouvertures dans le côté du four est ouverte pour faire sortir de la fonte et le laitier séparément. Le fer à repasser, une fois refroidi, est appelée la fonte brute, alors que le laitier peut être utilisé comme un matériau en la construction de routes ou pour améliorer les sols minéraux pauvres pour l'agriculture

La réduction du fer direct
Depuis coke est de plus en plus réglementé en raison de préoccupations environnementales, d'autres méthodes de traitement du fer ont été développés. L'un d'eux est connu comme la réduction du fer directe. Il réduit le minerai de fer à une substance en poudre appelé éponge de fer ou "directe fer", qui est approprié pour la production d'acier. Il ya deux principales réactions qui se passent dans le processus de réduction directe:
Le gaz naturel est partiellement oxydée (avec la chaleur et d'un catalyseur):
- 2 CH 4 + O 2 → 2 CO + 4 H 2
Ces gaz sont ensuite traités avec du minerai de fer dans un four, la production de mousse de fer solide:
- Fe 2 O 3 + 2 CO + H 2 → 2 Fe + CO 2 + H 2 O 2
La silice est éliminée par l'addition d'un flux, ce est-calcaire, plus tard.
D'autres procédés
Gueuses est pas le fer pur, mais a 5.4% de carbone dissous dans le avec de petites quantités d'autres impuretés telles que le soufre, le magnésium, le phosphore et le manganèse. Comme le carbone est l'impureté majeure, le fer (fonte) devient cassant et dur. Cette forme de fer, aussi connu comme la fonte, est utilisé pour couler des articles en fonderies comme les cuisinières, des tuyaux, des radiateurs, des lampadaires et des rails.
Alternativement fonte peut être transformé en (avec jusqu'à environ 2% de carbone) ou en fer forgé (fer commercialement pur) acier. Divers procédés ont été utilisés à cet effet, y compris forges de parure, fours à puddler, Convertisseurs Bessemer, fours Martin, fours à oxygène de base, et fours à arc électrique. Dans tous les cas, l'objectif consiste à oxyder une partie ou la totalité du carbone, ainsi que d'autres impuretés. En revanche, d'autres métaux peuvent être ajoutés pour rendre les aciers alliés.
La dureté de l'acier dépend de sa teneur en carbone: plus le pourcentage de carbone est élevé, plus la dureté et la malléabilité de la moindre. Les propriétés de l'acier peuvent également être modifiés par plusieurs méthodes.
Le recuit comprend le chauffage d'une pièce d'acier à 700-800 ° C pendant plusieurs heures et ensuite un refroidissement progressif. Il rend l'acier plus doux et plus viable.
Steel ne se endurcisse par travail à froid. Le métal est plié ou martelé dans sa forme définitive à une température relativement fraîche. Forgeage à froid est l'estampage d'une pièce d'acier en forme par une presse lourde. Clés sont généralement fabriqués par forgeage à froid. Laminage à froid, qui consiste à fabriquer une feuille mince mais plus difficile, et étirage à froid, ce qui rend un fil plus mince mais plus fort, sont deux autres méthodes de travail à froid. Pour durcir l'acier, il est chauffé à rouge et ensuite refroidi par trempe dans l'eau. Il devient de plus en plus fragile. Si elle est trop durci, il est ensuite chauffé à une température requise et on laisse refroidir. L'acier ainsi formé est moins fragile.
Le traitement thermique est une autre façon de durcir l'acier. L'acier est chauffé au rouge, puis refroidi rapidement. Les molécules de carbure de fer sont décomposés par la chaleur, mais ne pas avoir le temps de réformer. Depuis les atomes de carbone libres sont bloqués, il rend l'acier beaucoup plus dur et plus fort qu'avant.
Parfois, à la fois ténacité et la dureté sont souhaitées. Un processus appelé cémentation peut être utilisé. L'acier est chauffé à environ 900 ° C, puis plongé dans l'huile ou de l'eau. Carbone de l'huile peut diffuser dans l'acier, ce qui rend la surface très dur. La surface se refroidit rapidement, mais l'intérieur se refroidit lentement, faisant une surface extrêmement dure et une couche intérieure imperméable et résistant.
Le fer peut être passivé en le plongeant dans un concentré acide nitrique solution. Cela forme une couche protectrice d'oxyde sur le métal, la protégeant de la corrosion.
Applications
Métallurgique
| Pays | Minerai de fer | Saumon de fonte | Fer direct | Acier |
|---|---|---|---|---|
| Chine | 1,114.9 | 549,4 | 573,6 | |
| Australie | 393,9 | 4.4 | 5.2 | |
| Brésil | 305,0 | 25,1 | 0,011 | 26,5 |
| Japon | 66,9 | 87,5 | ||
| Inde | 257,4 | 38,2 | 23,4 | 63,5 |
| Russie | 92,1 | 43,9 | 4.7 | 60,0 |
| Ukraine | 65,8 | 25,7 | 29,9 | |
| Corée Du Sud | 0,1 | 27,3 | 48,6 | |
| Allemagne | 0,4 | 20,1 | 0,38 | 32,7 |
| Monde | 1,594.9 | 914,0 | 64,5 | 1,232.4 |
Le fer est le plus largement utilisé de tous les métaux, ce qui représente 95% de la production de métal dans le monde entier. Son faible coût et de haute résistance rendent indispensable dans les applications d'ingénierie tels que la construction de machines et de machines-outils, voitures , les coques de grands navires , et des composants structuraux pour les bâtiments. Depuis fer pur est assez doux, il est le plus souvent associé à des éléments d'alliage de l'acier.
Commercialement fer disponible est classé en fonction de la pureté et de l'abondance des additifs. Fonte a 3,5-4,5% de carbone et contient des quantités variables de contaminants tels que le soufre , de silicium et de phosphore . Cochon de fer ne sont pas un produit vendable, mais plutôt une étape intermédiaire dans la production de fonte et d'acier. La réduction des contaminants dans la fonte brute qui affectent négativement les propriétés des matériaux, tels que le soufre et le phosphore, les rendements fonte contenant 2-4% de carbone, 1-6% de silicium, et de petites quantités de manganèse . Il a un point de fusion dans la gamme de 1420-1470 K, ce qui est inférieur ou l'autre de ses deux principales composantes, et en fait le premier produit à être fondu lorsque le carbone et le fer sont chauffés ensemble. Ses propriétés mécaniques varient considérablement et dépendent de la forme prend le carbone dans l'alliage.
«Blanc» fontes contiennent leur carbone sous la forme de cémentite, ou carbure de fer. Ce composé dur et cassant domine les propriétés mécaniques des fontes blanches, les rendant difficile, mais peu résistants aux chocs. La surface brisée d'une fonte blanche est pleine de facettes fines du carbure de fer brisée, un matériau brillant très pâle, argenté, d'où l'appellation.
En fonte grise du carbone existe, fines paillettes distinctes de graphite, et rend aussi le fragile matériau en raison des flocons de graphite à arêtes vives qui produisent le stress des sites de concentration au sein du matériau. Une nouvelle variante de fonte grise, dite fonte ductile est spécialement traitée avec des traces de magnésium pour modifier la forme de graphite à sphéroïdes, ou des nodules, réduire les concentrations de contraintes et de nettement augmenter la ténacité et la force de la matière.
Fer forgé contient moins de 0,25% de carbone, mais de grandes quantités de laitier qui lui donnent un caractère fibreux. Il est un produit malléable difficile, mais pas comme fusible que la fonte brute. Si aiguisé à un bord, il perd rapidement. Le fer forgé est caractérisée par la présence de fibres fines de scories piégées à l'intérieur du métal. Le fer forgé est plus résistant à la corrosion que l'acier. Il a été presque complètement remplacé par l'acier doux pour les produits traditionnels "en fer forgé" et la forge.
Acier doux corrode plus facilement que le fer forgé, mais est moins cher et plus largement disponible. acier au carbone contient 2,0% de carbone ou moins, avec de petites quantités de manganèse , le soufre , le phosphore et le silicium. aciers alliés contiennent des quantités de carbone variant ainsi que d'autres métaux tels que le chrome , le vanadium , le molybdène , le nickel, le tungstène , etc. Leur teneur en alliage soulève leur coût, et donc ils ne sont généralement employées pour spécialiste utilise. Un alliage d'acier commun, cependant, est acier inoxydable. développements récents dans la sidérurgie ont produit une gamme croissante des aciers microalliés, également appelé ' HSLA »ou à haute résistance, les aciers faiblement alliés, contenant de minuscules ajouts pour produire des résistances élevées et ténacité souvent spectaculaire à un coût minime .
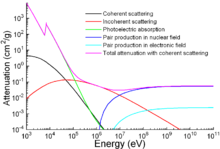
Outre les applications traditionnelles, le fer est également utilisé pour la protection contre les rayonnements ionisants. Bien qu'il soit plus léger que l'autre matériau de protection traditionnel, le plomb, il est beaucoup plus solide mécaniquement. L'atténuation d'un rayonnement en fonction de l'énergie est représenté sur le graphique.
Le principal inconvénient de fer et d'acier est que le fer pur, et la plupart de ses alliages, souffrent terriblement dela rouille si non protégé d'une certaine façon.Peinture,galvanisation,passivation, revêtement plastique etbleuissement sont tous utilisés pour protéger le fer de la rouille en excluantl'eauet de l'oxygène ou parune protection cathodique.
Les composés de fer
Bien que son rôle métallurgique est dominante en termes de montants, composés de fer sont omniprésents dans l'industrie ainsi être utilisé dans de nombreuses applications de niche. des catalyseurs de fer sont traditionnellement utilisés dans la procédé Haber-Bosch pour la production d'ammoniac et le procédé de Fischer-Tropsch pour la conversion du monoxyde de carbone en hydrocarbures pour carburants et lubrifiants. Poudre de fer dans un solvant acide a été utilisé dans la réduction Bechamp la réduction de nitrobenzene en aniline.
De fer (III) chlorure trouve une utilisation dans la purification de l'eau et de traitement des eaux usées, dans la teinture de tissu, comme un agent colorant dans les peintures, comme additif dans les aliments pour animaux, et comme un agent de gravure pour le cuivre dans la fabrication d' les cartes de circuits imprimés. Elle peut également être dissous dans alcool pour former la teinture de fer. Les autres halogénures ont tendance à être limitée à des utilisations en laboratoire.
Le sulfate de fer (II) est utilisé en tant que précurseur pour d'autres composés de fer. Il est également utilisé pour réduire le chromate dans le ciment. Il est utilisé pour enrichir les aliments et traiter anémie ferriprive. Ce sont les principales utilisations. sulfate de fer (III) est utilisé pour régler les particules d'égout minutes dans de l'eau du réservoir. Fer (II) chlorure est utilisé comme agent réducteur de floculation, dans la formation de complexes de fer et des oxydes de fer magnétiques, et en réduisant Agent en synthèse organique.
Rôle biologique
Le fer est abondant dans la biologie. Fer-protéines se trouvent dans tous les organismes vivants, allant de la évolutif primitive archées pour les humains. La couleur du sang est due à l'hémoglobine, une protéine contenant du fer. Comme illustré par l'hémoglobine, le fer est souvent lié à des cofacteurs, par exemple dans hemes. Le grappes fer-soufre sont omniprésents et comprennent nitrogénase, les enzymes responsables de la biologique fixation de l'azote . Théories influentes de l'évolution ont invoqué un rôle pour des sulfures de fer dans la théorie du monde fer-soufre.
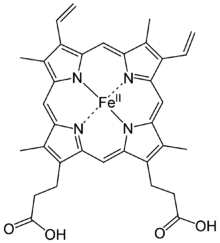
Le fer est un élément nécessaire oligo-élément trouvé dans presque tous les organismes vivants. Fer-contenant des enzymes et de protéines, contenant souvent hème groupements prosthétiques, participer à de nombreuses oxydations biologiques et dans les transports. Des exemples de protéines trouvées dans les organismes supérieurs comprennent l'hémoglobine, cytochrome (voir haut fer de valence) et catalase.
Composés bioinorganique
Les "plus connus et étudiés composés bioinorganiques "de fer (c.-à-composés de fer utilisées en biologie) sont les protéines de l'hème: exemples sont l'hémoglobine, la myoglobine, et le cytochrome P450. Ces composés peuvent transporter gaz, construisent des enzymes, et être utilisés dans le transfert des électrons . Métalloprotéines sont un groupe de protéines avec des ions métalliques cofacteurs. Quelques exemples de métalloprotéines de fer sont la ferritine et rubrédoxine. De nombreuses enzymes indispensables à la vie contiennent du fer, tels que la catalase, lipoxygenases, et IRE-BP.
Santé et alimentation
Le fer est omniprésente, mais des sources particulièrement riches de fer alimentaire comprennent la viande rouge, les lentilles, les haricots , la volaille , le poisson , les légumes feuilles, le cresson, le tofu , les pois chiches, les pois aux yeux noirs, mélasse, fortifiée du pain , et fortifiés céréales de petit déjeuner. Fer en faibles quantités se trouve dans la mélasse, le teff et farina. Fer dans la viande ( fer héminique) est plus facilement absorbé que le fer dans les légumes. Bien que certaines études suggèrent que l'hème / hémoglobine de la viande rouge a des effets qui peuvent augmenter le risque de cancer colorectal, il ya encore une certaine controverse, et même quelques études suggérant qu'il n'y a pas suffisamment de preuves pour appuyer ces revendications.
Fer fournies par des compléments alimentaires est souvent constaté que le fer (II) fumarate, bien que le sulfate de fer est moins cher et est aussi bien absorbé. Fer élémentaire, ou fer réduit, en dépit d'être absorbée à seulement un tiers-deux tierss l'efficacité (par rapport au sulfate de fer), est souvent ajouté aux aliments comme les céréales de petit déjeuner ou de la farine de blé enrichie. Le fer est le plus à la disposition du corps lorsque chélaté aux acides aminés et est également disponible pour l'utilisation comme un commun supplément de fer. Souvent, l'acide aminé choisi à cet effet est le moins cher et le plus courant acide aminé, la glycine, conduisant à "glycinate de fer" suppléments. Le apport nutritionnel recommandé (AJR) en fer varie considérablement en fonction de l'âge, le sexe, et la source de fer alimentaire (hème à base de fer a une plus grande biodisponibilité). Les nourrissons peuvent besoin de suppléments de fer si elles sont nourris au biberon de lait de vache. Les donneurs de sang et les femmes enceintes sont particulièrement à risque de faibles taux de fer et sont souvent conseillé de compléter leur apport de fer.
Absorption et le stockage
Fer acquisition pose un problème pour les organismes aérobies, parce que le fer ferrique est peu soluble près de pH neutre. Ainsi, les bactéries ont évolué de haute affinité des agents séquestrant appelés sidérophores.
Après absorption, dans les cellules , stockage du fer est soigneusement réglementé; Ne existent pas en tant que tels des ions de fer "libres". Un élément majeur de ce règlement est la protéine transferrine, qui lie les ions de fer absorbé par le duodénum et le transporte dans le sang pour les cellules. Chez les animaux, les plantes et les champignons, le fer est souvent l'ion métallique incorporé dans le complexe de l'hème. L'hème est une composante essentielle de protéines de cytochrome, qui médient les réactions d'oxydoréduction, et de l'oxygène des protéines porteuses telles que l'hémoglobine, la myoglobine, et leghémoglobine.
Fer inorganique contribue à des réactions redox amas fer-soufre de nombreuses enzymes, telles que la nitrogénase (impliqués dans la synthèse de l'ammoniac à partir d'azote et un atome d'hydrogène ) et hydrogénase. Protéines de fer non hémique comprennent la enzymes mono-oxygénase de méthane (oxyde de méthane au méthanol ), la ribonucléotide réductase (réduit ribose à désoxyribose; ADN biosynthèse), hemerythrins ( l'oxygène de transport et la fixation dans les invertébrés marins) et violet phosphatase acide ( hydrolyse de phosphate esters).
Distribution du fer est fortement réglementée dansles mammifères, en partie parce que les ions de fer ont un potentiel élevé de toxicité biologique.
Régulation de l'absorption
L'absorption de fer est étroitement régulée par le corps humain, qui n'a pas les moyens physiologiques réglementés de l'excrétion du fer. Seules de petites quantités de fer sont perdues tous les jours en raison de la muqueuse épithéliale de la peau et la desquamation cellulaire, de sorte que le contrôle des niveaux de fer est la plupart du temps en régulant l'absorption. Régulation de l'absorption du fer est altérée chez certaines personnes à la suite d'un défaut génétique qui correspond à la région du gène HLA-H sur le chromosome 6. Dans ces personnes, l'apport en fer excessif peut entraîner des troubles de surcharge en fer, tels que l'hémochromatose. Beaucoup de gens ont une prédisposition génétique à la surcharge en fer sans le savoir ou d'être au courant d'une histoire familiale du problème. Pour cette raison, il est conseillé que les gens ne prennent pas de suppléments de fer à moins qu'ils ne souffrent d' une carence en fer et ont consulté un médecin. Hémochromatose est estimé à causer la maladie entre 0,3 et 0,8% des Caucasiens.
IRM constate que le fer accumule dans lehippocampe du cerveau des personnes atteintesde la maladie d'Alzheimeret dans lasubstantia nigra avec ceux dela maladie de Parkinson.
Barrières réactives perméables
Valence zéro fer est le principal matériau réactif pourbarrières réactives perméables.
Précautions
| NFPA 704 |
|---|
 1 0 1 |
| diamant feu pour le métal de la poudre de fer |
De grandes quantités de fer ingéré peuvent provoquer des niveaux excessifs de fer dans le sang. Des taux sanguins élevés de fer ferreux libre réagissent avec des peroxydes pour produire des radicaux libres, qui sont très réactives et peuvent endommager l'ADN , des protéines , des lipides et d'autres composants cellulaires. Ainsi, la toxicité du fer se produit quand il ya du fer libre dans la cellule, ce qui se produit généralement lorsque les niveaux de fer excèdent la capacité de la transferrine à lier le fer. Les dommages aux cellules du tractus gastro-intestinal peut aussi les empêcher de régulation de l'absorption du fer menant à de nouvelles hausses des taux sanguins. Fer typiquement endommage les cellules dans le coeur , le foie et ailleurs, ce qui peut entraîner des effets négatifs importants, y compris le coma, acidose métabolique, choc, insuffisance hépatique, coagulopathie, syndrome de détresse respiratoire, des dommages aux organes à long terme, et même la mort. Les êtres humains éprouvent toxicité ferreuse dessus de 20 milligrammes de fer pour chaque kilogramme de masse, et 60 milligrammes par kilogramme est considéré comme une dose létale. La surconsommation de fer, souvent le résultat d'enfants qui mangent de grandes quantités de comprimés de sulfate ferreux destinés à la consommation des adultes, est une des causes toxicologiques les plus fréquentes de décès chez les enfants de moins de six ans. Le Apports nutritionnels de référence (DRI) répertorie l'apport maximal tolérable (UL ) pour les adultes que 45 mg / jour. Pour les enfants de moins de quatorze ans l'UL est de 40 mg / jour.
La prise en charge médicale de la toxicité ferreuse est compliqué, et peut inclure l'utilisation d'un spécifiqueagent chélateur appelédéféroxamine de lier et d'expulser l'excès de fer dans le corps.


