
Zinc
À propos de ce écoles sélection Wikipedia
Ce contenu de Wikipedia a été sélectionné par SOS Enfants d'aptitude dans les écoles à travers le monde. Voir http://www.soschildren.org/sponsor-a-child pour connaître le parrainage d'enfants.
| Zinc | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
30 Zn | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
gris argent  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | zinc, Zn, 30 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / z ɪ ŋ k / ZINGK | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Catégorie Metallic | métal de transition alternativement considéré comme un post-métal de transition | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | 12, 4, ré | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 65,38 (2) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Ar ] 3d 10 4s 2 2, 8, 18, 2 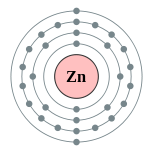 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Découverte | Métallurgistes indiens (avant 1000 BC) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | Andreas Sigismund Marggraf (1746) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reconnu comme un unique de métal par | Rasaratna Samuccaya (800) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 7,14 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densité au mp | 6,57 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 692,68 K , 419,53 ° C, 787,15 ° C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 1180 K, 907 ° C, 1665 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 7,32 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 123,6 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 25,470 J · mol -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 2, 1, 0 ( l'oxyde amphotère) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | 1,65 (échelle de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation ( plus) | 1er: 906,4 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2ème: 1733,3 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3ème: 3833 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 134 h | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 122 ± 16 heures | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de Van der Waals | 139 h | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | hexagonale compacte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magnétique | diamagnétique | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Résistivité électrique | (20 ° C) 59,0 nΩ · m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 116 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | (25 ° C) 30,2 um · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | ( rt) (laminés) 3850 m · s -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | 108 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 43 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | 70 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,25 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Mohs | 2,5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Brinell | 412 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-66-6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes du zinc | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Zinc, également dans le commerce Mattes, est un métallique élément chimique ; il a le Zn de symbole et de numéro atomique 30. Ce est le premier élément de groupe 12 du tableau périodique . Le zinc est, à certains égards, chimiquement semblables à du magnésium , parce que son ion est de taille similaire et sa seule commune état d'oxydation est deux. Zinc est l'élément le plus abondant dans la croûte 24 de la Terre et a cinq stables isotopes . Le zinc plus courante minerai est sphalérite (blende de zinc), un sulfure de zinc minéral. Les plus grandes quantités exploitables se trouvent en Australie, en Asie et aux États-Unis. La production de zinc comprend flottation par moussage du minerai, la torréfaction, et finale extraction utilisant l'électricité ( extraction électrolytique).
Laiton, qui est un alliage de cuivre et de zinc, a été utilisé depuis au moins le 10ème siècle BC. Impure métal de zinc n'a pas été produit à grande échelle jusqu'à ce que le 13ème siècle en Inde, alors que le métal était inconnu en Europe jusqu'à la fin du 16ème siècle. alchimistes brûlé zinc dans l'air pour former ce qu'ils appellent " la laine de philosophe »ou« neige blanche ".
L'élément a probablement été nommé par l'alchimiste Paracelse après le mot allemand Zinke. Chimiste allemand Andreas Sigismund Marggraf est normalement donné crédit pour découvrir zinc métallique pur en 1746. Les travaux de Luigi Galvani et Alessandro Volta a découvert les propriétés électrochimiques de zinc par 1800. corrosion , résistante zingage de fer ( galvanisation à chaud) est l'application majeure pour le zinc. D'autres applications sont en les batteries, les petites pièces non structurelles, et des alliages, tels que laiton. Une variété de composés de zinc sont couramment utilisés, tels que le carbonate de zinc et du gluconate de zinc (comme compléments alimentaires), le chlorure de zinc (dans les déodorants), pyrithione de zinc (anti shampooings antipelliculaires), le sulfure de zinc (dans les peintures luminescentes), et de zinc ou un groupe méthyle diéthyl-zinc dans le laboratoire organique.
Le zinc est un minéral essentiel de «biologique exceptionnelle et l'importance de la santé publique". La carence en zinc affecte environ deux milliards de personnes dans le monde en développement et est associé à de nombreuses maladies. Chez les enfants, il provoque un retard de croissance, la maturation sexuelle retardée, susceptibilité à l'infection, et la diarrhée, contribuant à la mort d'environ 800 000 enfants dans le monde par an. Enzymes avec un atome de zinc dans le centre réactif sont très répandues en biochimie, comme alcool déshydrogénase chez les humains. La consommation de l'excès de zinc peut causer ataxie, léthargie et carence en cuivre.
Caractéristiques
Propriétés physiques
Zinc, également appelé dans des contextes non scientifiques que Mattes, est un brillant blanc bleuté, métal diamagnétique, si la plupart des qualités commerciales communes du métal ont un fini mat. Il est un peu moins dense que le fer et a un hexagonal la structure cristalline.
Le métal est dur et cassant à la plupart des températures, mais devient malléable entre 100 et 150 ° C . Au-dessus de 210 ° C, le métal devient fragile et peut être à nouveau pulvérisé par battage. Le zinc est un juste conducteur de l'électricité. Pour un métal, le zinc est relativement bas point de fusion (419,5 ° C, 787,1 F) et des points d'ébullition (907 ° C). Son point de fusion est le plus bas de tous les métaux de transition en dehors de mercure et de cadmium .
Beaucoup alliages contiennent du zinc, y compris le laiton, un alliage de cuivre et de zinc. D'autres métaux connus depuis longtemps pour former des alliages avec le zinc binaires sont l'aluminium , l'antimoine , le bismuth , l'or , le fer, le plomb , le mercure , l'argent , l'étain , le magnésium , le cobalt , le nickel , le tellure et le sodium . Bien que ni zinc ni de zirconium sont ferromagnétique, leur alliage ZrZn deux expositions ferromagnétisme dessous de 35 K .
Occurrence
Zinc représente environ 75 ppm (0,0075%) de la croûte terrestre , ce qui en fait l'élément le plus abondant 24. Le sol contient de 5 à 770 ppm de zinc avec une moyenne de 64 ppm. L'eau de mer a seulement 30 ppb zinc et l'atmosphère contient de 0,1 à 4 mg / m 3.

L'élément se trouve normalement en association avec d'autres métaux de base tels que le cuivre et le plomb dans minerais. Le zinc est un chalcophile, ce qui signifie l'élément présente une faible affinité pour oxydes et préfère se lier avec sulfures. Chalcophiles formés comme la croûte solidifiée sous la des conditions de réduction de l'atmosphère de la Terre primitive. Sphalérite, qui est une forme de sulfure de zinc, le minerai est le contenant du zinc plus miné parce que son concentré contient 60-62% de zinc.
D'autres minéraux à partir de laquelle le zinc est extrait comprennent smithsonite (zinc carbonate ), hémimorphite (zinc silicate), wurtzite (un autre sulfure de zinc), et parfois hydrozincite (de base le carbonate de zinc). A l'exception de wurtzite, tous ces autres minéraux ont été formés à la suite de l'altération des processus sur les sulfures de zinc primordiales.
Les ressources de zinc du monde identifiés totalisent environ 1,9 milliard de tonnes. De grands gisements sont en Australie, le Canada et les États-Unis avec les plus grandes réserves de l'Iran . Au rythme actuel de la consommation, ces réserves sont estimées à quelque part entre appauvri 2027 et 2055. Environ 346 millions de tonnes ont été extraites à travers l'histoire à 2002, et une estimation constaté que environ 109 millions de tonnes de ce qui reste en cours d'utilisation.
Isotopes
Cinq isotopes de zinc se produisent dans la nature. 64 Zn est l'isotope le plus abondant (48,63% abondance naturelle). Cet isotope a une si longue demi-vie , à 4,3 × 10 18 un, que sa radioactivité peut être ignoré. De même, 70 Zn (0,6%), avec une demi-vie de 1,3 × 10 16 un ne est généralement pas considéré comme radioactif. Les autres isotopes présents dans la nature sont 66 Zn (28%), 67 Zn (4%) et 68 Zn (19%).
Plusieurs dizaines des radio-isotopes ont été caractérisés. 65 Zn, qui a une demi-vie de 243,66 jours, le radio-isotope est plus longue durée de vie, suivie d'une 72 Zn avec une demi-vie de 46,5 heures. Le zinc a 10 nucléaire isomères. 69m Zn a la demi-vie plus longue, 13,76 h. Le m exposant indique une isotope métastable. Le noyau d'un isotope métastable est dans un état excité et sera de retour à la état fondamental en émettant un photon dans la forme d'un rayons gamma. 61 Zn a trois états excités et 73 Zn a deux. Les isotopes 65 Zn, 71 Zn, 77 Zn et 78 Zn ont chacun un seul état excité.
Le plus commun mode d'un de décroissance radio-isotope de zinc avec un nombre de masse inférieure à 66 est capture d'électrons. Le désintégration des produits résultant de capture d'électrons est un isotope de cuivre.
- n
30 Zn + e - → n
29 Cu
Le mode de décroissance la plus courante d'un radio-isotope de zinc avec le nombre de masse est supérieur à 66 désintégration bêta (β -), qui produit un isotope de gallium .
- n
30 Zn → n
31 Ga + e - + ν
e
Les composés et la chimie
Réactivité
Le zinc a une configuration d'électrons [Ar] 3d 10 4s 2 et est un membre de la groupe 12 du tableau périodique . Ce est un métal modérément réactif et solide agent réducteur. La surface du métal pur ternit rapidement, pour finalement former une protection passivation de la couche de base le carbonate de zinc, Zn 5 (OH) 6 (CO 3) 2, par réaction avec l'atmosphère de dioxyde de carbone . Cette couche permet d'éviter une réaction ultérieure avec de l'air et de l'eau.
Zinc brûle dans l'air avec une flamme bleu-vert lumineux, dégageant des fumées de l'oxyde de zinc. Zinc réagit facilement avec des acides , alcalis et d'autres non-métaux. Extrêmement zinc pur réagit que lentement à température ambiante avec des acides. Acides forts, tels que chlorhydrique ou l'acide sulfurique , peuvent enlever la couche de passivation et la réaction subséquente avec l'eau des gaz d'hydrogène.
La chimie de zinc est dominée par l'état d'oxydation +2. Lorsque les composés dans cet état d'oxydation sont formés l'extérieur Les électrons de coquille sont perdus, ce qui donne un ion zinc nu avec la configuration électronique [Ar] 3d 10. En solution aqueuse un complexe octaédrique, [Zn (H 2 O) 6] 2+ est l'espèce prédominante. Le la volatilisation du zinc en combinaison avec du chlorure de zinc à des températures supérieures à 285 ° C indique la formation de Zn 2 Cl 2, un composé de zinc avec un état d'oxydation +1. Pas de composés de zinc dans l'oxydation des États autres que 1 ou 2 sont connus. Les calculs indiquent que un composé de zinc à l'état d'oxydation de +4 est peu susceptible d'exister.
la chimie de zinc est similaire à la chimie de la fin de la première rangée métaux de transition de nickel et de cuivre, si elle a un d-enveloppe remplie, de sorte que ses composés sont diamagnétique et le plus souvent incolore. Le rayons ioniques de zinc et de magnésium se trouvent à peu près identique. Pour cette raison certains de leurs sels ont le même la structure cristalline et dans des circonstances où le rayon ionique est un facteur déterminant de zinc et de magnésium chimiques ont beaucoup en commun. Sinon, il ya peu de ressemblance. Le zinc a tendance à former des liaisons avec un degré élevé de covalence et il forme beaucoup plus stable complexes avec N - et S - donateurs. Les complexes de zinc sont le plus souvent 4- ou 6- coordonner bien cinq coordonnée complexes sont connus.
Voir également Réduction de Clemmensen.
Zinc (I) composés
Zinc (I) composés sont rares, et nécessite ligands encombrants pour stabiliser l'état d'oxydation faible. La plupart zinc (I) contient des composés formellement le [Zn 2] 2+ noyau, qui est analogue à la [Hg 2] 2+ cation dimère présents dans le mercure des composés (I). Le diamagnétique nature de l'ion confirme sa structure dimère. Le premier composé de zinc (I) contenant la liaison Zn-Zn, (Η 5 -C 5 Me 5) 2 Zn 2, est aussi le premier dimetallocene. Le [Zn 2] 2+ rapide dismute en métal de zinc et de zinc (II), et a seulement été obtenu sous forme d'un verre jaune se est formé par refroidissement d'une solution de zinc métallique en fusion en ZnCl 2.
Zinc (II) des composés


Composés binaires de zinc sont connus pour la plupart de la métalloïdes et tout le non-métaux, à l'exception des gaz nobles . L'oxyde ZnO est une poudre blanche qui est pratiquement insoluble dans des solutions aqueuses neutres, mais est amphotères, dissolution dans des solutions basiques et acides forts. L'autre (chalcogénures ZnS, ZnSe et ZnTe) ont diverses applications dans l'électronique et l'optique. (Pnictogenides Zn 3 N 2, Zn 3 P 2, Zn 3 As 2 et Zn 3 Sb 2), le peroxyde ( ZnO 2), de l'hydrure ( ZNH 2), et le carbure (ZnC 2) sont également connus. Parmi les quatre halogénures, ZnF 2 a le caractère ionique plus, alors que les autres ( ZnCl 2 , ZnBr 2, et ZnI 2) présentent des points de fusion relativement bas et sont considérés comme ayant plus de caractère covalent.
Dans les solutions de base faibles contenant des ions Zn de, l'hydroxyde Zn (OH) 2 formes comme un blanc précipiter. Dans les solutions alcalines fortes, cet hydroxyde est dissous pour former zincates ( [Zn (OH) 4] 2-). Le nitrate Zn (NO 3) 2, le chlorate Zn (ClO 3) 2, le sulfate ZnSO 4, le phosphate Zn 3 (PO 4) 2, le molybdate ZnMoO 4, cyanure Zn (CN) 2, Zn arsénite (AsO 2) 2, l'arséniate de zinc (AsO 4) 2 · 8H 2 O et le chromate ZnCrO 4 (l'un des rares composés du zinc de couleur) sont quelques exemples d'autres composés inorganiques ordinaires de zinc. L'un des exemples les plus simples d'un composé organique de zinc est l'acétate d'éthyle ( Zn (O 2 CCH 3) 2).
Composés organozinciques sont ceux qui contiennent des liaisons covalentes carbone-zinc. Diethylzinc ( (C 2 H 5) 2 Zn) est un réactif dans la chimie de synthèse. Il a été signalé pour la première en 1848 par la réaction de zinc et l'iodure d'éthyle, et le premier composé connu pour contenir un métal-carbone liaison sigma.
Histoire
L'utilisation ancienne

Divers exemples isolés de l'utilisation de zinc impur dans les temps anciens ont été découverts. Une statuette préhistorique éventuellement contenant 87,5% de zinc a été trouvé dans un Dacian site archéologique Transylvanie (Roumanie moderne). Ornements en les alliages contenant de 80 à 90% de zinc avec le plomb, le fer, l'antimoine et d'autres métaux constituant le reste, ont été trouvés qui sont 2500 ans. Le Comprimés de zinc de Berne est une plaque votive datant de Roman Gaul constitué d'un alliage comprenant essentiellement du zinc. En outre, certains écrits anciens semblent avoir mentionné zinc. L'historien grec Strabon, dans un passage tiré d'un écrivain antérieure du 4ème siècle avant JC, mentionne "gouttes de faux argent", qui, lorsqu'ils sont mélangés avec du laiton cuivre marque. Ceci peut se référer à de petites quantités de zinc sous-produit de la fusion minerais sulfurés. Le Charaka Samhita, qui aurait été écrit en 500 avant JC ou avant, mentionne un métal qui, lorsqu'il est oxydé, produit pushpanjan, pensé pour être l'oxyde de zinc.
Minerais de zinc ont été utilisés pour faire les cuivres de l'alliage zinc-cuivre de nombreux siècles avant la découverte du zinc comme un élément distinct. Laiton Judée du 14e au 10e siècles BC contient 23% de zinc. Le livre de la Genèse, écrit entre le 10e et 5e siècles avant JC, mentionne (dans la traduction King James) Tubal-Caïn comme un «instructeur de chaque airain et de fer» ( Genèse 4:22), mais puisque le mot nechosheth, traduit par "laiton", signifie également «cuivre», la signification de ce ne est pas clair. La connaissance de la façon de produire laiton étendue à la Grèce antique par le 7ème siècle avant JC, mais quelques variétés ont été faites.
La fabrication de laiton était connu des Romains d'environ 30 BC. Ils ont fait en laiton en chauffant poudre calamine (zinc silicate ou carbonate), le charbon et le cuivre ensemble dans un creuset. La résultante laiton calamine a ensuite été soit coulé ou martelé en forme et a été utilisé dans l'armement. Certaines pièces frappées par les Romains en l'ère chrétienne sont faits de ce qui est probablement laiton calamine. Dans l'Ouest, le zinc impur a été connu de l'Antiquité à exister dans les restes dans les fours de fusion, mais il a été généralement écartée, car il a été pensé pour être sans valeur.
Mines de zinc à Zawar, près de Udaipur en Inde, ont été actifs depuis le Période Maurya à la fin du 1er millénaire av. La fusion du zinc métallique ici semble toutefois avoir commencé autour du 12ème siècle. Selon une estimation, ce est que cet endroit produit environ million de tonnes de zinc métallique et d'oxyde de zinc à partir de la 12ème à 16ème siècles. Une autre estimation donne une production totale de 60 000 tonnes de zinc métallique au cours de cette période. Le Rasaratna Samuccaya, écrit à peu près au 13ème siècle AD, mentionne deux types de minerais contenant du zinc; celui utilisé pour l'extraction de métaux et autres utilisés à des fins médicinales.
Les premières études et nommage
Zinc a été nettement reconnu comme un métal sous la désignation de Yasada ou Jasada dans le Lexicon médicale attribuée au roi hindou Madanapala et écrit sur l'année 1374. La fusion et l'extraction de zinc impur en réduisant calamine avec de la laine et d'autres substances organiques a été accompli dans le 13ème siècle en Inde. Les Chinois ne ont pas appris de la technique jusqu'à ce que le 17ème siècle.
Alchimistes brûlés zinc métallique dans de l'air et recueilli l'oxyde de zinc résultant sur une condenseur. Certains alchimistes appelaient cette oxyde de zinc lana philosophica, latin pour "laine de philosophe», parce qu'il a recueilli en touffes laineux tandis que d'autres pensaient qu'il ressemblait à neige blanche et l'a nommé album nix.
Le nom du métal a été probablement la première documentée par Paracelse, un alchimiste allemand né en Suisse, qui se est référé au métal comme «zincum" ou "zinken" dans son livre Liber Mineralium II, dans le 16ème siècle. Le mot est probablement dérivé du Zinke allemand, et soi-disant signifie «semblable à une dent, pointu ou déchiquetés" (cristaux de zinc métalliques ont une apparence semblable à une aiguille). Zink pourrait également impliquer "étain comme" en raison de sa relation avec l'allemand zinn signifie étain. Encore une autre possibilité est que le mot est dérivé du Mot persan سنگ Seng qui signifie pierre. Le métal a également été appelé indienne étain, tutanego, calamine, et Splinter.
Métallurgiste allemand Andreas Libavius reçu une quantité de ce qu'il a appelé "Calay" de Malabar à partir d'un cargo capturé par les Portugais en 1596. Libavius décrit les propriétés de l'échantillon, qui peut avoir été zinc. Zinc est régulièrement importé en Europe de l'Orient dans les 17e et début du 18e siècle, mais était parfois très cher.
Isolement de l'élément pur

L'isolement de zinc métallique en Occident peut avoir été réalisé indépendamment par plusieurs personnes. Dictionnaire universel de Postlewayt, une source contemporaine donnant l'information technologique en Europe, n'a pas mentionné le zinc avant 1751 mais l'élément a été étudié avant.
Métallurgiste flamande PM de Respour rapporté qu'il extrait du zinc métallique de l'oxyde de zinc en 1668. Au tournant du siècle, Étienne François Geoffroy a décrit comment l'oxyde de zinc se condense sous forme de cristaux jaunes sur des barres de fer placées au-dessus du minerai de zinc étant fondu. En Grande-Bretagne, John Lane est dit avoir mené des expériences pour fondre le zinc, probablement à Landore, avant sa faillite en 1726.
En 1738, William Champion breveté en Grande-Bretagne un processus pour extraire le zinc de la calamine à la verticale fonderie de style cornue. Sa technologie est quelque peu similaire à celle utilisée dans les mines de zinc dans Zawar Rajasthan mais il ne existe aucune preuve qu'il a visité l'Orient. Le processus de Champion a été utilisé par 1851.
Chimiste allemand Andreas Marggraf obtient normalement crédit pour découvrir zinc métallique pur même si chimiste suédois Anton von Swab distillé zinc à partir de calamine quatre ans avant. Dans son expérience 1746, Marggraf chauffé un mélange de calamine et de charbon de bois dans un récipient fermé sans cuivre pour obtenir un métal. Cette procédure est devenue commercialement pratique en 1752.
Des travaux ultérieurs

Le frère de William Champion, John, breveté un procédé en 1758 pour calciner le sulfure de zinc en un oxyde utilisable dans le procédé de l'autoclave. Avant cette calamine ne pourrait être utilisé pour produire du zinc. En 1798, Johann Christian Ruberg améliorée sur le processus de fusion par la construction de la première usine de cornue horizontale. Jean-Jacques Daniel Dony construit un autre type de fonderie de zinc horizontale en Belgique, qui a traité encore plus de zinc. Médecin italien Luigi Galvani a découvert en 1780 que la connexion la moelle épinière d'une grenouille fraîchement disséqué à un rail de fer attachée par un crochet en laiton causé la jambe de la grenouille à se contracter. Il pensait à tort qu'il avait découvert une capacité de nerfs et de muscles pour créer de l'électricité et a appelé l'effet " électricité animale ". La cellule galvanique et le processus de galvanisation ont tous deux été nommé pour Luigi Galvani et ces découvertes ouvert la voie à batteries électriques, la galvanisation et protection cathodique.
L'ami de Galvani, Alessandro Volta, a poursuivi des recherches sur cet effet et a inventé le Pile de Volta en 1800. L'unité de base de la pile de Volta a été un simplifiée Cellule galvanique, qui est constitué d'une plaque de cuivre et d'une plaque de zinc reliés entre eux à l'extérieur et séparé par un électrolyte. Ceux-ci ont été empilés en série pour rendre la cellule voltaïque, qui à son tour produit de l'électricité en dirigeant des électrons à partir du zinc au cuivre et le zinc permet de se corroder.
Le caractère non-magnétique de zinc et de son manque de coloration de la solution a retardé la découverte de son importance pour la biochimie et de la nutrition. Cela a changé en 1940, lorsque anhydrase carbonique, une enzyme qui frotte le dioxyde de carbone du sang, a été démontré que le zinc dans son site actif. L'enzyme digestive carboxypeptidase est devenu la seconde enzyme contenant du zinc connu en 1955.
Production
Extraction et de traitement
| Rang | Pays | Tonnes |
|---|---|---|
| 1 | | 3500000 |
| 2 | | 1520000 |
| 3 | | 1450000 |
| 4 | | 750000 |
| 5 | | 720000 |
| 6 | | 670000 |
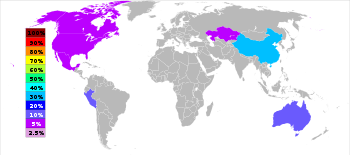
Le zinc est le quatrième métal le plus couramment utilisé, devancé seulement par le fer, l'aluminium et le cuivre avec une production annuelle d'environ 12 millions de tonnes. Le plus grand producteur de zinc au monde est Nyrstar, une fusion de l'Australian OZ Minerals et le Belge Umicore. Environ 70% de la zinc au monde provient de l'exploitation minière, tandis que les 30% restants proviennent du recyclage de zinc secondaire. Commercialement zinc pur est connu comme de qualité supérieure spéciale, SHG souvent abrégé, et 99,995% pure.
Dans le monde entier, 95% du zinc est extrait à partir de gisements sulfurés, dans lequel sphalérite ZnS est presque toujours mélangés avec les sulfures de cuivre, de plomb et de fer. Il ya des mines de zinc dans le monde entier, avec les principales zones minières étant la Chine, l'Australie et le Pérou. La Chine a produit 29% de la production mondiale de zinc en 2010.
Le métal de zinc est produit en utilisant métallurgie extractive. Après broyage du minerai, flottation, qui sépare sélectivement minéraux de gangue en profitant des différences dans leur hydrophobie, est utilisée pour obtenir un concentré de minerai. Une concentration finale de zinc de l'ordre de 50% est atteint par ce procédé avec le reste du concentré étant soufre (32%), le fer (13%) et SiO 2 (5%).
La torréfaction convertit le concentré de sulfure de zinc produit pendant le traitement à l'oxyde de zinc:
- 2 ZnS + 3 O 2 → 2 ZnO + 2 SO 2
Le dioxyde de soufre est utilisé pour la production d'acide sulfurique, ce qui est nécessaire pour le processus de lixiviation. Si des dépôts de carbonate de zinc, le silicate de zinc ou de zinc spinelle, comme le Skorpion en Namibie fort sont utilisés pour la production de zinc de la torréfaction peut être omis.
Pour un traitement ultérieur deux méthodes de base sont utilisées: pyrométallurgie ou électrolytique. Traitement pyrométallurgique réduit l'oxyde de zinc avec du carbone ou du monoxyde de carbone à 950 ° C (1740 ° F) dans le métal, qui est distillé sous forme de vapeur de zinc. La vapeur de zinc est récupéré dans un condenseur. L'ensemble des équations ci-dessous démontrer ce processus:
- 2 ZnO + C → 2 Zn + CO 2
- ZnO + CO → Zn + CO 2
traitement d'extraction électrolytique de zinc à partir de lixiviation du concentré de minerai par de l'acide sulfurique :
- ZnO + H 2 SO 4 → ZnSO 4 + H 2 O
Après cette étape d'électrolyse est utilisée pour produire du zinc métallique.
- 2 ZnSO 4 + 2 H 2 O 2 → Zn + 2 H 2 SO 4 + O 2
L'acide sulfurique régénéré est recyclé dans l'étape de lixiviation.
Impact environnemental
La production des minerais sulfurés de zinc produit de grandes quantités de dioxyde de soufre et le cadmium vapeur. Fonderie scories et autres résidus de procédé contiennent également des quantités importantes de métaux lourds. Environ 1,1 millions de tonnes de zinc métallique et 130 000 tonnes de plomb ont été extrait et fondu dans les villes belges de La Calamine et Plombières entre 1806 et 1882. Les décharges des opérations minières passées montants lixiviation importantes de zinc, de cadmium, et, par conséquent, les sédiments de la Geul rivière contient des quantités importantes de métaux lourds. Il ya environ deux mille ans les émissions de zinc provenant de l'extraction et de la fusion se élèvent à 10 000 tonnes par an. Après avoir augmenté de 10 fois à partir de 1850, les émissions de zinc ont culminé à 3,4 millions de tonnes par an dans les années 1980 et ont diminué à 2,7 millions de tonnes dans les années 1990, même si une étude de la troposphère de l'Arctique de 2005 a révélé que les concentrations il ne reflétaient pas la baisse. Les émissions anthropiques et naturelles se produisent dans un rapport de 20 à 1.
Les niveaux de zinc dans les rivières traversant des zones industrielles ou minières peuvent être aussi élevée que 20 ppm. Efficace traitement des eaux usées réduit considérablement ce; le traitement le long de la Rhénanie , par exemple, a diminué les niveaux de zinc à 50 ppb. Les concentrations de zinc aussi bas que 2 ppm affecte négativement la quantité d'oxygène que les poissons peuvent transporter dans leur sang.

Les sols contaminés avec du zinc par l'extraction de minerais contenant du zinc, raffinage, ou où les boues contenant du zinc est utilisé comme engrais, peut contenir plusieurs grammes de zinc par kg de sol sec. Les niveaux de zinc en excès de 500 ppm dans le sol interfèrent avec la capacité des plantes à absorber l'autre métaux essentiels tels que le fer et le manganèse . Les niveaux de zinc de 2 000 ppm à 180 000 ppm (18%) ont été enregistrés dans certains échantillons de sol.
Applications
Principales applications de zinc comprennent (chiffres sont donnés pour les Etats-Unis)
- Galvanisation (55%)
- Alliages (21%)
- Laiton et bronze (16%)
- Divers (8%)
Anti-corrosion et batteries

Le métal le plus souvent utilisé comme agent anti-corrosion. Galvanisation, qui est le revêtement de fer ou d'acier pour protéger les métaux contre la corrosion , est la forme la plus courante de l'utilisation de zinc de cette façon. En 2009 aux États-Unis, 55% ou 893 000 tonnes de métal de zinc a été utilisé pour la galvanisation.
Le zinc est plus réactif que le fer ou en acier et donc va attirer presque tous oxydation locale jusqu'à ce qu'il corrode complètement à l'écart. Une couche protectrice de surface d'oxyde et de carbonate (5 Zn (OH) 6 (CO 3) 2) que les formes de zinc se corrode. Cette protection dure même après la couche de zinc est rayé mais se dégrade dans le temps que le zinc corrode loin. Le zinc est appliquée par voie électrochimique ou par le zinc fondu galvanisation à chaud ou par pulvérisation. Galvanisation est utilisé sur une clôture en grillage, des glissières de sécurité, ponts suspendus, lightposts, toitures métalliques, échangeurs de chaleur, et des carrosseries de voiture.
La réactivité relative de zinc et de sa capacité à attirer l'oxydation se fait un efficace Anode sacrificielle en protection cathodique (CP). Par exemple, la protection cathodique d'une canalisation enterrée peut être réalisé en reliant les anodes à base de zinc sur le tuyau. Le zinc joue le rôle anode (extrémité négative) par la corrosion lentement lors de son passage de courant électrique à la canalisation d'acier. Le zinc est aussi utilisé pour protéger cathodiquement métaux qui sont exposés à l'eau de mer de la corrosion. Un disque de zinc attaché à la barre de fer d'un navire lentement corroder tout le gouvernail reste non attaqué. D'autres utilisations similaires comprennent un bouchon de zinc fixé à une hélice ou le capot de protection en métal pour la quille du navire.
Avec un potentiel d'électrode standard (SEP) de -0,76 volts , le zinc est utilisé en tant que matériau d'anode pour des piles. (Lithium Plus réactive (SEP -3,04 V) est utilisé pour les anodes dans piles au lithium). Zinc en poudre est utilisé de cette manière dans les piles et les feuilles de métal de zinc alcalines forment les cas et d'agir comme anodes dans piles zinc-carbone. Le zinc est utilisé comme anode ou du carburant cellulaire batterie zinc-air / carburant.
Alliages
Un alliage couramment utilisé qui contient du zinc est en laiton, en cuivre qui est allié avec ne importe où de 3% à 45% de zinc, en fonction du type de laiton. Le laiton est généralement plus ductile et plus résistant que le cuivre et supérieur a une résistance à la corrosion . Ces propriétés rendent utile dans les équipements de communication, matériel, instruments de musique, et les vannes d'eau.

D'autres alliages largement utilisés qui contiennent du zinc comprennent maillechort, machine à écrire métal, doux et l'aluminium soudure et commerciale bronze. Le zinc est également utilisé dans les orgues à tuyaux contemporains comme un substitut pour le traditionnel alliage de plomb / étain dans les tuyaux. Les alliages de 85 à 88% de zinc, 4-10% de cuivre, 2-8% d'aluminium et trouvent une utilisation limitée dans certains types de machines-roulements. Le zinc est le métal primaire utilisé dans la fabrication Américains pièces de un cent depuis 1982. Le noyau de zinc est recouverte d'une fine couche de cuivre pour donner l'impression d'une pièce de cuivre. En 1994, 33 200 tonnes (36 600 tonnes courtes) de zinc ont été utilisés pour produire 13,6 milliards pennies aux États-Unis.
Les alliages de zinc principalement avec de petites quantités de cuivre, l'aluminium et le magnésium sont utiles dans moulage sous pression ainsi que coulée centrifuge, en particulier dans les industries électrique, et matériel automobile. Ces alliages sont commercialisés sous le nom Zamak. Un exemple de ceci est aluminium de zinc. Le point de fusion bas avec le bas la viscosité de l'alliage permet la production de formes complexes et de petites possible. La température basse de travail conduit à un refroidissement rapide des produits de fonderie et l'assemblage rapide est donc possible. Un autre alliage, commercialisé sous le nom de marque Prestal, contient 78% de zinc et 22% d'aluminium et est signalé à être presque aussi fort que l'acier, mais aussi malléable que le plastique. Cette superplasticité de l'alliage permet d'être moulé en utilisant des moulages de matrice de la céramique et du ciment.
Alliages similaires avec l'ajout d'une petite quantité de plomb peuvent être laminées à froid en feuilles. Un alliage de 96% de zinc et 4% d'aluminium est utilisé pour faire estampage meurt pour des applications à faible production run pour lesquelles matrices métalliques ferreux serait trop coûteux. Dans la construction de façades, les toits ou d'autres applications dans lesquelles le zinc est utilisé comme tôles, des méthodes telles que emboutissage, rouleau de formation ou pliage, les alliages de zinc avec du titane et du cuivre sont utilisés. Zinc non allié est trop fragile pour ces types de procédés de fabrication.
En tant que matériau dense peu coûteux, facile à travailler, le zinc est utilisé comme le plomb remplacement. À la suite de préoccupations de plomb, de zinc apparaît dans poids pour diverses applications allant de la pêche à soldes de pneus et volants.
Le tellurure de cadmium et de zinc (CZT) est un semi-conducteur d'alliage qui peut être divisé en un ensemble de petits dispositifs de détection. Ces dispositifs sont similaires à un circuit intégré et capables de détecter de l'énergie entrante photons de rayons gamma. Lorsqu'il est placé derrière un masque absorbant, le réseau de capteurs CZT peut également être utilisé pour déterminer la direction des rayons.
Autres utilisations industrielles

Environ un quart de toute la production de zinc aux États-Unis (2009), est consommé sous la forme de composés de zinc; divers qui sont utilisés industriellement. L'oxyde de zinc est largement utilisé comme pigment blanc dans les peintures et en tant que catalyseur dans la fabrication de caoutchouc. Il est également utilisé comme un dispositif de dispersion de chaleur pour le caoutchouc et agit pour protéger les polymères de rayonnement ultraviolet (la même protection contre les UV est conféré à des matières plastiques contenant de l'oxyde de zinc). Les semi-conducteurs propriétés de l'oxyde de zinc, il est utile dans varistances et produits photocopies. Le cycle de zinc oxyde de zinc est un deux étapes procédé thermochimique à base de zinc et l'oxyde de zinc pour la production d'hydrogène.
Le chlorure de zinc est souvent ajouté à bois comme un ignifuge et peut être utilisé comme un bois agent de conservation. Il est également utilisé pour fabriquer d'autres produits chimiques. Méthyle zinc (Zn (CH 3 2)) est utilisé dans un certain nombre de organique synthèses. Le sulfure de zinc (ZnS) est utilisé dans pigments luminescents tels que sur les mains des horloges, De rayons X et les écrans de télévision, et peintures lumineuses. Cristaux de ZnS sont utilisés dans les lasers qui opèrent dans le milieu partie infrarouge du spectre. du sulfate de zinc est un produit chimique dans des colorants et des pigments. Pyrithione de zinc est utilisé en peintures antisalissures.
La poudre de zinc est parfois utilisée en tant que propulseur dans des maquettes de fusées. Lorsqu'on utilise un mélange comprimé de 70% de zinc et 30% de soufre en poudre est allumé il ya une réaction chimique violente. Ce produit du sulfure de zinc, ainsi que de grandes quantités de gaz chaud, la chaleur et la lumière.feuille de métal de zinc est utilisé pour faire zincdes bars.
64 Zn , l'isotope le plus abondant de zinc, est très sensible à l'activation neutronique, étant dans la transmuté hautement radioactifs 65 Zn , qui a une demi-vie de 244 jours et produit intense rayonnement gamma. Pour cette raison, l'oxyde de zinc utilisé dans les réacteurs nucléaires comme un anti- agent de la corrosion est appauvri en 64 Zn avant utilisation, ce qu'on appelle l'oxyde de zinc appauvri. Pour la même raison, le zinc a été proposée comme un matériau de salage pour des armes nucléaires ( cobalt est un autre matériau de salage, mieux connu). Une veste de isotopiquement enrichi 64 Zn serait irradié par le intense de haute énergie à partir d'un flux de neutrons bombe h explosion, en formant une grande quantité de 65 Zn augmenter significativement la radioactivité de l'arme de la retombée. Une telle arme est pas connu pour avoir jamais été construit, testé, ou utilisé. 65 Zn est également utilisé comme un traceur pour étudier comment les alliages qui contiennent du zinc usure, ou le chemin d'accès et le rôle de zinc dans les organismes.
Complexes Zinc dithiocarbamates sont utilisés comme agricoles fongicides; il se agit notamment Zineb, métirame, propinébe et Ziram. Le naphténate de zinc est utilisé comme agent de conservation du bois. Le zinc, sous forme de ZDDP, est également utilisé comme additif anti-usure pour les pièces de métal dans l'huile moteur.
Suppléments alimentaires

Le zinc est inclus dans la plupart seul comprimé over-the-counter vitamines et quotidiennes des suppléments minéraux. Les préparations comprennent l'oxyde de zinc, l'acétate de zinc et le gluconate de zinc. Il est censé posséder antioxydantes propriétés, qui peut protéger contre le vieillissement accéléré de la peau et les muscles du corps; études diffèrent quant à son efficacité. Le zinc aide également à accélérer le processus de guérison après une blessure. Il est également bénéfique pour le système immunitaire du corps. En effet, les carences en zinc peuvent avoir des effets sur pratiquement toutes les parties du système immunitaire humain. Le zinc aide à stimuler l'action de plus de 100 enzymes, et aide à stimuler le sens de l'odorat.
L'efficacité des composés de zinc lorsqu'il est utilisé pour réduire la durée ou la sévérité defroidsymptômes est controversée. A 2011 revue systématique conclut que la supplémentation donne une légère diminution de la durée et la sévérité des symptômes du rhume.
Zinc est un outil simple, peu coûteux, et critique pour traiter les épisodes diarrhéiques chez les enfants dans le monde en développement. Zinc est déchargée dans le corps pendant la diarrhée , mais des études récentes suggèrent que la reconstitution zinc avec un cours de 10 à 14 jours de traitement peut réduire la durée et la sévérité des épisodes diarrhéiques et peut également prévenir les épisodes futurs pour un maximum de trois mois.
Le Liée à l'Age-Eye Disease Study déterminé que le zinc peut faire partie d'un traitement efficace pour la dégénérescence maculaire liée à l'âge. La supplémentation en zinc est un traitement efficace pour acrodermatite entéropathique, une absorption de zinc trouble génétique affectant qui était auparavant fatale pour les bébés nés avec elle.
La gastro-entérite est fortement atténué par l'ingestion de zinc, et cet effet peut être dû à une action directe antimicrobienne des ions zinc dans le tractus gastro-intestinal, ou pour l'absorption du zinc et re-libération de cellules immunitaires (tous les granulocytes sécrètent zinc), ou deux. En 2011, des chercheurs de John Jay College of Criminal Justice ont indiqué que les suppléments de zinc alimentaires peuvent masquer la présence de drogues dans l'urine. Des réclamations similaires ont été faites dans les forums web sur ce sujet.
Bien que pas encore testé comme une thérapie chez les humains, un nombre croissant de preuves indique que le zinc peut préférentiellement tuer les cellules cancéreuses de la prostate. Parce zinc naturellement maisons à la prostate et parce que la prostate est accessible avec des procédures relativement non invasives, son potentiel comme agent chimiothérapeutique dans ce type de cancer a montré des résultats prometteurs. Cependant, d'autres études ont démontré que l'utilisation chronique de suppléments de zinc au-delà de la dose recommandée peut en fait augmenter le risque de développer un cancer de la prostate, également probable en raison de l'accumulation naturelle de ce métal lourd dans la prostate.
L'utilisation topique
L'administration topique de préparations de zinc comprennent ceux utilisés sur la peau, souvent sous la forme de l'oxyde de zinc. préparations de zinc peut protéger contre les coups de soleil en été et en hiver windburn. Appliquée en minces à la zone de la couche d'un bébé ( de périnée) à chaque changement de couche, il peut protéger contre l'érythème fessier.
Lactate de zinc est utilisé dans la pâte dentifrice pour empêcher halitose. la pyrithione de zinc est largement appliquée dans les shampooings en raison de sa fonction anti-pelliculaire. Ions de zinc sont efficaces agents antimicrobiens, même à de faibles concentrations.
Utilisation dans la chimie organique
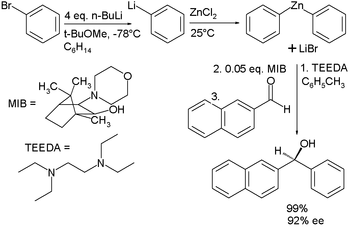
Il existe de nombreux importants organozinciques. Organozinc chimie est la science de la organozinciques décrivant leurs propriétés physiques, la synthèse et réactions. Parmi les applications importantes est la réaction Frankland-Duppa dans lequel un oxalate ester (ROCOCOOR) réagit avec un halogénure d'alkyle R'X, le zinc et l'acide chlorhydrique pour les esters d'α-hydroxycarboxylique RR'COHCOOR, la réaction qui convertit Reformatskii α-halogéno-esters et des aldéhydes de β-hydroxy-esters, la réaction de Simmons-Smith, dans lequel l'iodure carbénoïde (iodométhyl) de zinc réagit avec un alcène (ou alcyne) et les convertit en le cyclopropane, la réaction d'addition de composés organozinciques de composés carbonylés. Le réaction Barbier (1899) qui est l'équivalent de zinc du magnésium et réaction de Grignard est meilleure des deux. En présence d'à peu près toute l'eau de la formation de l'halogénure organomagnésien va échouer alors que la réaction Barbier peut même avoir lieu dans l'eau. Sur les organozincs baissiers sont beaucoup moins nucléophile que Grignard, sont coûteux et difficiles à manipuler. Commercialement composés diorganozinc disponibles sont diméthylzinc, le diéthylzinc et le diphénylzinc. Dans une étude, la organozincique actif est obtenu à partir de beaucoup moins cher précurseurs organobromés:
Le Couplage de Negishi est une réaction importante pour la formation de nouvelles liaisons carbone-carbone entre les atomes de carbone insaturés dans les alcènes, les alcynes et les arènes. Les catalyseurs sont le nickel et le palladium. Une étape clé dans le cycle catalytique est une transmétallation, dans lequel un halogénure de zinc échange son substituant organique à un autre atome d'halogène avec le palladium (nickel) centre métallique. Le accouplement Fukuyama est une autre réaction de couplage, mais celui-ci avec un thioester comme réactif formant une cétone.
Rôle biologique
Le zinc est un élément essentiel oligo-élément nécessaire pour les plantes, les animaux, et de micro-organismes. zinc se trouve dans près de 100 spécifiques des enzymes (d'autres sources disent 300), sert ions structurelles dans les facteurs de transcription et est stockée et transférée dans métallothionéines. Il est «typiquement le deuxième métal de transition le plus abondant dans l'organisme" après le fer et il est le seul métal qui apparaît dans toutes les classes d'enzymes.
Dans les protéines, les ions Zn sont souvent coordonnées pour les chaînes latérales d'acides aminés de l'acide aspartique, l'acide glutamique, la cystéine et l'histidine. La description théorique et computationnelle de la liaison en protéines ce zinc (ainsi que celle des autres métaux de transition) est difficile.
Il n'y a 2-4 grammes de zinc distribués dans tout le corps humain. La plupart zinc est dans le cerveau, les muscles, les os, les reins et le foie, les concentrations les plus élevées dans la prostate et les parties de l'œil. Semen est particulièrement riche en zinc, qui est un facteur clé dans la fonction de la glande de la prostate et la croissance des organes reproducteurs.
Chez l'homme, le zinc joue "omniprésents rôles biologiques". Elle interagit avec "un large éventail de organiques ligands ", et a un rôle dans le métabolisme de l'ARN et de l'ADN, la transduction du signal, et l'expression du gène. Elle réglemente également apoptose. Une étude de 2006 estime que près de 10% de protéines humaines (2800) lie potentiellement zinc, en plus de centaines qui transportent et le zinc de la circulation; un semblable in silico étude dans l'usine d'Arabidopsis thaliana trouvé 2367 protéines liées zinc.
Dans le cerveau, le zinc spécifiques sont stockées dans les vésicules synaptiques par les neurones glutamatergiques et peut "moduler l'excitabilité cérébrale». Il joue un rôle clé dans la plasticité synaptique et ainsi dans l'apprentissage. Toutefois, il a été appelé "cheval noir de cerveau", car il peut aussi être une neurotoxine, suggérant zinc homéostasie joue un rôle essentiel dans le fonctionnement normal du cerveau et système nerveux central.
Enzymes
Le zinc est un efficace acide de Lewis, ce qui en fait un agent catalytique utile dans hydroxylation et d'autres réactions enzymatiques. Le métal a également souple géométrie de coordination, ce qui permet de l'utiliser protéines de passer rapidement conformations pour effectuer des réactions biologiques. Deux exemples d'enzymes contenant du zinc sont anhydrase carbonique et carboxypeptidase, qui sont essentielles aux processus de dioxyde de carbone ( CO 2 ) la réglementation et la digestion des protéines, respectivement.
Dans le sang des vertébrés, l'anhydrase carbonique convertit CO 2 dans du bicarbonate et la même enzyme transforme le bicarbonate de nouveau dans CO 2 pour l'exhalation par les poumons. Sans cette enzyme, cette conversion se produirait environ un million de fois plus lent au sang normal pH de 7 ou nécessiterait un pH de 10 ou plus. L'anhydrase carbonique de β-non-lié est nécessaire dans les installations pour la formation de la feuille, la synthèse d'indole de l'acide acétique (auxine) et la fermentation alcoolique.
Clive CARBOXYPEPTIDASE liens peptidiques lors de la digestion des protéines. Un liaison covalente de coordination est formé entre le peptide terminal et un groupe = O C attaché à zinc, qui donne le carbone une charge positive. Cela permet de créer une poche hydrophobe sur la proximité de l'enzyme de zinc, qui attire la partie non polaire de la protéine digérée.
D'autres protéines
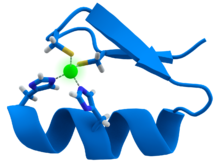
Zinc joue un rôle purement structurel dans les doigts de zinc, des torsions et des clusters. Les doigts de zinc forment des parties de certains facteurs de transcription, qui sont des protéines qui reconnaissent des séquences de bases d'ADN pendant la replication et la transcription de l'ADN . Chacun des neuf ou dix Zn 2+ ions dans un doigt de zinc aide à maintenir la structure du doigt en se liant par coordination à quatre acides aminés dans le facteur de transcription. Le facteur de transcription enroule autour de l'hélice d'ADN et utilise ses doigts pour se lier de façon précise à la séquence d'ADN.
En le plasma sanguin, le zinc est lié à et transportée par de l'albumine (60%, à faible affinité) et la transferrine (10%). Depuis la transferrine transporte également du fer, fer réduit l'absorption excessive de zinc, et vice-versa. Une réaction similaire se produit avec le cuivre. La concentration du zinc dans le plasma sanguin reste relativement constante quelle que soit l'apport en zinc. Les cellules de la glande salivaire, de la prostate, du système immunitaire et de l'utilisation de l'intestin grêle signalisation de zinc comme une manière de communiquer avec d'autres cellules.
Le zinc peut être tenu dans les réserves de la métallothionéine dans les micro-organismes ou dans les intestins ou le foie des animaux. Métallothionéine dans les cellules intestinales est capable d'ajuster l'absorption de zinc par 15 à 40%. Cependant, l'apport en zinc insuffisant ou excessif peut être nocif; excès de zinc affecte particulièrement l'absorption du cuivre parce métallothionéine absorbe les deux métaux.
L'apport alimentaire

Aux États-Unis, le Apport nutritionnel recommandé (ANR) est de 8 mg / jour pour les femmes et 11 mg / jour pour les hommes. Apport médian aux États-Unis autour de 2000 était de 9 mg / jour pour les femmes et 14 mg / jour chez les hommes. Huîtres, du homard et les viandes rouges, en particulier le bœuf , l'agneau et le foie ont quelques-unes des plus fortes concentrations de zinc dans les aliments.
La concentration de zinc dans les plantes varie en fonction des niveaux de l'élément dans le sol. Quand il est suffisant de zinc dans le sol, les plantes alimentaires qui contiennent le plus de zinc sont le blé (germe et le son) et diverses graines ( sésame , pavot, la luzerne, le céleri , moutarde). Le zinc est également trouvé dans les haricots , les noix , les amandes , les grains entiers, graines de citrouille, les graines de tournesol et de cassis.
D'autres sources comprennent aliments enrichis et les compléments alimentaires, qui viennent dans diverses formes. Un examen de 1998 a conclu que l'oxyde de zinc, l'un des suppléments les plus courantes aux États-Unis, et du carbonate de zinc sont presque insoluble et mal absorbé dans le corps. Cet avis a cité des études qui ont trouvé des concentrations de zinc bas de plasma après l'oxyde de zinc et le carbonate de zinc ont été consommés par rapport à ceux observés après consommation de l'acétate de zinc et des sels de sulfate. Cependant, la supplémentation excessive nuisibles est un problème parmi la relativement aisés, et devrait probablement pas dépasser 20 mg / jour chez les personnes en bonne santé, bien que la US National Research Council a fixé un apport maximal tolérable de 40 mg / jour.
Pour fortification, toutefois, un examen de 2003 a recommandé l'oxyde de zinc dans les céréales comme pas cher, stable, et aussi facilement absorbée en formes plus coûteuses. Une étude de 2005 a révélé que les différents composés de zinc, y compris l'oxyde et le sulfate, n'a pas montré de différence statistiquement significative dans l'absorption lorsqu'il est ajouté comme fortifiants au maïs tortillas. Une étude de 1987 a révélé que le picolinate de zinc a été mieux absorbé que le gluconate de zinc ou de citrate de zinc. Cependant, une étude publiée en 2008 a déterminé que glycinate de zinc est le meilleur absorbé des quatre types de suppléments alimentaires disponibles.
Carence
La carence en zinc est généralement due à un apport alimentaire insuffisant, mais peut être associée à un syndrome de malabsorption, acrodermatite entéropathique, maladie chronique du foie, une maladie rénale chronique, la drépanocytose, le diabète, le cancer et d'autres maladies chroniques. Symptômes de carence en zinc doux sont diverses. Les résultats cliniques comprennent la croissance, la diarrhée, l'impuissance et la maturation sexuelle, retardés déprimés alopécie, des lésions oculaires et cutanées, troubles de l'appétit, la cognition altérée, propriétés douteux de défense de l'hôte, des défauts dans l'utilisation des glucides, et tératogenèse reproductive. Carence en zinc légère déprime l'immunité, bien que le zinc excessive fait aussi. Les animaux avec un déficient alimentation riche en zinc nécessitent deux fois plus de nourriture afin d'atteindre le même gain de poids que les animaux ayant reçu suffisamment de zinc.
Les groupes à risque de carence en zinc sont les personnes âgées, les enfants des pays en développement, et ceux présentant une insuffisance rénale. Le zinc chélateur phytates, trouve dans les graines et céréales bran , peut contribuer au zinc malabsorption.
Malgré certaines préoccupations, les végétariens et les végétaliens occidentaux ont pas été trouvés à souffrir de carences en zinc manifestes, pas plus que les mangeurs de viande. Principales sources végétales de zinc comprennent les haricots secs cuits, les légumes de mer, les céréales enrichies, soyfoods, les noix, les pois et les graines. Cependant, les phytates dans de nombreux grains entiers et de fibres dans de nombreux aliments peuvent interférer avec les effets absorption du zinc et de l'apport de zinc marginale a mal compris. Il ya des preuves pour suggérer que plus de la US RDA (15 mg) de zinc par jour peuvent être nécessaires chez les personnes dont le régime alimentaire est riche en phytates, comme certains végétariens. Ces considérations doivent être équilibrés contre le fait qu'il ya un manque de zinc adéquates biomarqueurs, et l'indicateur le plus largement utilisé, zinc plasmatique, a une faible sensibilité et la spécificité. Diagnostiquer la carence en zinc est un défi persistant.
Près de deux milliards de personnes dans le monde en développement sont déficients en zinc. Chez les enfants, il provoque une augmentation de l'infection et de la diarrhée, de contribuer à la mort d'environ 800 000 enfants dans le monde par an. L'Organisation mondiale de la Santé préconise la supplémentation en zinc pour malnutrition sévère et la diarrhée. Les suppléments de zinc aident à prévenir les maladies et de réduire la mortalité, en particulier chez les enfants de faible poids de naissance ou un retard de croissance. Toutefois, les suppléments de zinc ne devraient pas être administré seul, puisque beaucoup dans le monde en développement ont plusieurs lacunes, et le zinc interagit avec d'autres micronutriments.
La carence en zinc est la carence en micronutriments la plus courante de plantes cultivées; il est particulièrement fréquente dans les sols à pH élevé. Zinc-déficient sol est cultivé dans les terres cultivées d'environ la moitié de la Turquie et de l'Inde, un tiers de la Chine, et la plupart de l'Australie occidentale, et des réponses substantielles au zinc fécondation ont été rapportées dans ces domaines. Les plantes qui poussent dans les sols qui sont carencée en zinc sont plus sensibles aux maladies. Le zinc est principalement ajouté au sol par l'érosion des roches, mais les humains ont ajouté du zinc par la combustion de combustible fossile, déchets miniers, les engrais phosphatés, le calcaire, le fumier, les boues d'épuration, et les particules de surfaces galvanisées. Excès de zinc est toxique pour les plantes, bien que la toxicité du zinc est beaucoup moins répandue.
Précautions
Toxicité
Bien que le zinc est une condition essentielle pour une bonne santé, l'excès de zinc peut être nuisible. L'absorption excessive de zinc supprime le cuivre et l'absorption du fer. L'ion de zinc libre en solution est hautement toxique pour les plantes, les invertébrés et même des poissons vertébrés. Le Ion Activité gratuite modèle est bien établi dans la littérature, et montre que seulement des quantités micromolaires de l'ion libre tue certains organismes. Un exemple récent a montré 6 micromolaire tuant 93% de tous les daphnies dans l'eau.
L'ion de zinc libre est un puissant acide de Lewis jusqu'au point d'être corrosif. l'acide de l'estomac contient de l'acide chlorhydrique , dans lequel le zinc métallique se dissout facilement pour donner du chlorure de zinc corrosif. L'ingestion d'une Amérique post-1982 une pièce de cent (97,5% de zinc) peut causer des dommages à la muqueuse de l'estomac en raison de la forte solubilité de l'ion de zinc dans l'estomac acide.
Il existe des preuves de induite carence en cuivre à de faibles apports de 100-300 mg Zn / jour; un récent procès avait hospitalisations pour complications urinaires élevés par rapport au placebo chez les hommes âgés prenant 80 mg / jour. Le USDA RDA a 11 ans et 8 mg Zn / jour pour les hommes et les femmes, respectivement. Niveaux encore plus bas, plus près de la RDA, peuvent interférer avec l'utilisation de cuivre et de fer ou nuire cholestérol. Les niveaux de zinc en excès de 500 ppm dans le sol interfèrent avec la capacité des plantes à absorber d'autres métaux essentiels tels que le fer et le manganèse. Il existe également une condition appelée les secousses de zinc ou de zinc "frissons" qui peuvent être induites par l'inhalation de l'oxyde de zinc fraîchement formée formé lors de la soudure de matériaux galvanisés. Le zinc est un ingrédient commun de la crème de la prothèse qui peut contenir entre 17 et 38 mg de zinc par gramme. Il ya eu des cas d'invalidité ou même la mort en raison de l'utilisation excessive de ces produits.
Les É.U Food and Drug Administration (FDA) a déclaré que les dommages de zinc récepteurs nerveux dans le nez, ce qui peut causer une anosmie. Rapports de anosmie ont également été observées dans les années 1930, lorsque les préparatifs de zinc ont été utilisés dans une vaine tentative pour empêcher la polio infections. Le 16 Juin 2009, la FDA a déclaré que les consommateurs devraient cesser d'utiliser intranasale produits froids à base de zinc et a ordonné leur retrait des tablettes des magasins. La FDA a déclaré la perte de l'odorat peut être mortelle parce que les gens souffrant de troubles odeur ne peuvent pas détecter une fuite de gaz ou de fumée et ne peuvent pas savoir si un aliment a gâté avant qu'ils mangent. Des recherches récentes suggèrent que la pyrithione de zinc topique antimicrobien est un puissant choc thermique réponse inducteur qui peut nuire à l'intégrité du génome à l'induction de crise de l'énergie PARP-dépendante en matière de culture des kératinocytes et mélanocytes.
Empoisonnement
En 1982, l' United States Mint a commencé la frappe de pièces de monnaie en cuivre enduites mais principalement fabriqués en zinc. Avec les nouvelles pièces de monnaie de zinc, il ya le potentiel pour intoxication de zinc, qui peut être fatale. Un cas déclarés de l'ingestion chronique de 425 pennies (plus de 1 kg de zinc) ont abouti à la mort due à bactérienne et fongique gastro septicémie, tandis qu'un autre patient, qui avait ingéré 12 grammes de zinc, seulement montré léthargie et ataxie (manque flagrant de coordination des mouvements musculaires) . Plusieurs autres cas ont été signalés des humains souffrant d'intoxication de zinc par l'ingestion de pièces de zinc.
Pennies et autres petites pièces sont parfois ingérés par les chiens, entraînant la nécessité d'un traitement médical pour retirer le corps étranger. La teneur en zinc de quelques pièces de monnaie peut causer la toxicité du zinc, qui est généralement mortelle chez les chiens, où elle provoque une grave anémie hémolytique, et aussi du foie ou des reins; des vomissements et la diarrhée sont les symptômes possibles. Le zinc est hautement toxique dans les perroquets et l'intoxication peut souvent être fatale. La consommation de jus de fruits entreposés dans des contenants galvanisés a entraîné des empoisonnements de masse perroquet avec le zinc.


