
Acetona
Fundo para as escolas Wikipédia
Este conteúdo da Wikipedia foi escolhida pela SOS Children para adequação nas escolas de todo o mundo. Crianças SOS é a maior doação de caridade do mundo órfãos e crianças abandonadas a chance da vida familiar.
| Acetona | |
|---|---|
 |  |
 |  |
Nome IUPAC preferido Propanona | |
Propan-2-ona | |
Outros nomes Dimetilformaldeído Dimetil cetona | |
| Identificadores | |
| Abreviações | DMK |
| Número CAS | 67-64-1 |
| PubChem | 180 |
| ChemSpider | 175 |
| UNII | 1364PS73AF |
| Número da CE | 200-662-2 |
| Número ONU | 1090 |
| KEGG | D02311 |
| MeSH | Acetona |
| Chebi | Chebi: 15347 |
| ChEMBL | CHEMBL14253 |
| Número RTECS | AL31500000 |
| Beilstein Referência | 635680 |
| Gmelin Referência | 1466 |
| 3DMet | B00058 |
| Imagens-jmol 3D | Imagem 1 Image 2 |
SMILES
| |
InChI
| |
| Propriedades | |
| Fórmula molecular | C 3 H 6 O |
| Massa molar | 58,08 g mol-1 |
| Aparência | Líquido incolor (forma de neve como o branco quando sólida) |
| Densidade | 0,7925 g / cm 3 |
| Ponto de fusão | -94,9 ° C, K 178, -139 ° F |
| Ponto de ebulição | 56,53 ° C, 330 K, 134 ° F |
| Solubilidade em água | miscível |
| Acidez (p Ka) | 24,2 |
| Índice de refracção (n D) | 1,35900 (20 ° C) |
| Viscosidade | 0,3075 c P |
| Estrutura | |
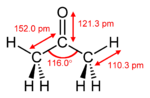
| Forma molecular | planar trigonal em C = O |
| Momento de dipolo | 2.91 D |
| Perigos | |
| MSDS | MSDS External |
| Classificação da UE | |
| Frases R | R11, R36, R66, R67 |
| Frases-S | (S2), S9, S16, S26 |
| NFPA 704 |  3 1 0
|
| Ponto de centelha | -17 ° C |
| De auto-ignição temperatura | 465 ° C |
| Limites de explosividade | 4,0-57,0 |
| Valor Limite | 500 ppm (TWA), 750 ppm (STEL) |
| LD 50 | > 2000 mg / kg, por via oral (ratos) |
| Os compostos relacionados | |
| Relacionados solventes | Água Etanol Isopropanol Tolueno |
| Página Suplementar dados | |
| Estrutura e Propriedades | N, ε r, etc. |
| Termodinâmica dados | Comportamento de fase Sólido, líquido, gasoso |
| Os dados espectrais | UV, IV, RMN , MS |
Excepto quando indicado, os dados são dados para materiais no seu estado normal (a 25 ° C, 100 kPa) | |
| Referências de Infobox | |
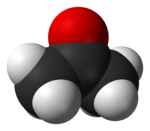
A acetona é o composto orgânico com a fórmula (CH3) 2CO. Este, móvel, líquido inflamável incolor é o exemplo mais simples das cetonas . A acetona é miscível com água e serve como um importante solvente por direito próprio, tipicamente como o solvente de escolha para fins de limpeza no laboratório. Sobre 5,1 milhões toneladas foram produzidos em todo o mundo em 2009, principalmente para uso como um solvente e de produção metacrilato de metilo e bisfenol A. agregado familiar usa de acetona são como o ingrediente activo em unha polonês removedor e como solvente de tinta. É um bloco de construção comum em química orgânica.
A acetona é produzida naturalmente e eliminados do corpo humano, como resultado de processos metabólicos normais. Testes de toxicidade reprodutiva mostram que ela tem baixo potencial para causar problemas reprodutivos. Na verdade, o corpo naturalmente aumenta o nível de acetona em mulheres grávidas, mães e crianças de enfermagem, porque as suas necessidades energéticas mais elevadas levam a maiores níveis de produção de acetona. A comunidade médica está agora usando cetogênica dietas que aumentam a acetona no corpo para reduzir ataques epilépticos em lactentes e crianças que sofrem de epilepsia refratária recalcitrante.
Produção
A acetona é produzido directamente ou indirectamente a partir de propileno. Mais comumente, no processo de cumeno, o benzeno é alquilado com propeno e o resultante cumeno (isopropilbenzeno) é oxidado para dar o fenol e acetona:
- C 6 H 5 CH (CH3) 2 + O 2 → C 6 H 5 OH + (CH3) 2CO
Esta conversão envolve a intermediação do hidroperóxido de cumeno, C 6 H 5 C (OOH) (CH 3) 2.
Métodos de produção mais velhos
Anteriormente, a acetona foi produzido pela destilação seca de acetatos, por exemplo acetato de cálcio. Durante a I Guerra Mundial acetona foi produzido via bacteriana fermentação, como desenvolvido pela Chaim Weizmann (mais tarde o primeiro presidente de Israel ) a fim de ajudar o esforço de guerra britânico. Este Processo de acetona Butanol etanol foi abandonado devido aos pequenos rendimentos.
Biossíntese
Pequenas quantidades de acetona são produzidos no corpo pelos descarboxilação de corpos cetônicos.
Usos
Cerca de um terço de acetona do mundo é usado como um solvente, e um quarto é consumida como um precursor para metacrilato de metilo. Esta aplicação começa com a conversão inicial de acetona para acetona cianidrina:
- (CH3) 2CO + HCN → (CH 3) 2 C (OH) CN
Num passo subsequente, o nitrilo é hidrolisado ao insaturado amida, que é esterificado:
- (CH3) 2 C (OH) CN + CH3OH → CH2 = (CH3) 2 CH 3 CCO + NH3
A terceira maior uso de acetona (cerca de 20%) implica a sua condensação com fenol para dar bisfenol A:
- (CH3) 2 CO + 2 C 6 H 5 OH → (CH 3) 2 C (C 6 H 4 OH) 2 + H2O
O bisfenol-A é um componente de muitos polímeros, tais como policarbonatos, poliuretanos, e resinas epóxi.
Como solvente
A acetona é um bom solvente para a maioria dos materiais plásticos e fibras sintéticas, incluindo as utilizadas em garrafas de laboratório feitas de poliestireno , policarbonatos e alguns tipos de polipropileno. É ideal para o desbaste resina de fibra de vidro, fibra de vidro e limpeza de instrumentos dissolução de duas partes epóxis e superglue antes de endurecer. É usado como um componente volátil de alguns tintas e vernizes. Como um desengordurante para serviços pesados, que é útil na preparação de metais antes da pintura; também dilui resinas de poliéster, vinilo e adesivos.
Muitos milhões de kg de acetona são consumidos na produção de álcool a solventes e metil-isobutil- metil-isobutil-cetona. Estes produtos surgir através de um inicial condensação aldólica para dar álcool diacetona.
- 2 (CH 3) 2 CO → (CH 3) 2 C (OH) CH 2 C (O) CH 3
A acetona é utilizada como solvente pela indústria farmacêutica, e como um agente de desnaturação em álcool desnaturado. Acetona também está presente como um excipiente em alguns produtos farmacêuticos.
Armazenamento de acetileno
Embora inflamável si, acetona também é utilizado extensivamente como um solvente para o transporte seguro de acetileno , o qual não pode ser pressurizado com segurança como um composto puro. Vasos contendo um material poroso são primeiramente cheio com acetona seguido de acetileno, que se dissolve em acetona. Um litro de acetona pode dissolver cerca de 250 litros de acetileno.
Usos médicos e cosméticos
A acetona é usada em uma variedade de aplicações médicas e cosméticas gerais e também está listada como um componente em aditivos alimentares e de embalagem de alimentos.
A acetona é comumente utilizado no processo de rejuvenescimento da pele em consultórios médicos e spas médicos. Desde os dias do antigo Egito, as pessoas têm vindo a utilizar métodos abrasão química, também conhecido como peeling químico, para rejuvenescer a pele. Os agentes mais comuns usados hoje em dia para cascas químicas são ácido salicílico, ácido glicólico, 30% de ácido salicílico em etanol, e ácido tricloroacético (TCA). Antes de chemexfoliation, a pele deve ser devidamente limpo e excesso de gordura removida. Este processo é conhecido como desengorduramento. Acetona, Septisol, ou uma combinação destes agentes é utilizada neste processo.
Utilizações laboratoriais
No laboratório, a acetona é utilizada como um polar solvente aprótico numa variedade de reacções orgânicas, tal como S N 2 reacções. O uso de solvente de acetona também é crítico para o Oxidação de Jones. Ele é um solvente comum para enxaguar o material de vidro por causa do seu baixo custo e volatilidade, no entanto, ele não forma uma azeótropo com água (ver azeótropo (dados)). Apesar de seu uso comum como um suposto agente de secagem, não é eficaz excepto por deslocamento em massa e de diluição. Acetona pode ser arrefecido com gelo seco a -78 ° C, sem congelação; acetona / banho de gelo seco são normalmente usadas para realizar reacções a temperaturas baixas. A acetona é fluorescente sob luz ultravioleta, e o vapor pode ser utilizado como um marcador fluorescente nas experiências de fluxo de fluido.
Usos domésticos e outros nichos
A acetona é frequentemente o componente principal em agentes de limpeza, tais como removedor de unha polonês. O acetato de etilo, um outro solvente orgânico, é por vezes usado como bem. A acetona é um componente de removedor de supercola e remove facilmente resíduos de vidro e porcelana.
Ele pode ser usado como um agente artístico; quando esfregado na parte de trás de uma impressão a laser ou fotocópia colocados com a face para baixo sobre uma outra superfície e polido firmemente, o toner das transferências de imagens para a superfície do destino.
Make-up artistas usar acetona para remover o adesivo de pele da rede de perucas e bigodes por imersão do produto em um banho de acetona, em seguida, remover o resíduo de cola amolecida com uma escova dura.
Alguns entusiastas automotivos adicionar acetona em cerca de 1 parte em 500 para o seu combustível, na sequência de pedidos de melhoria na economia de combustível e vida útil do motor.
Segurança
Inflamabilidade
O perigo mais comum associado com acetona é a sua extrema inflamabilidade. Ele auto-inflama-se a uma temperatura de 465 ° C (869 ° F). A temperaturas superiores a acetona do ponto de inflamação -20 ° C (-4 ° F), misturas de ar de entre 2,5% e 12,8% de acetona, em volume, possam explodir ou causar um incêndio flash. Os vapores podem fluir ao longo das superfícies a fontes de ignição distantes e costas. Descarga estática também podem inflamar vapores de acetona.
Informação em Saúde
Acetona tem sido estudado extensivamente e é geralmente reconhecida a ter baixa toxicidade aguda e crónica se ingerida e / ou inalada. A inalação de concentrações elevadas (cerca de 9200 ppm) em ar causada irritação da garganta em seres humanos em tão pouco quanto 5 minutos. A inalação de concentrações de 1000 ppm causou irritação da garganta e olho em menos de 1 hora; no entanto, Inalação 500 ppm de acetona em ar não causou sintomas de irritação em seres humanos, mesmo após 2 horas de exposição. Acetona não é considerado atualmente como um cancerígeno, uma substância química mutagénicas ou uma preocupação para efeitos de neurotoxicidade crônicas.
Acetona pode ser encontrado como um ingrediente de uma variedade de produtos de consumo que variam de cosméticos para alimentos processados e não transformados. Acetona tem sido classificado como um GRAS (Geralmente Reconhecido como Seguro) substância quando presente em bebidas, produtos de panificação, sobremesas, e preserva em concentrações que variam de 5 a 8 mg / L. Além disso, um estudo norte-americano-europeia conjunta descobriu que de acetona "riscos para a saúde são pequenas."
Toxicologia
Acetona Acredita-se que exibem apenas uma ligeira toxicidade em uso normal, e não há uma forte evidência de efeitos crónicos de saúde se precauções básicas são seguidos.
Em concentrações muito elevadas de vapor, acetona é irritante e, como muitos outros solventes, podem deprimir o sistema nervoso central. É também um irritante grave em contacto com os olhos, e um potencial risco de aspiração pulmonar. Em um caso documentado, a ingestão de uma quantidade substancial de acetona levou a toxicidade sistémica, embora o paciente eventualmente totalmente recuperado. Algumas fontes estimam LD 50 para a ingestão humana em 1,159 g / kg; LD 50 para inalação por ratos é dado como 44 g / m 3, durante 4 horas.
A acetona foi mostrado para ter efeitos anticonvulsivos em modelos animais de epilepsia , na ausência de toxicidade, quando administradas em concentrações milimolares. Postula-se que o alto teor de gordura baixo teor de carboidratos dieta cetogênica utilizada clinicamente para controlar a epilepsia fármaco-resistente em crianças funciona, elevando acetona no cérebro.
- EPA EPCRA Exclusão (1995). EPA removido acetona da lista de "produtos químicos tóxicos" mantidos ao abrigo da Secção 313 do Planeamento de Emergência e comunitária Direito de Saber Act (EPCRA). Ao tomar essa decisão, a EPA realizou uma extensa revisão dos dados toxicológicos disponíveis no acetona e descobriu que acetona "exposições toxicidade aguda apenas em níveis que excedem em muito as emissões e as exposições resultantes", e ainda que de acetona "exposições baixa toxicidade em estudos crônicos."
- Genotoxicidade. A acetona foi testada em mais de duas dúzias in vitro e em ensaios in vivo.
Estes estudos indicam que a acetona não é genotóxico.
- Carcinogenicidade. EPA em 1995 concluiu, "Não há atualmente nenhuma evidência para sugerir uma preocupação para a carcinogenicidade." (EPCRA Review, descrito na Seção 3.3). NTP cientistas têm recomendado contra os testes de toxicidade crónica / carcinogénese de acetona porque "os estudos prechronic só demonstrou uma resposta muito leve tóxico em altas doses em roedores".
- Neurotoxicidade e do Desenvolvimento neurotoxicidade. O potencial neurotóxico de ambos acetona e isopropanol, o precursor metabólico de acetona, ter sido extensivamente estudada. Estes estudos demonstram que apesar da exposição a doses elevadas de acetona pode causar efeitos no sistema nervoso central transientes, acetona não possuem efeitos neurotóxicos. Uma diretriz estudo neurotoxicidade para o desenvolvimento foi realizado com isopropanol, e não foram identificados efeitos neurotóxicos no desenvolvimento, mesmo na dose mais elevada testada. (SIAR, pp. 1, 25, 31).
- Ambiental. Quando a EPA isentos acetona de regulação como compostos orgânicos voláteis (VOC) em 1995, a EPA afirmou que esta isenção seria "contribuir para a realização de vários objectivos ambientais importantes e apoiaria os esforços de prevenção da poluição da EPA." 60 Fed. Reg. 31.634 (16 de Junho de 1995). 60 Fed. Reg. 31.634 (16 de Junho de 1995). EPA observou que acetona poderia ser usado "como um substituto para vários compostos que são listados como poluentes atmosféricos perigosos (HAP) ao abrigo da secção 112 da Lei [Clean Air].
Os efeitos ambientais
Acetona evapora rapidamente, mesmo a partir da água e do solo. Uma vez na atmosfera, é degradado pela luz UV com uma meia-vida de 22 dias. Acetona dissipa-se lentamente no solo, animais, ou cursos de água, uma vez que é por vezes consumidos por microorganismos, mas é um contaminante significativo águas subterrâneas, devido à sua alta solubilidade em água. O LD 50 de acetona para peixes é 8,3 g / l de água (ou cerca de 0,8%) ao longo de 96 horas, e a sua meia-vida ambiental é de cerca de 1 a 10 dias. Acetona pode representar um risco significativo de depleção de oxigênio nos sistemas aquáticos devido à atividade microbiana consumi-la.
Peróxido de acetona
Quando oxidadas, acetona forma acetona peróxido como um subproduto, o qual é um composto altamente instável. Ele pode ser formado acidentalmente, por exemplo, quando os resíduos de peróxido de hidrogênio é derramado em solvente resíduos contendo acetona. Peróxido de acetona é mais de dez vezes mais sensíveis ao atrito e choque enquanto nitroglicerina. Devido à sua instabilidade, que é raramente usada, apesar de a sua síntese química fácil.

