
Reacção ácido-base
Informações de fundo
Esta seleção Wikipedia está offline disponível a partir de Crianças SOS, para distribuição no mundo em desenvolvimento. Crianças SOS tem cuidado de crianças na África por 40 anos. Você pode ajudar o seu trabalho na África ?
| Ácidos e Bases |
|---|
| Constante de dissociação de ácido Extração ácido-base Reacção ácido-base Acidimetria A constante de dissociação Função de acidez Soluções tampão pH Afinidade Proton A auto-ionização de água Ácido força |
| Ácido tipos |
| Brønsted · Lewis · Mineral Organic · Forte Superácidos · Fraco |
| Os tipos base |
| Brønsted · Lewis · Orgânico Forte · Superbases Não-nucleofílica · Fraco |
Uma reacção ácido-base é uma reacção química que ocorre entre um ácido e um base. Existem vários conceitos que fornecem definições alternativas para os mecanismos de reação envolvidos e sua aplicação na resolução de problemas relacionados. Apesar de várias semelhanças nas definições, torna-se aparente a sua importância como diferentes métodos de análise, quando aplicado a reacções de ácido-base para a espécie gasosa ou líquida, ou quando o ácido ou base de caracteres pode ser um pouco menos aparente. Historicamente, o primeiro destes conceitos científicos de ácidos e bases foi fornecida pelo Francês químico Antoine Lavoisier , circa 1776 .
Teorias ácido-base comum
Definição Lavoisier
Desde que o conhecimento de Lavoisier de ácidos fortes foi restrita principalmente para oxiácidos, que tendem a conter átomos centrais em alto estados de oxidação cercadas por oxigênio, como HNO 3 e H 2 SO 4 , e desde que ele não estava ciente da verdadeira composição dos ácidos hidro-halogenados, HCl, HBr, e HI, ele definiu ácidos em termos da sua contendo oxigênio , que em fato que ele chamou de palavras gregas que significa "ácido-ex" (do grego οξυς (oxys) que significa "ácido" ou "afiado" e γεινομαι (geinomai) ou "gerar"). A definição Lavoisier foi realizada como verdade absoluta há mais de 30 anos, até que o artigo 1810 e palestras subsequentes por Sir Humphry Davy em que ele provou a falta de oxigênio no H 2 S, H 2 Te, eo ácidos hidro-halogenados.
Definição Liebig
Esta definição foi proposta por Justus von Liebig circa 1838 , com base em suas extensas obras sobre a composição química da ácidos orgânicos. Este terminou o turno doutrinária de ácidos à base de oxigénio para substâncias ácidas à base de hidrogênio, começou por Davy. De acordo com Liebig, um ácido é uma substância contendo hidrogénio, em que o hidrogénio pode ser substituído por um metal. Definição de Liebig, enquanto completamente empírica, permaneceu em uso por quase 50 anos até à adopção da definição de Arrhenius.
Definição de Arrhenius
A definição de Arrhenius de reações ácido-base é um conceito ácido-base mais simplificado concebido por Svante Arrhenius, que foi usado para fornecer uma definição moderna de bases que se seguiu a partir de seu trabalho com Friedrich Wilhelm Ostwald no estabelecimento da presença de iões em solução aquosa, em 1884 , e levou a receber o Arrhenius Prêmio Nobel de Química em 1903 por "reconhecimento pelos extraordinários serviços prestados ... para o avanço da química por sua teoria da dissociação eletrolítica"
Conforme definido no momento da descoberta, as reações ácido-base são caracterizados por ácidos de Arrhenius, que dissociar em forma de solução aquosa de hidrogénio ou o mais tarde denominado- oxonium (H 3 O +) íons, e bases de Arrhenius, que formam o hidróxido (OH -) íons. Mais recente Recomendações da IUPAC sugerem agora o termo mais recente "hydronium" ser utilizados em favor do termo aceito "oxonium" mais antigos para ilustrar mecanismos de reação, tais como os definidos na definição do sistema de solventes Brønsted-Lowry e mais claramente, com a definição de Arrhenius servindo como um simples esboço geral de caráter ácido-base mais sucinta, a definição de Arrhenius pode ser imaginado como;
| " | Ácidos de Arrhenius formar iões de hidrogénio na solução aquosa com bases que formam iões de hidróxido de Arrhenius. | " |
A definição do ácido-base aquosa universal do conceito de Arrhenius é descrita como a formação de água a partir de hidrogénio e iões de hidróxido, iões hidrónio ou iões hidróxido e produzido a partir da dissociação de um ácido e uma base em solução aquosa (2 H2O → OH - + H3O +), o que leva a que a definição de Arrhenius em reacções de ácido-base, um sal e de água é formado a partir da reacção entre um ácido e uma base - em definições científicas mais simples, esta forma de reacção é chamado um Reacção de neutralização.
- ácido + + base - → sal + água
O ião positivo de uma base pode formar um sal com o ião negativo a partir de um ácido. Por exemplo, dois moles da base de hidróxido de sódio (NaOH) pode combinar-se com um mole de ácido sulfúrico (H 2 SO 4), para formar duas moles de água e uma mole de sulfato de sódio .
- 2NaOH + H 2 SO 4 → 2 H 2 O + Na 2 SO 4
Definição de Bronsted-Lowry
A definição de Brønsted-Lowry, formulado de forma independente por seus dois defensores Johannes Nicolaus Brønsted e Martin Lowry em 1923 baseia-se na ideia de protonação de bases por meio do de-protonação de ácidos - mais comumente referido como a capacidade dos ácidos para "doar" íons hidrogênio (H +) ou prótons para bases, que "aceitar" a eles. Em contraste com a definição de Arrhenius, a definição de Bronsted-Lowry refere-se aos produtos de uma reacção ácido-base como ácidos e bases conjugadas para se referir à relação de um protão, e para indicar que houve uma reacção entre as duas quantidades, em vez de uma "formação" de sal e de água, tal como explicado na definição de Arrhenius.
Ela define que nas reacções, não é a doação e recepção de um protão, que essencialmente se refere à remoção de um ião hidrogénio ligado dentro de um composto e a sua reacção com outro composto, e não a remoção de um protão a partir do núcleo de um átomo , o que exigiria enormes quantidades de energia não atingíveis através do simples dissociação dos ácidos. Na diferenciação da Definição de Arrhenius, a definição de Bronsted-Lowry postula que, para cada ácido, existe um conjugado de ácido e de base ou "par ácido-base conjugado" que é formada por meio de uma reacção completa, o que também inclui água, que é amphoteric:
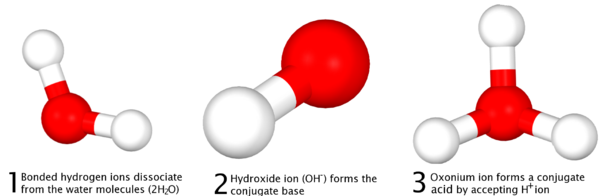
|
Definição Lewis
A definição de Lewis reações ácido-base, concebido por Gilbert N. Lewis em 1923 é uma teoria abrangente para as definições de Bronsted-Lowry e do sistema solvente que diz respeito à premissa de um mecanismo de doação, o que, inversamente, os atributos de doação de electrões de pares de bases e a aceitação por parte dos ácidos, em vez de protões ou outras substâncias ligadas e abrange tanto reacções aquosas e não-aquosas.
- Ag + + 2: NH 3 → [H 3 N: Ag: NH3] +
- Um catião prata reage como um ácido com amoníaco , que actua como um dador de electrão-par, formando um produto de adição de amoníaco-prata
Em reacções entre E ácidos de Lewis bases, existe a formação de um aduto quando a maior ocupada molecular orbital ( HOMO) de uma molécula, tal como com NH3 disponível par (es) de electrões doa pares solitário isolado de electrões para a molécula de electrões deficiente menor orbital molecular desocupado ( LUMO) através de um coordenar ligação covalente; Numa tal reacção, que interactua com a molécula HOMO actua como uma base, e a molécula que interactua com LUMO actua como um ácido. Em moléculas altamente polares, tais como o boro tri-fluoreto (BF 3), a mais elemento eletronegativo puxa electrões em relação aos seus próprios orbitais, proporcionando uma carga mais positiva sobre o elemento menos electronegativo e uma diferença na sua estrutura electrónica devido à posição axial ou equatorial em órbita de seus electrões, causando efeitos repulsivos de par solitário de ajustamento do casal (Lp -bp) interações entre átomos ligados superiores aos já fornecidos pela ligação dos pares da união monógama (PA-PA) interações. Os aductos que envolvem iões metálicos são referidos como compostos de coordenação.
Definição do sistema solvente
Esta definição baseia-se uma generalização da definição anterior de Arrhenius para todos os solventes autodissociating. Em todos estes solventes, há uma certa concentração de uma espécie positivos, catiões solvonium e espécies negativas, aniões solvato, em equilíbrio com as moléculas solventes neutros. Por exemplo:
- 2H 2 O ⇌ H3O + ( hidrónio) + OH - ( hidróxido )
- 2NH 3 ⇌ NH 4 + ( amónio) + NH2 - ( amida)
ou até mesmo alguns sistemas apróticos
- N 2 O 4 + ⇌ NÃO ( nitrosónio) + NO 3 - ( nitrato )
- 2SbCl 3 ⇌ SbCl 2 + (dichloroantimonium) + SbCl 4 - (tetrachloroantimonate)
Um soluto causando um aumento na concentração dos iões solvonium e uma diminuição dos iões de solvato é um ácido e um causando o inverso é uma base. Assim, no estado líquido amónia , KNH 2 (fornecendo NH 2 -) é uma base forte, e NH 4 NO 3, (NH 4 + fornecimento) é um ácido forte. Em líquido dióxido de enxofre (SO2), compostos de tionilo (fornecimento de SO 2 +) se comportam como ácidos, e sulfitos (fornecendo SO3 2-) comportar-se como bases.
Aqui estão algumas reações ácido-base não aquosos em amoníaco líquido
- 2NaNH 2 (base) + Zn (NH2) 2 ( amida anfifílico) → Na 2 [Zn (NH 2) 4]
- 2NH 4 I (ácido) + Zn (NH2) 2 ( amida anfifílico) → [Zn (NH3) 4)] I 2
Ácido nítrico pode ser uma base em ácido sulfúrico líquido:
- HNO3 (base) + 2H 2 SO 4 → NO2 + + H 3 O + + 2HSO 4 -
E as coisas tornam-se ainda mais estranha no mundo aprótico, por exemplo, em N2 líquido O 4:
- AgNO 3 (base) + NOCl (ácido) → N 2 O 4 + AgCl
Uma vez que a definição do sistema de solvente depende do solvente, bem como sobre o próprio composto, o mesmo composto pode alterar o seu papel, dependendo da escolha do solvente. Assim, HClO 4 é um ácido forte em água, um ácido fraco em ácido acético, e uma base fraca de ácido fluorossulfónico.
Outras teorias ácido-base
Definição Usanovich
A definição mais geral é o de o químico russo Mikhail Usanovich, e, basicamente, podem ser resumidos como definindo um ácido como qualquer coisa que aceita espécies negativas ou doa os positivos, e uma base como o inverso. Isto tende a sobrepor-se ao conceito de redox (redução-oxidação), e por isso não é muito favorecida pelos químicos. Isso ocorre porque as reações redox se concentrar mais em processos de transferência de elétrons físicos, em vez de ligação tomada / processos de obrigações quebra, embora a distinção entre esses dois processos é um pouco ambígua.
Definição Lux-Flood
Esta definição, proposta pelo químico alemão Hermann Lux em 1939 , ainda melhorada Circa Håkon Flood 1947 e agora comumente usado em moderno geoquímica e electroquímica de sais fundidos, descreve um ácido como um aceitador de iões de óxido e uma base como um dador de ião óxido. Por exemplo:
- MgO (base) + CO2 (ácido) → MgCO3
- CaO (base) + SiO 2 (ácido) → CaSiO3
- NO 3 - (base) + S 2 O 7 2- (ácido) → NO2 + + 2 SO 4 2-
Definição Pearson
Em 1963 Ralph Pearson propôs um conceito qualitativo avançado conhecido como Princípio ácido-base duro macio, mais tarde fez quantitativa com a ajuda de Robert Parr em 1984 . 'Hard' aplica-se a espécies que são pequenas, têm estados de carga altas, e são fracamente polarizable. 'Suave' aplica-se a espécies que são grandes, têm estados de baixa carga e são fortemente polarizada. Ácidos e bases interagem e as interações mais estáveis são hard-duro e macio-soft. Esta teoria tem encontrado uso em química orgânica e inorgânica.


