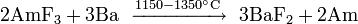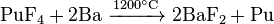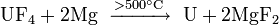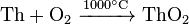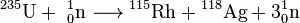Actinide
Informações de fundo
Crianças SOS, uma instituição de caridade educação , organizou esta selecção. Um link rápido para o patrocínio criança é http://www.sponsor-a-child.org.uk/
| Actinídeos na tabela periódica | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

O (actinide ou Actinóide nomenclatura IUPAC ) série abrange os 15 metálicos elementos químicos com números atômicos 89-103, actinium através lawrencium .
A série actinide deriva seu nome do grupo 3 elemento actinium. Todos, exceto um dos actinídeos são f-bloco de elementos, o que corresponde ao enchimento do 5f escudo do elétron; lawrencium, um d-bloco elemento, também é geralmente considerado um actinide. Em comparação com os lantanídeos , também na maior parte elementos f-bloco, os actinídeos mostrar muito mais variável valência .
| 89 CA | 90 Th | 91 Pa | 92 U | 93 Np | 94 Pu | 95 Sou | 96 Cm | 97 Bk | 98 Cf | 99 Es | 100 Fm | 101 Md | 102 Nenhuma | 103 Lr |
Dos actinídeos, primordial tório e urânio ocorrem naturalmente em quantidades substanciais e pequenas quantidades de persistindo naturais plutónio também foram identificados. O decaimento radioativo do urânio produz quantidades transitórios de actinium e protactinium , e os átomos de neptúnio , amerício , cúrio , berquélio e califórnio ocasionalmente são produzidos a partir de reações de transmutação em minérios de urânio. Os outros actinídeos são puramente elementos sintéticos. Testes de armas nucleares lançaram pelo menos seis actinides mais pesado do que o plutônio em ambiente; análise de entulho de 1952 explosão de uma bomba de hidrogênio mostrou a presença de amerício, cúrio, berquélio, califórnio, einsteinium e fermium .
Todos os actinídeos são energia radioativa e liberação em cima do decaimento radioativo; ocorrência natural de urânio e tório e de plutónio produzido sinteticamente são os actinides mais abundantes na Terra. Estes são utilizados em reatores nucleares e armas nucleares . Urânio e tório também têm diversos usos atuais ou históricos, e amerício é usado na câmaras de ionização de mais moderno detectores de fumaça.
Em apresentações da tabela periódica , os lantanídeos e actinídeos são habitualmente apresentadas como duas linhas adicionais abaixo do corpo principal da tabela, com marcadores ou então um único elemento selecionado de cada série (ou de lantânio ou lutécio , e quer actínio ou laurêncio , respectivamente) mostrado em uma única célula da tabela principal, entre bário e háfnio , e rádio e rutherfordium , respectivamente. Esta convenção é inteiramente uma questão de estética e praticidade formatação; uma usado raramente wide-formatado tabela periódica insere o lantanídeos e séries actinide em seus devidos lugares, como partes da sexta e sétima linhas da tabela (períodos).
Descoberta, isolamento e síntese
| Elemento | Ano | Método |
|---|---|---|
| Neptúnio | 1940 | Bombardeando 238 U por nêutrons |
| Plutônio | 1941 | Bombardeando 238 U por deuterons |
| Amerício | 1944 | Bombardeando 239 Pu por nêutrons |
| Curandeiro | 1944 | Bombardeando 239 Pu por -partículas α |
| Berkelium | 1949 | Bombardeando 241 Am por α-partículas |
| Californium | 1950 | Bombardeando 242 Cm por α-partículas |
| Einsteinium | 1952 | Como um produto de explosão nuclear |
| Fermium | 1952 | Como um produto de explosão nuclear |
| Mendelevium | 1955 | Bombardeando 253 Es por α-partículas |
| Nobelium | 1965 | Bombardeando 243 Am por 15 N ou com 238 L-partículas α |
| Laurêncio | 1961-1971 | Bombardeando 252 Cf por 10 B ou 11 B e de 243 Am com 18O |
Como os lantanídeos , os actinídeos formam uma família de elementos com propriedades semelhantes. Dentro dos actinídeos, existem dois grupos sobrepostos: elementos transuranianos, que seguem urânio na tabela periódica -e elementos transplutónios, que seguem plutônio. Em comparação com os lantanideos, que (com excepção para o promécio ) se encontram na natureza em quantidades apreciáveis, a maioria dos actinídeos são raras. Os actinides mais abundantes, ou fáceis de sintetizar são urânio e tório, seguido de plutônio, amerício, actínio, protactinium e neptunium.
A existência de elementos transuranianos foi sugerido por Enrico Fermi baseado em suas experiências em 1934. No entanto, apesar de quatro actinides eram conhecidos por esse tempo, ele ainda não foi entendido que eles formaram uma família semelhante ao lantanídeos. A visão prevalecente que dominou as primeiras pesquisas em transuranics era que eles eram elementos regulares no sétimo período, com tório, urânio e protactinium correspondente a sexta-período háfnio , tântalo e tungstênio , respectivamente. Síntese de transuranics gradualmente minado este ponto de vista. Em 1944, uma observação que cúrio não conseguiu exibir estados de oxidação acima de 4 (enquanto seu suposto sexto período vizinho, platina , pode chegar a estado de oxidação de 7) solicitado Glenn Seaborg para formular uma chamada "hipótese actinídeos". Estudos de actinides conhecidos e descobertas de novos elementos transurânicos fornecido mais dados em apoio a este ponto de vista, mas a frase "hipótese actinide" (o que implica que "hipótese" é algo que não tenha sido provado decisivamente) permaneceu em uso ativo por cientistas através final dos anos 1950.
Actualmente, existem dois métodos principais de produção de isótopos de elementos transplutónios: irradiação dos elementos mais leves, quer com neutrões ou partículas carregadas aceleradas. O primeiro método é mais importante para as aplicações, uma vez que apenas a irradiação de neutrões utilizando reatores nucleares permite a produção de quantidades substanciais de actinides sintéticas; no entanto, é limitada a elementos relativamente leves. A vantagem do segundo método é que os elementos mais pesados do que o plutónio, bem como isótopos de neutrões deficiente, pode ser obtido, o qual não são formados durante a irradiação de neutrões.
Em 1962-1966, houve tentativas nos Estados Unidos para produzir isótopos transplutónios usando uma série de seis explosões nucleares subterrâneas. Pequenas amostras de rocha foram extraídos a partir da área da explosão imediatamente após o ensaio para estudar os produtos de explos, mas não com isótopos número de massa maior do que 257 poderia ser detectada, apesar das previsões que tais isótopos teria relativamente longas semi-vidas de α-decadência. Isto foi atribuído à inobservation fissão espontânea devido à grande velocidade dos produtos e outros canais de decaimento, como a emissão de nêutrons e de fissão nuclear .
De actinium para neptunium

Urânio e tório foram os primeiros actinides descobertos. O urânio foi identificado em 1789 pelo químico alemão Martin Heinrich Klaproth em minério de uraninita. Nomeou-o após o planeta Urano , que tinha sido descoberto apenas oito anos antes. Klaproth foi capaz de precipitar um composto amarelo (provável diuranato de sódio) por dissolução pitchblende em ácido nítrico e neutralização da solução com hidróxido de sódio . Ele, então, reduzida a pó amarelo obtido com carvão, e extraída uma substância negra que ele confundiu com metal. Somente 60 anos depois, o cientista francês Eugène-Melchior Peligot identificaram com óxido de urânio. Ele também isolado a primeira amostra de urânio metálico por aquecimento tetracloreto de urânio com potássio . O massa atômica de urânio foi então calculada como 120, mas Dmitri Mendeleev em 1872 corrigido para 240 usando suas leis de periodicidade. Este valor foi confirmado experimentalmente em 1882 por K. Zimmerman.
Óxido de tório foi descoberto por Friedrich Wöhler no mineral, que foi encontrado em Noruega (1.827). Jöns Jacob Berzelius caracterizado este material em mais detalhes por em 1828. Por redução de tetracloreto de tório com o potássio, ele isolou o metal e nomeou-tório após o deus nórdico do trovão e relâmpagos Thor . O mesmo método de isolamento foi usado mais tarde por Peligot de urânio.
Actinium foi descoberto em 1899 por André-Louis Debierne, um assistente de Marie Curie , nos resíduos de uraninita deixado após a remoção do rádio e polônio. Ele descreveu a substância (em 1899) como semelhante ao de titânio e (em 1900) como semelhante a tório. A descoberta de actinium por Debierne foi, porém, questionou em 1971 e 2000, argumentando que as publicações da Debierne em 1904 contradisse seu trabalho anterior de 1899-1900. O nome por palavra actinium vem do grego Aktis, aktinos (ακτίς, ακτίνος), ou seja, viga ou ray. Este metal não foi descoberta pela sua própria radiação, mas pela radiação dos produtos filhas. Devido à estreita semelhança de actinium e lantânio e baixa abundância, actinium puro só podia ser produzido em 1950. O termo actinide foi provavelmente introduzido por Victor Goldschmidt em 1937.
Protactinium possivelmente foi isolado em 1900 por William Crookes. Ele foi identificado pela primeira vez em 1913, quando Kasimir Fajans e Oswald Helmuth Göhring encontrou o curta duração 234m isótopo Pa (meia-vida de 1,17 minutos) durante os seus estudos do 238 U decadência. Eles nomearam o novo brevium elemento (do latim que significa brevis breve); o nome foi mudado para protoactinium (do grego πρῶτος + ἀκτίς que significa "primeiro elemento feixe") em 1918, quando dois grupos de cientistas, liderada por Otto Hahn e Lise Meitner da Alemanha e Frederick Soddy e John Cranston da Grã-Bretanha, descobriram de forma independente 231 Pa. O nome foi encurtado para Protactinium em 1949. Este elemento foi caracterizado pouco até 1960, quando AG Maddock e colegas de trabalho no Reino Unido produziu 130 gramas de protactínio de 60 toneladas de resíduos deixados após a extração do urânio de seu minério.
Neptunium (nomeado para o planeta Netuno , o próximo planeta fora de Uranus, após o qual o urânio foi nomeado) foi descoberto por Edwin McMillan e Philip H. Abelson em 1940 em Berkeley, Califórnia. Eles produziram o Np isótopo 239 (meia-vida 2,4 dias) bombardeando o urânio com nêutrons lentos. Foi o primeiro transurânico elemento produzido sinteticamente.
Plutónio e acima

Elementos transuranianos não ocorrem em quantidades apreciáveis na natureza e são comumente sintetizado via reações nucleares realizados com reatores nucleares. Por exemplo, sob irradiação com nêutrons do reator, urânio-238 parcialmente converte em plutônio-239:
Desta forma, Enrico Fermi com colaboradores, utilizando o primeiro reactor nuclear Chicago Pile-1, valores obtidos significativas de plutónio-239, que foram, então, utilizado em armas nucleares.
Actinídeos com os números mais elevados de massa são sintetizados pelo bombardeio de urânio, plutônio, cúrio e califórnio com íons de nitrogênio, oxigênio, carbono, neon ou boro em um acelerador de partículas. Então, nobelium foi produzido bombardeando o urânio-238 com neon-22 como
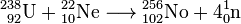 .
.
Primeiros isótopos de elementos transplutónios, amerício-241 e cúrio-242, foram sintetizados em 1944 por Glenn T. Seaborg, Ralph A. James e Albert Ghiorso. Cúrio-242 foi obtido bombardeando plutônio-239 com 32 MeV α-partículas
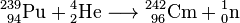 .
.
Os amerício-241 e cúrio-242 isótopos foram também produzido por irradiação de plutónio em um reator nuclear. O último elemento foi nomeado após Marie Curie e seu marido Pierre, que estão marcados para descobrir o rádio e para o seu trabalho em radioactividade.
Bombarding cúrio-242 com α-partículas resultou em um isótopo de californium Cf 245 (1950), e um procedimento semelhante produziu em 1949 berquélio-243 a partir de amerício-241. Os novos elementos foram nomeados após Berkeley, Califórnia, por analogia com o seu lanthanide homólogo térbio , que foi nomeado após a vila de Ytterby, na Suécia.
Em 1945, o BB Cunningham obteve o primeiro composto químico grandes quantidades de um elemento transplutónios, nomeadamente hidróxido de amerício. Ao longo dos próximos três a quatro anos, quantidades de miligramas de amerício e microgramas quantidades de cúrio foram acumulados que permitiu a produção de isótopos de berquélio (Thomson, 1949) e califórnio (Thomson, 1950). Quantidades consideráveis desses elementos foram produzidos apenas em 1958 (Burris B. Cunningham e Stanley G. Thomson), e o primeiro composto califórnio (0,3 ug de CfOCl) foi obtida apenas em 1960 por BB Cunningham e JC Wallmann).
Einsteinium e fermium foram identificados em 1952-1953 na precipitação da " Ivy Mike "teste nuclear (01 de novembro de 1952), o primeiro teste bem sucedido de uma bomba de hidrogênio. Exposição instantânea de urânio-238 a um grande fluxo de nêutrons resultante da explosão produzido isótopos pesados de urânio, incluindo o urânio-253 e urânio-255, e seus β-decadência rendeu einsteinium-253 e fermium-255. A descoberta dos novos elementos e os novos dados sobre a captura de nêutrons foram inicialmente mantidos em segredo sob as ordens do exército dos EUA até 1955, devido à Guerra Fria tensões. No entanto, a equipe de Berkeley foram capazes de preparar einsteinium e fermium por meios civis, através do bombardeamento de neutrões de plutônio-239, e publicou este trabalho em 1954, com o aviso de que não foram os primeiros estudos que foram realizados sobre os elementos. Os estudos "Ivy Mike" foram desclassificados e publicados em 1955. Os primeiros significativas (submicrograms) quantidades de einsteinium foram produzidas em 1961 por Cunningham e seus colegas, mas isso não tem sido feito para fermium ainda.
O primeiro isótopo de mendelevium, Md 256 (semi-vida de 87 min), foi sintetizado por Albert Ghiorso, Glenn T. Seaborg, R. Gregory Choppin, Bernard G. Harvey e Stanley G. Thompson quando um alvo bombardeado com 253 Es partículas alfa na de 60 polegadas ciclotrão de Laboratório de Radiação Berkeley; este foi o primeiro isótopo de qualquer elemento que se pretende sintetizar um átomo de cada vez.
Houve várias tentativas de obter isótopos de nobelium pelo sueco (1957) e (1958) grupos americanos, mas os primeiros resultados confiáveis foi a síntese de 256 No pelo grupo russo ( Georgy Flyorov et al.), Em 1965, como reconhece pela IUPAC em 1992. Em seus experimentos, Flyorov et al. Bombardeados urânio-238 com néon-22.
Em 1961, Ghiorso et al. Obteve o primeiro isótopo de lawrencium por irradiação califórnio (principalmente califórnio-252) com boro-10 e boro-11 íons. O número de massa deste isótopo não foi claramente estabelecida (possivelmente 258 ou 259) com o tempo. Em 1965, Lr 256 foram sintetizados por Flyorov et ai. De 243 Am e 18 O. Assim IUPAC reconheceu as equipas de física nuclear na Dubna e Berkeley como os co-descobridores do lawrencium.
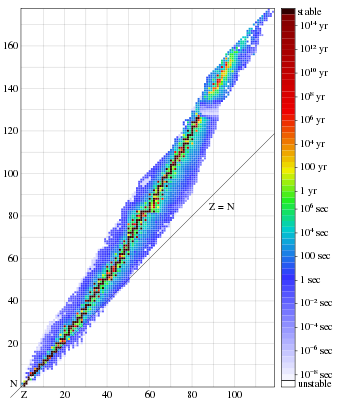
Isótopos
| Isótopo | Meia-vida | Probabilidade de fissão espontânea em% | Emissão energia, MeV (rendimento em%) | A actividade específica de | ||
|---|---|---|---|---|---|---|
| α | γ | α, β-partículas, Bq / kg | fissão, Bq / kg | |||
| 241 Am | 432,2 (7) anos | 4,3 (18) × 10 -10 | 5,485 (84,8) 5,442 (13,1) 5,388 (1,66) | 0,059 (35,9) 0,026 (2,27) | 1,27 × 10 14 | 546,1 |
| 243 Am | 7,37 (4) 10 × 3 anos | 3,7 (2) x 10 -9 | 5,275 (87,1) 5,233 (11,2) 5,181 (1,36) | 0,074 (67,2) 0,043 (5,9) | 7,39 × 10 12 | 273.3 |
| 242 Cm | 162,8 (2) dias | 6,2 (3) × 10 -6 | 6,069 (25,92) 6,112 (74,08) | 0,044 (0,04) 0,102 (4 x 10 -3) | 1,23 × 10 17 | 7,6 x 10 9 |
| 244 Cm | 18,10 (2) anos | 1,37 (3) x 10 -4 | 5,762 (23,6) 5,804 (76,4) | 0,043 (0,02) 0,100 (1,5 x 10 -3) | 2,96 × 10 15 | 4,1 x 10 9 |
| 245 Cm | 8,5 (1) 10 × 3 anos | 6,1 (9) × 10 -7 | 5,529 (0,58) 5,488 (0,83) 5,361 (93,2) | 0,175 (9,88) 0,133 (2,83) | 6,35 × 10 12 | 3,9 x 10 4 |
| 246 Cm | 4,76 (4) 10 × 3 anos | 0,02615 (7) | 5,343 (17,8) 5,386 (82,2) | 0,045 (19) | 1,13 × 10 13 | 2,95 × 10 9 |
| 247 Cm | 1,56 (5) 10 × 7 anos | - | 5,267 (13,8) 5.212 (5,7) 5,147 (1,2) | 0,402 (72) 0,278 (3.4) | 3,43 × 10 9 | - |
| 248 Cm | 3,48 (6) 10 × 5 anos | 8,39 (16) | 5,034 (16,52) 5.078 (75) | - | 1,40 × 10 11 | 1,29 × 10 10 |
| 249 Bk | 330 (4) dias | 4,7 (2) × 10 -8 | 5,406 (1 × 10 -3) 5,378 (2,6 x 10 -4) | 0,32 (5,8 x 10 -5) | 5,88 × 10 16 | 2,76 x 10 7 |
| 249 Cf | 351 (2) anos | 5.0 (4) x 10 -7 | 6,193 (2,46) 6,139 (1,33) 5.946 (3,33) | 0,388 (66) 0,333 (14,6) | 1,51 × 10 14 | 7,57 × 10 5 |
| 250 Cf | 13,08 (9) anos | 0,077 (3) | 5,988 (14,99) 6.030 (84,6) | 0,043 | 4,04 × 10 15 | 3,11 × 10 12 |
| 251 Cf | 900 (40) anos | ? | 6,078 (2,6) 5,567 (0,9) 5,569 (0,9) | 0,177 (17,3) 0,227 (6,8) | 5,86 × 10 13 | - |
| 252 Cf | 2.645 (oito) anos | 3,092 (8) | 6,075 (15,2) 6,118 (81,6) | 0,042 (1,4 x 10 -2) 0,100 (1,3 x 10 -2) | 1,92 × 10 16 | 6,14 × 10 14 |
| 254 Cf | 60,5 (2) dias | ≈100 | 5,834 (0,26) 5,792 (5,3 x 10 -2) | - | 9,75 × 10 14 | 3,13 × 10 17 |
| 253 Es | 20,47 (3) dias | 8,7 (3) × 10 -6 | 6,540 (0,85) 6,552 (0,71) 6.590 (6,6) | 0,387 (0,05) 0,429 (8 × 10 -3) | 9,33 × 10 17 | 8,12 × 10 10 |
| 254 Es | 275,7 (5) dias | <3 x 10 -6 | 6,347 (0,75) 6,358 (2,6) 6,415 (1,8) | 0,042 (100) 0,034 (30) | 6,9 x 10 16 | - |
| 255 Es | 39.8 (12) dias | 0,0041 (2) | 6,267 (0,78) 6,401 (7) | - | 4,38 x 10 17 (β) 3,81 x 10 16 (α) | 1,95 × 10 13 |
| 255 Fm | 20,07 (7) horas | 2,4 (10) x 10 -5 | 7,022 (93,4) 6,963 (5,04) 6,892 (0,62) | 0,00057 (19,1) 0,081 (1) | 2,27 × 10 19 | 5,44 × 10 12 |
| 256 Fm | 157,6 (13) min | 91,9 (3) | 6,872 (1,2) 6.917 (6,9) | - | 1,58 × 10 20 | 1,4 x 10 19 |
| 257 Fm | 100,5 (2) dias | 0,210 (4) | 6,752 (0,58) 6,695 (3,39) 6,622 (0,6) | 0,241 (11) 0,179 (8,7) | 1,87 × 10 17 | 3,93 × 10 14 |
| 256 Md | 77 (2) min | - | 7,142 (1,84) 7,206 (5,9) | - | 3,53 × 10 20 | - |
| 257 Md | 5,52 (5) horas | - | 7,074 (14) | 0,371 (11,7) 0,325 (2,5) | 8,17 × 10 19 | - |
| 258 Md | 51,5 (3) dias | - | 6.73 | - | 3,64 × 10 17 | - |
| 255 n | 3,1 (2) min | - | 8,312 (1,16) 8,266 (2,6) 8,121 (27,8) | 0,187 (3.4) | 8,78 × 10 21 | - |
| 259 n | 58 (5) min | - | 7,455 (9,8) 7,500 (29,3) 7,533 (17,3) | - | 4,63 × 10 20 | - |
| 256 LR | 27 (3) s | <0,03 | 8,319 (5.4) 8,390 (16) 8,430 (33) | - | 5,96 × 10 22 | - |
| 257 LR | 646 (25) ms | - | 8,796 (18) 8.861 (82) | - | 1,54 × 10 24 | - |
Trinta e um isótopos de actinium e oito animado estados isom�icas de alguns dos seus nuclides foram identificados por 2010. Três isótopos, 225 Ac, 227 Ac e 228 Ac, foram encontrados na natureza e os outros foram produzidas em laboratório; apenas os três isótopos naturais são usados em aplicações. Actínio-225 é um membro da radioativo série neptunium; foi descoberto pela primeira vez em 1947 como um produto de fissão de urânio-233, que é um emissor-α com uma meia-vida de 10 dias. Actínio-225 é menos disponível do que actinium-228, mas é mais promissor em aplicações radiofármaco. Actínio-227 (meia-vida 21,77 anos) ocorre em todos os minérios de urânio, mas em pequenas quantidades. Um grama de urânio (em equilíbrio radioactivos) contém apenas 2 x 10 -10 gramas de 227 Ac. Actínio-228 é um membro da série do tório radioativo formados pela decomposição de 228 Ra; é um β - emissor com uma meia-vida de 6,15 horas. Em uma tonelada de tório há 5 x 10 -8 grama de 228 Ac. Foi descoberto pela Otto Hahn em 1906.
Vinte e nove isótopos de protactinium são conhecidos com números de massa 212-240, bem como três animado estados isoméricos. Somente 231 Pa e 234 Pa foram encontrados na natureza. Todos os isótopos têm vida curta, com exceção de protactinium-231 (meia-vida de 32.760 anos). Os isótopos mais importantes são 231 Pa e 233 Pa, que é um produto intermediário na obtenção de urânio-233 e é o mais acessível entre os isótopos artificiais de protactinium. 233 Pa tem conveniente meia-vida e energia de γ por radiação, e assim, foi utilizado, na maioria dos estudos de Protactínio química. Protactinium-233 é um β-emissor, com uma semi-vida de 26,97 dias.
O urânio tem o maior número (25) de ambos natural e sintético isótopos. Eles têm números de massa de 217-242, e três deles, 234 L, 235 L e 238 U, estão presentes em quantidades apreciáveis na natureza. Entre outros, o mais importante é de 233 L, o qual é um produto final de transformações de 232 Th irradiado por nêutrons lentos. 233 L tem uma muito maior eficiência fissão por nêutrons de baixa energia (térmica), em comparação, por exemplo, com 235 U. A maioria dos estudos de química de urânio foram realizadas em urânio-238, devido à sua longa meia-vida de 4,4 x 10 9 anos.
Há 19 isótopos de neptunium com números de massa 225-244; todos eles são altamente radioactivos. O mais popular entre os cientistas são de longa duração 237 Np (t ½ = 2,20 x 10 6 anos) e de curta duração 239 Np, 238 Np (t ½ ~ 2 dias).
Dezesseis isótopos de amerício são conhecidos com números de massa de 232 a 248. Os mais importantes são Am 241 e 243 Am, que são alfa-emissores e emitem também macio, mas raios γ intensos; ambos podem ser obtidos de uma forma isotopicamente puro. Propriedades químicas de amerício foram estudados pela primeira vez com 241 Am, mas mais tarde mudou para 243 Am, que é quase 20 vezes menos radioativo. A desvantagem de 243 Am é a produção de curta duração filha isótopo Np 239, que tem de ser considerado na análise dos dados.
Entre 19 isótopos de cúrio, o mais acessível são 242 Cm e 244 cm; eles são α-emissores, mas com tempo de vida muito mais curto do que os isótopos de amerício. Estes isótopos emitem radiação quase não-γ, mas que são submetidos fissão espontânea com a emissão associado de nêutrons. Mais isótopos de vida longa de cúrio (245-248 cm, todos os emissores α) são formados como uma mistura durante a irradiação de neutrões de plutónio ou amerício. Após a irradiação curto, esta mistura é dominado por cúrio-246, e, em seguida, cúrio-248 começa a acumular-se. Ambos estes isótopos, especialmente 248 cm, tem uma meia-vida mais longa (3,48 x 10 5 anos) e são muito mais conveniente para a realização de investigação química do que 242 Cm e 244 cm, mas elas também têm uma bastante elevada taxa de fissão espontânea . 247 cm, tem o tempo de vida mais longo entre os isótopos de cúrio (1,56 x 10 7 anos), mas não é formado em grandes quantidades, devido à forte fissão induzida por neutrões térmicos.
Catorze isótopos de berquélio foram identificados com números de massa 238-252. Apenas 249 Bk está disponível em grandes quantidades; que tem uma semi-vida relativamente curto de 330 dias e emite principalmente suave β-partículas, que são inconvenientes para a detecção. Sua radiação alfa é bastante fraca (1,45 x 10 -3% em relação à radiação β-), mas é algumas vezes utilizado para detectar este isótopo. Bk 247 é um emissor alfa com uma semi-vida longa de 1380 anos, mas é difícil para se obter em quantidades apreciáveis; não é formada após a irradiação de neutrões de plutônio por causa da β-estabilidade de isótopos de isótopos cúrio com número de massa 248 abaixo.
Isótopos de califórnio com números de massa 237-256 são formados em reatores nucleares; califórnio-253 é um β-emissor eo resto são α-emissores. Os isótopos com números pares de massa (250 Cf, 252 e 254 Cf. CF) têm uma alta taxa de fissão espontânea, especialmente 254 Cf, dos quais 99,7% decai por fissão espontânea. Californium-249 tem uma meia-vida relativamente longo (352 anos), fissão espontânea fraca e forte emissão γ que facilita a sua identificação. Cf 249 não é formado em grandes quantidades num reactor nuclear, devido à lenta β-deterioração do pai isótopo 249 Bk e uma grande secção transversal de interacção com neutrões, mas pode ser acumulada na forma isotopicamente puro como o produto de decaimento β-(pré-seleccionado) 249 Bk. Californium produzido por reator de irradiação de plutónio maioria é constituída por 250 Cf e 252 Cf, sendo esta última predominante para grandes densidades de energia de nêutrons, e seu estudo é dificultada pela forte radiação de nêutrons.
| Principal isótopo | t½ | Filha isótopo | t½ | Tempo para estabelecer equilíbrio radioativo |
|---|---|---|---|---|
| 243 Am | 7370 anos | 239 Np | 2,35 dias | 47,3 dias |
| 245 Cm | 8265 anos | 241 Pu | 14 anos | 129 anos |
| 247 Cm | 1,64 x 10 7 anos | 243 Pu | 4,95 horas | 7,2 dias |
| 254 Es | 270 dias | 250 Bk | 3,2 hora | 35,2 horas |
| 255 Es | 39,8 dias | 255 Fm | 22 horas | 5 dias |
| 257 Fm | 79 dias | 253 Cf | 17,6 dias | 49 dias |
Entre as 16 conhecidas isótopos de einsteinium com números de massa 241-257 o mais acessível é 253 Es. É um α-emissor, com uma meia-vida de 20,47 dias, uma emissão-γ relativamente fraca e pequena taxa de fissão espontânea, em comparação com os isótopos de californium. Irradiação de nêutrons prolongada também produz um isótopo de longa vida 254 Es (t ½ = 275,5 dias).
Dezenove isótopos de fermium são conhecidos com números de massa de 242-260. 254 Fm, Fm 255 e 256 Fm são α-emissores com uma meia-vida curta (horas), que pode ser isolado em quantidades significativas. 257 FM (t½ = 100 dias) pode acumular-se, após irradiação prolongada e forte. Todos estes isótopos são caracterizados por altas taxas de fissão espontânea.
Entre o 15 conhecido isótopos de mendelévio (números de massa 245-260), a mais estudada é de 256 Md, que decai principalmente através da captura de elétrons (α-radiação é ≈10%) com a meia-vida de 77 minutos. Outro emissor alfa, 258 MD, tem uma meia-vida de 53 dias. Ambos estes isótopos são produzidos a partir einsteinium rara (253 Es e 255 Es respectivamente), que limita o seu modo sua disponibilidade.
Longevo isótopos de nobelium e isótopos de laurêncio (e de elementos mais pesados) têm relativamente pequenas meias-vidas. Para nobelium 11 isótopos são conhecidos com números de massa 250-260 e 262. Propriedades químicas dos nobelium e lawrencium foram estudados com 255 n (t ½ = 3 min) e 256 LR (t ½ = 35 s). O nobelium isótopo mais longa duração 259 Não tem uma meia-vida de 1,5 horas.
Distribuição na natureza
Tório e urânio são os actinides mais abundantes na natureza com as respectivas concentrações em massa de 1,6 × 10 -3 % e 4 × 10 -4 %. Urânio ocorre principalmente na crosta terrestre como uma mistura dos seus óxidos minerais no uraninite, que também é chamado pitchblende por causa da sua cor preta. Há várias dezenas de outros minerais de urânio, tais como carnotite (KUO 2 VO 4 · 3H 2 O) e autunite (Ca (UO 2 ) 2 (PO 4 ) 2 · NH 2 O). A composição isotópica de urânio natural é 238 U (abundância relativa 99,2742%), 235 L (0,7204%) e 234 U (0,0054%); destes 238 L tem a maior meia-vida de 4,51 × 10 9 anos. A produção mundial de urânio em 2009 ascendeu a 50.572 toneladas, das quais 27,3% foram minadas no Cazaquistão . Outros países importantes de mineração de urânio são o Canadá (20,1%), Austrália (15,7%), Namíbia (9,1%), Rússia (7,0%), e Niger (6,4%).
| Minério | Localização | Urânio conteúdo,% | Relação de massa 239Pu / minério | Rácio de 239PU / L (×1012) |
|---|---|---|---|---|
| Uraninite | Canadá | 13.5 | 9,1×10-12 | 7.1 |
| Uraninite | Congo | 38 | 4,8×10-12 | 12 |
| Uraninite | Colorado, EUA | 50 | 3,8×10-12 | 7.7 |
| Monazita | Brasil | 0.24 | 2,1×10-14 | 8.3 |
| Monazita | North Carolina, Estados Unidos | 1.64 | 5,9×10-14 | 3.6 |
| Fergusonite | - | 0,25 | <1×10-14 | <4 |
| Carnotite | - | 10 | <4×10-14 | <0,4 |
Os mais abundantes minerais tório são torianita (ThO 2 ), thorite (ThSiO 4 ) e monazita, ((Th, Ca, Ce) PO 4 ). A maioria dos minerais de urânio de tório conter e vice-versa; e todos eles têm fração significativa dos lantanídeos. Ricos depósitos de minerais de tório estão localizados nos Estados Unidos (440 mil toneladas), Austrália e Índia (~ 300 mil toneladas cada) e Canadá (~ 100 mil toneladas).
A abundância de actinium na crosta da Terra é apenas cerca de 5 × 10 -15 %. Actínio está presente principalmente em contendo urânio, mas também em outros minerais, embora em quantidades muito menores. O teor de actínio na maioria dos objectos singulares corresponde ao equilíbrio isotópico de isótopo pai 235 L, e que não é afectado pela fraca migração Ac. Protactinium é mais abundante (10 -12 %) na crosta da Terra do que actinium. Ele foi descoberto no minério de urânio em 1913 por Fajans e Göhring. Como actínio, a distribuição de Protactínio que segue de 235 U.
A meia-vida do isótopo de vida mais longa de neptunium, 237 Np, é insignificante em comparação com a idade da Terra. Assim neptunium está presente na natureza em quantidades insignificantes produzidos como produtos de decaimento intermediários de outros isótopos. Traços de plutónio em minerais de urânio foi encontrado pela primeira vez em 1942, e os resultados mais sistemáticos sobre 239 Pu estão resumidos na tabela (não há outros isótopos de plutónio pode ser detectado nas amostras). O limite superior da abundância do isótopo de vida mais longo do plutónio, 244 Pu, é de 3 × 10 -20 %. O plutónio não pôde ser detectado em amostras de solo lunar. Devido à sua escassez na natureza, mais plutônio é produzido sinteticamente.
Quantidades insignificantes deamerício,cúrio,berquélioecalifórniosão produzidos porreações de captura de nêutrons edecaimento beta em depósitos de urânio-rolamento muito altamente concentrados.
Extração
Devido à baixa abundância dos actinídeos, a sua extracção é, um processo de passos múltiplos complexo. Os fluoretos de actinídeos são normalmente utilizados, porque eles são insolúveis em água e podem ser facilmente separados com reacções redox. Fluoretos são reduzidos com cálcio , magnésio ou bário :
Entre os actinídeos, tório e urânio são mais fáceis de isolar. Tório é extraído na sua maior parte de monazite: difosfato de tório (Th (PO 4 ) 2 ) é feito reagir com o ácido nítrico , e o nitrato de tório produzido tratados com fosfato de tributilo. impurezas de terras raras são separados através do aumento do pH na solução de sulfato.
Num outro método de extracção, a monazite é decomposto com uma solução aquosa a 45% de hidróxido de sódio a 140 ° C. Hidróxidos de metal mistos são extraídos em primeiro lugar, filtrada a 80 ° C, lavou-se com água e dissolveu-se com concentrado ácido clorídrico . Em seguida, a solução ácida é neutralizada com hidróxidos até pH = 5,8, que resulta na precipitação do hidróxido de tório (Th (OH) 4 ) contaminado com ~ 3% de hidróxidos de terras raras; o resto de hidróxidos de terras raras permanece em solução. Hidróxido de tório é dissolvido num ácido mineral e, em seguida, purificadas a partir dos elementos de terras raras. Um método eficiente é a dissolução do hidróxido de tório em ácido nítrico, porque a solução resultante pode ser purificado por extracção com solventes orgânicos:
Th (OH)4+ 4 HNO3→ Th (NO3)4+ 4 H2O
Tório metálico é separada do óxido anidro, cloreto ou fluoreto de fazendo-o reagir com o cálcio numa atmosfera inerte:
ThO2Ca + 2 → 2 CaO + Th
Às vezes o tório é extraído por electrólise de um fluoreto de uma mistura de cloreto de sódio e de potássio a 700-800 ° C num cadinho de grafite. Altamente tório puro pode ser extraída a partir do seu iodeto com o processo barra de cristal.
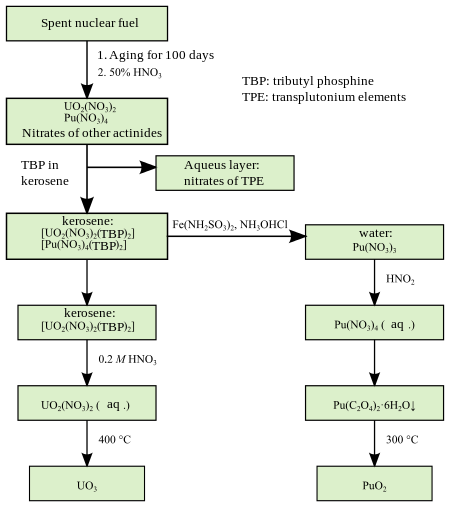
O urânio é extraída a partir dos seus minérios de várias maneiras. Num método, o minério é queimada e, em seguida, feito reagir com ácido nítrico para converter urânio num estado dissolvido. Tratar a solução com uma solução de fosfato de tributilo (TBP) em querosene urânio transforma numa forma de UO orgânica 2 (NO 3 ) 2 (TBP) 2 . As impurezas insolúveis são filtrados e o urânio é extraído por meio de reacção com hidróxidos como (NH 4 ) 2 U 2 S 7 ou com peróxido de hidrogénio como UO 4 · 2H 2 O.
Quando o minério de urânio é rica em minerais como dolomita, magnesita, etc., esses minerais consumir ácido muito. Neste caso, o método do carbonato é utilizado para a extracção de urânio. O seu componente principal é uma solução aquosa de carbonato de sódio, que se converte em um complexo de urânio [UO 2 (CO 3 ) 3 ] 4- , que é estável em soluções aquosas a concentrações baixas de iões de hidróxido. As vantagens do método do carbonato de sódio são os produtos químicos que têm baixa corrosividade (comparado com nitratos) e que a maioria dos metais não-urânio precipitar a partir da solução. A desvantagem é que os compostos de urânio tetravalentes precipitar bem. Portanto, o urânio é tratada com carbonato de sódio a temperatura elevada e sob pressão de oxigénio:
- 2 UO2+ O2+ 6CO2
3→ 2 [UO2(CO3)3]4-
Esta equação indica que o melhor solvente para o processamento de carbonato de urânio é uma mistura de carbonato com bicarbonato. A pH elevado, isto resulta na precipitação de diuranato, o qual é tratado com hidrogénio na presença de níquel produzindo um tetracarbonate urânio insolúvel.
Outro método de separação utiliza resinas poliméricas como um polielectrólito. Processos de permuta de iões das resinas resultar na separação do urânio. Urânio a partir de resinas é lavada com uma solução de nitrato de amónio ou ácido nítrico que produz nitrato de uranilo, UO 2 (NO 3 ) 2 · 6H 2 O. Quando aquecido, que se transforma em UO 3 , que é convertido em UO 2 com hidrogénio:
- UO3+ H2→ UO2+ H2O
Reagindo dióxido de urânio comácido fluorídrico altera paratetrafluoreto de urânio, que produz urânio metálico na reacção com magnésio metálico:
- 4 HF + UO2→ UF4+ 2 H2O
Para extrair plutónio, urânio irradiadas com neutrões é dissolvido em ácido nítrico, e um agente redutor ( FeSO 4 , ou H 2 O 2 ) é adicionado à solução resultante. Esta adição muda o estado de oxidação do plutónio 6-4, enquanto urânio permanece sob a forma de nitrato de uranilo (UO 2 (NÃO 3 ) 2 ). A solução é tratada com um agente redutor e neutralizou-se com carbonato de amónio a pH = 8, que resulta em precipitação de Pu 4+ compostos.
Em outro método, Pu4+eUO2 +
2são primeiramente extraída com fosfato de tributilo, então reagido comhidrazina de lavar roupa para fora do plutónio recuperado.
A maior dificuldade na separação de actínio representa a similitude das suas propriedades com as de lantânio. Assim actinium ou é sintetizado em reações nucleares de isótopos de rádio ou separados utilizando procedimentos de troca iônica.
Propriedades
Actinides tem propriedades semelhantes a lantanídeos. Os 6 d e 7 s escudos eletrônicos são preenchidos actinium e tório, ea 5 f shell está sendo preenchido com novo aumento de número atômico; o 4 f shell é preenchido os lantanídeos. A primeira evidência experimental para o enchimento do 5 f shell em actinides foi obtido por McMillan e Abelson em 1940. Como em lantanídeos (veja contração dos lantanídeos), o raio iônico do actinides monotonamente diminui com o número atômico (ver também Princípio de Aufbau).
| Propriedade | CA | Th | Pa | U | Np | Pu | Sou | Cm | Bk | Cf | Es | Fm | Md | Não | Lr |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Carga do núcleo | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 |
| massa atômica | [227] | 232.0381 | 231,03588 | 238,02891 | [237] | [244] | [243] | [247] | [247] | [251] | [252] | [257] | [258] | [259] | [262] |
| Número de isótopos naturais | 3 | 9 | 5 | 9 | 4 | 5 | 5 | 8 | 2 | 5 | - | - | - | - | - |
| Isótopos naturais | 225, 227-228 | 226-232, 234-235 | 231, 233-236 | 232-240 | 237-240 | 238-240, 242, 244 | 241-245 | 242-249 | 249-250 | 249-253 | - | - | - | - | - |
| Isótopo de vida mais longa | 227 | 232 | 231 | 238 | 237 | 244 | 243 | 247 | 247 | 251 | 252 | 257 | 258 | 259 | 262 |
| Meia-vidado isótopo de vida mais longa | 21,8 anos | 14000000000 anos | 32.500 anos | 4470 milhões anos | 2140 mil anos | 80.800 mil anos | 7370 anos | 15.600 mil anos | 1400 anos | 900 anos | 1,29 anos | 100,5 dias | 52 dias | 58 min | 261 min |
| Configuração eletrônica no estado fundamental | 6d17s2 | 6d27s2 | 5f26d17s2ou 5f16d27s2 | 5f36d17s2 | 5f46d17s2ou 5f57s2 | 5f67s2 | 5f77s2 | 5f76d17s2 | 5f97s2ou 5f86d17s2 | 5f107s2 | 5f117s2 | 5f127s2 | 5f137s2 | 5f147s2 | 5F147s27P1 |
| Estado de oxidação | 3 | 3, 4 | 3, 4, 5 | 3, 4, 5, 6 | 3, 4, 5, 6, 7 | 3, 4, 5, 6, 7 | 2, 3, 4 | 3, 4 | 3, 4 | 2, 3 | 2, 3 | 2, 3 | 2, 3 | 2, 3 | 3 |
| Raio Metálico, nm | 0,203 | 0,180 | 0,162 | 0,153 | 0,150 | 0,162 | 0,173 | 0,174 | 0,170 | 0,186 | 0,186 | - | - | - | - |
| Raio iônico, nm: An4+ An3+ | - 0,126 | 0,114 - | 0,104 0,118 | 0,103 0,118 | 0,101 0,116 | 0,100 0,115 | 0,099 0,114 | 0,099 0,112 | 0,097 0,110 | 0,096 0,109 | 0,085 0,098 | 0,084 0,091 | 0,084 0,090 | 0,084 0,095 | 0,083 0,088 |
| Temperatura, ° C: fusão de ebulição | 1050 3300 | 1750 4800 | 1572 4400 | 1130 3800 | 640 3900 | 640 3230 | 1176 2610 | 1340 - | 1050 - | 900 - | 860 - | 1530 - | 830 - | 830 - | 1630 - |
| Densidade, g / cm3 | 10,07 | 11,78 | 15,37 | 19,06 | 20,25 | 19.84 | 11,7 | 13.51 | 14.78 | 15.1 | 8,84 | ||||
| Potencial padrão de eletrodo, V: E° (Um4+/ Uma0) E° (Um3+/ Uma0) | - -2,13 | -1,83 - | -1,47 - | -1,38 -1,66 | -1,30 -1,79 | -1.25 -2.00 | -0,90 -2,07 | -0,75 -2,06 | -0.55 -1.96 | -0,59 -1,97 | -0,36 -1,98 | -0,29 -1,96 | - -1,74 | - -1,20 | - -2,10 |
| Cor [M (H2O)n]4+ [M (H2O)n]3+ | - Incolor | Incolor Azul | Amarelo Azul escuro | Verde Roxo | Amarelo verde Roxo | Marrom Violeta | Vermelho Rose | Amarelo Incolor | Bege Amarelo verde | Verde Verde | - Rosa | - - | - - | - - | - - |
| Estado de oxidação | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 |
| +3 | CA3+ | º3+ | Pa3+ | VOCÊ3+ | Np3+ | Pu3+ | Sou3+ | Cm3+ | Bk3+ | Cf3+ | Es3+ |
| 4 | º4+ | Pa4+ | VOCÊ4+ | Np4+ | Pu4+ | Sou4+ | Cm4+ | Bk4+ | Cf4+ | ||
| 5 | PaO+ 2 | UO+ 2 | NPO+ 2 | Può+ 2 | AmO+ 2 | ||||||
| 6 | UO2 + 2 | NPO2+ 2 | Può2+ 2 | AmO2+ 2 | |||||||
| +7 | NPO3+ 2 | Può3+ 2 | [AmO6]5- |
Propriedades físicas
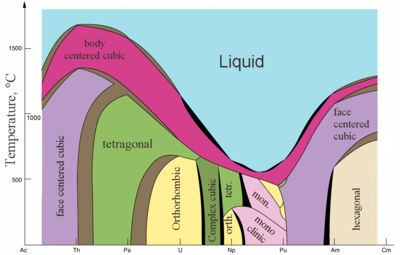 | 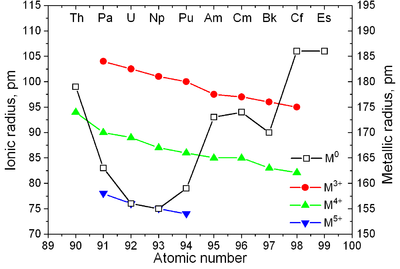 |
| Principais estruturas cristalinas de alguns actinídeos vs. temperatura | Metallic eraios iônicos de actinides |

Actinídeos são metais típicos. Todas elas são suaves e têm uma cor prateada (mas manchar no ar), relativamente elevada densidade e plasticidade. Alguns deles podem ser cortados com uma faca. Seu resistividade eléctrica varia entre 15 e 150 μOhm · cm. A dureza de tório é semelhante à do aço macio, tório puro assim aquecido pode ser enrolado em folhas e puxado para dentro do fio. O tório é quase a metade da densidade do urânio e plutônio, mas é mais difícil do que qualquer um deles. Todos os actinídeos são radioativos, paramagnética, e, com exceção de actinium, têm várias fases cristalinas: plutónio tem sete, e urânio, neptunium e califórnio três. estruturas cristalinas de protactinium, urânio, plutónio neptunium e não têm análogos claras entre os lantanídeos e são mais semelhantes aos das 3 d - metais de transição .
Todos os actinídeos são pirofórico, especialmente quando finamente dividido, isto é, se inflamam espontaneamente após reacção com o ar. O ponto de fusão dos actinídeos não tem uma clara dependência do número de f -electrons. O invulgarmente baixo ponto de Neptúnio e plutónio (~ 640 ° C) de fusão é explicado por hibridação de 5 f 6 e d orbitais e a formação de ligações direccionais nestes metais.
| Lantanídeos | Ln3+, Å | Actinides | Um3+, Å | Um4+, Å |
|---|---|---|---|---|
| Lantânio | 1.061 | Actínio | 1.11 | - |
| Cério | 1.034 | Tório | 1.08 | 0.99 |
| Praseodímio | 1.013 | Protactínio | 1.05 | 0.93 |
| Neodímio | 0,995 | Urânio | 1.03 | 0.93 |
| Promécio | 0,979 | Neptúnio | 1.01 | 0,92 |
| Samário | 0,964 | Plutônio | 1.00 | 0,90 |
| Európio | 0.950 | Amerício | 0.99 | 0,89 |
| Gadolínio | 0,938 | Curandeiro | 0.98 | 0,88 |
| Térbio | 0,923 | Berkelium | - | - |
| Disprósio | 0,908 | Californium | - | - |
| Holmium | 0,894 | Einsteinium | - | - |
| Erbium | 0,881 | Fermium | - | - |
| Túlio | 0,869 | Mendelevium | - | - |
| Itérbio | 0,858 | Nobelium | - | - |
| Lutécio | 0,848 | Laurêncio | - | - |
Propriedades químicas
Como os lantanídeos, todos os actinídeos são altamente reactivos com halogênios e Calcogênios; no entanto, os actinídeos reagir mais facilmente. Actinídeos, especialmente aqueles com um número pequeno de 5 f -electrons, são propensos a hibridação. Isto é explicado pela semelhança das energias de elétrons no 5 f , 7 s e 6 d conchas. A maioria dos actinídeos apresentam uma maior variedade de estados de valência, e os mais estáveis são 6 para o urânio, 5 para protactinium e neptunium, 4 de tório e de plutónio e três para actinium e outros actinídeos.
Quimicamente, actínio é semelhante ao de lantânio, que é explicada pela sua raios iónicos semelhante e estrutura electrónica. Tal como o lantânio, o actínio tem de oxidação de +3, mas é menos reactivo e tem mais pronunciadas propriedades básicas. Entre outros actinídeos trivalentes Ac 3+ é menos ácida, isto é, tem a tendência mais fraca para hidrolisar em soluções aquosas.
O tório é quimicamente, em vez ativo. Devido à falta de elétrons em 6 d e 5 de f orbitais, os compostos tetravalente tório são incolores. A pH <3, as soluções de sais de tório são dominadas pelos catiões [Th (H 2 O) 8 ] 4+ . O Th 4+ ião é relativamente grande, e, dependendo do número de coordenação pode ter um raio de entre 0,95 e 1,14 Â. Como resultado, sais de tório têm uma fraca tendência para a hidrólise. A capacidade distintiva de sais de tório é a sua elevada solubilidade, não apenas em água como também em solventes orgânicos polares.
Protactinium apresenta dois estados de valência; o 5 é estável, eo estado quatro facilmente oxida a protactinium (V). Assim Protactínio tetravalente em soluções é obtida pela acção de agentes redutores fortes numa atmosfera de hidrogénio. Protactínio tetravalente é quimicamente semelhante ao urânio (IV) e o tório (IV). Fluoretos, fosfatos, hipofosfato, iodato e phenylarsonates de protactinium (IV) são insolúveis em água e ácidos diluídos. Protactinium forma carbonatos solúveis. As propriedades hidrolíticas de pentavalente protactinium estão próximos aos de tântalo (V) e de nióbio (V). O comportamento químico complexo de Protactínio é uma consequência do início do enchimento do 5 f concha neste elemento.
O urânio tem uma valência de 3 a 6, a última sendo mais estável. No estado hexavalente, o urânio é muito semelhante ao sexto elementos do grupo. Muitos compostos de urânio (IV) e urânio (VI) são nonstoichiometric, ou seja, têm composição variável. Por exemplo, a fórmula química real de dióxido de urânio é UO 2 + x , onde x varia entre -0,4 e 0,32. O urânio (VI) são compostos fracos oxidantes. A maioria deles contêm a linear " grupo uranyl ", UO 2 +
2 . Entre 4-6 ligandos podem ser acomodados num plano equatorial perpendicular ao grupo de uranilo. O grupo uranyl atua como um ácido forte e forma complexos fortes com ligantes de oxigênio doadores que com ligantes de nitrogênio por doadores. NPO 2+
2 e può 2+
2 também são a forma comum de Np e Pu no estado de oxidação +6. O urânio (IV) compostos exibem propriedades redutoras, por exemplo, eles são facilmente oxidados pelo oxigénio atmosférico. Urânio (III) é um agente redutor muito forte. Devido à presença do revestimento d, urânio (assim como muitas outras actinídeos) formar compostos organometálicos, tais como L III (C 5 H 5 ) 3 e L EU V (C 5 H 5 ) 4 .
Neptunium tem estados de valência 3-7, que podem ser observadas simultaneamente em soluções. O estado mais estável em solução é de 5, mas a valência 4 é preferido, em compostos de neptúnio sólidos. Neptunium metal é muito reativo. Os iões de Neptúnio são propensos a hidrólise e a formação de compostos de coordenação.
O plutónio também exibe a valência entre 3 e 7, e, assim, é quimicamente semelhante à Neptúnio e urânio. É altamente reactivo, e rapidamente forma uma película de óxido no ar. O plutónio reage com hidrogénio mesmo a temperaturas tão baixas como 25-50 ° C; que também forma facilmente halogenetos e compostos intermetálicos. Reações de hidrólise de íons de plutônio de diferentes estados de oxidação são bastante diversificadas. O plutónio (V) pode entrar reacções de polimerização.
A maior diversidade química entre os actinídeos é observada em amerício, o qual pode ter de valência entre 2 e 6. divalentes amerício é obtido apenas em compostos secos e soluções não aquosas ( acetonitrilo). Estados de oxidação +3, 5 e 6 são típicas de soluções aquosas, mas também no estado sólido. Formas tetravalentes amerício compostos estáveis sólidos (dióxido de carbono, fluoreto e hidróxido), bem como complexos em soluções aquosas. Foi relatado que, em solução alcalina amerício podem ser oxidado para o estado heptavalente, mas estes dados provou errada. A valência mais estável do amerício é 3 nas soluções aquosas e 3 ou 4 em compostos sólidos.
Valence 3 é dominante em todos os elementos que se seguiram até lawrencium (com a possível exceção de nobelium). Cúrio pode ser tetravalente em sólidos (flúor, dióxido). Berkelium, juntamente com uma valência de 3, também mostra a valência de 4, mais estável do que a de cúrio; a valência 4 observa-se em fluoreto de sólido e de dióxido de. A estabilidade de Bk 4+ em solução aquosa é próximo do de Ce 4+ . Apenas valência 3 foi observado para califórnio, einsteinium e fermium. O estado bivalente é comprovada para mendelevium e nobelium, e em nobelium é mais estável do que o estado trivalente. Lawrencium valência 3 mostra tanto em soluções e sólidos.
Os potenciais redox 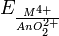 aumenta de -0,32 V em urânio, através de 0,34 V (Np) e 1,04 V (Pu) a 1,34 V em amerício revelando a crescente habilidade de redução da Um 4+ íon de amerício de urânio. Todos os actinides formar Anh 3 hidretos de cor preta com propriedades de sal-like. Actinides também produzem carbonetos com a fórmula geral de AnC ou AnC 2 (U 2 C 3 de urânio), bem como sulfetos Um 2 S 3 e pela ANS 2 .
aumenta de -0,32 V em urânio, através de 0,34 V (Np) e 1,04 V (Pu) a 1,34 V em amerício revelando a crescente habilidade de redução da Um 4+ íon de amerício de urânio. Todos os actinides formar Anh 3 hidretos de cor preta com propriedades de sal-like. Actinides também produzem carbonetos com a fórmula geral de AnC ou AnC 2 (U 2 C 3 de urânio), bem como sulfetos Um 2 S 3 e pela ANS 2 .
Compostos
Óxidos e hidróxidos
| Composto | Cor | Cristal simetria, tipo | Constantes de rede, Å | Densidade, g / cm3 | Temperatura, ° C | ||
|---|---|---|---|---|---|---|---|
| um | b | c | |||||
| Ac2O3 | Branco | Hexagonal, La2Ó3 | 4.07 | - | 6.29 | 9.19 | - |
| PaO2 | - | Cúbico, a CAF2 | 5.505 | - | - | - | - |
| Pa2O5 | Branco | cúbico, a CAF2 Cúbico Tetragonal Hexagonal romboédricos Orthorhombic | 5,446 10,891 5,429 3,817 5,425 6,92 | - - - - - 4.02 | - 10.992 5.503 13.22 - 4. 18 | - | 700 700-1100 1000 1000-1200 1240-1400 - |
| ThO2 | Incolor | Cúbico | 5.59 | - | - | 9,87 | - |
| UO2 | Preto amarronzado | Cúbico | 5.47 | - | - | 10,9 | - |
| NPO2 | Marrom-esverdeada | Cúbico, a CAF2 | 5,424 | - | - | 11.1 | - |
| Può | Preto | Cúbico, NaCl | 4.96 | - | - | 13,9 | - |
| Può2 | Verde-oliva | Cúbico | 5.39 | - | - | 11,44 | - |
| Am2O3 | Red-brown Red-brown | Cúbico, Mn2O3 Hexagonal, La2Ó3 | 11.03 3,817 | - | - 5,971 | 10,57 11,7 | - |
| AmO2 | Preto | Cúbico, a CAF2 | 5,376 | - | - | - | - |
| Cm2O3 | Branco - - | Cúbico, Mn2O2 Hexagonal, lacL3 Monoclinic, Sm2O3 | 11.01 3.80 14,28 | - - 3.65 | - 6 8,9 | 11,7 | - |
| OCM2 | Preto | Cúbico, a CAF2 | 5.37 | - | - | - | - |
| Bk2O3 | Marrom claro | Cúbico, Mn2O3 | 10,886 | - | - | - | - |
| BKO2 | Marrom-vermelho | Cúbico, a CAF2 | 5.33 | - | - | - | - |
| Cf2O3 | Incolor amarelado - | Cúbico, Mn2O3 Monoclinic, Sm2O3 Hexagonal, La2Ó3 | 10,79 14.12 3,72 | - 3.59 - | - 8,80 5.96 | - | - |
| Diretor Financeiro2 | Preto | Cúbico | 5.31 | - | - | - | - |
| Es2O3 | - | Cúbico, Mn2O3 Monoclinic Hexagonal, La2Ó3 | 10.07 14.1 3.7 | - 3.59 - | - 8,80 6 | - | - |
| Estado de oxidação | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| +3 | Pu2O3 | Am2O3 | Cm2O3 | Bk2O3 | Cf2O3 | Es2O3 | |||||
| 4 | ThO2 | PaO2 | UO2 | NPO2 | Può2 | AmO2 | OCM2 | BKO2 | Diretor Financeiro2 | ||
| 5 | Pa2O5 | L2O5 | Np2O5 | ||||||||
| 6 | L3O8 | ||||||||||
| UO3 |
| Fórmula química | ThO2 | PaO2 | UO2 | NPO2 | Può2 | AmO2 | OCM2 | BKO2 | Diretor Financeiro2 |
| CAS-número | 1314-20-1 | 12036-03-2 | 1344-57-6 | 12035-79-9 | 12059-95-9 | 12005-67-3 | 12016-67-0 | 12010-84-3 | 12015-10-0 |
| Massa molar | 264,04 | 263,035 | 270,03 | 269,047 | 276,063 | 275,06 | 270-284 ** | 279,069 | 283,078 |
| Ponto de fusão | 3390 ° C | 2865 ° C | 2547 ° C | 2400 ° C | 2175 ° C | ||||
| A estrutura de cristal |  Um 4+:__/ O2-:__ | ||||||||
| Grupo espacial | Fm3m | ||||||||
| Número de coordenação | Um, O [4] | ||||||||
- Um- actinídeos
** Dependendo dos isótopos
Alguns actinides pode existir em várias formas tais como óxido de Um 2 O 3 , año 2 , An 2 O 5 e año 3 . Para todos os actinídeos, óxidos año 3 são anfotéricos e Um 2 O 3 , año 2 e An 2 O 5 são básicos, eles facilmente reagem com a água, formando bases:
- Um2S3+ 3 H22 O → Um (OH)3.
Estas bases são pouco solúveis em água e pela sua actividade estão próximos dos hidróxidos de metais das terras raras. A base mais forte é de actinium. Todos os compostos de actinium são incolores, com exceção de preto sulfureto actinium (Ac 2 S 3 ). Dióxidos de actinídeos tetravalentes cristalizam no sistema cúbico, mesmo que em fluoreto de cálcio.
Tório reagir com o oxigênio forma exclusivamente dióxido de:
Dióxido de tório é um material refractário com o ponto de fusão mais elevado entre qualquer óxido conhecido (3390 ° C). Adicionando 0,8-1% ThO 2 para tungstênio estabiliza sua estrutura, de modo que os filamentos dopados têm melhor estabilidade mecânica a vibrações. Para dissolver ThO 2 em ácidos, é aquecido a 500-600 ° C; aquecimento acima de 600 ° C produz uma muito resistente aos ácidos e outros reagentes de forma ThO 2 . Pequena adição de íons de flúor catalisa dissolução de dióxido de tório em ácidos.
Dois óxidos protactinium foram obtidos: PaO 2 (preto) e Pa 2 O 5 (branco); o primeiro é isomorfo com ThO 2 e o último é mais fácil de obter. Ambos os óxidos são básicos, e Pa (OH) 5 é uma base fraca, fracamente solúvel.
Decomposição de certos sais de urânio, por exemplo UO 2 (NO 3 ) · 6H 2 ó em ar a 400 ° C, produz UO laranja ou amarelo 3 . Este óxido é anfotérico e forma vários hidróxidos, os mais estáveis UO 2 (OH) 2 . A reacção de urânio (VI) com óxido de resultados de hidrogénio em dióxido de urânio, o qual é semelhante nas suas propriedades, com ThO 2 . Este também é o óxido básico e corresponde ao hidróxido de urânio (U (OH) 4 ).
Plutónio, neptúnio e amerício forma dois óxidos básicos: An 2 O 3 e año 2 . Neptunium trióxido é instável; Assim, apenas Np 3 S 8 poderia ser obtido até agora. No entanto, os óxidos de plutónio e Neptúnio com a fórmula química áno 2 e An 2 S 3 são bem caracterizado.
Sais
| Fórmula química | AcCl3 | UCl3 | NpCl3 | PUCL3 | AMCL3 | CMCL3 | BkCl3 | CFCL3 |
| CAS-número | 22986-54-5 | 10025-93-1 | 20737-06-8 | 13569-62-5 | 13464-46-5 | 13537-20-7 | 13536-46-4 | 13536-90-8 |
| Massa molar | 333,386 | 344,387 | 343,406 | 350,32 | 349,42 | 344-358 ** | 353,428 | 357,438 |
| Ponto de fusão | 837 ° C | 800 ° C | 767 ° C | 715 ° C | 695 ° C | 603 ° C | 545 ° C | |
| Ponto de ebulição | 1657 ° C | 1767 ° C | 850 ° C | |||||
| A estrutura de cristal |  Um 3+:__/ Cl-:__ | |||||||
| Grupo espacial | P63/ m | |||||||
| Número de coordenação | Um* [9], Cl | |||||||
| Constantes de rede | um= 762pm c= 455 pm | um= 745,2 pm c= 432,8 pm | um= 739,4 pm c= 424,3 pm | um= 738,2 pm c= 421,4 pm | um= 726 pm c= 414 pm | um= 738,2 pm c= 412,7 pm | um= 738 pm c= 409 pm | |
- *Um- actinídeos
** Dependendo dos isótopos
| Composto | Cor | Cristal simetria, tipo | Constantes de rede, Å | Densidade, g / cm3 | ||
|---|---|---|---|---|---|---|
| um | b | c | ||||
| AcF3 | Branco | Hexagonal, LaF3 | 4.27 | - | 7,53 | 7,88 |
| Paf4 | Marrom escuro | Monoclinic | 12,7 | 10,7 | 8,42 | - |
| Paf5 | Preto | Tetragonal, β-UF5 | 11,53 | - | 5.19 | - |
| THF4 | Incolor | Monoclinic | 13 | 10.99 | 8,58 | 5.71 |
| UF3 | Vermelho-púrpura | Hexagonal | 7.18 | - | 7,34 | 8,54 |
| UF4 | Verde | Monoclinic | 11.27 | 10,75 | 8,40 | 6,72 |
| α-UF5 | Azulado | Tetragonal | 6.52 | - | 4.47 | 5.81 |
| β-UF5 | Azulado | Tetragonal | 11,47 | - | 5.20 | 6.45 |
| UF6 | Amarelado | Orthorhombic | 9.92 | 8.95 | 5.19 | 5.06 |
| NpF3 | Preto ou roxo | Hexagonal | 7,129 | - | 7,288 | 9.12 |
| NpF4 | Luz verde | Monoclinic | 12.67 | 10,62 | 8.41 | 6.8 |
| NpF6 | Laranja | Orthorhombic | 9.91 | 8,97 | 5.21 | 5 |
| PUF3 | Azul-violeta | Trigonal | 7,09 | - | 7.25 | 9.32 |
| PUF4 | Castanho claro | Monoclinic | 12,59 | 10,57 | 8.28 | 6,96 |
| PUF6 | Marrom-vermelho | Orthorhombic | 9.95 | 9.02 | 3.26 | 4.86 |
| AMF3 | Bege rosa ou luz | hexagonal, LaF3 | 7.04 | - | 7,255 | 9.53 |
| AMF4 | Vermelho-alaranjado | Monoclinic | 12,53 | 10,51 | 8.20 | - |
| CMF3 | A partir de marrom para branco | Hexagonal | 4,041 | - | 7,179 | 9.7 |
| CMF4 | Amarelo | Monoclinic, UF4 | 12,51 | 10,51 | 8.20 | - |
| BKF3 | Amarelo verde | Trigonal, LaF3 Orthorhombic, YF3 | 6,97 6,7 | - 7,09 | 7.14 4.41 | 10.15 9.7 |
| BKF4 | - | Monoclinic, UF4 | 12,47 | 10,58 | 8.17 | - |
| CFF3 | - - | Trigonal, LaF3 Orthorhombic, YF3 | 6. 94 6.65 | - 7.04 | 7.10 4.39 | - |
| CFF4 | - - | Monoclinic, UF4 Monoclinic, UF4 | 1.242 1.233 | 1.047 1.040 | 8,126 8,113 | - |
Actinides reagem facilmente com halogênios formar sais com as fórmulas MX 3 e MX 4 (X = halogéneo ). Assim, o primeiro composto berquélio, BkCl 3 , foi sintetizada em 1962, com um montante de 3 nanogramas. Tal como os halogéneos de elementos das terras raras, actinídeos cloretos, brometos, e iodetos são solúveis em água, e fluoretos são insolúveis. Urânio facilmente produz um hexafluoreto incolor, que sublima a uma temperatura de 56,5 ° C; devido à sua volatilidade, que é usado na separação de isótopos de urânio com centrifugação a gás ou a difusão gasosa. Hexafluorides actinídeos têm propriedades perto de anidridos. Eles são muito sensíveis à umidade e hidrolisar formando año 2 F 2 . O pentacloreto de hexacloreto de urânio e preto foram sintetizados, mas eles são ambos instável.
Acção de ácidos sobre os actinídeos produz sais, e se os ácidos são não-oxidante, em seguida, o actinídeo em que o sal é, em estado de baixa valência:
- L + 2 H2SO4→ L (SO4)2+ 2 H2
- Pu + 2 6 2 HCl → PUCL3+ 3H2
No entanto, nestas reacções de regeneração do hidrogénio pode reagir com o metal, formando o hidreto correspondente. O urânio reage com ácidos e água muito mais facilmente do que o tório.
Sais de actinídeos também podem ser obtidos por dissolução dos ácidos em hidróxidos correspondentes. Nitratos, cloretos, sulfatos e os percloratos de actinídeos são solúveis em água. Quando da cristalização a partir de soluções aquosas, estes sais formadores de hidratos, tais como Th (NO 3 ) 4 · 6H 2 O, Th (SO 4 ) 2 · 9H 2 O e Pu 2 (SO 4 ) 3 · 7H 2 O. Os sais dos actinídeos de alta valência hidrolisar facilmente. Então, sulfato incolor, cloreto, nitrato e perclorato de tório transformar em sais básicos com fórmulas Th (OH) 2 SO 4 e Th (OH) 3 NO 3 . A solubilidade e insolubilidade do trivalentes e tetravalentes actinides é semelhante ao de sais de lantanídeos. Então, fosfatos, fluoretos, oxalatos, iodatos e carbonatos de actinídeos são fracamente solúvel em água; eles precipitam como hidratos, tais como THF 4 · 3H 2 O e Th (CRO 4 ) 2 · 3H 2 O.
Actinídeos com estado de oxidação 6, exceto para o año 2 2+ -tipo cátions, forma [ANO 4 ] 2- , [An 2 S 7 ] 2- e outros ânions complexos. Por exemplo sais, urânio, neptúnio e plutónio formulário do Na 2 UO 4 (uranate) e (NH 4 ) 2 U 2 O 7 (diuranato) tipos. Em comparação com lantanídeos, actinídeos mais facilmente formar compostos de coordenação, e esta capacidade aumenta com a valência actinide. Actinídeos trivalentes não formam compostos de coordenação de flúor, enquanto formas de tório tetravalentes K 2 THF 6 , KThF 5 , e até mesmo K 5 THF 9 complexos. Tório também forma os correspondentes sulfatos (por exemplo Na 2 SO 4 · Th (SO 4 ) 2 · 5H 2 O), nitratos e tiocianatos. Os sais com a fórmula geral Um 2 Th (NO 3 ) 6 · N H 2 O são de natureza coordenação, com o número de coordenação de tório igual a 12. Ainda mais fácil é a produção de sais de complexos de pentavalentes e hexavalentes actinídeos. Os compostos de coordenação mais estáveis de actinídeos tetravalentes - tório e urânio - são obtidos em reacções com dicetonas, por exemplo, acetilacetona.
Aplicações
Enquanto actinides ter algumas aplicações na vida diária estabelecidos, tais como detectores de fumaça (em amerício) e camisas de (tório), eles são utilizados principalmente em armas nucleares e usar como combustível em reatores nucleares. As duas últimas áreas explorar a propriedade dos actinídeos para liberar uma enorme energia em reações nucleares, que sob certas condições podem tornar-se auto-sustentável reação em cadeia.
O isótopo mais importante para a energia nuclear aplicações é o urânio-235. É usado no reactor térmico, e a sua concentração em urânio natural não exceda 0,72%. Este isótopo absorve fortemente nêutrons térmicos liberando muita energia. Um ato de fissão 1 grama de 235 U converte em cerca de 1 MW · dia. De importância, é que 235 U emite mais nêutrons do que absorve; ao atingir a massa crítica, 235 U entra em uma reação em cadeia auto-sustentável. Tipicamente, o núcleo de urânio é dividido em dois fragmentos com a libertação de 2-3 neutrões, como por exemplo:
Outros prometem isótopos de actinídeos para a energia nuclear sãotório-232 e seu produto a partir dociclo do combustível de tório,urânio-233.
| Reator nuclear |
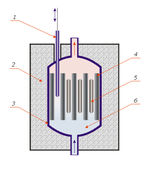
| O núcleo de qualquer reactor nuclear contém um conjunto de hastes de metal oco, geralmente feito dezircônioligas, cheio de células de combustível nuclear - principalmente óxido, carboneto, nitreto ou monossulfureto de urânio, plutónio ou tório, ou a sua mistura (o chamado Combustível MOX). O combustível mais comum é o óxido de urânio-235. Nêutrons rápidos são retardados por moderadores, que contêm água,carbono, deutério, ouberílio, como neutrões térmicos para aumentar a eficácia da sua interacção com urânio-235. A taxa de reacção nuclear é controlada através da introdução de hastes adicionais feitas de boro ou cádmio ou um absorvente de líquido, geralmente ácido bórico. Reactores para produção de plutônio são chamados reactor criador ou criadores; eles têm um design diferente e usar nêutrons rápidos. |
Emissão de nêutrons durante a fissão do urânio é importante não só para manter a reação em cadeia nuclear, mas também para a síntese dos actinídeos mais pesados. O urânio-239 converte via β-decadência em plutônio-239, que, como o urânio-235, é capaz de fissão espontânea. Primeiros reatores nucleares do mundo foram construídas não para a energia, mas para a produção de plutónio-239 para armas nucleares.
Cerca de metade do tório produzido é utilizado como o material de emissão de luz de mantos de gás. Tório também é adicionado em multicomponentes de ligas de magnésio e de zinco . Assim, as ligas de Mg-Th são leves e resistentes, mas também tem ponto de fusão elevado e ductilidade e, portanto, são largamente utilizados na indústria da aviação e na produção de mísseis. Tório também tem boas propriedades de emissão de electrões, com longa vida útil e baixo potencial barreira para a emissão. O teor relativo de tório e urânio isótopos é amplamente utilizado para estimar a idade de vários objetos, incluindo estrelas (ver datação radiométrica).
A principal aplicação de plutónio foi em armas nucleares , em que o isótopo plutónio-239 era um componente-chave devido a sua facilidade de fissão e disponibilidade. O desenho baseado em plutônio permitem reduzir a massa crítica para cerca de um terço do que para o urânio-235. O " Fat Man "bombas de plutônio -tipo produzidos durante o Projeto Manhattan usou a compactação explosiva de plutônio para obter densidades significativamente mais elevados do que o normal, combinado com um nêutron centro source para iniciar a reação e aumentar a eficiência. Assim, era necessário apenas 6,2 kg de plutônio para um rendimento explosivo equivalente a 20 quilotons de TNT. (Veja também projeto arma nuclear.) Hipoteticamente, tão pouco quanto 4 kg de plutônio e talvez até menos poderia ser usado para fazer uma única bomba atômica usando projetos de montagens muito sofisticados.
Plutônio-238 é potencialmente isótopo mais eficiente para reatores nucleares, já que tem massa crítica menor do que o urânio-235, mas libera muito mais energia térmica (0,56 W / g). No entanto, a sua aplicação é limitada pelo preço elevado (cerca de 1000 US / g). Este isótopo tem sido utilizado em termopilhas e água de destilação sistemas de alguns satélites e estações espaciais. Assim Galileo e Apollo naves espaciais (por exemplo, Apollo 14) tinha aquecedores alimentados por quantidades kg de plutônio-238 óxido; esse calor também é transformada em eletricidade com termopilhas. O decaimento do plutónio-238 é produzido partículas alfa relativamente inofensivos e não é acompanhado por irradiação gama. Por conseguinte, e este isótopo (~ 160 mg) é utilizado como fonte de energia em estimuladores cardíacos quando dura cerca de 5 vezes mais do que as baterias convencionais.
Actínio-227 é utilizado como uma fonte de neutrões. A sua energia específica elevada (14,5 W / g) e a possibilidade de obtenção de quantidades significativas de compostos termicamente estáveis são atraentes para utilização em longa duração geradores termoeléctricos para uso remoto. 228 Ac é utilizado como um indicador de radioactividade na pesquisa química, uma vez que emite elétrons de alta energia (2,18 MeV) que podem ser facilmente detectados. 228 Ac- 228 misturas Ra são amplamente utilizados como uma intensa gama-fonte na indústria e na medicina.
Desenvolvimento de materiais dopados com actinídeos auto-brilhante com matrizes cristalinas duráveis é uma nova área de utilização actinide como a adição de radionuclídeos emissores alfa para alguns vidros e cristais podem conferir luminescência.
Toxicidade
Substâncias radioativas podem prejudicar a saúde humana através de (i) a contaminação da pele local, (ii) exposição interna devido à ingestão de isótopos radioativos, e (iii) a superexposição externo por β-atividade e γ-radiação. Juntamente com rádio e transuranium elementos, actinium é um dos venenos mais perigosos radioativos com alto específica α-atividade. A característica mais importante do actínio é a sua capacidade para acumular e permanecer na camada superficial de esqueletos. Na fase inicial de envenenamento, actínio acumula no fígado. Outro perigo de actínio é que ele sofre decaimento radioactivo mais rapidamente do que ser excretado. A adsorção a partir do tracto digestivo é muito menor (~ 0,05%) para que o rádio actínio.
Protactínio no corpo tende a acumular-se nos rins e ossos. A dose máxima de segurança de Protactínio no corpo humano é de 0,03 uCi que corresponde a 0,5 microgramas de 231 Pa. Este isótopo, o qual pode estar presente no ar, como aerossol, é de 2,5 × 10 8 vezes mais tóxico do que o ácido cianídrico .
O plutónio, ao entrar no corpo através do ar, alimentos ou sangue (por exemplo, uma ferida), principalmente se instala nos pulmões, fígado e ossos, com apenas cerca de 10% indo para outros órgãos, e permanece lá por décadas. O longo tempo de residência de plutónio no corpo é parcialmente explicada pela sua baixa solubilidade em água. Alguns isótopos de plutónio emitem radiações ionizantes α-, que danifica as células vizinhas. O mediana da dose letal (LD 50 ) por 30 dias em cães após uma injecção intravenosa de plutónio é de 0,32 miligrama por quilograma de massa corporal e, portanto, a dose letal para os seres humanos é de aproximadamente 22 mg para uma pessoa de 70 kg; a quantidade de exposição respiratória deve ser de aproximadamente quatro vezes maior. Outra estimativa assume que o plutónio é 50 vezes menos tóxico do que o rádio , e, portanto, o conteúdo admissível de plutónio no corpo deve ser de 5 g ou 0,3 uCi. Tal montante é quase invisível no microscópio sob. Depois de ensaios em animais, esta dose máxima permitida foi reduzida para 0,65 mg ou 0,04 uCi. Estudos com animais revelaram também que a via de exposição plutónio mais perigoso é através de inalação, após o que 5-25% de substâncias inaladas é retida no corpo. Dependendo do tamanho de partícula e da solubilidade dos compostos de plutónio, plutónio é localizada ou nos pulmões ou no sistema linfático, ou é absorvido no sangue e, em seguida, transportados para o fígado e os ossos. Contaminação através dos alimentos é a maneira menos provável. Neste caso, apenas cerca de 0,05% a 0,01% de compostos insolúveis de plutónio absorve solúveis em sangue, e o resto é excretado. A exposição da pele danificada de plutónio iria reter cerca de 100% do mesmo.
Usando actinides em combustível nuclear, fontes radioactivas seladas ou materiais avançados, como cristais de auto-incandescente tem muitos benefícios potenciais. No entanto, uma grande preocupação é a extremamente elevada toxicidade dos actinídeos e sua migração no ambiente. Uso de formas quimicamente instáveis da actinides em MOX e fontes radioactivas seladas não é apropriado para os padrões de segurança modernos. Há um desafio para desenvolver materiais estáveis e duráveis portadores de actinídeos, que fornecem armazenamento seguro, utilização e eliminação final. A necessidade fundamental é a aplicação de soluções sólidas de actinídeos em fases de acolhimento cristalino duráveis.


![\ Mathrm {{} ^ {238} _ {92} U + {} ^ {1} _ {0} n \ \ xrightarrow \ \ {} ^ {239} _ {92} L \ \ xrightarrow [23.5 \ min] {\ beta ^ -} \ {} ^ {239} _ {93} Np \ \ xrightarrow [2,3 \ dias] {\ beta ^ -} \ {} ^ {239} _ {94} Pu \ \ xrightarrow [2.4 \ cdot 10 ^ 4 \ anos] {\ alpha}}](../../images/1195/119579.png)