
Amerício
Sobre este escolas selecção Wikipedia
Esta seleção é feita para as escolas de caridade infantil leia mais . Patrocinar uma criança para fazer uma diferença real.
| Amerício | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
95 Am | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Aparência | |||||||||||||||||||||||||||||||||||||
branco prateado  | |||||||||||||||||||||||||||||||||||||
| Propriedades gerais | |||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | amerício, Am, 95 | ||||||||||||||||||||||||||||||||||||
| Pronúncia | / ˌ æ m ə r ɪ s Eu ə m / AM -ə- RIS -ee-əm | ||||||||||||||||||||||||||||||||||||
| Categoria Metallic | actinide | ||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | n / D, 7, f | ||||||||||||||||||||||||||||||||||||
| Peso atômico padrão | (243) | ||||||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Rn ] 5f 7 7s 2 2, 8, 18, 32, 25, 8, 2 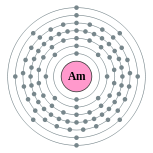 | ||||||||||||||||||||||||||||||||||||
| História | |||||||||||||||||||||||||||||||||||||
| Descoberta | Glenn T. Seaborg, Ralph A. James, Leon O. Morgan, Albert Ghiorso (1944) | ||||||||||||||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||||||||||
| Densidade (perto RT) | 12 g cm -3 · | ||||||||||||||||||||||||||||||||||||
| Ponto de fusão | 1449 K , 1176 ° C, 2149 ° F | ||||||||||||||||||||||||||||||||||||
| Ponto de ebulição | 2880 K, 2607 ° C, 4725 ° F | ||||||||||||||||||||||||||||||||||||
| Calor de fusão | 14.39 kJ mol -1 · | ||||||||||||||||||||||||||||||||||||
| Capacidade calorífica molar | 62,7 J · · mol -1 K -1 | ||||||||||||||||||||||||||||||||||||
| Pressão de vapor | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Propriedades atômicas | |||||||||||||||||||||||||||||||||||||
| Estados de oxidação | 7, 6, 5, 4, 3, 2 ( óxido anfotérico) | ||||||||||||||||||||||||||||||||||||
| Eletronegatividade | 1,3 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||
| Energias de ionização | 1º: 578 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||
| Raio atômico | 173 pm | ||||||||||||||||||||||||||||||||||||
| O raio de covalência | 180 ± 18:00 | ||||||||||||||||||||||||||||||||||||
| Miscelânea | |||||||||||||||||||||||||||||||||||||
| A estrutura de cristal | hexagonal  | ||||||||||||||||||||||||||||||||||||
| Ordenamento magnético | paramagnético | ||||||||||||||||||||||||||||||||||||
| Resistividade elétrica | 0,69 μΩ · m | ||||||||||||||||||||||||||||||||||||
| Condutividade térmica | 10 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||
| Número de registo CAS | 7440-35-9 | ||||||||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | |||||||||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de amerício | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
Amerício (pron .: / ˌ æ m ə r ɪ s Eu ə m / AM -ə- RIS -ee-əm) é uma transuranic radioativo elemento químico que tem o símbolo Am e número atômico 95. Este transurânico elemento do actinídeos série está localizado na tabela periódica abaixo do lantanídeo elemento európio , e assim por analogia recebeu o nome de outro continente, América.
Amerício foi produzido pela primeira vez em 1944 pelo grupo de Glenn T. Seaborg no Universidade da Califórnia, Berkeley. Embora seja o terceiro elemento da série transurânico, descobriu-se em quarto lugar, após o mais pesado cúrio . A descoberta foi mantida em segredo e só lançado ao público em novembro de 1945. A maioria amerício é produzido bombardeando urânio ou plutónio com neutrões em reactores nucleares - uma tonelada de gasto combustível nuclear contém cerca de 100 gramas de amerício. É amplamente utilizada em comercial câmara de ionização detectores de fumo, bem como na fontes de neutrões e medidores industriais. Várias aplicações incomuns, como uma bateria nuclear ou combustível para naves espaciais com propulsão nuclear, têm sido propostos para o isótopo Am 242m, mas eles são ainda como dificultado pela escassez e alta de preços deste isómero nuclear.
Amerício é relativamente suave metal radioactivo com aparência prateada. Seus isótopos mais comuns são 241 e 243 Am Am. Em compostos químicos, eles geralmente assumir o estado de oxidação +3, especialmente em soluções. Vários outros estados de oxidação são conhecidos, os quais variam 2-7 e podem ser identificados pela sua característica Os espectros de absorção óptica. A estrutura de cristal do sólido amerício e seus compostos contém defeitos intrínsecos, que são induzida por auto-irradiação com partículas alfa e acumulam-se com o tempo; isto resulta num desvio de algumas propriedades dos materiais.
História

Embora amerício foi provavelmente produzida em experimentos nucleares anteriores, foi primeiro intencionalmente sintetizadas, isoladas e identificadas no final do outono de 1944, no University of California, Berkeley por Glenn T. Seaborg, Leon O. Morgan, Ralph A. James, e Albert Ghiorso. Eles usaram uma de 60 polegadas ciclotron na Universidade da Califórnia, em Berkeley. O elemento foi identificado quimicamente no Laboratório Metalúrgico (agora Argonne National Laboratory) do Universidade de Chicago. Seguindo o isqueiro neptunium , plutónio , e mais pesado cúrio , amerício era o quarto elemento transurânico para ser descoberto. Na época, a tabela periódica foi reestruturado por Seaborg para seu layout atual, contendo a linha actinide abaixo do lanthanide um. Isso levou a amerício estar localizado bem abaixo do seu gêmeo európio elemento lantanídeos; foi assim, por analogia, o nome de outro continente, América: "O amerício nome (após Américas) e o símbolo Am são sugeridos para o elemento a partir da sua posição como o sexto membro do actinídeos série terras-raras, análogo ao európio, Eu, da série dos lantanídeos."
O novo elemento foi isolado a partir do seu em óxidos, um processo multi-passo complexo. Primeiro plutónio -239 solução de nitrato de (puno 3 239) foi revestido sobre uma platina de folha de cerca de 0,5 cm2 de área, a solução foi evaporada e o resíduo foi convertido em dióxido de plutónio (Può 2) por recozimento. Após a irradiação de ciclotrão, o revestimento foi dissolvido com ácido nítrico , e, em seguida, precipitada como o hidróxido usando uma solução aquosa concentrada solução de amoníaco. O resíduo foi dissolvido em ácido perclórico. Além disso a separação foi realizada por de permuta iónica, obtendo-se um certo isótopo de cúrio. A separação de cúrio e amerício era tão meticuloso que esses elementos foram inicialmente chamados pelo grupo de Berkeley como pandemônio (do grego para todos os demônios ou inferno) e delirium (do latim para a loucura).
As experiências iniciais rendeu quatro isótopos americium: 241 Am, 242 Am, 239 e 238 Am Am. Amerício-241 foi diretamente obtida a partir de plutónio sobre a absorção de um nêutron. Ele decai por emissão de um α-partícula de 237 Np; a semi-vida deste decaimento foi determinada pela primeira vez como 510 ± 20 anos, mas, em seguida, corrigidas para 432,2 anos.
- Os horários são meias-vidas
O segundo isótopo 242 Am foi produzido após bombardeamento de neutrões do já criado 241 Am. Após a rápida β-cárie, 242 Am converte para o isótopo de cúrio 242 cm (que já tinha sido descoberto). A semi-vida deste decaimento foi inicialmente determinada às 17 horas, o que era próxima do valor presentemente aceite de 16,02 h.
A descoberta de amerício e cúrio em 1944 foi intimamente relacionado com o Projeto Manhattan; os resultados eram confidenciais e desclassificados apenas em 1945. Seaborg vazou a síntese dos elementos 95 e 96 sobre o programa de rádio dos Estados Unidos para as crianças, os Questionário Kids, cinco dias antes da apresentação oficial em um American Chemical Society reunião em 11 de Novembro de 1945, quando um dos ouvintes perguntou se algum novo elemento transurânico ao lado de plutónio e neptunium tinha sido descoberto durante a guerra. Após a descoberta de amerício Am isótopos 241 e 242 Am, a sua produção e compostos foram patenteados listando apenas Seaborg como o inventor. As amostras de amerício iniciais pesava alguns microgramas; eles eram pouco visíveis e foram identificados pela sua radioatividade. As primeiras quantidades substanciais de amerício metálico pesando 40-200 microgramas não foram preparados até 1951 pela redução da amerício (III) com fluoreto de bário metálico em alto vácuo a 1100 ° C.
Ocorrência

Os isótopos de vida mais longa e mais comuns de amerício, 241 e 243 Am Am, tem meia-vida de 432,2 e 7.370 anos, respectivamente. Portanto, tudo amerício primordial (amerício que estava presente na Terra durante sua formação) deve ter se deteriorado por agora.
Amerício existente está concentrado nas áreas utilizadas para a atmosfera testes nucleares realizados entre 1945 e 1980, bem como nos locais de acidentes nucleares, como o desastre de Chernobyl . Por exemplo, a análise dos detritos no local de teste do primeiro US bomba de hidrogênio, Ivy Mike, (01 de novembro de 1952, Enewetak), revelaram concentrações elevadas de vários actinides incluindo amerício; devido ao segredo militar, esse resultado só foi publicado em 1956. Trinitite, o resíduo vítreo deixou no chão do deserto perto Alamogordo, Novo México, após o plutônio baseados em Trinity teste de bomba nuclear em 16 de Julho de 1945, contém traços de amerício-241. Os níveis elevados de amerício também foram detectados no local do acidente de um US bombardeiro B-52, que levava quatro bombas de hidrogênio, em 1968, em Greenland .
Em outras regiões, a radioactividade média de solo de superfície devido à amerício residual é apenas cerca de 0,01 picocuries / g (0,37 MBq / g). Compostos amerício atmosféricas são pouco solúveis em solventes comuns e principalmente aderir às partículas do solo. A análise do solo revelou cerca de 1.900 concentração mais elevada de amerício para dentro do que as partículas do solo de areia na água presente nos poros do solo; uma proporção ainda maior foi medida em solos argilosos.
Amerício é produzido artificialmente principalmente em pequenas quantidades, para fins de pesquisa. Uma tonelada de combustível nuclear irradiado contém cerca de 100 gramas de vários isótopos amerício, principalmente Am 241 e 243 Am. Sua radioatividade prolongada é indesejável para a eliminação, e, portanto, amerício, juntamente com outros actinídeos de longa duração, têm de ser neutralizados. O procedimento associado podem envolver vários passos, onde amerício é separado antes e, em seguida, convertidos por bombardeamento de neutrões em reactores especiais para nuclídeos de vida curta. Este procedimento é bem conhecido como transmutação, mas ainda está sendo desenvolvido para o amerício.
Alguns átomos de amerício podem ser produzidos por reações captura de neutrões e decaimento beta em muito altamente concentrados de urânio depósitos -bearing.
Síntese e extracção
Nucleosyntheses de isótopos
Amerício foi produzido em pequenas quantidades na reatores nucleares ao longo de décadas, e quilos de seus 241 AM e 243 Am isótopos foram acumulados até agora. No entanto, desde que foi oferecida pela primeira vez à venda em 1962, o seu preço, cerca de 1.500 USD por grama de 241 Am, permanece praticamente inalterado, devido ao processo de separação muito complexo. Quanto mais pesado isótopo 243 Am é produzido em quantidades muito menores; é, assim, mais difícil de separar, o que resulta num custo mais elevado da ordem de USD 100-160 / mg.
Amerício não é sintetizado diretamente do urânio - material reator mais comum -, mas a partir do isótopo de plutônio 239 Pu. Este último tem de ser produzido em primeiro lugar, de acordo com o seguinte processo nuclear:
A captura de dois neutrões por Pu 239 (a chamada n, γ) reacção de (), seguido por um decaimento β-, resulta em 241 Am:
O plutônio presente no combustível nuclear irradiado contém cerca de 12% dos 241 Pu. Porque converte-se espontaneamente para 241 Am, Pu 241 pode ser extraída e pode ser usado para gerar mais 241 Am. No entanto, este processo é bastante lento: metade da quantidade original de 241 Pu decai para 241 Am após cerca de 15 anos, eo montante 241 Am atinge um máximo após 70 anos.
A Am 241 obtido pode ser usado para gerar mais pesados isótopos mais amerício por captura de neutrões no interior de um reactor nuclear. Em um reactor de água leve (LWR), 79% dos 241 Am converte a 242 Am e de 10% a sua 242m isômero nuclear Am:
- 79%:
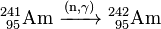
- 10%:
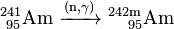
Amerício-242 tem uma meia-vida de apenas 16 horas, o que torna seu posterior up-conversion a 243 Am, extremamente ineficiente. O último isótopo é produzida em vez de um processo onde Pu 239 capta quatro neutrões sob alto nêutrons fluxo:
Geração de metal
A maioria das rotinas de síntese de produzir uma mistura de diferentes isótopos de actinídeos, em formas de óxido, a partir dos quais isótopos de amerício precisam de ser separados. Num procedimento típico, o reactor de combustível gasto (por exemplo, MOX) é dissolvido em ácido nítrico , e a maior parte de urânio e plutónio é removido utilizando um Extração PUREX-type (P lutonium - UR anium EX tração) com o fosfato de tributilo num hidrocarboneto. Os lantanídeos e actinídeos remanescentes são em seguida separados a partir do resíduo aquoso ( refinado) por um à base de diamida de extracção, para dar, após a remoção, uma mistura de actinídeos e lantanídeos trivalentes. Amerício compostos são, em seguida, extraiu-se selectivamente utilizando várias etapas cromatográficas e técnicas de centrifugação com um reagente apropriado. Uma grande quantidade de trabalho tem sido feito na extracção por solvente do amerício. Por exemplo, uma recente UE projeto financiado codinome "EUROPART" estudado triazinas e outros compostos como agentes de extracção potenciais. Bis complexo -triazinyl bipiridina foi recentemente proposto como tal reagente como altamente seletivo para amerício (e cúrio). Separação de amerício do cúrio altamente semelhante pode ser conseguida por tratamento de uma lama de hidróxidos em solução aquosa seus bicarbonato de sódio, com ozono , a temperaturas elevadas. Ambos Am e Cm são principalmente presentes em soluções no estado de valência 3; Considerando cúrio permanece inalterada, amerício oxida a solúvel Am (iv) os complexos que podem ser lavados.
Amerício metálico é obtido pela redução de seus compostos. Amerício (III), fluoreto foi usado pela primeira vez para este propósito. A reacção foi conduzida usando elementar de bário como agente redutor em um ambiente de água e isento de oxigénio no interior de um aparelho feito de tântalo e tungsténio .
Uma alternativa é a redução de dióxido de amerício por metálico lantânio ou tório :
Propriedades físicas
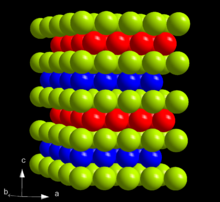
Na tabela periódica , amerício está localizado para a direita do plutónio, à esquerda de cúrio, e abaixo do lantanídeo európio , com o qual partilha muitas similaridades nas propriedades físicas e químicas. Amerício é um elemento altamente radioactivos. Quando preparado de fresco, que tem um brilho metálico-prateado branco, mas, em seguida, mancha lentamente no ar. Com uma densidade de 12 g / cm3, é mais leve que o amerício tanto cúrio (13,52 g / cm 3) e o plutónio (19,8 g / cm 3); mas é mais pesado do que o európio (5,264 g / cm 3) -principalmente por causa da sua maior massa atómica. Amerício é relativamente macio e facilmente deformável e tem uma significativamente menor módulo de volume do que os actinides antes dele: Th, PA, U, Np e Pu. O seu ponto de fusão de 1173 ° C é significativamente maior do que a de plutónio (639 ° C) e európio (826 ° C), mas inferior à cúrio (1340 ° C).
Em condições ambientes, amerício se encontra presente na sua forma α mais estável que tem uma simetria cristalina hexagonal, e um grupo espacial P6 3 / MMC com parâmetros de rede a = 346,8 pm e c = 1.124 pm, e quatro átomos por célula unitária. O cristal é constituído por um duplo hexagonal perto a embalagem com a sequência camada ABAC e por isso é isotípico com α-lantânio e vários actinides como α-cúrio. A estrutura cristalina do amerício muda com a temperatura e pressão. Quando comprimido, à temperatura ambiente a 5 GPa, α-Am transforma para a modificação β, que tem um de face centrada cúbico (FCC) simetria, grupo espacial Fm 3 m e treliça constante a = 489 pm. Esta estrutura de FCC é equivalente à embalagem mais próximo com a sequência ABC. Após a compressão adicional de 23 GPa, amerício transforma a um estrutura ortorrômbica γ-Am semelhante ao da α-urânio. Não existem quaisquer transições observadas até 52 GPa, excepto para uma aparência de uma fase monoclínica a pressões entre 10 e 15 GPa. Não há consistência sobre o estado desta fase na literatura, o que algumas vezes também lista as fases α, β e γ como I, II e III. A transição β-γ é acompanhada por uma diminuição de 6% em volume de cristal; Embora a teoria prevê também uma alteração de volume significativo para a transição α-β, não é observado experimentalmente. A pressão da transição α-β diminui com o aumento da temperatura, e quando α-amerício é aquecido à pressão ambiente, a 770 ° C muda para uma fase FCC que é diferente do β-Am, e a 1075 ° C, converte-se a um corpo-estrutura cúbica centrada. O diagrama de fases de pressão-temperatura de amerício é, portanto, bastante semelhantes às de lantânio, praseodímio e neodímio .
Tal como acontece com muitos outros actinídeos, auto-dano da rede cristalina devido a irradiação de partículas alfa é intrínseca ao amerício. É especialmente notável a baixas temperaturas, em que a mobilidade do produzido defeitos de rede é relativamente baixo, através de um alargamento da Picos de difracção de raios-X. Este efeito torna bastante incerto a temperatura de amerício e algumas das suas propriedades, tais como eléctricos resistividade. Assim, para amerício-241, a resistividade de 4,2 K aumenta com o tempo de cerca de 2 μOhm · cm a 10 cm μOhm · após 40 horas, e satura em cerca de 16 μOhm · cm depois de 140 horas. Este efeito é menos pronunciado à temperatura ambiente, devido a aniquilação de defeitos de radiação; também aquecer até à temperatura ambiente a amostra que foi mantida durante horas a baixas temperaturas restaura a sua resistividade. Em amostras frescas, a resistividade gradualmente aumenta com a temperatura a partir de cerca de 2 cm em μOhm · hélio líquido a 69 μOhm · cm à temperatura ambiente; Este comportamento é semelhante ao do Neptúnio, urânio e tório e Protactínio , mas é diferente de plutónio e cúrio, que mostram uma rápida subida até 60 K, seguido por saturação. O valor da temperatura ambiente durante amerício é menor do que a de Neptúnio, plutónio e cúrio, mas mais elevado do que para o urânio e tório e Protactínio.
Amerício é paramagnética em uma ampla gama de temperaturas, a partir de que hélio líquido, à temperatura ambiente, e acima. Esse comportamento é muito diferente da de seu vizinho curium que apresentam transição antiferromagnética a 52 K. A coeficiente de expansão térmica do amerício é ligeiramente anisotrópica e eleva-se a (7,5 ± 0,2) x 10 -6 / ° C ao longo do mais curto e um eixo (6,2 ± 0,4) x 10 -6 / ° C para o eixo hexagonal mais c. O entalpia de dissolução do amerício do metal em ácido clorídrico , em condições normalizadas é -620,6 ± 1,3 kJ / mol, a partir do qual o mudança padrão entalpia de formação (Δ f H °) de íon Am aquosa 3+ é -621,2 ± 2,0 kJ / mol -1. O Am potencial padrão 3+ / Am 0 é 2,08 ± 0,01 V.
Propriedades químicas
Amerício prontamente reage com o oxigênio e se dissolve bem em ácidos . O mais comum estado de oxidação para americium é 3, em que os compostos amerício são bastante estável contra oxidação e redução. Neste sentido, amerício é quimicamente semelhante à maioria dos lantanídeos. As formas trivalente amerício insolúveis flúor, oxalato, iodato, hidróxido , fosfato e outros sais. Outros estados de oxidação ter sido observada entre 2 e 7, que é o mais amplo intervalo entre os elementos actinídeos. Sua cor em soluções aquosas varia da seguinte forma: Am 3+ (incolor ao amarelo-avermelhado), Am 4+ (amarelo-avermelhado), Am V O +
2; (Amarelo), Am VI O 2+
2 (marrom) e Am VII O 5-
6 (verde escuro). Todos os estados de oxidação têm os seus espectros de absorção óptica característicos, com alguns picos agudos nas regiões do visível e no infravermelho médio, bem como a posição e a intensidade destes picos pode ser convertido nas concentrações dos correspondentes estados de oxidação. Por exemplo, Am (III) tem dois picos agudos em 504 e 811 nm, Am (V) a 514 e 715 nm, e Am (VI) em 666 e 992 nm.
Compostos amerício com estado de oxidação +4 e superior são agentes oxidantes fortes, comparável em força para o íon permanganato (MnO -
4) em soluções ácidas. Considerando que os íons Am 4+ são instáveis em soluções e facilmente converter para sou 3+, o estado de oxidação +4 ocorre bem em sólidos, tais como dióxido de amerício (AmO 2) e amerício (IV) de fluoreto (AMF 4).
Todos os pentavalentes e hexavalentes compostos amerício são sais complexos, como Kamo 2 F 2, Li 3 AmO 4 e 6 Li AmO 6, Ba 3 AmO 6, AmO 2 F 2. Estes estados de oxidação, Am elevada (IV), Am (V) e Am (VI) pode ser preparado a partir de Am (III) por oxidação com persulfato de amónio em ácido nítrico diluído, com prata (I) em óxido de ácido perclórico, ou com ozono ou persulfato de sódio em soluções de carbonato de sódio. O estado de oxidação pentavalente de amerício foi observada pela primeira vez em 1951. Ela está presente na solução aquosa sob a forma de AmO +
2 íons (ácido) ou AmO -
3 íons (alcalino), que são, contudo, instável e sujeita a vários rápida reacções desproporcionação:
Os compostos químicos
Compostos oxigenados
Dois óxidos amerício são conhecidos, com os estados de oxidação 3 (AM 2 O 3) e 4 (AmO 2). Amerício óxido (III) é um sólido vermelho-marrom com um ponto de fusão 2205 ° C. Amerício (IV) é a principal forma de amerício sólido que é utilizado em quase todas as suas aplicações. Como a maioria dos outros dióxidos de actinídeos, é um sólido negro com um cúbico ( fluorite) estrutura de cristal.
O oxalato de amerício (III), secou-se sob vácuo à temperatura ambiente, tem a fórmula química Am 2 (C 2 O 4) 3 · 7H 2 O. Após aquecimento em vácuo, ela perde água a 240 ° C e começa a decompor em AmO 2 a 300 ° C, a decomposição completa a cerca de 470 ° C. O oxalato inicial dissolve-se em ácido nítrico com a solubilidade máxima de 0,25 g / L.
Halides
Halogenetos de amerício são conhecidos para os estados de oxidação de +2, +3 e +4, em que a 3 é mais estável, especialmente em soluções.
| Estado de oxidação | F | Cl | Br | EU |
|---|---|---|---|---|
| 4 | Amerício (IV) de fluoreto AMF 4 rosa pálido | |||
| +3 | Amerício (III), fluoreto AMF 3 rosa | Amerício (III) cloreto de AMCL 3 rosa | Amerício (III) brometo Ambr 3 luz amarela | Amerício (III), iodeto de Ami-3 luz amarela |
| 2 | Amerício (II) cloreto de AMCL 2 preto | Amerício (II) brometo Ambr 2 preto | Amerício (II) de iodeto de AmI 2 preto |
Redução de Am (III) com os compostos de sódio amálgama produz Am sais (II) - os halogenetos preto AMCL 2, Ambr 2 e Ami 2. Eles são muito sensíveis ao oxigénio e oxidar em água, libertando hidrogénio e conversão de volta para o estado de Am (III). Constantes de rede específicos são:
- Ortorrômbica AMCL 2: a = 896,3 ± 0,8 horas, b = 757,3 ± 0,8 pm e c = 453,2 ± 12:06
- Tetragonal Ambr 2: A = 1159,2 ± 0,4 e C = 712.1 ± 12:03.
Eles também podem ser preparados por reacção de amerício metálico com um halogeneto de mercúrio apropriado HGX 2, em que X = Cl, Br ou I:
Amerício (III) flúor (AMF 3) é pouco solúvel e precipita por reacção de Am 3+ e íons fluoreto em soluções ácidas fracas:
O tetravalente amerício (IV) fluoreto (AMF 4) é obtido por reacção de amerício sólido (III) com fluoreto molecular flúor :
Outra forma conhecida de cloreto tetravalente amerício sólida é KAmF 5. Amerício tetravalente também foi observada na fase aquosa. Para este efeito, preto Am (OH) 4 foi dissolvido em 15- H NH F 3 com a concentração de amerício de 0,01 M. A solução avermelhada resultante tinha um espectro de absorção óptica característica que é semelhante ao do AMF 4 mas difere de outros estados de oxidação do amerício. O aquecimento da solução Am (IV) a 90 ° C não resultou na sua desproporcionação ou redução, no entanto, uma redução lenta foi observada em Am (III) e atribuído a auto-irradiação do amerício por partículas alfa.
Mais amerício (iii) halogenetos de formar cristais hexagonais com uma ligeira variação da cor e estrutura exacta entre os halogéneos. Então, cloreto de (AMCL 3) é avermelhada e tem uma estrutura de isotípico urânio (III) cloreto de (grupo espacial P6 3 / m) e o ponto de fusão de 715 ° C. O fluoreto é isotípico de LaF 3 (grupo espacial P6 3 / MMC) e o iodeto de 3 BII (espaço grupo R 3). O brometo é uma exceção com o orthorhombic pUBR 3 -tipo estrutura e espaço grupo Cmcm. Os cristais do hexa-hidratado (amerício AMCL 3 .6H 2 O) pode ser preparado por dissolução de dióxido de amerício em ácido clorídrico e evaporação do líquido. Esses cristais são higroscópico e tem cor amarelo-avermelhada e um estrutura cristalina monoclínica.
Oxi-halogenetos de amerício, sob a forma Am VI O 2 x 2, Am V O X 2, OX 2 Am Am IV e III OX pode ser obtido fazendo reagir o halogeneto correspondente amerício com oxigénio ou Sb 2 O 3, e AmOCl também pode ser produzido por fase de vapor hidrólise:
Chalcogenides e pnictides
O conhecido calcogenetos de amerício incluem o AmS sulfureto 2, selenetos AMSE 2 e 3 se Am 4, e Teluretos sou 2 Te 3 e AMTE 2. O pnictides de amerício (243 Am) do tipo AMX são conhecidos pela elementos fósforo , arsênio , antimônio e bismuto . Eles cristalizar no treliça de sal-gema.
Silicietos e boretos
Amerício monosilicide (AMSI) e "disilicieto" (nominalmente com AMSI x: 1,87 <x <2,0) foram obtidos por redução de amerício (III) com flúor elementar silício em vácuo a 1050 ° C (AMSI) e 1150-1200 ° C (AMSI x). AMSI é um sólido preto isomorfo com LASI, que tem uma simetria do cristal ortorrômbico. AMSI x tem um brilho prateado brilhante e uma estrutura de cristal tetragonal (grupo espacial I 4 1 / AMD), que é isomorfo com PUSI 2 e Thsi 2. Boretos de amerício incluem AmB 4 e 6 AmB. O tetraboride pode ser obtido por aquecimento de um óxido ou um halogeneto de amerício com diboreto de magnésio em vácuo ou em atmosfera inerte.
Compostos Organoamericium
Análogo ao uranocene, amerício forma um composto organometálico com dois ligantes cyclooctatétraène, que é (η 8 -C 8 H 8) 02:00. Ele também faz trigonal (η 5 -C 5 H 5) 3 complexos estou com três anéis de ciclopentadienilo.
Formação de complexos do tipo Am (NC 3 H 7 -BTP) 3, onde BTP representa 2,6-di (1,2,4-triazina-3-il) piridina, em soluções que contenham NC 3 H 7 - íons BTP e estou 3+ foi confirmada pela EXAFS. Alguns desses complexos do tipo BTP interagir selectivamente com amerício e, por conseguinte, são úteis na sua separação selectiva de lantanídeos e actinídeos outro.
Aspectos biológicos
Amerício é um elemento artificial, e, assim, uma função biológica que envolve o elemento, como todos os elementos mais pesados do que o tungsténio , seria impossível. Tem sido proposto o uso de bactérias para a remoção de amerício e outros metais pesados a partir de rios e correntes. Assim, Enterobacteriaceae do género Citrobacter precipitar iões de amerício de soluções aquosas, vinculando-os em um complexo de metal-fosfato em suas paredes celulares. Vários estudos têm sido relatados no biosorption e bioacumulação de amerício por bactérias e fungos.
Fissão
O isótopo Am 242m1 (meia-vida de 141 anos) tem as maiores seções transversais para a absorção de nêutrons térmicos (5,700 celeiros), que resulta em um pequeno massa crítica para uma sustentada reação nuclear em cadeia. A massa crítica para uma esfera 242m1 Am nua é de cerca de 9-14 kg (os resultados de incerteza de insuficiente conhecimento das suas propriedades materiais). Ele pode ser reduzido para 3-5 kg com um refletor de metal e deve se tornar ainda menor com um refletor de água. Essa massa crítica pequeno é favorável para portáteis armas nucleares , mas os baseados em 242m1 Am ainda não são conhecidos, provavelmente por causa de sua escassez e alta de preços. As massas críticas de dois outros isótopos prontamente disponíveis, 241 e 243 Am Am, são relativamente elevados - 57,6-75,6 kg para 241 Am e 209 kg para 243 Am. Escassez e alta de preços ainda um obstáculo à aplicação de amerício como um combustível nuclear em reatores nucleares.
Existem propostas de muito compactas de 10 kW reatores de alto fluxo, usando tão pouco como 20 gramas de 242m1 Am. Tais reatores de baixa potência seria relativamente seguro para usar como fontes de neutrões para terapia de radiação, em hospitais.
Isótopos
Cerca de 19 isótopos e 8 isómeros nucleares são conhecidos por amerício. Há dois emissores alfa de longa duração, 241 AM e 243 Am com meias-vidas de 432,2 e 7.370 anos, respectivamente, e a 242m1 isômero nuclear Am tem uma meia-vida longa de 141 anos. As meias-vidas de outros isótopos e isômeros variam de 0,64 microssegundos para 245m1 Am para 50,8 horas para 240 Am. Tal como acontece com a maioria dos outros actinides, os isótopos de americium com número ímpar de nêutrons tem taxa relativamente alta de fissão nuclear e baixa massa crítica.
Amerício-241 decai para 237 Np partículas emissores alfa de 5 energias diferentes, principalmente em 5,486 MeV (85,2%) e 5,443 MeV (12,8%). Porque muitos dos estados resultantes são metastable, eles também emitem raios gama com as energias discretos entre 26,3 e 158,5 keV.
Amerício-242 é um isótopo de curta duração com uma meia-vida de 16,02 h. É na maior parte (82,7%) converte por β-decadência a 242 cm, mas também por a captura eletrônica de 242 Pu (17,3%). Ambos 242 Cm e 242 Pu transformar via quase a mesma cadeia de decaimento através de Pu 238 até 234 U.
Quase todos (99,541%) de 242m1 Am decai por conversão interna de 242 Am e os restantes 0,459% em α-decadência para 238 Np. As últimas decompõe a 238 Pu e, em seguida, a 234 U.
Amerício-243 transformações por emissão-α em 239 Np, que converte por β-decadência a 239 Pu, e 239 Pu muda para 235 U através da emissão de uma partícula α.
Aplicações
Detectores de ionização
Amerício é o único elemento sintético ter encontrado seu caminho para o lar, onde um tipo comum de detector de fumaça usa 241 Am na forma de dióxido de amerício como sua fonte de radiação ionizante. Este isótopo é preferível contra 226 Ra porque emite cinco vezes mais partículas alfa e relativamente pouco de γ-radiação nociva. A quantidade de amerício em um novo detector de fumo típico é 1 microcurie (37 kBq) ou 0,28 microgramas. Este montante diminui lentamente como o amerício decai em neptunium -237, um elemento transuranic diferente com uma meia-vida muito mais longa (cerca de 2140 mil anos). Com uma meia-vida de 432,2 anos, o amerício em um detector de fumo inclui cerca de 3% Neptúnio após 19 anos, e cerca de 5% após 32 anos. A radiação passa através de um câmara de ionização, um espaço cheio de ar entre dois eletrodos, uma pequena e autorizações, constante corrente entre os eléctrodos. Tanto o fumo que entra na câmara absorve as partículas alfa, o que reduz a ionização e afecta esta corrente, disparar o alarme. Em comparação com o detector óptico de fumo alternativa, o detector de fumaça de ionização é mais barato e pode detectar partículas que são demasiado pequenas para produzir espalhamento de luz significativa; no entanto, é mais propenso a falsos alarmes.
Radionuclídeo
Como Am 241 tem uma meia-vida significativamente mais longa do que 238 Pu (432,2 ano vs. 87 anos), foi proposto como elemento ativo de geradores termoelétricos de radioisótopos, por exemplo, na nave espacial. Embora amerício produz menos calor e electricidade - o rendimento de potência é de 114,7 mW / g para 241 Am e 6.31 mW / g para 243 Am (cf. 390 mW / g para 238 Pu) - e sua radiação representa mais ameaça aos seres humanos devido a nêutrons emissão, a Agência Espacial Europeia está planejando usar amerício por suas sondas espaciais.
Outra aplicação relacionada com o espaço proposto de amerício é um combustível para naves espaciais com propulsão nuclear. Baseia-se na taxa muito elevada de fissão nuclear de 242m Am, que pode ser mantido mesmo em uma folha micrômetros de espessura. Pequena espessura evita o problema de auto-absorção da radiação emitida. Este problema é pertinente para urânio ou plutónio hastes, em que apenas as camadas superficiais proporcionam partículas alfa. Os produtos de fissão de 242m Am pode impulsionar diretamente a nave ou eles pode aquecer um gás de empurrão; eles também podem transferir a sua energia para um fluido e gerar eletricidade através de um gerador magneto.
Mais uma proposta que utiliza a alta taxa de fissão nuclear 242m Am é uma bateria nuclear. Seu projeto não conta com a energia do emitida por partículas alfa de amerício, mas em seu cargo, que são os atos de amerício como o "cátodo" auto-sustentável. Um único 3,2 kg 242m de carga Am de tal bateria poderia fornecer cerca de 140 kW de energia durante um período de 80 dias. Com todos os benefícios potenciais, as aplicações atuais de 242m Am são ainda dificultada pela escassez e alta de preços deste isómero nuclear.
Produção de outros elementos
Amerício é um material de partida para a produção de outros elementos transurânicos e transactinides - por exemplo, 82,7% de 242 Am decai para 242 Cm e 17,3% para 242 Pu. No reactor nuclear, 242 Am é também up-convertido por captura de neutrões de 243 Am e 244 Am, que transforma por β-decadência para 244 Cm:
Irradiação de 241 Am por 12 C ou 22 íons Ne produz os isótopos 247 Es ( einsteinio ) ou 260 Db ( dubnium ), respectivamente. Além disso, o elemento de berquélio ( 243 Bk isótopo) tinha sido primeiro intencionalmente produzidos e identificados por bombardeando 241 Am com partículas alfa, em 1949, pelo mesmo grupo Berkeley, utilizando o mesmo ciclotrão de 60 polegadas. Da mesma forma, nobelium foi produzido no Instituto Conjunto de Pesquisa Nuclear, de Dubna, Rússia, em 1965, em diversas reações, um dos quais incluídos irradiação de 243 Am com 15 íons N. Além disso, uma das reações de síntese para lawrencium , descobertos por cientistas em Berkeley e Dubna, incluídos bombardeio de 243 Am com 18 O.
Espectrômetro
Amerício-241 foi usado como uma fonte portátil de ambos os raios gama e partículas alfa para um número de utilizações médicas e industriais. As emissões de 60 keV gamma ray da 241 Am em tais fontes podem ser utilizadas para a análise indireta de materiais em radiografia e espectroscopia de fluorescência de raios-X, bem como para o controle de qualidade na fixos medidores de densidade nuclear e densometers nucleares. Por exemplo, o elemento tem sido utilizada para medir o vidro de espessura para ajudar a criar vidro plano. Amerício-241 também é adequado para calibração de espectrômetros de raios gama na faixa de baixa energia, uma vez que o seu espectro é composto por quase um pico único e insignificante contínuo Compton (pelo menos três ordens de grandeza menor intensidade). Raios gama amerício-241 também foram usados para fornecer o diagnóstico passivo de função da tireóide. Esta aplicação médica no entanto é obsoleto.
Problemas de saúde
Como um elemento altamente radioativo, amerício e seus compostos só podem ser tratadas num laboratório adequado no âmbito de acordos especiais. Embora a maioria dos isótopos amerício predominantemente emitem partículas alfa que podem ser bloqueadas por finas camadas de materiais comuns, muitos dos produtos filhas emitem raios gama e neutrões que têm uma profundidade de penetração de comprimento.
Se consumido, amerício é excretado em poucos dias e só 0,05% é absorvido no sangue. A partir daí, cerca de 45% do que vai para o fígado e 45% para os ossos, e os restantes 10% é excretado. A captação para o fígado depende do indivíduo e aumenta com a idade. Nos ossos, amerício é depositado em primeiro lugar sobre cortical e trabecular superfícies e redistribui-se lentamente sobre o osso com o tempo. A meia-vida biológica do 241 Am é de 50 anos nos ossos e 20 anos no fígado, enquanto que nas gônadas (testículos e ovários) continua a ser permanentemente; em todos estes órgãos, amerício promove a formação de células cancerosas como resultado da sua radioactividade.
Amerício muitas vezes entra aterros a partir descartado detectores de fumaça. As regras associadas à disposição dos detectores de fumaça estão relaxados na maioria das jurisdições. Em os EUA, o "Radioactive Boy Scout" David Hahn foi capaz de se concentrar amerício de detectores de fumaça depois de conseguir comprar uma centena deles a preços restante e também roubar alguns. Houve casos de humanos serem contaminados com amerício, o pior caso é que de Harold McCluskey, que aos 64 anos de idade foi exposto a 500 vezes o padrão ocupacional para amerício-241, como resultado de uma explosão em seu laboratório. McCluskey morreu com a idade de 75, e não como resultado da exposição, mas de uma doença cardíaca que ele tinha antes do acidente.

![\ Mathrm {^ {239} _ {\ 94} Pu \ \ xrightarrow {(n, \ gamma)} \ ^ {240} _ {\ 94} Pu \ \ xrightarrow {(n, \ gamma)} \ ^ {241 } _ {\ 94} Pu \ \ xrightarrow [14,35 \ yr] {\ beta ^ -} \ ^ {241} _ {\ 95} Am \ \ left (\ \ xrightarrow [432,2 \ yr] {\ alpha} \ ^ {237} _ {\ 93} Np \ right)}](../../images/1281/128125.png)
![\ Mathrm {^ {241} _ {\ 95} Am \ \ xrightarrow {(n, \ gamma)} \ ^ {242} _ {\ 95} Am \ \ left (\ \ xrightarrow [16.02 \ h] {\ beta ^ -} \ ^ {242} _ {\ 96} Cm \ right)}](../../images/1281/128126.png)
![\ Mathrm {^ {238} _ {\ 92} L \ \ xrightarrow {(n, \ gamma)} \ ^ {239} _ {\ 92} L \ \ xrightarrow [23.5 \ min] {\ beta ^ -} \ ^ {239} _ {\ 93} Np \ \ xrightarrow [2,3565 \ d] {\ beta ^ -} \ ^ {239} _ {\ 94}} Pu](../../images/1281/128135.png)
![\ Mathrm {^ {239} _ {\ 94} Pu \ \ xrightarrow {2 (n, \ gamma)} \ ^ {241} _ {\ 94} Pu \ \ xrightarrow [14,35 \ yr] {\ beta ^ -} \ ^ {241} _ {\ 95}} Am](../../images/1281/128136.png)
![\ Mathrm {^ {239} _ {\ 94} Pu \ \ xrightarrow {4 (n, \ gamma)} \ ^ {243} _ {\ 94} Pu \ \ xrightarrow [4,956 \ h] {\ beta ^ -} \ ^ {243} _ {\ 95}} Am](../../images/1281/128139.png)
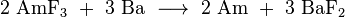
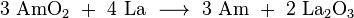
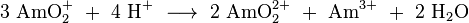
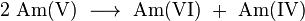
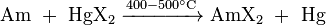
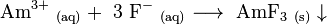
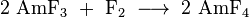


![\mathrm{^{243}_{\ 95}Am\ \xrightarrow {(n,\gamma)} \ ^{244}_{\ 95}Am\ \xrightarrow [10.1 \ h]{\beta^-} \ ^{244}_{\ 96}Cm}](../../images/1281/128167.png)
