
Anticorpo
Você sabia ...
Esta seleção wikipedia foi escolhido por voluntários que ajudam Crianças SOS da Wikipedia para este Seleção Wikipedia para as escolas. Crianças SOS tem cuidado de crianças na África por 40 anos. Você pode ajudar o seu trabalho na África ?

Os anticorpos (também conhecido como imunoglobulinas) são gamaglobulina proteínas que são encontradas no sangue ou outros fluidos corporais de vertebrados , e são utilizados pelo sistema imunológico para identificar e neutralizar objectos estranhos, tais como bactérias e vírus . Eles são normalmente feitas de unidades estruturais básicas - cada um com dois grandes cadeias pesadas e duas pequenas - cadeias leves para formar, por exemplo, Os monómeros com uma unidade, dímeros com duas unidades ou pentâmeros com cinco unidades. Os anticorpos são produzidos por uma espécie de glóbulo branco chamado de Células B. Existem vários tipos diferentes de cadeias pesadas de anticorpos, e vários tipos diferentes de anticorpos, que são agrupadas em diferentes isotipos com base em qual cadeia pesada que eles possuem. Cinco diferentes isotipos de anticorpos são conhecidos em mamíferos, que desempenham diferentes papéis, e ajudam a orientar a resposta imunológica adequada para cada tipo diferente de objeto estranho que encontram.
Embora a estrutura geral de todos os anticorpos é muito similar, uma pequena região na ponta da proteína é extremamente variável, permitindo que milhões de anticorpos com um pouco diferentes estruturas de ponta de existir. Esta região é conhecida como a região hipervariável. Cada uma destas variantes se podem ligar a um alvo diferente, conhecida como um antigénio. Esta enorme diversidade de anticorpos permite que o sistema imunitário para reconhecer uma igualmente ampla diversidade de antigénios. A única parte do antigénio reconhecido por um anticorpo é chamado um epitopo. Estes epitopos ligam-se com o seu anticorpo em uma interacção altamente específica, denominada apto induzido, que permite que os anticorpos para identificar e ligar apenas o seu antigénio único no meio dos milhões de moléculas diferentes que compõem um organismo . O reconhecimento de um antigénio de um anticorpo etiquetas lo para o ataque por outras partes do sistema imunitário. Os anticorpos também podem neutralizar alvos directamente por, por exemplo, a ligação a uma parte de um agente patogénico que é necessário para causar uma infecção.
A população grande e diverso de anticorpos é gerado pela combinação de um conjunto aleatório de segmentos de genes que codificam para diferentes locais de ligação ao antigénio (ou paratopos), seguido por aleatório mutações neste domínio do gene do anticorpo, que criam ainda mais a diversidade. Genes de anticorpos também re-organizar em um processo chamado a troca de classe que altera a base da cadeia pesada para o outro, criando um isotipo diferente do anticorpo que retém região variável específica do antigénio. Isto permite que um único anticorpo a ser utilizado por várias partes diferentes do sistema imunitário. A produção de anticorpos é a função principal da sistema imune humoral.
Formas de anticorpos
As células B activadas diferenciar em qualquer células produtoras de anticorpos chamados células de plasma que segregam anticorpo solúvel, ou em células de memória que sobrevivem no corpo durante anos mais tarde, para permitir que o sistema imunitário para se lembrar de um antigénio e responder mais rapidamente após a exposição futura. Os anticorpos são, por conseguinte, um produto essencial do sistema imunológico adaptativo que aprende e se lembra respostas a patógenos invasores. Anticorpos ocorrer de duas formas: uma solúvel forma segregada para o sangue e outros fluidos do corpo, e um forma ligada à membrana que está ligado à superfície de um Células B.
Anticorpos solúveis que são segregadas a partir de uma célula B activada (na sua forma de células plasmáticas) se ligam a substâncias estranhas e sinal para a sua destruição pelo resto do sistema imunológico. Eles também podem ser chamados de anticorpos livres (até que eles se ligam um antígeno e se tornar parte de uma complexo imune) ou anticorpos segregados.
A forma ligada a membrana de um anticorpo pode ser chamado de uma imunoglobulina de superfície (slg) ou uma imunoglobulina de membrana (MIG). Faz parte do receptor da célula B (BCR), que permite a uma célula B para detectar quando um antigénio específico está presente no corpo e provoca a activação das células B. O BCR é composto por IgD ou IgM anticorpos ligados à superfície e associados Ig-α e Ig-β heterodimeros, que são capazes de transdução de sinal. Uma célula B humana típica terá 50.000 a 100.000 anticorpos ligados à sua superfície. Após a ligação ao antígeno, eles agrupar em grandes manchas, que podem exceder 1 micrômetro de diâmetro, em jangadas lipídicas que isolam os BCRs da maioria dos outros receptores celulares de sinalização. Estes emplastros podem melhorar a eficiência do resposta imune celular. Nos seres humanos, a superfície da célula é nua em torno dos receptores de células B para vários milhares de angstroms, o que reduz ainda mais isola os BCRs de influências concorrentes.
Isotipos
| Nome | Tipos | Descrição | Complexos de anticorpo |
| IgA | 2 | Encontrado em áreas da mucosa, tais como a gut, tracto respiratório e urogenital trato, e impede a colonização por patógenos. Também encontrado na saliva, lágrimas e leite materno. |  |
| IgD | 1 | Funciona principalmente como um receptor de antigénio em células B, que não tenham sido expostos a antigénios. Sua função é menos definida do que outros isotipos. | |
| IgE | 1 | Liga-se a alérgenos e gatilhos a libertação de histamina a partir de e mastócitos basófilos, e está envolvido na alergia . Também protege contra vermes parasitas. | |
| IgG | 4 | Nas suas quatro formas, fornece a maior parte da imunidade baseada em anticorpos contra os agentes patogénicos invasores. O único anticorpo capaz de atravessar a placenta para dar imunidade passiva para o feto. | |
| IgM | 1 | Expresso na superfície de células B e de uma forma segregada com muito elevada avidez. Elimina agentes patogénicos nas fases iniciais de células B mediada por imunidade (humoral) antes que haja suficiente IgG. |
Os anticorpos podem vir em diferentes variedades conhecidas como isotipos ou classes. Em placentados existem cinco isotipos de anticorpos conhecidas como IgA, IgD, IgE, IgG e IgM. Eles são cada um nomeado com um prefixo "IG" que se destaca para a imunoglobulina, um outro nome para o anticorpo, e diferem nas suas propriedades biológicas, funcionais locais e capacidade de lidar com os antigénios diferentes, como representado na tabela.
O isotipo de anticorpo de uma célula B muda durante célula e desenvolvimento activação. Células B imaturas, que nunca foram expostos a um antigénio, são conhecidas como células B virgens e expressam apenas o isotipo IgM para uma forma ligada à superfície celular. As células B começam a expressar ambos IgM e IgD quando atingem a maturidade - a co-expressão de ambos os isotipos de imunoglobulina torna a célula B "madura" e pronta para responder ao antigénio. A activação das células B segue acoplamento da molécula de anticorpo ligado à célula com um antigénio, fazendo com que a célula se divide e diferenciar-se em uma célula produtora de anticorpo chamado células de plasma. Nesta forma activada, a célula B começa a produzir anticorpo numa secretado forma, em vez de um forma ligada à membrana. Alguns células filhas das células B ativadas sofrer comutação do isotipo, um mecanismo que faz com que a produção de anticorpos para mudar de IgM ou IgD para os outros isotipos de anticorpos, IgE, IgA ou IgG, que definiram funções no sistema imune.
Estrutura
Os anticorpos são pesado (~ 150k Da) globular proteínas do plasma que também são conhecidos como imunoglobulinas. Eles têm cadeias de açúcar adicionado a alguns de seus aminoácidos resíduos. Em outras palavras, os anticorpos são glicoproteínas. A unidade funcional de base de cada anticorpo é uma imunoglobulina (Ig) monómero (contendo apenas uma unidade de IG); Os anticorpos também podem ser segregadas dimérico com duas unidades de Ig como IgA com, tetramérica com quatro unidades de Ig como peixes teleósteos IgM, ou pentamérica com cinco unidades de Ig, como IgM de mamífero.
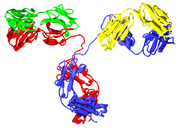
Domínios de imunoglobulina
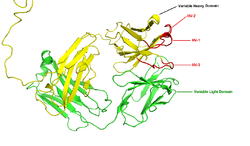
O monómero de Ig é um "Y" em forma de molécula que é constituída por quatro cadeias polipeptídicas; duas cadeias pesadas idênticas e duas cadeias leves idênticas ligadas por ligações dissulfureto. Cada cadeia é constituída por domínios estruturais chamado domínios Ig. Estes domínios contêm cerca de 70-110 aminoácidos e são classificados em diferentes categorias (por exemplo, variável ou IgV, e constante ou CIG) de acordo com seu tamanho e função. Eles têm uma característica dobra de imunoglobulina em que dois folhas beta criar um "sanduíche" de forma, mantidas juntas por interacções entre conservada cisteínas e outros aminoácidos carregados.
Cadeia pesada
Existem cinco tipos de mamíferos Ig cadeia pesada denotado pelas letras gregas : α, δ, ε, γ e μ. O tipo de presente pesada cadeia define a classe de anticorpo; estas cadeias são encontrados em IgA, IgD, IgE, IgG e IgM, respectivamente. Pesadas correntes distintas diferem em tamanho e composição; α γ e conter cerca de 450 aminoácidos, enquanto μ e ε têm aproximadamente 550 aminoácidos .
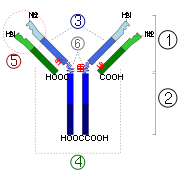
2. Região Fc
3. Cadeia pesada com uma variável (VH) seguido por um domínio de domínio constante (C H 1), uma regi de articulao, e dois mais constante (C H 2 e C H 3) domínios.
4. Cadeia leve com uma variável (VL) e um constante (C L) domínio
Local de ligação 5. Antigen (paratopo)
6. regiões dobradiça.
Cada cadeia pesada tem duas regiões, a região constante e a região variável. A região constante é idêntico em todos os anticorpos do mesmo isotipo, mas difere em anticorpos de diferentes isotipos. As cadeias pesadas γ, α e δ tem uma região constante composta de três em tandem (em linha) de Ig domínios, e uma região de charneira para uma maior flexibilidade; cadeias pesada e μ ε tem uma região constante composto por quatro domínios de imunoglobulina. A região variável da cadeia pesada difere em anticorpos produzidos por diferentes células B, mas é a mesma para todos os anticorpos produzidos por uma única célula B ou Clone de células B. A região variável de cada cadeia pesada é de aproximadamente 110 aminoácidos de comprimento e é composto por um único domínio Ig.
Cadeia leve
Nos mamíferos há dois tipos de cadeia leve, que são chamados lambda (λ) e kappa (κ). A cadeia leve tem dois domínios sucessivos: um domínio constante e um domínio variável. O comprimento aproximado de uma cadeia leve é 211-217 aminoácidos. Cada anticorpo contém duas cadeias leves, que são sempre idênticos; apenas um tipo de cadeia leve, ou κ λ, está presente por anticorpos em mamíferos. Outros tipos de cadeias leves, tais como a cadeia de iota (ι), são encontrados em menores vertebrados como Chondrichthyes e Teleostei.
Fab e Fc Regiões
Algumas partes de um anticorpo têm funções únicas. As pontas do Y, por exemplo, conter o local que se liga ao antigénio e, portanto, reconhecer objectos estranhos específicos. Esta região do anticorpo é chamado o Fab (fragmento, ligação ao antígeno) região. É composto por uma constante e um domínio variável de cada cadeia pesada e leve do anticorpo. O paratopo é moldada no extremidade do terminal amino do anticorpo monómero pelos domínios variáveis das cadeias pesadas e leves.
A base do Y desempenha um papel na modulação da actividade de células imunitárias. Esta região é denominada Fc (fragmento, cristalizável) região, e é composta de duas cadeias pesadas que contribuem dois ou três domínios constantes dependendo da classe do anticorpo. Ao ligar-se a proteínas específicas região Fc assegura que cada anticorpo gera uma resposta imune adequada para um determinado antigénio. A região Fc também se liga a várias células receptores, tais como Receptores de Fc, e outras moléculas imunológicas, tais como proteínas do complemento. Ao fazer isso, ela media diferente efeitos fisiológicos, incluindo opsonização, célula lise, e desgranulação de mastócitos, basófilos e eosinófilos.
Função
Uma vez que existem anticorpos livremente na corrente sanguínea, que são referidos como sendo parte do sistema imune humoral. Anticorpos circulantes são produzidos por células clonais B que respondem especificamente a uma única antigénio, um vírus fragmento de proteína casco, por exemplo. Anticorpos para contribuir imunidade de três maneiras principais: eles podem evitar a entrada de agentes patogénicos ou danificar as células ligando-se a eles; podem estimular a remoção de um agente patogénico pela macrófagos e outras células por revestimento do agente patogénico; e eles podem provocar a destruição de agentes patogénicos através da estimulação directa de outras respostas imunes , tais como a via do complemento.
A activação do complemento
Os anticorpos que se ligam a antigénios de superfície, por exemplo uma bactéria, atrair o primeiro componente do cascata complementar com a sua região Fc e iniciar a activação do sistema do complemento "clássica". Isto resulta na morte de bactérias de duas maneiras. Em primeiro lugar, a ligação do anticorpo e complemento moléculas marca o micróbio para ingestão por fagócitos num processo denominado opsonização; estes fagócitos são atraídas por certas moléculas do complemento gerados na cascata do complemento. Em segundo lugar, alguns componentes do sistema do complemento formar um complexo de ataque à membrana para ajudar anticorpos para matar a bactéria diretamente.
A activação de células efectoras
Para combater patogénios que replicam fora das células, os anticorpos ligam-se a agentes patogénicos para os ligar em conjunto, levando-os a aglutinam. Uma vez que um anticorpo tem pelo menos dois paratopos ele pode ligar-se mais do que um antigénio por epitopos idênticos efectuados sobre as superfícies destes antigénios de ligação. Ao revestir o agente patogénico, anticorpos estimulam as funções efectoras contra o agente patogénico em células que reconhecem a sua regi Fc.
Aquelas células que reconhecem patógenos revestidos possuem receptores Fc que, como o nome sugere, interage com o Região Fc de anticorpos IgA, IgG, e IgE. O acoplamento de um anticorpo particular, com o receptor de Fc numa célula particular desencadeia uma função efectora da célula; fagócitos vontade phagocytose, e mastócitos neutrófilos será Degranulate, células assassinas naturais lançará citocinas e moléculas citotóxicas; que, em última análise resultar na destruição do microorganismo invasor. Os receptores Fe são específicos de isotipo, que dá maior flexibilidade para o sistema imunitário, invocando unicamente os mecanismos imunes adequadas para agentes patogénicos distintas.
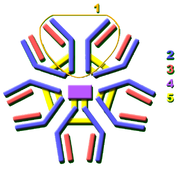
Diversidade de imunoglobulina
Virtualmente todos os micróbios podem desencadear uma resposta de anticorpos. Reconhecimento bem sucedido e erradicação de muitos tipos diferentes de micróbios requer diversidade entre os anticorpos; a sua composição de aminoácidos varia o que lhes permite interagir com muitos antigénios diferentes. Estimou-se que os seres humanos gerar cerca de 10 mil milhões de diferentes anticorpos, cada um capaz de se ligar a um epitopo de um antigénio distinto. Apesar de um grande repertório de anticorpos diferentes é gerado em um único indivíduo, o número de genes disponíveis para fazer tais proteínas é limitado. Vários mecanismos genéticos complexos têm evoluído que permitem que as células de vertebrados B para gerar um conjunto diverso de anticorpos a partir de um número relativamente pequeno de genes de anticorpos.
Variabilidade de domínio
A região (local) de um cromossoma que codifica para um anticorpo é grande e contém vários genes distintos para cada domínio do anticorpo - o locus contendo genes da cadeia pesada ( IGH @) é encontrado no cromossoma 14, e os loci contendo genes de cadeia leve lambda e kappa ( IGL @ e IGK @) são encontrados nos cromossomas 22 e 2 em seres humanos. Um destes domínios é chamado o domínio variável, que está presente em cada uma das cadeias leve e pesada de cada anticorpo, mas podem diferir em diferentes anticorpos gerados a partir de células B distintas. As diferenças entre os domínios variáveis, estão localizados em três lacetes conhecidas como regiões hipervariáveis (HV-1, HV-2 e HV-3) ou regiões determinantes de complementaridade (CDR1, CDR2 e CDR3). CDRs são suportados dentro dos domínios variáveis de regiões estruturais conservadas. O locus da cadeia pesada contém cerca de 65 genes diferentes do domínio variável que diferem em todos os seus CDRs. Combinando estes genes com uma variedade de genes para outros domínios de anticorpo gera uma grande cavaleiros de anticorpos com um elevado grau de variabilidade. Esta combinação é chamado de V (D) J recombinação discutido abaixo.
V recombinação (D) J
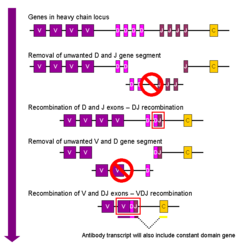
A recombinação somática de imunoglobulinas, também conhecido como recombinação V (D) J, envolve a geração de uma região variável de imunoglobulina original. A região variável de cada cadeia pesada ou leve de imunoglobulina é codificado em várias peças - conhecido como segmentos de gene. Estes segmentos são chamados variável (V) de união (J), de diversidade (D) e. V, os segmentos D e J são encontrados em Ig cadeias pesadas, mas apenas os segmentos V e J encontram-se em Cadeias leves de Ig. Várias cópias do V, existe segmentos de genes D e J, e estão dispostas em tandem na genomas de mamíferos . Na medula óssea, cada célula B irá desenvolver montar uma região variável de imunoglobulina, seleccionando aleatoriamente e combinando um V, um D e um segmento do gene J (ou um V e um segmento J, em que a cadeia leve). Como há várias cópias de cada tipo de segmento de gene, e diferentes combinações de segmentos de gene pode ser usado para gerar cada região variável de imunoglobulina, esse processo gera um grande número de anticorpos, cada um com diferentes paratopos, e, assim, diferentes especificidades antigénio.
Depois de uma célula B produz um gene de imunoglobulina funcional durante V (D) J de recombinação, que não pode expressar qualquer outra região variável (um processo conhecido como exclusão alélica), assim, cada célula B pode produzir anticorpos que contêm apenas um tipo de cadeia variável.
Hipermutação somática e maturação de afinidade
Outro mecanismo que gera a diversidade de anticorpos ocorre em células B maduras. Após a activação com antigénio, as células B a iniciar proliferam rapidamente. Nestas células que se dividem rapidamente, os genes que codificam para os domínios variáveis das cadeias pesada e leve submetido a uma elevada taxa de mutação de ponto, por um processo chamado de mutação somática (SHM). SHM resultados em cerca de um alteração de nucleótido por gene variável, por divisão celular. Como consequência, as células B filha irá adquirir pequenas de aminoácidos diferenças nos domínios variáveis das suas cadeias de anticorpo.
Hipermutação somática serve para aumentar a diversidade da piscina anticorpo e impactos do anticorpo de ligação do antigénio afinidade. Algumas mutações pontuais resultará na produção de anticorpos que possuem uma interacção mais fraca (baixa afinidade) com o seu antigénio que o anticorpo original, e algumas mutações irá gerar anticorpos com uma interacção mais forte (elevada afinidade). As células B que expressam anticorpos de afinidade elevada na sua superfície vai receber um sinal de sobrevivência forte durante as interacções com outras células, enquanto que aqueles com anticorpos de baixa afinidade não, e morrerão apoptose. Assim, as células B que expressam anticorpos com uma maior afinidade para o antigénio vai outcompete aqueles com afinidades mais fracas para função e sobrevivência. O processo de geração de anticorpos com maiores afinidades de ligação é chamado de maturação por afinidade. Maturação por afinidade ocorre em células B maduras após V (D) J recombinação, e é dependente de ajuda As células T helper.
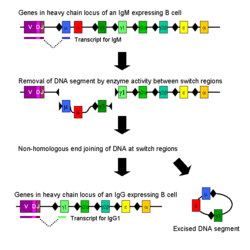
Classe de comutação
Isotipo ou classe de comutação é um processo biológico que ocorre após a activação da célula B, que permite que a célula para a produção de diferentes classes de anticorpos (IgA, IgE, ou IgG). As diferentes classes de anticorpos e, portanto, as funções efectoras, são definidos por (C) regiões constantes da cadeia pesada de imunoglobulina. Inicialmente, as células B virgens expressam apenas IgM de superfície celular e IgD com as regiões de ligação ao antigénio idênticos. Cada isotipo é adaptada para uma função distinta, por conseguinte, após a activação, um anticorpo com uma função efectora de IgG, IgA, ou IgE pode ser requerido para eliminar de forma eficaz um antigénio. Classe de comutação permite que diferentes células filhas do mesmo células B activadas para produzir anticorpos de diferentes isotipos. Apenas a região constante das alterações da cadeia pesada do anticorpo durante a troca de classe; as regiões variáveis, e, por conseguinte, a especificidade de antigénio, permanecem inalterados. Assim, a descendência de uma única célula B pode produzir anticorpos específicos, todos para o mesmo antigénio, mas com a capacidade de produzir a função efectora apropriado para cada desafio antigénico. Classe de comutação é desencadeada por citocinas; o isotipo gerada depende citocinas que estão presentes no ambiente de célula B.
Classe comutação ocorre no gene da cadeia pesada lócus por uma recombinação mudança de classe mecanismo chamado (CSR). Este mecanismo baseia-se conservado motivos de nucleótidos, chamado regiões de troca (S), encontrada em ADN a montante de cada um dos genes da região constante (excepto na cadeia δ). A cadeia de ADN é quebrado pela actividade de uma série de enzimas em duas regiões S-seleccionados. O domínio variável exão é reintegrado por meio de um processo chamado extremidade de união (NHEJ) para a região constante desejada não homóloga (γ, α ou ε). Este processo resulta em um gene de imunoglobulina que codifica um anticorpo de um isotipo diferente.
As aplicações médicas
Diagnóstico da doença
A detecção de anticorpos específicos é uma forma muito comum de médica diagnósticos e aplicações, tais como sorologia dependem desses métodos. Por exemplo, em ensaios bioquímicos para o diagnóstico da doença, uma título de anticorpos dirigidos contra Vírus de Epstein-Barr, ou a doença de Lyme é estimado a partir do sangue. Se esses anticorpos não estão presentes, ou a pessoa não está infectada, ou a infecção ocorreu há muito tempo atrás, e as células B que geram estes anticorpos específicos têm naturalmente deteriorado. Em imunologia clínica, níveis de aulas individuais de imunoglobulinas são medidos por nefelometria (ou turbidimetria) para caracterizar o perfil de anticorpos do paciente. As elevações em diferentes classes de imunoglobulinas são por vezes úteis para determinar a causa dano hepático em doentes a quem o diagnóstico é incerto. Por exemplo, elevado IgA indica alcoólica cirrose, indica elevada IgM hepatite viral e cirrose biliar primária, enquanto que a IgG é elevada em hepatite viral, hepatite auto-imune e cirrose. Doenças auto-imunes podem muitas vezes ser atribuída a anticorpos que se ligam o corpo do próprio epítopos; muitos podem ser detectados através exames de sangue. Os anticorpos dirigidos contra sangue vermelho antigénios da superfície celular em imunitária mediada anemia hemolítica são detectados com o Teste de Coombs. O teste de Coombs é também utilizado para o rastreio de anticorpos em preparação de transfusão de sangue e também para pesquisa de anticorpos em mulheres pré-natal. Na prática, vários métodos de imunodiagnóstico com base na detecção do complexo antigénio-anticorpo são usadas para diagnosticar doenças infecciosas, por exemplo ELISA, imunofluorescência, Western blot, imunodifusão, e immunoelectrophoresis.
Terapia doença
"Alvejado" A terapia de anticorpo monoclonal é empregue para o tratamento de doenças tais como artrite reumatóide, esclerose múltipla , psoríase, e muitas formas de câncer , incluindo linfoma não-Hodgkin, câncer colorretal, câncer de cabeça e pescoço e câncer de mama. Algumas deficiências imunes, tais como Agamaglobulinemia ligada ao X e hipogamaglobulinemia, resultar em falta parcial ou completa de anticorpos. Estas doenças são muitas vezes tratadas através da indução de uma forma de curto prazo imunidade chamado imunidade passiva. Imunidade passiva é conseguida através da transferência de anticorpos pré-fabricados sob a forma de humano ou animal soro, imunoglobulina agrupada ou anticorpos monoclonais, para o indivíduo afectado.
Terapia pré-natal
Anticorpos Rho (D) Imunoglobulina são específicos para Rhesus D (Rh) antigénio humano, também conhecido como Fator de Rhesus. Estes anticorpos anti-RhD são conhecidos sob vários nomes de marcas, incluindo RhoGAM, BayRHo-D, Gamulin Rh, HypRho-D, e WinRho SDF. Fator Rhesus é um antigénio encontrado no glóbulos vermelhos; indivíduos que são Rhesus-positivo (Rh +) tem este antígeno em seus glóbulos vermelhos e indivíduos que são Rhesus-negativo (Rh-) não. Durante o normal parto, trauma entrega ou complicações durante a gravidez, o sangue a partir de um feto pode entrar no sistema da mãe. No caso de uma mãe e filho Rh-incompatível, a mistura de sangue pode sensibilizar um consequente mãe Rh- para o antigénio Rh sobre as células do sangue da criança Rh +, colocando o restante da gravidez , e quaisquer gravidezes subsequentes, em risco de doença hemolítica do recém-nascido. Os anticorpos anti-RhD são administrados como parte de um regime de tratamento pré-natal para prevenir a sensibilização que pode ocorrer quando uma mãe Rhesus-negativo tem um feto Rh-positivo. O tratamento de uma mãe com anticorpos anti-RhD antes e imediatamente após o trauma e entrega destrói antígeno Rh no sistema da mãe do feto. É importante ressaltar que este ocorre antes do antígeno pode estimular as células B maternas para "lembrar" antígeno Rh, gerando células B de memória. Portanto, ela sistema imune humoral não vai fazer anticorpos anti-Rh, e não atacar os antígenos Rhesus do bebê atual ou posterior. Rho (D) tratamento Imunoglobulina impede a sensibilização que pode levar a Doença Rh, mas não prevenir ou tratar a doença em si subjacente.
Aplicações de pesquisa
Os anticorpos específicos são produzidos através da injecção de um antigénio em um mamífero , tal como um ratinho , rato ou coelho para pequenas quantidades de anticorpo, ou cabra , ovelha , ou cavalo para grandes quantidades de anticorpo. O sangue isolado a partir destes animais contém Os anticorpos policlonais - vários anticorpos que se ligam ao mesmo antigénio - na de soro, que pode agora ser chamado anti-soro. Os antigénios são também injectados em galinhas para a produção de anticorpos policlonais em gema. Para obter o anticorpo que é específico para um único epítopo de um antigénio, o anticorpo secretor os linfócitos são isolados a partir do animal e imortalizados fundindo-os com uma linha celular de cancro. As células fundidas são chamados hibridomas, e irão crescer continuamente e secretam anticorpos em cultura. As células de hibridoma individuais são isolados por clonagem de diluição para gerar Os clones de células que produzem todos o mesmo anticorpo; estes anticorpos são chamados anticorpos monoclonais. Os anticorpos policlonais e monoclonais gerados são muitas vezes purificadas utilizando A proteína A / G ou antigénio-cromatografia de afinidade.
Uso
Em investigação, os anticorpos purificados são utilizados em muitas aplicações. Eles são mais comumente usados para identificar e localizar e intracelular proteínas extracelulares. Os anticorpos são utilizados em citometria de fluxo para diferenciar tipos de células de proteínas que expressam; diferentes tipos de células expressam diferentes combinações de aglomerado de moléculas de diferenciação em sua superfície, e produzir diferentes proteínas intracelulares e segreg�el. Eles são também utilizados em imunoprecipitação de proteínas e qualquer separadas ligadas a eles (co-imunoprecipitação) a partir de outras moléculas numa ligado celular, em Análises de Western blot para identificar proteínas separadas por electroforese, e em ou imuno-histoquímica imunofluorescência para examinar a expressão de proteínas em secções de tecido ou para localizar as proteínas no interior das células com a ajuda de um microscópio . As proteínas também podem ser detectados e quantificados com anticorpos, usando E ELISA Técnicas ELISPOT.
História
O estudo de anticorpos começou em 1890, quando Emil von Behring e Shibasaburo Kitasato descrito actividade de anticorpo contra difteria e toxinas do tétano. Behring e Kitasato apresentar a teoria da imunidade humoral, propondo que um mediador no soro poderia reagir com um antígeno estranho. Sua idéia solicitado Paul Ehrlich a propor a teoria da cadeia lateral para o anticorpo e da interacção antigénio em 1897, quando a hipótese de que os receptores (descritos como "cadeias laterais") na superfície de células podem ligar-se especificamente a toxinas - numa interacção "fechadura e chave" - e que esta reacção de ligação foi o gatilho para a produção de anticorpos. Outros investigadores acreditavam que existiam anticorpos livremente no sangue e, em 1904, Almroth Wright sugeriu que os anticorpos solúveis revestidos bactérias para classificá-los para fagocitose e morte; um processo que ele chamou de opsoninization.
Na década de 1920, Michael Heidelberger e Oswald Avery observado que os antigénios podem ser precipitadas por anticorpos e passou a mostrar que os anticorpos eram feitas de proteína. As propriedades bioquímicas das interacções de ligação antigénio-anticorpo foram examinadas em maior detalhe, no final dos anos 1930 por John Marrack. O próximo grande avanço foi na década de 1940, quando Linus Pauling confirmou a teoria fechadura e chave proposto por Ehrlich, mostrando que as interações entre antígenos e anticorpos dependia mais da sua forma de sua composição química. Em 1948, Astrid Fagreaus descoberto que as células B, sob a forma de células de plasma, foram responsáveis pela produção de anticorpos.
Além disso trabalho concentrada para se caracterizar as estruturas das proteínas de anticorpo. Um grande avanço nesses estudos estruturais foi a descoberta na década de 1960 por Gerald Edelman e Joseph Gally do anticorpo da cadeia leve, e a sua percepção de que esta proteína era a mesma que a Proteína de Bence-Jones descrito em 1845 por Henry Bence Jones. Edelman passou a descobrir que os anticorpos são compostas de dissulfureto ligado cadeias pesadas e leves. Em torno do mesmo tempo, cauda (Fab) de ligação ao anticorpo e anticorpo (Fc) de IgG regiões foram caracterizados por Rodney Porter. Juntos, esses cientistas deduziram a estrutura e completa aminoácido seqüência de IgG, uma façanha para a qual foram concedidos conjuntamente de 1972 Prêmio Nobel de Fisiologia ou Medicina . Embora a maioria desses estudos iniciais voltados para IgM e IgG, outros isotipos de imunoglobulinas foram identificados na década de 1960: Thomas Tomasi descobriu anticorpo secretor ( IgA) e David Rowe e John Fahey identificado IgD, e IgE foi identificado pela Kikishige Ishizaka e Ishizaka Teruki como uma classe de anticorpos envolvidos em reacções alérgicas.
Estudos genéticos revelou a base da grande diversidade destas proteínas de anticorpos quando recombinação somática dos genes de imunoglobulina foi identificado pela Susumu Tonegawa, em 1976.

