Antimônio
Você sabia ...
Crianças SOS voluntários ajudaram a escolher artigos e fez outro material currículo Clique aqui para mais informações sobre Crianças SOS.
| Antimônio | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
51 Sb | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Aparência | |||||||||||||||||||||||||
cinzento prateado brilhante  | |||||||||||||||||||||||||
| Propriedades gerais | |||||||||||||||||||||||||
| Nome, símbolo, número | antimônio, Sb, 51 | ||||||||||||||||||||||||
| Pronúncia | Reino Unido / æ n t ɨ m ə n Eu / AN -ti-mə nee; EU / æ n t ɨ m oʊ n Eu / AN -ti-moh-nee | ||||||||||||||||||||||||
| Categoria Metallic | metalóide | ||||||||||||||||||||||||
| Grupo, período, bloco | 15 (pnictogens), 5, p | ||||||||||||||||||||||||
| Peso atômico padrão | 121,760 (1) | ||||||||||||||||||||||||
| Configuração eletrônica | [ Kr ] 4d 10 5s 2 5p 3 2, 8, 18, 18, 5 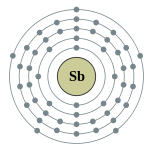 | ||||||||||||||||||||||||
| História | |||||||||||||||||||||||||
| Descoberta | 3000 aC | ||||||||||||||||||||||||
| Primeiro isolamento | Vannoccio Biringuccio (1540) | ||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||
| Densidade (perto RT) | 6,697 g · cm -3 | ||||||||||||||||||||||||
| Líquido densidade no pf | 6,53 g cm -3 · | ||||||||||||||||||||||||
| Ponto de fusão | 903,78 K , 630,63 ° C, 1167,13 ° F | ||||||||||||||||||||||||
| Ponto de ebulição | 1860 K, 1587 ° C, 2889 ° F | ||||||||||||||||||||||||
| Calor de fusão | 19.79 kJ mol -1 · | ||||||||||||||||||||||||
| Calor de vaporização | 193,43 kJ mol -1 · | ||||||||||||||||||||||||
| Capacidade calorífica molar | 25.23 J · · mol -1 K -1 | ||||||||||||||||||||||||
| Pressão de vapor | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Propriedades atômicas | |||||||||||||||||||||||||
| Estados de oxidação | 5, 3, -3 | ||||||||||||||||||||||||
| Eletronegatividade | 2,05 (escala de Pauling) | ||||||||||||||||||||||||
| Energias de ionização ( Mais) | 1º: 834 kJ · mol -1 | ||||||||||||||||||||||||
| 2: 1594,9 kJ · mol -1 | |||||||||||||||||||||||||
| 3: 2440 kJ · mol -1 | |||||||||||||||||||||||||
| Raio atômico | 140 pm | ||||||||||||||||||||||||
| O raio de covalência | 139 ± 17:00 | ||||||||||||||||||||||||
| Van der Waals raio | 206 pm | ||||||||||||||||||||||||
| Miscelânea | |||||||||||||||||||||||||
| A estrutura de cristal | trigonal simples 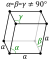 | ||||||||||||||||||||||||
| Ordenamento magnético | diamagnetic | ||||||||||||||||||||||||
| Resistividade elétrica | (20 ° C) 417 Nco · m | ||||||||||||||||||||||||
| Condutividade térmica | 24,4 W · m -1 · K -1 | ||||||||||||||||||||||||
| Expansão térmica | (25 ° C) 11 uM · · K -1 m -1 | ||||||||||||||||||||||||
| Velocidade do som (haste fina) | (20 ° C) 3420 m · s -1 | ||||||||||||||||||||||||
| O módulo de Young | 55 GPa | ||||||||||||||||||||||||
| Módulo de cisalhamento | 20 GPa | ||||||||||||||||||||||||
| Massa de módulo | 42 GPa | ||||||||||||||||||||||||
| Dureza de Mohs | 3.0 | ||||||||||||||||||||||||
| Dureza Brinell | 294 MPa | ||||||||||||||||||||||||
| Número de registo CAS | 7440-36-0 | ||||||||||||||||||||||||
| A maioria dos isótopos estáveis | |||||||||||||||||||||||||
| Ver artigo principal: Isótopos de antimônio | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
Antimônio ( Latin : stibium) é um elemento químico com o símbolo Sb e número atômico 51. A cinza brilhante metalóide, que é encontrado na natureza, principalmente, como o de mineral de sulfureto estibina (Sb 2 S 3). Compostos de antimónio são conhecidas desde tempos antigos e foram usados para cosméticos; antimônio metálico também era conhecido, mas foi erroneamente identificado como chumbo . Ele foi criado para ser um elemento em torno do século 17.
Por algum tempo, a China tem sido o maior produtor de antimônio e seus compostos, com a maioria da produção proveniente do Mina Xikuangshan em Hunan. Os métodos industriais para a produção de antimônio são torrefação e redução carbotérmica subsequente ou redução direta de stibnite com ferro.
Os maiores pedidos de antimônio metálico são como material de liga de chumbo e estanho e antimônio para placas de chumbo no baterias de chumbo-ácido. De liga de chumbo e de estanho com antimónio melhora as propriedades das ligas que são utilizados nas soldas, balas e mancais de deslizamento. Compostos de antimónio são aditivos proeminentes para cloro e bromo contendo retardadores de fogo encontradas em muitos produtos comerciais e domésticos. Uma aplicação emergente é a utilização de antimónio em microeletrônica.
Características
Propriedades


O antimónio é no grupo de azoto (grupo 15) e tem uma eletronegatividade de 2,05. Como esperado pelas tendências periódicas, é mais electronegativo que estanho ou bismuto , e menos electronegativo que telúrio ou arsénio . O antimónio é estável em ar à temperatura ambiente, mas reage com o oxigénio para formar se aquecido de trióxido de antimónio, Sb 2 O 3.
Antimônio é um metal cinza prateado, brilhante que tem uma escala de Mohs dureza de 3. Portanto, antimônio puro não é usado para fazer objetos duros: moedas feitas de antimónio foram emitidos na China de Província de Guizhou, em 1931, mas por causa de seu desgaste rápido, a sua cunhagem foi interrompido. O antimónio é resistente ao ataque por ácidos.
Quatro allotropes de antimônio são conhecidas: a forma metálica estável e três formas metaestáveis (explosivos, preto e amarelo). Antimónio metálico é um frágil, brilhante metal branco-prateado. Quando antimónio fundida é arrefecida lentamente, antimónio metálico cristaliza numa célula trigonal, isomorfo com a do alótropo cinza de arsénio . Uma forma explosiva rara de antimónio pode ser formada a partir da electrólise de tricloreto de antimônio. Quando riscado com um instrumento pontiagudo, uma reação exotérmica ocorre e libertação de fumos brancos fora como antimônio metálico é formada; quando esfregado com um pilão em um almofariz, ocorre uma forte detonação. Preto antimónio é formado por arrefecimento rápido de vapor de derivado de antimónio metálico. Ele tem a mesma estrutura cristalina como fósforo vermelho e preto arsênico, oxida no ar e pode inflamar-se espontaneamente. A 100 ° C, ele transforma-se gradualmente em forma estável. O allotrope amarelo de antimônio é o mais instável. Só foi gerado por oxidação de stibine (SBH 3) a -90 ° C. Acima desta temperatura e à luz ambiente, esta allotrope metastable transforma no allotrope preto mais estável.
Antimônio metálico adota uma estrutura em camadas ( espaço grupo R3 m n ° 166) em que as camadas consistem de franzidas anéis de seis membros fundidos. Os vizinhos mais próximos e próximos-nearest formar um complexo octaédrico distorcido, com três átomos no mesmo sendo um pouco mais perto do que os três átomos no próximo dupla camada. Esta embalagem relativamente estreita conduz a uma elevada densidade de 6,697 g / cm3, mas a fraca ligação entre as camadas leva à baixa dureza e fragilidade de antimónio.
Isótopos
Antimônio existe como dois isótopos estáveis, 121 Sb com uma abundância natural de 57,36% e 123 Sb com uma abundância natural de 42,64%. Ele também tem 35 radioisótopos, sendo que a mais longa duração é de 125 Sb com uma meia-vida de 2,75 anos. Além disso, 29 estados metaestáveis foram caracterizados. A maior parte destes é estável 124 Sb com uma meia-vida de 60,20 dias, que tem uma aplicação de alguma fontes de neutrões. Isótopos que são mais leves do que o estável 123 Sb tendem a decadência por β + decaimento, e aqueles que são mais pesadas tendem a deterioração pela β - decadência, com algumas exceções.
Ocorrência

A abundância de antimônio na Terra crosta é estimado em 0,2 a 0,5 partes por milhão, comparável ao tálio em 0,5 partes por milhão e prata em 0,07 ppm. Mesmo que este elemento não é abundante, que é encontrada em mais de 100 minerais espécies. Antimônio é encontrado às vezes de forma nativa, mas mais frequente que é encontrada no sulfeto estibina (Sb 2 S 3), que é o predominante minério mineral .
Compostos
Compostos de antimónio são muitas vezes classificados em aqueles de Sb (III) e Sb (V). Em relação ao seu congénere arsénio , a 5 estado de oxidação é mais estável.
Óxidos e hidróxidos
De trióxido de antimónio (Sb 4 O 6) é formado quando antimónio é queimado no ar. Na fase gasosa, este composto existe como Sb 4 O 6, mas que polimeriza em cima de condensação. Pentóxido de antimónio (Sb 4 O 10) só pode ser formada por oxidação pelo concentrada de ácido nítrico . Antimônio também forma um óxido misto-Valence, tetróxido de antimónio (Sb 2 O 4), que apresenta tanto Sb (III) e Sb (V). Ao contrário de fósforo e arsênico , estes são vários óxidos anfotérico, não formam bem definida oxoacids e reagir com ácidos para formar sais de antimônio.
Ácido Antimonous Sb (OH) 3 é desconhecido, mas o antimonite de sódio base conjugada ([Na 3 SBO 3] 4) formas sobre fusão óxido de sódio e Sb 4 O 6. Antimonites de metais de transição são também conhecidos. Ácido antimonic existe apenas como o hidrato HSB (OH) 6, formar sais que contêm o anião antimonato Sb (OH) -
6. Sais metálicos que contenham esta Desidratação rendimentos ânions óxidos mistos.
Muitos minérios de antimônio são sulfetos, incluindo estibina (Sb 2 S 3), pyrargyrite (Ag 3 SbS 3), zinkenite, jamesonite, e boulangerite. Pentasulfide antimônio é não-estequiométrico e dispõe de antimónio presente nas três estado de oxidação e SS títulos. Vários thioantimonides são conhecidos, tal como [Sb 6 S 10] 2- e [Sb 8 S 13] 2-.
Halides
Antimônio forma duas séries de halogenetos, SBX 3 e 5 SBX. Os trialogenetos SbF 3, SbCl 3, SBBR 3, e SBI 3 são todos os compostos moleculares que têm piramidal trigonal geometria molecular. SBF trifluoreto 3 é preparado por reacção de Sb 2 O 3 com IC:
- Sb 2 O 3 + 6 HF → SbF 2 3 + 3 H2O
É Lewis ácido e prontamente aceita íons de flúor para formar ânions complexos SBF -
4 e 2- SbF
5. Molten SbF 3 é um fraco condutor eléctrico. O tricloreto de SbCl 3 é preparado por dissolução Sb 2 S 3 em ácido clorídrico :
- Sb 2 S 3 + 6 HCl → SbCl 2 3 + 3 H 2 S
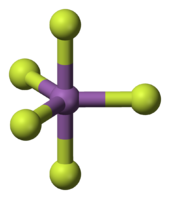
Os penta-SBF 5 e 5 têm SBCL geometria molecular bipiramidal trigonal na fase gasosa, mas na fase líquida, é SbF5 polimérico, enquanto SbCl 5 é monomérica. SbF5 é um poderoso ácido de Lewis utilizado para fazer o superácido ácido fluorantimônico ("HSbF 6").
Oxi são mais comuns do que para o antimónio arsénio e fósforo. De trióxido de antimónio se dissolve em ácido concentrado para formar compostos, tais como oxoantimonyl SbOCl e (SBO) 2 SO 4.
Antimonides, hidretos, e compostos organoantimony
Os compostos desta classe são geralmente descritos como derivados de 3- Sb. Formas de antimônio antimonides com metais, como o antimonide índio (InSb) e prata antimonide (Ag 3 Sb). Os de metal e zinco antimonides alcalinos, tais como Na 3 Sb e Zn 3 Sb 2, são mais reativos. Tratar estes antimonides com ácido produz o gás instável stibine, SbH 3:
- Sb 3- + 3 + H → SbH 3
Stibine também pode ser produzido por tratamento de sais de Sb 3+ com reagentes hidreto tais como boro-hidreto de sódio. Stibine decompõe espontaneamente à temperatura ambiente. Porque tem um stibine positiva calor de formação, é termodinamicamente instável e, portanto, antimónio não reage com hidrogénio directamente.
Organoantimony compostos são normalmente preparados por alquilação de halogenetos de antimónio com Reagentes de Grignard. Uma grande variedade de compostos são conhecidos tanto com Sb (III) e centros de Sb (V), incluindo os derivados mistos cloro-orgânico, aniões e catiões. Exemplos incluem Sb (C 6 H 5) 3 ( triphenylstibine), Sb 2 (C 6 H 5) 4 (com uma ligação Sb-Sb), e cíclico [Sb (C 6 H 5)] n. Compostos organoantimony pentacoordenado são comuns, sendo exemplos Sb (C 6 H 5) cinco e vários halogenetos relacionados.
História
O antimónio (III), sulfureto, Sb 2 S 3, foi reconhecido em predynastic Egito como um cosmético olho ( Kohl), logo em cerca 3100 aC, quando o paleta cosmética foi inventado.
Um artefato, disse ser parte de um vaso, feito de antimônio namoro de cerca de 3000 aC foi encontrado na Telloh, Caldéia (parte da atual Iraque ), e um objeto de cobre revestido com antimônio namoro entre 2500 aC e 2200 aC foi encontrado no Egito . Austen, em uma palestra de Herbert Gladstone em 1892, comentou que "nós só sabemos de antimônio nos dias de hoje como um metal altamente frágil e cristalina, que dificilmente poderia ser formado em um vaso útil, e, portanto, este notável 'achado' (artefato mencionado acima) deve representar a arte perdida da prestação de antimônio maleável ".
Moorey não estava convencido o artefato era de fato um vaso, mencionando que Selimkhanov, após sua análise do objeto Tello (publicado em 1975) ", tentou relacionar o metal a Transcaucásia antimônio natural" (ou seja, nativo metal) e que "os objetos de antimônio Transcaucásia são todos pequenos ornamentos pessoais. " Isto enfraquece a evidência para uma arte perdida "de tornar antimônio maleável."
A primeira descrição Europeia de um procedimento para isolar antimónio está no livro De la pirotechnia de 1540 por Vannoccio Biringuccio; este é anterior ao mais famoso livro de 1556 Agricola, De re metallica. Neste contexto Agricola tem sido muitas vezes incorretamente creditado com a descoberta de antimónio metálico. O livro Currus Triumphalis Antimonii (The Chariot triunfal do Antimônio), descrevendo a preparação de antimônio metálico, foi publicado na Alemanha em 1604. Foi suposto ter sido escrito por um Monge beneditino, escrevendo sob o nome Basilius Valentinus, no século 15; se fosse autêntico, o que não é, seria anteriores Biringuccio.
Antimónio puro foi bem conhecidos Jābir ibn Hayyān no século oitavo. Há uma controvérsia em curso, com tradutor Marcellin Berthelot afirmando antimônio nunca foi encontrado nos livros de Jabir, mas outros alegando que Berthelot traduziu apenas algumas das livros menos importantes, enquanto os mais interessantes (alguns dos quais podem descrever antimônio) ainda não são traduzidos , e seu conteúdo é completamente desconhecido.
A primeira ocorrência natural de antimônio puro na crosta da Terra foi descrito pelo Cientista sueco e engenheiro distrito de mina de locais Anton von Swab em 1783; o -sample tipo foi recolhido a partir do Sala Mina de Prata no distrito de mineração de Bergslagen Sala, Västmanland, Suécia .
Etimologia
As palavras antigas para antimônio têm em sua maioria, como o seu significado principal, Kohl, o sulfeto de antimônio. Plínio, o Velho, no entanto, faz uma distinção entre formas femininas de antimônio masculino e; a forma masculina é provavelmente o sulfeto, enquanto que a forma feminina, que é superior, mais pesado e menos friável, foi suspeito de ser antimônio metálico nativo.
Os egípcios chamado antimônio mśdmt; em hieróglifos, as vogais são incertos, mas há uma tradição árabe que a palavra é ميسديميت mesdemet. A palavra grega, stimmi στίμμι, é provavelmente uma palavra de empréstimo do árabe ou sdm egípcia
|
e é usado por Sótão trágico poetas do século 5 aC; mais tarde gregos também usado stibi στἰβι, como fez Celso e Plínio, escrita em latim, no primeiro século dC. Plínio também dá os nomes stimi [ sic], larbaris, alabastro, e os platyophthalmos "muito comuns", "olho grande" (a partir do efeito do cosmético). Autores latinos mais tarde adaptada para a palavra Latina como stibium. A palavra árabe para a substância, ao contrário do cosmético, pode aparecer como إثمد ithmid, athmoud, othmod, ou uthmod. Littré sugere a primeira forma, que é o mais antigo, deriva stimmida, um acusativo para stimmi.
A utilização de BS como o símbolo químico padrão para o antimónio é devido a Jöns Jakob Berzelius, que usou esta abreviatura do nome stibium. A forma latina medieval, a partir do qual as línguas modernas e tarde Grego Bizantino levar seus nomes para o antimónio, é antimonium. A origem desta é incerto; todas as sugestões têm alguma dificuldade ou de forma ou de interpretação. O etimologia popular, a partir ἀντίμοναχός anti-monachos ou antimoine francês, ainda tem adeptos; isso significaria "monge-assassino", e é explicado por muitos primeiros alquimistas sendo monges, e antimônio ser venenoso.
Outra etimologia popular é a palavra grega hipotético ἀντίμόνος antimonos, "contra a solidão", explicou como "não encontrado como metal", ou "não encontrado pura". Lippmann conjecturou uma palavra grega hipotético ανθήμόνιον anthemonion, o que significaria "florzinha", e cita vários exemplos de palavras gregas relacionadas (mas não que um) que descrevem químico ou biológico eflorescência.
Os primeiros usos de antimónio incluem as traduções, em 1050-1100, por Constantino, o Africano de tratados médicos árabes. Várias autoridades acreditam antimonium é uma corrupção de escriba de alguma forma árabe; Meyerhof deriva de ithmid; outras possibilidades incluem athimar, o nome árabe do metalóide, e um hipotético as-stimmi, derivadas ou paralelo ao grego.
Produção
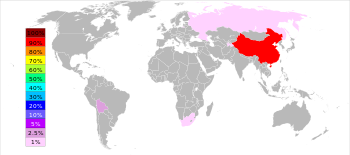
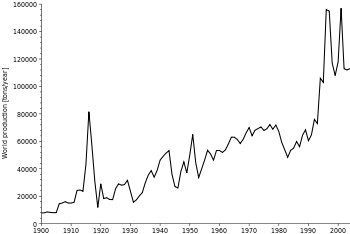
Principais produtores e os volumes de produção
O Britânico Geological Survey informou que, em 2005, a República Popular da China foi o maior produtor de antimônio, com uma participação mundial aproximadamente 84%, seguido à distância pela África do Sul, Bolívia e Tadjiquistão. Mina Xikuangshan em Província de Hunan tem os maiores depósitos na China com um depósito estimado de 2,1 milhões de toneladas.
Em 2010, de acordo com o US Geological Survey, a China respondeu por 88,9% da produção total de antimônio com a África do Sul, Bolívia e Rússia partilha o segundo lugar.
| País | Toneladas | % Do total |
|---|---|---|
| | 120.000 | 88,9 |
| | 3.000 | 2.2 |
| | 3.000 | 2.2 |
| | 3.000 | 2.2 |
| | 2000 | 1,5 |
| Top 5 | 131.000 | 97,0 |
| Total mundial | 135.000 | 100.0 |
No entanto, Roskill Consulting estima para a mostra principal de produção que, em 2010, a China detinha uma quota de 76,75% da oferta mundial, com 120.462 toneladas (90.000 toneladas de relatado e 30.464 toneladas de produção relatou-un), seguido pela Rússia (4,14% de participação, 6.500 toneladas de produção), Myanmar (3,76% de participação, 5897 toneladas), Canadá (3,61% de participação, 5660 toneladas), Tajiquistão (3,42% de participação, 5.370 toneladas) e Bolívia (3,17% de participação, 4980 toneladas).
Roskill estima que a produção secundária globalmente em 2010 foi de 39.540 toneladas.
Antimônio foi classificada em primeiro lugar em uma Lista de Riscos, publicado pela Britânico Geological Survey, no segundo semestre de 2011. A lista fornece uma indicação do risco relativo ao fornecimento de elementos químicos ou grupos de elementos necessários para manter a economia britânica atual e estilo de vida.
Além disso, antimônio foi identificado como uma das 12 matérias-primas críticas para a UE em um relatório publicado em 2011, principalmente devido à falta de oferta fora da China.
Relatado produção de antimônio na China caiu em 2010 e é pouco provável que aumente nos próximos anos, de acordo com o relatório Roskill. Não há depósitos de antimônio significativas na China têm sido desenvolvidos para cerca de dez anos, e os restantes reservas econômicas estão se esgotando rapidamente.
Maiores produtores de antimônio em todo o mundo, de acordo com Roskill, estão listados abaixo:
| País | Companhia | Capacidade (toneladas por ano) |
|---|---|---|
| | Recursos Mandalay | 2750 |
| | vário | 5460 |
| | Beaver Brook | 6000 |
| | Hsikwangshan Twinkling Estrela | 55.000 |
| | Hunan Chenzhou Mining | 20.000 |
| | China Tin Grupo | 20.000 |
| Shenyang Huacheng Antimônio | 15.000 | |
| | Kazzinc | 1000 |
| | Kadamdzhai | 500 |
| | SRS | 500 |
| | US Antimônio | 70 |
| | vário | 6000 |
| | GeoProMining | 6500 |
| | Murchison Consolidado | 6000 |
| | Unzob | 5500 |
| | desconhecido | 600 |
| | Cengiz & Özdemir Antimuan Madenleri | 2400 |
Reservas
De acordo com estatísticas do US Geological Survey (USGS), as reservas globais atuais de antimônio será esgotada em 13 anos. No entanto, o United States Geological Survey espera que mais recursos serão encontrados.
| País | Reservas (toneladas de conteúdo antimônio) | % Do total |
|---|---|---|
| | 950.000 | 51.88 |
| | 350.000 | 19.12 |
| | 310.000 | 16.93 |
| | 50.000 | 2.73 |
| | 21.000 | 1.15 |
| Outros países | 150.000 | 8.19 |
| Total mundial | 1831000 | 100.0 |
Processo de produção
A extracção de antimónio a partir de minérios depende da qualidade do minério e composição do minério. Mais antimónio é extraído como o sulfureto; minérios de grau inferior são concentrados por flotação, enquanto que os minérios de grau superior é aquecido a 500-600 ° C, a temperatura a que se derrete estibnite e é separada do minerais de ganga. O antimónio pode ser isolado a partir do sulfureto de antimónio em bruto por uma redução com sucata de ferro:
- Sb 2 S 3 + 3 Fe → Sb 2 + 3 FeS
O sulfureto é convertido em um óxido e vantagem é muitas vezes tomada a volatilidade do óxido de antimónio (III), o qual é recuperado a partir de ustulação. Este material é muitas vezes usado diretamente para as principais aplicações, as impurezas sendo arsênico e sulfeto. O isolamento a partir do seu óxido de antimónio é realizado por uma redução carbotérmica:
- 2 Sb 2 O 3 + 3 C → 4 Sb + 3 CO 2
Os minérios de grau inferior são reduzidos em altos-fornos, enquanto os minérios de grau superior são reduzidos em fornos reverberatory.
Aplicações
Cerca de 60% de antimónio é consumido em retardadores de chama, e 20% é usado em ligas de baterias, mancais de deslizamento e soldas.
Retardadores de chama
Antimônio é usado principalmente como o seu trióxido na tomada compostos à prova de chamas. É quase sempre utilizada em combinação com os retardadores de chama halogenados, com a única excepção de ser em polímeros contendo halogéneo. A formação de compostos de antimónio halogenados é a causa para a chama de trióxido de antimónio efeito de retardamento, devido a reacção destes compostos com átomos de hidrogénio e, provavelmente, também com átomos de oxigénio e os radicais OH, inibindo assim a fogo. Os mercados para esses aplicativos retardadores de chama incluem roupas, brinquedos, aeronaves e assento automóvel tampas das crianças. É também utilizado no fibra de vidro compósitos indústria como um aditivo para resinas de poliéster para itens tais como tampas do motor de aeronaves leves. A resina vai queimar, enquanto a chama é realizada a ele, mas irá extinguir-se assim que a chama é removido.
Alloys
O antimónio forma uma altamente útil liga com vantagem , aumentar a sua dureza e resistência mecânica. Para a maioria das aplicações que envolvam o chumbo, quantidades variáveis de antimónio são usados como liga de metal. Em baterias de chumbo-ácido, esta alteração melhora as características de carregamento e reduz a geração de hidrogênio indesejado durante o carregamento. Ele é usado em ligas de antifricção (tais como Babbitt metal), em balas e granalha de chumbo, revestimento de cabos, tipo de metal (por exemplo, para máquinas de impressão de linotipo), solda (alguns " lead-free "soldas conter 5% Sb), em estanho, e em endurecer ligas com baixo estanho conteúdo na fabricação de tubos de órgão.
Outras aplicações
Três outras aplicações compõem quase todo o resto do consumo. Uma dessas utilizações é como estabilizante e um catalisador para a produção de tereftalato de polietileno. Outra aplicação é servir como um agente de clarificação para remover as bolhas microscópicas de vidro , principalmente para telas de TV; isto é conseguido através da interacção de iões antimónio com oxigénio, o que interfere o último a partir de bolhas que se formam. A terceira principal aplicação é a utilização como pigmento.
Antimônio está sendo cada vez mais utilizado no semicondutor indústria como um dopante para fortemente dopado tipo-n silício bolachas na produção de diodos, detectores infravermelhos, e Dispositivos de efeito Hall. Na década de 1950, minúsculas contas de um chumbo liga -antimônio foram usadas para dopar os emissores e colecionadores de NPN transistores de junção liga com antimônio. Antimoneto de índio é usado como um material para médio Os detectores de infravermelhos.
Existem poucas aplicações biológicas ou médicas para antimônio. Tratamentos principalmente contendo antimônio são conhecidos como antimoniais e são usados como eméticos. Compostos de antimónio são usados como drogas antiprotozoários. Tartarato de potássio antimonial, ou tártaro emético, já foi usado como um anti- droga schistosomal de 1919 por diante. Ele foi subsequentemente substituído por praziquantel. O antimónio e seus compostos são utilizados em várias Preparações veterinárias como anthiomaline lítio ou antimónio tiomalato, que é utilizado como um condicionador da pele em ruminantes. Antimônio tem um efeito nutritivo ou condicionado em tecidos queratinizados, pelo menos em animais.
Medicamentos baseados em antimónio, tais como antimoniato de meglumina, também são considerados as drogas de escolha para o tratamento de leishmaniose em animais domésticos. Infelizmente, além de ter baixa índices terapêuticos, as drogas são pobres em penetrar a medula óssea, onde alguns dos Leishmania amastigotas residem, e assim a cura da doença - especialmente a forma visceral - é muito difícil. Antimônio elementar como um pill antimônio já foi usado como uma medicina. Pode ser reutilizados por outras pessoas após a ingestão.
Nas cabeças de alguns fósforos de segurança, antimónio (III) é usado sulfureto. Antimónio-124 é usado em conjunto com o berílio em fontes de neutrões; o raios gama emitidos por antimónio-124 iniciar a fotodesintegração de berílio. Os nêutrons emitidos têm uma energia média de 24 keV. Sulfetos de antimônio foram mostrados para ajudar a estabilizar o coeficiente de atrito em materiais de pastilhas de travão para automóveis.
Antimônio também é usado na fabricação de balas e traçadores de bala. Este elemento também é usado em cosméticos, tintas tradicionais evento e artesanato de arte em vidro. Um aplicativo como um opacificante em esmalte diminuiu em uso após a década de 1930, depois de várias intoxicações foram relatados.
Precauções
O antimónio e muitos dos seus compostos são tóxicos e os efeitos do envenenamento antimónio são semelhantes aos envenenamento por arsênico. A toxicidade de antimónio é de longe mais baixa do que do arsénio; isto pode ser causado pelas diferenças significativas de absorção, metabolismo e excreção entre arsénio e antimónio. A absorção de antimónio (III) ou de antimónio (V) no tracto gastrointestinal é, no máximo, 20%. O antimónio (V) não é quantitativamente reduzida para antimónio (III) na célula (de facto de antimónio (III) é oxidado para antimónio (V) em vez).
Desde metilação de antimónio não ocorrer, a excreção de antimónio (V) na urina é a principal via de eliminação. Como o arsénio, o efeito mais grave de intoxicação aguda de antimônio é cardiotoxicidade e o resultado miocardite, no entanto, também pode se manifestar como Adams-Stokes síndrome que o arsênico não. Os casos notificados de intoxicação por antimônio equivalente a 90 mg tartarato de potássio e antimónio dissolvidos de esmalte tem sido relatado para mostrar efeitos apenas de curto prazo. Uma intoxicação com 6 g de tartarato de potássio de antimónio foi relatada como resultando em morte após 3 dias.
A inalação de poeira de antimónio é prejudicial e, em certos casos pode ser fatal; em pequenas doses, antimônio provoca dores de cabeça , tonturas, e depressão. Doses maiores, como o contato prolongado com a pele pode causar dermatite, ou danificar os rins e no fígado, causando violentos e freqüentes vómitos, levando à morte em poucos dias.
O antimónio é incompatível com forte agentes oxidantes, ácidos fortes, ácidos de halogéneo, cloro , ou flúor . Ele deve ser mantido afastado do calor.
Antimônio lixivia de tereftalato de polietileno (PET) para garrafas de líquidos. Embora os níveis observados durante garrafas de água estão abaixo de água potável orientações, suco de frutas concentrados (para os quais são estabelecidos quaisquer orientações) produzidos no Reino Unido foram encontrados para conter até 44,7 mg / L de antimónio, bem acima dos limites da UE para água da torneira de 5 ug / L. As diretrizes são:
- Organização Mundial de Saúde : 20 ug / L
- Japão: 15 ug / L
- Estados Unidos Agência de Proteção Ambiental, Saúde do Canadá eo Ministério do Meio Ambiente de Ontário: 6 mg / L
- Ministério Federal Alemão do Meio Ambiente: 5 mg / L