
Argão
Sobre este escolas selecção Wikipedia
Esta seleção Escolas foi originalmente escolhido pelo SOS Children para as escolas no mundo em desenvolvimento sem acesso à internet. Ele está disponível como um download intranet. Clique aqui para saber mais sobre apadrinhamento de crianças.
| Argão | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
18 Ar | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Aparência | |||||||||||||||||||||||||||||||||||||||||||||||||
gás incolor que exibe um brilho lilás / violeta, quando colocado num campo eléctrico de alta tensão  Linhas espectrais de argônio | |||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades gerais | |||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | árgon, Ar, 18 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Pronúncia | / ɑr ɡ ɒ n / | ||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria Metallic | gases nobres | ||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | 18 (gases nobres) , 3, p | ||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atômico padrão | 39,948 (1) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Ne ] 3s 2 3p 6 2, 8, 8 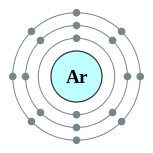 | ||||||||||||||||||||||||||||||||||||||||||||||||
| História | |||||||||||||||||||||||||||||||||||||||||||||||||
| Descoberta | Lord Rayleigh e William Ramsay (1894) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Primeiro isolamento | Lord Rayleigh e William Ramsay (1894) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | gás | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densidade | (0 ° C, 101,325 kPa) 1,784 g / L | ||||||||||||||||||||||||||||||||||||||||||||||||
| Líquido densidade no pb | 1,40 g cm -3 · | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de fusão | 83,80 K , -189,35 ° C, -308,83 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de ebulição | 87,30 K, -185,85 ° C, -302,53 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto Triplo | 83,8058 K (-189 ° C), 69 kPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto crítico | 150,87 K, 4,898 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusão | 1.18 kJ mol -1 · | ||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de vaporização | 6,43 kJ mol -1 · | ||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidade calorífica molar | 5 R / 2 = 20,786 J · · mol -1 K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Pressão de vapor | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades atômicas | |||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidação | 0 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Eletronegatividade | não há dados (escala Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Energias de ionização ( Mais) | 1º: 1520,6 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2: 2665,8 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| 3: 3931 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| O raio de covalência | 106 ± 22:00 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals raio | 188 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelânea | |||||||||||||||||||||||||||||||||||||||||||||||||
| A estrutura de cristal | cúbica de face centrada  | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamento magnético | diamagnetic | ||||||||||||||||||||||||||||||||||||||||||||||||
| Condutividade térmica | 17.72x10 -3 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidade do som | (Gás, 27 ° C) 323 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registo CAS | 7440-37-1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | |||||||||||||||||||||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de árgon | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
Argon é um elemento químico com o símbolo Ar e número atômico 18. É no grupo 18 (gases nobres) da tabela periódica . Argon é o terceiro gás mais comum na atmosfera da Terra , em 0,93% (9300 ppm), tornando-se cerca de 23,8 vezes tão abundantes como próximos gás atmosférico mais comum, o dióxido de carbono (390 ppm), e mais de 500 vezes tão abundante como o próximo gás mais comum nobre, neon (18 ppm). Quase tudo isto é árgon radiogênico árgon-40 derivado a partir do decaimento de potássio-40 na crosta da Terra. No universo, árgon-36 é, de longe, o isótopo mais comum de árgon, sendo o isótopo árgon preferido produzido por estelar nucleossíntese em supernovas .
O nome "árgon" é derivado do Grego palavra αργον significando "preguiçoso" ou "a uma inactiva", uma referência ao facto de o elemento sofre quase sem reacções químicas. A completa octeto (oito elétrons) no shell atômica exterior faz argônio estáveis e resistentes à ligação com outros elementos. Sua temperatura do ponto triplo de 83,8058 K é um ponto fixo de definição na Escala Internacional de Temperatura de 1990.
O árgon é produzido industrialmente pela destilação fracionada do ar líquido. Argon é usado principalmente como um gás de proteção inerte em soldadura e outros processos industriais de alta temperatura onde as substâncias normalmente não reactivos tornar-se reativa; por exemplo, uma atmosfera de árgon é usado em fornos eléctricos de grafite para evitar que a grafite da queima. Gás argônio também tem usos na incandescentes e fluorescentes, e outros tipos de tubos de descarga de gás. Argon faz um distintivo laser de gás azul esverdeado.
Características

Árgon tem aproximadamente a mesma solubilidade em água como o oxigénio, e é 2,5 vezes mais solúvel em água do que o azoto . Árgon é incolor, inodoro, não tóxico e como um sólido, líquido e gasoso. Argon é quimicamente inerte sob a maioria das condições e formas não confirmados compostos estáveis à temperatura ambiente.
Embora árgon é um gás nobre , verificou-se ter a capacidade de formar alguns compostos. Por exemplo, a criação de fluorohydride argônio (Harf), um composto marginalmente estável de árgon com flúor e hidrogênio , foi relatado por pesquisadores da Universidade de Helsínquia, em 2000. Embora os compostos químicos neutros do estado fundamental de argônio são actualmente limitados a Harf, argônio pode formar clatratos com água quando os átomos de que está preso numa estrutura das moléculas de água. Contendo argônio íons e complexos estados excitados, como ArH + e ArF, respectivamente, são conhecidos como existentes. Cálculos teóricos previram vários compostos de argônio que deve ser estável, mas para as quais não há rotas de síntese são actualmente conhecidos.
História
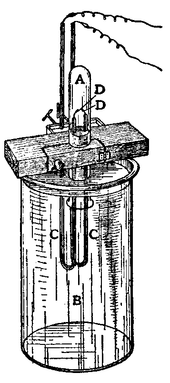
Argon (αργος, grega que significa "inativo", em referência à sua inatividade química) era suspeito de estar presente no ar por Henry Cavendish em 1785, mas não foi isolado até 1894 por Lord Rayleigh e Sir William Ramsay na Escócia, em um experimento no qual eles removido todo o oxigênio , dióxido de carbono , água e nitrogênio a partir de uma amostra de ar limpo. Eles determinaram que o azoto produzido a partir de compostos químicos foi de meio por cento mais leve do que o azoto da atmosfera. A diferença parecia insignificante, mas que era importante o suficiente para atrair a sua atenção por muitos meses. Eles concluíram que não havia outro gás no ar misturado com o nitrogênio. Argon também foi encontrado em 1882 através de pesquisa independente de HF Newall e WN Hartley. Cada observadas novas linhas no espectro de cores de ar, mas não foram capazes de identificar o elemento responsável pelas linhas. Árgon tornou-se o primeiro membro dos gases nobres a ser descoberto. O símbolo para argônio é agora Ar, mas até 1957 era um.
Ocorrência
Argon constitui 0,934% em volume e 1,28% em massa da atmosfera da Terra , e do ar é a principal matéria-prima utilizada pela indústria para produzir produtos de argônio purificados. O árgon é isolado a partir do ar através de fraccionamento, o mais geralmente por criogênico destilação fraccionada, um processo que também produz purificada de azoto , oxigénio , néon , cripton e xénon .
Isótopos
Os principais isótopos de árgon são encontradas na Terra 40 Ar (99,6%), 36 Ar (0,34%), e 38 Ar (0,06%). De ocorrência natural de 40 K com uma semi-vida de 1,25 x 10 9 anos, decai para o estável 40 Ar (11,2%) de captura de elétrons ou de emissão de positrões, e também para estável Ca 40 (88,8%) através decaimento beta. Estas propriedades e rácios são utilizados para determinar a idade de pedras pelo método de K-Ar namoro.
Na atmosfera da Terra, 39 Ar é feita por atividade dos raios cósmicos, principalmente com 40 Ar. No ambiente do subsolo, que também é produzida através captura de nêutrons por 39 K ou alfa por emissão de cálcio 37. Ar é criado a partir do nêutron espalação de Ca como um 40 resultado da subsuperfície explosões nucleares. Tem uma meia-vida de 35 dias.
Argon é notável em que a sua composição isotópica varia muito entre diferentes locais do sistema solar . Onde a principal fonte de árgon é o decaimento do 40 K em rochas, 40 Ar será o isótopo dominante, uma vez que está na Terra. Argon produzida diretamente pela nucleosíntese estelar, em contraste, é dominada pela alfa nuclídeo processo, 36 Ar. Correspondentemente, árgon solares contém 84,6% com base em 36 Ar medições de vento solar.
A predominância de radiogênico 40 Ar é responsável pelo facto de o peso atómico padrão de árgon terrestre é maior do que a do elemento seguinte, de potássio . Este era intrigante no momento árgon foi descoberto, uma vez que Mendeleev tinha colocado os elementos em sua tabela periódica , a fim de peso atômico, embora a inércia de argônio implica que deve ser colocado antes do potássio metal alcalino reactivo. Henry Moseley depois resolveu este problema ao mostrar que a tabela periódica é realmente dispostos em ordem de número atômico . (Ver História da Tabela Periódica).
O muito maior abundância atmosférica de árgon em relação aos outros gases nobres também é devido à presença de radiogênico 40 Ar. Primordial 36 Ar tem uma abundância de apenas 31,5 ppmv (= 9340 ppmv x 0,337%), comparável ao de neon (18,18 ppmv).
O Atmosfera marciana contém 1,6% de 40 Ar e 5 36 ppm de Ar. O Sonda espacial Mariner fly-by do planeta Mercúrio em 1973 descobriu que Mercúrio tem uma atmosfera muito fina, com 70% de argônio, acredita-se que resultam de lançamentos do gás como um produto de decaimento do material radioativo do planeta. Em 2005, o Huygens sonda também descobriu a presença de 40 Ar no Titã, a maior lua de Saturno .
Compostos
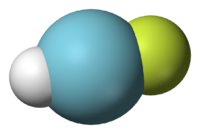
Octeto completo de Argon de elétrons indica completo e s p subshells. Este nível de energia externa completa faz argônio muito estável e extremamente resistente a ligação com outros elementos. Antes de 1962, o árgon e outros gases raros foram considerados como quimicamente inerte e incapaz de formar compostos; no entanto, os compostos de gases nobres mais pesados uma vez que foram sintetizados. Em agosto de 2000, o primeiro composto de árgon, foi formado por pesquisadores da Universidade de Helsínquia. Brilhando a luz ultravioleta para argônio congelado contendo uma pequena quantidade de fluoreto de hidrogénio com iodeto de césio, fluorohydride argônio (Harf) foi formado. É estável até 40 kelvin (-233 ° C). O metastable ArCF 2+
2 dication, que é de valência isoeletrônica com fluoreto de carbonilo, foi observada em 2010.
Produção
Industrial
O árgon é produzido industrialmente pela destilação fracionada do ar líquido numa criogênico a unidade de separação de ar; um processo que separa azoto líquido, que ferve a 77,3 K, de árgon, que ferve a 87,3 K, e oxigênio líquido, que ferve a 90,2 K. Sobre 700.000 toneladas de árgon são produzidos em todo o mundo a cada ano.
Em decaimentos radioativos
40 Ar, o mais abundante isótopo de árgon, é produzido pela decomposição de 40 K com uma semi-vida de 1,25 x 10 9 anos, captura de elétrons ou emissão de pósitrons. Devido a isto, é usado em potássio-argônio para determinar a idade das rochas.
Aplicações

Existem várias razões diferentes árgon é utilizado em aplicações particulares:
- Um é necessário um gás inerte. Em particular, o árgon é a alternativa mais barata quando azoto não é suficientemente inerte.
- Baixo condutividade térmica é necessária.
- As propriedades electrónicas (ionização e / ou o espectro de emissão) são necessários.
Outros gases nobres provavelmente iria funcionar bem na maior parte destas aplicações, mas árgon é, de longe, o mais barato. Árgon é barato, uma vez que é um subproduto da produção de oxigênio líquido e de azoto líquido a partir de um criogênico a unidade de separação de ar, ambos os quais são usados em larga escala industrial. Os outros gases nobres (excepto hélio ) são produzidos desta forma, bem como, de árgon, mas é a mais abundantes de longe, uma vez que tem uma concentração muito mais elevada na atmosfera. A maior parte das aplicações de árgon surge simplesmente porque é inerte e relativamente barato.
Os processos industriais
O árgon é utilizado em alguns processos industriais de alta temperatura, em que as substâncias normalmente não reactivos se tornam reactivos. Por exemplo, uma atmosfera de árgon é usado em fornos eléctricos de grafite para evitar que a grafite da queima.
Para alguns destes processos, a presença de gases de azoto ou de oxigénio pode causar defeitos no interior do material. O árgon é usado em vários tipos de tais como soldadura por arco de gás metal de soldadura por arco e Soldagem TIG , bem como no tratamento de titânio e de outros elementos reactivos. Uma atmosfera de árgon, é também utilizado para crescimento de cristais de silício e germânio .
Argon é uma asfixiante na indústria avícola, tanto para abate em massa após surtos da doença, ou como um meio de abate mais humano do que o banho elétrico. Relativamente elevada densidade de Argon faz com que ele permaneça perto do chão durante gaseamento. Sua natureza não-reativa o torna adequado num produto alimentar, e uma vez que substitui o oxigênio dentro do pássaro morto, argônio também aumenta a vida de prateleira.
O árgon é por vezes utilizado para extinção de incêndios, onde os danos ao equipamento é para ser evitado.
Pesquisa científica
Argon é usado, principalmente na forma líquida, como o destino para diretos de matéria escura pesquisas. A interação de uma hipotética FRACO partícula com núcleo de árgon produz luz de cintilação que é então detectada por tubos fotomultiplicadores. Detectores de duas fases também usam gás argônio para detectar os elétrons ionizados produzidos durante a dispersão WIMP-núcleo. Tal como acontece com a maioria dos outros gases liquefeitos nobres, o árgon tem um lightyield cintilação alta (~ 51 fotões / keV), é transparente para a sua própria luz de cintilação, e é relativamente fácil de purificar. Em comparação com xénon , árgon é mais barato e tem um perfil distinto de cintilação tempo que permite a separação de recuos electrónicos de recuos nucleares. Por outro lado, a sua intrínseca fundo de raios gama é maior devido a 39 Ar contaminação, a menos que se usa fontes de argônio subterrâneas com um baixo nível de radioatividade. Detectores de matéria escura que operam atualmente com árgon líquido incluem urdidura, ARDM, MicroClean e DEAP-I.
Preservativo

Árgon é usado para deslocar o ar e oxigénio contendo humidade no material de embalagem para alargar o prazo de vida dos conteúdos (o árgon tem Código Europeu aditivo alimentar E938). Oxidação aérea, hidrólise, e outras reacções químicas que degradam os produtos são retardados ou impedidos inteiramente. Garrafas de produtos químicos de alta pureza e de determinados produtos farmacêuticos estão disponíveis em garrafas seladas ou embaladas em ampolas de árgon. Em vinificação, argônio é usado para barris top-off para evitar a oxidação aérea de etanol de ácido acético durante o processo de envelhecimento.
Argon também está disponível em latas de aerossol do tipo, que podem ser usados para preservar a compostos tais como verniz, poliuretano, tintas, etc. para o armazenamento após a abertura.
Desde 2002, o americano Lojas National Archives importantes documentos nacionais, como o Declaração de Independência ea Constituição no prazo de casos cheio de argônio para retardar a sua degradação. Usando argônio reduz o vazamento de gás, em comparação com o hélio usado nos últimos cinco décadas.
Equipamento de laboratório

Árgon pode ser usado como o gás inerte dentro Linhas de Schlenk e caixas de luvas. A utilização de árgon ao longo de azoto comparativamente menos caro é preferível que o azoto pode reagir com os reagentes ou aparelhos experimentais.
Árgon pode ser usado como o gás de transporte em cromatografia em fase gasosa e em espectrometria de massa por ionização por electropulverização; é o gás de escolha para o plasma utilizado no ICP espectroscopia . O árgon é preferido para o revestimento por pulverização de amostras de microscopia eletrônica de varredura. Gás argônio também é comumente usado para de deposição por pulverização de finas películas, como no microeletrônica e para wafer de limpeza em microfabricação.
Uso médico
Criocirurgia procedimentos tais como uso crioablação liquefeito argônio para destruir cancerosas células. Em cirurgia é utilizada num processo chamado "árgon reforçada coagulação", que é uma forma de feixe de plasma de árgon eletrocirurgia. O procedimento acarreta um risco de produzir embolia gasosa no paciente e resultou na morte de uma pessoa por meio deste tipo de acidente. Lasers argônio azuis são usadas em cirurgia para soldar artérias, destruir tumores, e para corrigir defeitos oculares. Também tem sido usada experimentalmente para substituir azoto na mistura respiratória ou de descompressão, a velocidade da eliminação do azoto dissolvido a partir do sangue. Ver Argox.
Iluminação

Luzes incandescentes são preenchidos com árgon, para preservar o filamentos a alta temperatura da oxidação. É utilizado para o modo específico que ioniza e emite luz, tal como em globos de plasma e calorimetria em experimental de física de partículas . Lâmpadas de descarga de gás cheios de argônio fornecer luz azul. Argon também é utilizado para a criação de azul e verde luz laser.
Segurança
Embora árgon é não-tóxico, que é 38% mais denso do que o ar e, por conseguinte, é considerado um perigoso asfixiante em áreas fechadas. Também é difícil de detectar, pois é incolor, inodoro, insípido e. Um incidente de 1994 no qual um homem foi asfixiados depois de entrar uma seção argônio cheio de tubo de óleo em construção em Alaska destaca os perigos de vazamento do tanque de argônio em espaços confinados, e sublinha a necessidade de uso adequado, armazenamento e manuseamento.

