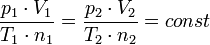A lei de Avogadro
Você sabia ...
Crianças SOS, que corre cerca de 200 sos escolas no mundo em desenvolvimento, organizado esta selecção. Crianças SOS é a maior doação de caridade do mundo órfãos e crianças abandonadas a chance da vida familiar.
A lei de Avogadro (Hipótese de Avogadro, ou o Princípio de Avogadro) é uma lei do gás nomeado após Amedeo Avogadro, que em 1811 a hipótese de que:
- Volumes iguais de gases ideais ou perfeitos, à mesma temperatura e pressão, contêm o mesmo número de partículas ou moléculas.
Assim, o número de moléculas de um determinado volume de de gás é independente do tamanho ou massa das moléculas de gás quando relacionada com um gás ideal aproximada. É muito importante notar que se aplicam um gás ideal ou perfeito definição de gás (um gás hipotético que consiste em partículas idênticas de volume zero, sem forças intermoleculares, mas a capacidade de trocar impulso com as moléculas de gás idênticas) para um gás tal como verdadeiro hidrogênio ou nitrogênio para que possamos aproximar estatisticamente o comportamento do gás real.
Como um exemplo, volumes iguais de molecular de hidrogénio e azoto que contém o mesmo número de moléculas, desde que eles estão à mesma temperatura e pressão e observar o comportamento ideal ou perfeito gás. Embora isto não é o caso do mundo real, é estatisticamente muito próximo.
O aspecto menor da lei pode ser indicado matematicamente como:
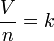 .
.
onde:
- V é o volume do gás.
- n é o número de em moles do gás.
- k é uma constante de proporcionalidade.
No entanto, esta equação acima é apenas um trivial, que é válido para todas as substâncias homogêneos, incluindo líquidos e sólidos homogêneos. Esta relação é fácil deduzir; sua validade foi assumido antes do trabalho de Avogadro.
A consequência mais importante da lei de Avogadro é o seguinte: A constante de gás ideal tem o mesmo valor para todos os gases. Isto significa que a constante
onde:
- p é a pressão do gás
- T é a temperatura do gás
tem o mesmo valor para todos os gases, independente do tamanho ou massa das moléculas de gás. Esta declaração não é trivial, e ele encarna engenhosa percepção de Avogadro sobre a natureza da gases ideais. Levou décadas para provar a lei de Avogadro com base no teoria cinética dos gases.
Um mol de um gás ideal ocupa 22,4 litros (dm³) a STP, e ocupa 24,45 litros em SATP (Standard Ambient Temperatura e Pressão = 25 graus C e 1 atm / 101.3kPa). Este volume é muitas vezes referida como a volume molar de um gás ideal. Gases reais podem divergir a partir deste valor.
O número de moléculas de uma mole é chamado número de Avogadro : cerca de 6,022 x 10 23 partículas por mole.
A lei de Avogadro, em conjunto com o combinado lei do gás, constitui a lei do gás ideal.