
Catálise
Você sabia ...
Esta seleção wikipedia foi escolhido por voluntários que ajudam Crianças SOS da Wikipedia para este Seleção Wikipedia para as escolas. Patrocínio da criança ajuda as crianças uma a uma http://www.sponsor-a-child.org.uk/ .
Em química e biologia , a catálise é um modo de acelerar a velocidade de uma reacção química por meio de contacto dos reagentes com uma substância chamada um catalisador, que por si só não é consumido pela reacção global. Em termos mais gerais, pode-se, por vezes, chamar qualquer coisa que acelera um processo, um "catalisador" (Do grego καταλύειν, ou seja, para anular e para desatar ou para pegar).
Um catalisador proporciona uma via alternativa para produtos, a via catalítica ser sujeito a mais baixa energia de activação do que na reacção não catalisada. A energia de activação reduzido aumenta a taxa de reacção . Os catalisadores geralmente mudar no decurso de uma reacção mas são regenerados.
Um bom exemplo do uso de um catalisador é na disproporciona�o de peróxido de hidrogénio para dar água e oxigênio :
- 2 H 2 O 2 → 2 H2O + O2
Esta reacção é lenta, como demonstrado pelo facto de que se pode comprar soluções de peróxido de hidrogénio. Após a adição de dióxido de manganês para o peróxido de hidrogénio, a reacção ocorre rapidamente como assinalado por efervescência de oxigênio. Nas demonstrações, o oxigênio evoluída é detectável por seu efeito sobre uma tala brilhante. O dióxido de manganês pode ser recuperado e reutilizado indefinidamente, portanto, é um catalisador - que não é consumido pela reacção. (A H 2 O 2 vendido como um agente de esterilização nas farmácias for demasiado diluída para o sistema funcionar de forma dramática.)
Um promotor modifica quimicamente um catalisador, mas não é ele próprio um catalisador. Um inibidor reduz a eficácia do (ou diminui o efeito de) um catalisador.
História
Os processos frase catalisada foi cunhado por Jöns Jakob Berzelius em 1836 para descrever as reacções que são acelerados por substâncias que permanecem inalterados depois da reacção. Outros químicos iniciais foram envolvidas na catálise Alexander Mitscherlich que, em 1831, que se refere o contato com os processos e Johann Wolfgang Döbereiner que falou de ação de contato e cuja isqueiro com base em hidrogénio e um de platina esponja se tornou um enorme sucesso comercial em 1820. Humphrey Davy descobriu o uso de platina em catálise. Na década de 1880, Wilhelm Ostwald em Universidade de Leipzig iniciaram uma série de investigações sistemáticas em reacções que foram catalisadas pela presença de ácidos e bases, e descobriu que tanto reacções químicas ocorrem a taxas finitas, e que estas taxas pode ser usado para determinar as forças de ácidos e bases. Para este trabalho, Ostwald foi premiado com o 1909 Prêmio Nobel de Química .
Mecanismo típico
Os catalisadores geralmente reagir com um ou mais reagentes para formar um intermediário que subsequentemente se obter o produto final da reacção, no processo de regeneração do catalisador. O seguinte é um esquema de reacção típico, em que C representa o catalisador de reagentes, A e B são, e D é o produto da reacção de A e B:
- A + C → CA (1)
- B + AC → ABC (2)
- ABC → CD (3)
- CD → C D + (4)
Embora o catalisador (C) é consumido pela reacção de 1, é produzido subsequentemente por reacção de 4, de modo que para a reacção geral:
- A + B D →
Ciclos catalíticos
Um ciclo catalítico ou mecanismo catalítico é um mecanismo de reacção que envolve um catalisador. Ciclos catalíticos são fundamentais para qualquer discussão sobre a catálise, seja em bioquímica , química organometálica, ou química do estado sólido.
Muitas vezes, um catalisador denominado de sacrifício é também parte do sistema de reacção com o objectivo de regenerar o verdadeiro catalisador em cada ciclo. Como o nome indica o catalisador sacrificial não é regenerado e em vez disso é irreversivelmente consumidos. Este composto sacrificial é também conhecido como um catalisador estequiométrica quando adicionado em quantidades estequiométricas em relação ao reagente principal. Normalmente, o catalisador é uma verdadeira molécula e adicionados em quantidades tão pequenas quanto possível, caro e complexo. O catalisador de estequiométrica, por outro lado deve ser barata e abundante.
Os catalisadores de reacção e a energética
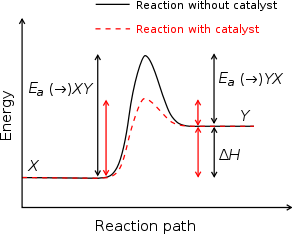
Catalisadores trabalho, fornecendo um (alternativa) mecanismo que envolve um estado de transição diferente e menor energia de ativação . O efeito disto é que as colisões mais moleculares têm a energia necessária para atingir o estado de transição. Assim, os catalisadores podem efectuar reacções que, embora termodinamicamente possível, não seria de funcionar sem a presença de um catalisador, ou realizá-las muito mais rápido, mais específico, ou a temperaturas mais baixas. Isto pode ser observado numa Distribuição de Boltzmann e diagrama de perfil de energia. Isto significa que os catalisadores de reduzir a quantidade de energia necessária para iniciar uma reacção química.
Os catalisadores não pode fazer reacções energeticamente desfavoráveis possível - eles não têm qualquer efeito sobre o equilíbrio químico de uma reacção porque a taxa de a parte da frente e a reacção inversa são igualmente afectados (ver também termodinâmica ). A variação de energia livre de uma reacção de líquido é o mesmo quer um catalisador é usado ou não; o catalisador apenas torna mais fácil para ativar.
O SI unidade derivada para a medição da actividade catalítica de um catalisador, é a katal, que é moles por segundo. O grau de actividade de um catalisador também pode ser descrito pela virar número (ou TON) e a eficiência catalítica na virada sobre frequência (TOF). O equivalente bioquímica é a unidade de enzima.
Para obter mais informações sobre a eficiência da catálise enzimática ver o Seção enzima # Kinetics.
Autocatálise
Em autocatálise, uma reacção produz catalisadores.
Os tipos de catalisadores
Os catalisadores podem ser tanto ou heterogénea homogênea. Biocatalisadores são muitas vezes vistos como um grupo separado.
Catalisadores heterogéneos estão presentes em diferentes fases do reagentes (por exemplo, um sólido de catalisador num líquido mistura de reacção ), ao passo que os catalisadores homogéneos são na mesma fase (por exemplo, uma catalisador dissolvido numa mistura líquida de reacção).
Catalisadores heterogêneos
Um modelo simples para catálise heterogénea envolve o fornecimento de um catalisador superfície sobre a qual os reagentes (ou substratos) tornam-se temporariamente adsorvidas. Bonds no substrato tornar-se enfraquecido suficientemente por novos títulos a serem criados. Os laços entre os produtos e o catalisador são mais fracos, assim que os produtos são liberados. Diferentes mecanismos possíveis para reacções em superfícies são conhecidos, dependendo do modo como a adsorção ocorre ( Langmuir-Hinshelwood e Eley-Rideal).
Por exemplo, no Haber processo para a fabricação de amoníaco , finamente divididas de ferro actua como um catalisador heterogéneo. Sítios activos sobre o metal permitir ligação parcial fraco para o reagente de gases , que são adsorvido sobre a superfície do metal. Como resultado, a ligação no interior da molécula de um reagente é enfraquecido e as moléculas reagentes são mantidos em estreita proximidade uns dos outros. Desta forma, o particularmente forte ligação tripla em azoto é enfraquecido e as moléculas de hidrogénio e azoto é apresentado mais perto em conjunto do que seria o caso na fase gasosa, de modo que a taxa de reacção aumenta.
Outros catalisadores heterogéneos incluem vanádio (V) no óxido de processo de contacto, níquel no fabrico de margarina, de alumina e de sílica no craqueamento de alcanos e platina , ródio e paládio em conversores catalíticos. Silicatos mesoporosos têm encontrado utilidade na catálise heterogênea reação porque a sua grande área de superfície acessível permite o carregamento de alta catalisador.
Em motores de automóveis, incompleta combustão do combustível produz monóxido de carbono , que é tóxico. A faísca elétrica e altas temperaturas também permitem que o oxigênio e nitrogênio para reagir e forma monóxido de azoto e dióxido de nitrogênio, que são responsáveis por fotoquímica poluição e chuva ácida . Os conversores catalíticos reduzir tais emissões por adsorção CO e NO sobre a superfície catalítica, em que os gases passam por um . reacção redox dióxido de carbono e azoto são dessorvido da superfície e emitida como gases relativamente inofensivos:
- 2NO + 2CO → 2CO 2 + N2
Muitos catalisadores utilizados em refinarias e em aplicações petroquímicas são regenerados e reutilizados várias vezes para economizar custos e energia e reduzir o impacto ambiental da reciclagem ou eliminação de catalisadores usados.
Catalisadores homogêneos
Os catalisadores homogéneos são na mesma fase que os reagentes.
Em catálise homogénea o catalisador é uma molécula que facilita a reacção. O catalisador provoca reacção com um ou mais reagentes para formar intermediários (s) e, em alguns casos, um ou mais produtos. Os passos subsequentes levar à formação de produtos restantes e para a regeneração do catalisador.
Os exemplos de catalisadores homogéneos são os seguintes:
1) O ião H + (aq), que actua como um catalisador em esterificação, assim como na reacção inversa - a hidrólise de ésteres, tais como acetato de metilo é catalisada por H +
2) O cloro radicais livres no quebra de ozônio . Estes radicais formam-se pela acção de radiação ultravioleta radiação sobre clorofluorocarbonetos (CFCs). Eles reagem com o ozônio para formar moléculas de oxigênio e regenerar os radicais catalisador. Este processo destrói a camada fina de ozono estratosférico.
- Cl + · O 3 → ClO · + O 2
- ClO · · + O → Cl + · O 2
3) Óxidos de azoto na oxidação de dióxido de enxofre para trióxido de enxofre por dioxigénio no processo câmara.
Biocatalisadores
Natural enzimas são catalisadores em metabolismo. Na bioquímica catálise também é observada com abzimas e ribozimas, deoxyribozymes também foram criados em laboratório.
Biocatalisadores pode ser pensado como uma mistura de um catalisador homogéneo e heterogénea. Isto é porque a enzima é em si mesma solução, mas a reacção ocorre na superfície da enzima. Vários factores afectam a actividade de enzimas. Os mais importantes são:
- Temperatura
- pH
- A concentração da enzima
- A concentração do substrato
Eletrocatalisadores
No contexto da eletroquímica, especificamente no engenharia de célula de combustível, vários catalisadores ricos em metais são usados para promover a eficiência de um metade de reacção que ocorre no interior da célula de combustível. Um tipo comum de electrocatalisador de célula de combustível é baseada em pequenas nanopartículas de platina que adornam um pouco maiores de carbono partículas. Quando este tipo de electrocatalisador é platina em contacto com um dos eléctrodos de uma célula de combustível, que aumenta a velocidade da redox metade de reacção em que oxigénio do gás é reduzida para a água (ou hidróxido ou peróxido de hidrogénio ).
Significado
Catalysis é de suma importância na indústria química. A produção da maioria dos produtos químicos industrialmente importantes, envolve a catálise. Dois processos comerciais notáveis são o Haber processo para amoníaco e a síntese Síntese Fischer-Tropsch. A investigação sobre a catálise é um importante campo na ciência aplicada, e envolve muitos campos da química, nomeadamente no química organometálica, e física. Catálise é importante em muitos aspectos da ciência ambiental , a partir da catalisador em automóveis para as supostas causas do buraco de ozônio . Catalítico, em vez de reacções estequiométricas são preferidos em ambientalmente amigável química verde, devido à diminuição da quantidade de resíduos gerados.
Exemplos notáveis
As estimativas são de que 90% de todos os produtos químicos produzidos comercialmente envolvem catalisadores em algum estágio de seu processo de fabricação.
Dióxido de manganês é usado no laboratório para preparar oxigénio pela decomposição de peróxido de hidrogénio a oxigénio e água .
Aplicações bem conhecidas de catalisadores sintéticos são:
- Catalisadores feitos de platina e manganês quebrar alguns dos subprodutos mais nocivos da exaustão do automóvel. Os catalisadores utilizados são micro-modificados para ter grandes áreas de superfície.
- o Haber processo para a síntese de amoníaco a partir de azoto e hidrogénio , em que o ferro é o catalisador.
Exemplos de catalisadores que executam transformações específicas em grupos funcionais:
- Transformações de olef�icas grupos:
- o Catalisador de Ziegler-Natta usado para produzir em massa polietileno e polipropileno.
- o Catalisador de Grubbs de metátese de olefinas.
- o Processo Monsanto
- o Processo Wacker
- o Reacção de Heck.
Estes exemplos dados mostram que diferentes catalisadores executar outras transformações sobre os mesmos grupos funcionais, em que a reacção não se proceder, proceder de forma muito lenta, ou prosseguir de uma forma não selectiva, sem a presença do catalisador.
O catalisador mais comum é a protão. Muitos metais de transição e metal de transição complexos são utilizados em catálise bem.
Novos rumos - organocatálise
Enquanto os catalisadores de metais de transição são bem estabelecida, uma nova tendência é de organocatálise que usam moléculas orgânicas relativamente simples como catalisadores. Enquanto tipicamente, carga de catalisador é muito mais elevada do que os catalisadores à base de metais de transição, os catalisadores são geralmente comercialmente disponíveis em grandes quantidades, ajudando a reduzir drasticamente os custos. Organocatalisadores da "nova geração" são competitivos para catalisadores contendo metais tradicionais e são devido à inibição baixo produto aplicável em quantidades subestequiométricas. O caráter químico de Organocatalisadores oferece novas e atraentes perspectivas e vantagens para sinteticamente químicos que trabalham.
Processos catalíticos
Em 2005, os processos catalíticos gerado cerca de $ 900 bilhões em produtos no mundo inteiro. (Pdf)
- Catálise ácido-base
- Catalisadores feitos de platina e ródio quebrar alguns dos subprodutos mais nocivos da exaustão do automóvel.
- As células de combustível
- Síntese Fischer-Tropsch.
- Processo de Haber (síntese de amoníaco a partir de azoto e hidrogénio , onde comum de ferro é utilizado como um catalisador)
- Hidrogenação
- Metanol síntese
- Ácido nítrico produção
- Petróleo refino e processamento
- Alkylation
- Craqueamento catalítico - quebra de cadeia longa de hidrocarbonetos em pedaços menores
- Nafta reforma
- Reforma a vapor do hidrocarbonetos para produzir gás de síntese
- Ácido sulfúrico produção
- Transesterificação
- A polimerização de olefinas

