
Cério
Você sabia ...
Esta seleção é feita para as escolas de caridade infantil leia mais . Clique aqui para saber mais sobre apadrinhamento de crianças.
| Cério | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
58 Ce | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aparência | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
branco prateado  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades gerais | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | cério, Ce, 58 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pronúncia | / s ɪər Eu ə m / | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria Metallic | lantanídeos | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | n / D, 6, f | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atômico padrão | 140,116 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Xe ] 4f 1 5d 1 6s 2 2, 8, 18, 19, 9, 2 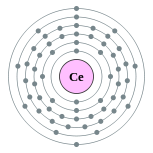 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| História | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Descoberta | Martin Heinrich Klaproth, Jöns Jakob Berzelius, Wilhelm Hisinger (1803) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Primeiro isolamento | Carl Gustaf Mosander (1839) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidade (perto RT) | 6,770 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líquido densidade no pf | 6,55 g cm -3 · | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de fusão | 1,068 K , 795 ° C, 1463 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de ebulição | 3716 K, 3443 ° C, 6229 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusão | 5.46 kJ mol -1 · | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de vaporização | 398 kJ mol -1 · | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidade calorífica molar | 26,94 J · · mol -1 K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressão de vapor | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades atômicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidação | 4, 3, 2, 1 (Levemente óxido de base) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Eletronegatividade | 1,12 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energias de ionização | 1º: 534,4 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Segunda: 1050 kJ mol -1 · | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3: 1949 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio atômico | 181,8 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| O raio de covalência | 204 ± 21:00 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelânea | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A estrutura de cristal | cúbica de face centrada  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamento magnético | paramagnético | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistividade elétrica | ( RT) (β, poli) 828 Nco · m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Condutividade térmica | 11.3 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Expansão térmica | ( RT) (γ, poli) 6,3 uM / (mK) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidade do som (haste fina) | (20 ° C) 2100 m · s -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| O módulo de Young | (Forma γ) 33,6 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de cisalhamento | (Forma γ) 13,5 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massa de módulo | (Forma γ) 21,5 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rácio de Poisson | (Forma γ) 0,24 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza de Mohs | 2,5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza de Vickers | 270 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 412 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registo CAS | 7440-45-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de cério | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
O cério é um elemento químico com o símbolo Ce e número atômico 58. É um prateado metal macio, dúctil, que oxida facilmente no ar. O cério foi nomeado após o planeta anão Ceres (ele próprio nomeado para o Deusa romana da agricultura). O cério é o mais abundante do elementos de terras raras, que compõem cerca de 0,0046% da crosta terrestre em peso. Pode ser encontrada num certo número de minerais, sendo a mais importante monazita e bastnasite. As aplicações comerciais de cério são numerosos. Eles incluem catalisadores, aditivos para combustível para reduzir emissões e ao vidro e esmaltes para mudar sua cor. Óxido de cério é um componente importante de vidro para polimento pós e fósforos usados em telas e lâmpadas fluorescentes. É também utilizado no "flint" (na verdade ferrocério) de isqueiros.
Características
Propriedades físicas
O cério é um metal prateado, pertencente ao lantanídeo grupo. Assemelha-se ferro em cor e brilho, mas é macio, e ambos maleável e dúctil. Cério tem o terceiro maior gama de líquido qualquer elemento: 2648 ° C (795 ° C a 3443 ° C) ou 4766 ° F (1463 ° F a 6229 ° F). (Apenas neptunium e tório têm intervalos mais líquidos.)
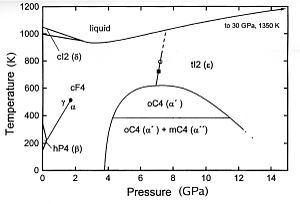
O cério tem uma estrutura eletrônica variável. A energia do nível 4f interior é quase a mesma que a dos electrões de valência ou exteriores, e apenas uma pequena energia é necessária para mudar a ocupação relativa destes níveis electrónicos. Isto dá origem a estados de valência dupla. Por exemplo, uma alteração de volume de cerca de 10% ocorre quando o cério é submetido a pressões altas ou baixas temperaturas. Afigura-se que a valência muda de cerca de 3 a 4 quando é arrefecido ou comprimido. O comportamento de baixa temperatura de cério é complexa. Quatro modificações alotrópicas-se que existam: cério, à temperatura ambiente e à pressão atmosférica é conhecido como γ-cério. Após arrefecimento a -16 ° C, alterações γ-cério para β-cério. Os restantes inicia-γ cério para alterar a α-cério quando arrefecida a -172 ° C, e a transformação está completa a -269 ° C. α-cério tem uma densidade de 8,16; δ-cério existe acima de 726 ° C. À pressão atmosférica, cério líquido é mais denso do que a sua forma sólida no ponto de fusão.
O cério é de metal altamente pirofórico, o que significa que quando é facto ou riscado, as aparas resultantes pegar fogo.
Propriedades químicas
Cério de metal mancha lentamente no ar e queimaduras prontamente a 150 ° C, para formar de cério (IV), óxido de:
- Ce + O 2 → CeO2
O cério é bastante electropositive e reage lentamente com água fria e muito rapidamente com água quente para formar hidróxido de cério:
- Ce 2 (s) + 6 H2O (l) → 2 Ce (OH) 3 (aq) + 3H 2 (g)
Cério de metal reage com todos os halogéneos:
- Ce 2 (s) + 3 F 2 (g) → 2 CEF 3 (s) [branco]
- Ce 2 (s) + 3 Cl2 (g) → 2 CeCl3 (s) [branco]
- Ce 2 (s) + 3 Br 2 (g) → 2 CEBR 3 (s) [branco]
- Ce 2 (s) + 3 I 2 (g) → 2 CEI 3 (s) [amarelo]
Cério dissolve prontamente em diluída de ácido sulfúrico para formar soluções contendo o incolor Ce (III), iões que existem como uma [Ce (OH 2) 9] 3+ complexos:
- Ce 2 (s) + 3 H 2 SO 4 (aq) → 2 Ce 3+ (aq) + SO 3 2-
4 (aq) + 3H 2 (g)
Compostos

Cério (IV) (cério) sais são de cor laranja vermelho ou amarelada, enquanto cério (III) (ceroso) sais são geralmente branco ou incolor. Ambos os estados de oxidação absorvem a luz ultravioleta fortemente. Cério (III) pode ser utilizado para o fabrico de vidro que são incolores, ainda absorver luz ultravioleta quase completamente. Cério pode ser facilmente detectado em misturas de terras raras por um teste qualitativo muito sensível: adição de amónia e peróxido de hidrogénio a uma solução aquosa de lantanídeos produz uma cor castanha escura característica, se estiver presente o cério.
Cério apresenta três estados de oxidação , 2, 3 e 4. O estado 2 é rara e é observado em CEH 2, CEI 2 e CES. O composto mais comum de cério é de cério (IV), óxido de (CeO2), que é usado como " Rouge do joalheiro ", bem como nas paredes de alguns auto-limpeza de fornos. Dois comum Os agentes oxidantes utilizadas em As titulações são de cério (IV) (sulfato de amónio cérico (NH4) 2 Ce (SO 4 3)) de amónio e sulfato de amónio e cério (IV) nitrato (nitrato de amónio cérico ou CAN, (NH4) 2 Ce (NO3 6)). Cério também forma uma cloreto, ou CeCl3 cloreto de cério (III), utilizado para facilitar a reacções grupos carbonilo em química orgânica . Outros compostos incluem o cério (III), carbonato de (Ce 2 (CO 3) 3), cério (III), fluoreto (CEF 3), óxido de cério (III) (Ce 2 O 3), bem como de cério (IV) sulfato (sulfato cérico, Ce (SO4) 2) e de cério (III), triflato (Ce (OSO 2 CF 3) 3).
Os dois estados de oxidação de cério diferem enormemente em basicidade: cério (III) é uma base forte, comparável ao dos outros lantanídeos trivalentes, mas de cério (IV) é fraca. Esta diferença tem sempre permitido cério ser de longe a de outra forma um grupo notoriamente difíceis mais facilmente isolada e purificada de todos os lantanídeos, dos elementos para separar. Uma vasta gama de procedimentos foram concebidos ao longo dos anos para explorar a diferença. Estes incluem:
- Os hidróxidos mistos de lixiviação com ácido nítrico diluído: os lantanídeos trivalentes dissolver em condições isentas de cério, de cério e tetravalente permanece no resíduo insolúvel sob a forma de um concentrado para ser ainda mais purificado através de outros meios. Uma variação deste utiliza ácido clorídrico e os óxidos de calcinados bastnasita, mas a separação é menos acentuada.
- Precipitar de cério ou uma solução de nitrato de cloreto utilizando permanganato de potássio e carbonato de sódio numa razão molar 1: 4.
- Fervente soluções de nitrato de terras raras com bromato de potássio e mármore fichas.
Anteriormente usado comercialmente foi um método em que uma solução de cério (IV) em ácido nítrico seria adicionado para diluir o ácido sulfúrico. Isto fez com que o cério (IV) em grande parte, para precipitar como um seu sal de base, deixando lantanídeo trivalente em solução. No entanto, o precipitado finamente dividido foi difícil de filtrar a partir do meio altamente corrosivo. Usando os métodos clássicos de separação de terra-rara, houve uma vantagem considerável para uma estratégia de remoção a partir da mistura de cério no início. Cério tipicamente composta de 45% do cerite ou terras raras monazíticas, e removendo-o início grandemente reduzida a maior parte do que necessário para ser processado (ou o custo de reagentes a serem associados com tal tratamento). No entanto, nem todos os métodos de purificação de cério invocado basicidade. De nitrato de amónio cérico [hexanitratocerate amónio (IV)] cristalização a partir de ácido nítrico era um método de purificação. Cério (IV) nitrato (ácido hexanitratoceric) foi mais facilmente extraível em certos solventes (por exemplo, fosfato de tri-n-butilo) do que os lantanídeos trivalentes. No entanto, a prática moderna na China parece ser a de fazer a purificação de cério por contra-corrente extração por solvente, na sua forma trivalente, assim como os outros lantanídeos.
Cério (IV) é um oxidante forte sob condições ácidas, mas estável sob condições alcalinas, quando é de cério (III), que se torna um redutor forte, facilmente oxidado pelo oxigénio atmosférico (O 2). Esta facilidade de oxidação sob condições alcalinas leva à separação geoquímica ocasional das maneiras entre cério e os lantanídeos leves trivalentes sob supergene intemperismo condições, levando diversas vezes para o "negativo cério anomalia "ou para a formação do cerianita mineral. Ar-oxidação alcalina de cério (III) é a forma mais económica para obter a cério (IV), que pode então ser tratada em solução ácida.
Isótopos
Existem quatro isótopos de cério que ocorrem naturalmente. Estes são 140 Ce, que compõe 88,5% do cério na terra; 142 Ce, que compõe 11% de cério na terra; 138 Ce, o que torna-se 0,3% de cério na terra; e 136 Ce, o que torna-se 0,2% de cério na Terra. No entanto, apenas 140 Ce é estável. 142 Ce, 138 Ce, e 136 Ce têm meias-vidas de 5 × 10 16 anos, 1,5 × 10 15 anos, e 70 trillion anos, respectivamente. Além disso, alguns isótopos de cério ocorrem naturalmente em quantidades vestigiais, como o resultado da fissão de Urânio.
39 isótopos de cério foram descobertos por completo. Eles variam de 119 a 157 Ce Ce.
História
Cério foi descoberto em Bastnäs na Suécia por Jöns Jakob Berzelius e Wilhelm Hisinger, e de forma independente em Alemanha por Martin Heinrich Klaproth, ambos em 1803. O cério foi nomeado por Berzelius após a planeta anão Ceres , descoberto dois anos antes (1801). Tal como originalmente isolado, cério estava na sua forma de óxido, e foi chamado de céria, um termo que ainda é usado. O próprio metal era demasiado electropositivo para ser isolados por tecnologia de fundição, em seguida,-corrente, uma característica de metais das terras raras em geral. Após o desenvolvimento de Eletroquímica por Humphry Davy , cinco anos depois, as terras logo produziu os metais que continham. Ceria, como isolado em 1803, continha todos os lantanídeos presentes no minério cerite de Bastnäs, Suécia, e, portanto, continha apenas cerca de 45% do que é agora conhecido por ser ceria puro. Não foi até Carl Gustaf Mosander conseguiram remover óxido de lantânio e "didymia" no final dos anos 1830, que ceria foi obtido puro. Wilhelm Hisinger era um rico proprietário de minas e cientista amador, e patrocinador do Berzelius. Ele detida ou controlada a mina em Bastnäs, e vinha tentando há anos para descobrir a composição da abundante ganga pesado rocha (o "tungstênio de Bastnäs"), agora conhecido como cerite, que ele tinha em sua mina. Mosander e sua família viveu por muitos anos na mesma casa como Berzelius, e Mosander foi, sem dúvida, persuadido por Berzelius para investigar ceria mais.
Quando as terras raras foram descobertos em primeiro lugar, uma vez que eles eram bases fortes como os óxidos de cálcio ou de magnésio, que foram pensados para ser divalente. Assim, cério "cérico" foi pensado para ser trivalente, e a relação de estado de oxidação foi, portanto, considerada 1,5. Berzelius estava aborrecido para continuar recebendo a proporção correta 1.33.
No final dos anos 1950, o Chemical Division of American Chemical Corporation Potash e de Lindsay West Chicago, Illinois, em seguida, o maior produtor de terras raras do mundo, estava oferecendo compostos de cério em dois intervalos de pureza, "comercial" em 94-97% de pureza, e "purificada", informou em um 99,9 +% de pureza. Em sua 01 de outubro de 1958 lista de preços, as quantidades de uma libra dos óxidos foram ao preço de 3,30 dólares ou 8,10 dólares, respectivamente, para os dois graus de pureza; o preço por libra para quantidades de 50 libras foram, respectivamente, 1,95 dólares ou US $ 4,95 para os dois graus. Sais de cério foram proporcionalmente mais barato, o que reflecte o seu conteúdo líquido inferior de óxido.
Ocorrência

O cério é o mais abundante do elementos de terras raras, perfazendo aproximadamente 0.0046% da crosta da Terra em peso. Encontra-se em uma série de minerais, incluindo alanita (também conhecido como orthite) - (Ca, Ce, La, Y) 2 (Al, Fe) 3 (SiO 4) 3 (OH), monazita (Ce, La, Th, Nd, Y) PO 4, bastnasite (Ce, La, Y) CO 3 F, hydroxylbastnasite (Ce, La, Nd) CO 3 (OH, F), rhabdophane (Ce, La, Nd) PO 4-H 2 O, zircão (ZrSiO4), e synchysite Ca (Ce, La, Nd, Y) (CO 3) 2 F. Monazita e bastnasite são actualmente as duas mais importantes fontes de cério. Grandes depósitos de monazita, allanite, e bastnasite fornecerão cério, tório e outros metais terras raras durante muitos anos vindouros.
Teor de cério no solo varia entre 2 e 150 partes por milhão (ppm), com uma média de 50 ppm. A água do mar contém 1,5 partes por trilhão de cério. Não há quase nenhum cério na atmosfera.
Produção
As misturas minerais são triturada, moída e tratada com ácido sulfúrico concentrado quente de ácido sulfúrico para produzir sulfatos solúveis em água de terras raras. Os filtrados ácidos são parcialmente neutralizados com hidróxido de sódio até pH 3-4. Tório precipita da solução como hidróxido e é removido. Depois que a solução é tratada com oxalato de amónio para converter terras raras em que a sua insolúvel oxalatos. Os oxalatos são convertidos em óxidos pela recozimento. Os óxidos são dissolvidos em ácido nítrico que exclui um dos componentes principais, cério, cujos sais são insolúveis em HNO 3. Cério metálico é preparado por técnicas de redução de metallothermic, tal como por redução do fluoreto de cério ou com cloreto de cálcio , ou por electrólise de cloreto de cério fundido ou outros halogenetos de cério. A técnica metallothermic é usado para produzir produtos de alta pureza de cério.
Aplicações
A aplicação tecnológica importante para cério óxido (III) é um catalisador para a redução das emissões de CO nos gases de escape dos veículos a motor. Em particular, o óxido de cério é adicionado em combustíveis diesel. Outro uso importante do óxido de cério é um hidrocarboneto catalisador em fornos auto-limpantes, incorporados paredes do forno e como um catalisador de craqueamento de petróleo em refino de petróleo.
Cério (IV) é considerado um dos mais eficazes agentes para polimento de precisão de componentes ópticos. Compostos de cério são também utilizados no fabrico de vidro , tanto como um componente e, como um descolorante. Por exemplo, o cério (IV) em combinação com óxido de de titânio (IV), óxido dá uma cor amarelo dourado com vidro; também permite a absorção selectiva de luz ultravioleta em vidro. Óxido de cério tem um alto índice de refracção e adiciona-se esmalte para torná-lo mais opaca.
Cério (IV) é utilizado em camisas de incandescência, tais como o Welsbach manto, onde foi combinado com tório, lantânio , magnésio ou ítrio óxidos. Dopado com outros óxidos de terras raras, que tem sido investigado como um electrólito sólido de óxido sólido temperatura intermédia As células de combustível: de cério (IV), óxido de cério-(III), óxido de ciclo ou CeO 2 / Ce ciclo 2 O 3 é um dois passos termoquímico processo baseado em cério (IV), óxido de cério e (III), óxido de produção de hidrogênio.
A fotoestabilidade dos pigmentos pode ser aumentada pela adição de cério. Ele fornece pigmentos com resistência à luz e impede polímeros claras de escurecimento na luz solar. Placas de vidro de televisão estão sujeitos a bombardeamento de electrões, o que tende a escurecer-los por criação de Centros de cor de centro-F. Este efeito foi suprimido pela adição de óxido de cério. O cério é também um componente essencial de fósforos usados em telas de TV e lâmpadas fluorescentes. Sulfureto de cério forma um pigmento vermelho que permanece estável de até 350 ° C. O pigmento é uma alternativa não tóxica aos pigmentos de sulfeto de cádmio.
A utilização tradicional de cério estava na pyrophoric liga de metal misto utilizado para pedras de luz. Por causa da elevada afinidade de cério de enxofre e de oxigénio, que é usado em várias ligas de alumínio e ligas de ferro. Em aços , degasifies cério e pode ajudar a reduzir sulfetos e óxidos, e é um endurecimento por precipitação no agente aço inoxidável. A adição de cério de ferros fundidos opõe grafitização e produz um ferro maleável. A adição de 3-4% de cério de magnésio ligas, juntamente com 0,2 a 0,6% de zircónio , ajuda refinar o grão e dar som fundição de formas complexas. Ele também adiciona resistência ao calor para castings de magnésio. Cério metálico é adicionado às vezes a de alumínio para melhorar a resistência do alumínio à corrosão.
Ligas de cério são usados em ímãs permanentes e em tungstênio eletrodos para Soldagem TIG . O cério é usado em iluminação de arco de carbono, especialmente na imagem em movimento da indústria. O cério é um oxalato fármaco anti-emético. Cério (IV) sulfato é utilizado extensivamente como um volumétrica agente oxidante na análise quantitativa. De nitrato de amónio cérico é útil um oxidante de um electrão em química orgânica, utilizado para gravar oxidativamente componentes electrónicos, e como padrão primário para a análise quantitativa.
Papel biológico
Cério pode agir semelhante ao cálcio em organismos, de modo acumula-se no ossos em pequenas quantidades. O cério é também encontrada em pequenas quantidades em plantas de tabaco, cevada e da madeira de árvores de faia . No entanto, muito pouco se acumula no cério cadeia alimentar. Humana sangue contém 0.001 ppm, ossos humanos contêm de 3 ppm, e humano tecido contém 0,3 ppm de cério. Há um total de 40 miligramas de cério em um humano típico com 70 kg. Os seres humanos tipicamente consomem menos de um miligramas por dia de cério. Cério não apresenta nenhuma função biológica conhecida, mas sais de cério pode estimular o metabolismo.
Precauções
Cério, como todos os metais das terras raras, é de baixo para toxicidade moderada. O cério é um agente de redução forte e inflama-se espontaneamente ao ar a 65 a 80 ° C. Gases da combustão do cério são tóxicos. A água não deve ser utilizado para parar incêndios de cério, como cério reage com água para produzir gás de hidrogénio. Trabalhadores expostos ao cério apresentaram coceiras, sensibilidade ao calor, e lesões na pele. O cério não é tóxico quando consumido por via oral, mas os animais injetados com altas doses de cério morreram devido a colapso cardiovascular. O cério é mais perigosa para os organismos aquáticos, em virtude de ser prejudicial para as membranas celulares. Cério (IV) é um poderoso agente oxidante a elevadas temperaturas e vai reagir com materiais orgânicos combustíveis. Enquanto cério não é radioativo, a classe comercial impura pode conter tório, que é fracamente radioativa.

