
Cloro
Você sabia ...
Crianças SOS, que corre cerca de 200 sos escolas no mundo em desenvolvimento, organizado esta selecção. Patrocínio da criança ajuda as crianças uma a uma http://www.sponsor-a-child.org.uk/ .
| Cloro | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
17 Cl | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Aparência | ||||||||||||||||||||||||||||
gás verde-amarelo pálido  | ||||||||||||||||||||||||||||
| Propriedades gerais | ||||||||||||||||||||||||||||
| Nome, símbolo, número | cloro, Cl, 17 | |||||||||||||||||||||||||||
| Pronúncia | / k l ɔər Eu n / KLOHR -een ou / k l ɔər ɨ n / KLOHR -ən | |||||||||||||||||||||||||||
| Categoria Metallic | halogéneo | |||||||||||||||||||||||||||
| Grupo, período, bloco | (17) átomos de halogénio , 3, p | |||||||||||||||||||||||||||
| Peso atômico padrão | 35,45 (1) | |||||||||||||||||||||||||||
| Configuração eletrônica | [ Ne ] 3s 2 3p 5 2, 8, 7 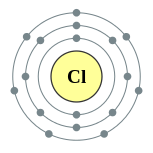 | |||||||||||||||||||||||||||
| História | ||||||||||||||||||||||||||||
| Descoberta | Carl Wilhelm Scheele (1774) | |||||||||||||||||||||||||||
| Primeiro isolamento | Carl Wilhelm Scheele (1774) | |||||||||||||||||||||||||||
| Reconhecido como um elemento por | Humphry Davy (1808) | |||||||||||||||||||||||||||
| Propriedades físicas | ||||||||||||||||||||||||||||
| Fase | gás | |||||||||||||||||||||||||||
| Densidade | (0 ° C, 101,325 kPa) 3,2 g / L | |||||||||||||||||||||||||||
| Líquido densidade no pb | 1,5625 g · cm -3 | |||||||||||||||||||||||||||
| Ponto de fusão | 171,6 K , -101,5 ° C, -150,7 ° F | |||||||||||||||||||||||||||
| Ponto de ebulição | 239,11 K, -34,04 ° C, -29,27 ° F | |||||||||||||||||||||||||||
| Ponto crítico | 416,9 K, 7,991 MPa | |||||||||||||||||||||||||||
| Calor de fusão | (Cl 2) 6,406 kJ mol -1 · | |||||||||||||||||||||||||||
| Calor de vaporização | (Cl 2) 20,41 kJ mol -1 · | |||||||||||||||||||||||||||
| Capacidade calorífica molar | (Cl 2) 33,949 J · · mol -1 K -1 | |||||||||||||||||||||||||||
| Pressão de vapor | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Propriedades atômicas | ||||||||||||||||||||||||||||
| Estados de oxidação | 7, 6, 5, 4, 3, 2, 1, -1 (Fortemente ácida óxido) | |||||||||||||||||||||||||||
| Eletronegatividade | 3,16 (escala de Pauling) | |||||||||||||||||||||||||||
| Energias de ionização ( Mais) | 1º: 1251,2 kJ · mol -1 | |||||||||||||||||||||||||||
| 2: 2298 kJ · mol -1 | ||||||||||||||||||||||||||||
| 3: 3822 kJ · mol -1 | ||||||||||||||||||||||||||||
| O raio de covalência | 102 ± 16:00 | |||||||||||||||||||||||||||
| Van der Waals raio | 175 pm | |||||||||||||||||||||||||||
| Miscelânea | ||||||||||||||||||||||||||||
| A estrutura de cristal | orthorhombic  | |||||||||||||||||||||||||||
| Ordenamento magnético | diamagnetic | |||||||||||||||||||||||||||
| Resistividade elétrica | (20 ° C)> 10 Ω · m | |||||||||||||||||||||||||||
| Condutividade térmica | 8,9 × 10 -3 W · m -1 · K -1 | |||||||||||||||||||||||||||
| Velocidade do som | (Gás, 0 ° C) 206 m · s -1 | |||||||||||||||||||||||||||
| Número de registo CAS | 7782-50-5 | |||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | ||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de cloro | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
O cloro é um elemento químico com o símbolo Cl e número atômico 17. O cloro é no grupo halogéneo (17) e é a segunda mais leve depois de halogéneo flúor . O elemento é um gás amarelo-verde, em condições normalizadas, onde forma moléculas diatómicas. Ele tem a maior afinidade eletrônica eo terceiro mais alto electronegatividade de todos os elementos; Por esta razão, o cloro é um forte agente oxidante. O cloro livre é raro na Terra e, normalmente, é resultado da oxidação directa ou indirecta de oxigênio.
O composto mais comum de cloro, cloreto de sódio , é conhecida desde os tempos antigos. Por volta de 1630 gás de cloro foi sintetizada pela primeira vez em uma reacção química, mas não é reconhecido como uma substância fundamentalmente importante. Caracterização de gás de cloro foi feito em 1774 pela Carl Wilhelm Scheele, que supõe que um óxido de um elemento novo. Em 1809, os químicos sugeriu que o gás poderia ser um elemento puro, e isso foi confirmado por Sir Humphry Davy em 1810, que deu o nome a partir do grego clássico : khlôros χλωρóς "verde pálido".
Quase todos cloro na crosta da Terra ocorre como cloreto em vários compostos iônicos, incluindo sal de mesa. É o segundo halogênio mais abundante e 21 mais abundante elemento químico na crosta da Terra. Cloro elementar é comercialmente produzido a partir de salmoura por eletrólise. O alto potencial de oxidação do cloro elementar levou comercialmente ao cloro da livre de branqueamento e desinfectantes utilizações, bem como as suas muitas utilizações de um reagente essencial na indústria química. O cloro é usado no fabrico de uma vasta gama de produtos de consumo, cerca de dois terços das quais são produtos químicos orgânicos, tais como cloreto de polivinilo, bem como muitos intermediários para a produção de plásticos e outros produtos finais que não contêm o elemento. Como um desinfetante comum, compostos de cloro e cloro geradoras elementares são utilizados mais diretamente na piscinas para mantê-los limpos e sanitária.
Na forma de iões cloreto, o cloro é necessária para todas as espécies conhecidas de vida. Outros tipos de compostos de cloro são raros em organismos vivos, e compostos orgânicos clorados produzidos artificialmente variar de inerte a substâncias tóxicas. No atmosfera superior, as moléculas orgânicas que contêm cloro, tais como clorofluorocarbonetos têm sido implicados na destruição do ozono . Pequenas quantidades de cloro elementar são gerados por oxidação de cloreto de em hipoclorito neutrófilos, como parte da resposta imunitária contra as bactérias. Cloro elementar em altas concentrações é extremamente perigoso e venenoso para todos os organismos vivos, e foi historicamente usado na Primeira Guerra Mundial como o primeiro agente de guerra química gasoso.
Características
As características físicas de cloro e seus compostos

Em a temperatura e pressão padrão, dois átomos de cloro formar o molécula diatomic Cl 2. Este é um gás verde-amarelo que tem um odor forte característico, familiar para a maioria dos comum lixívia doméstica. A ligação entre os dois átomos é relativamente fraco (apenas 242,580 ± 0,004 kJ / mol), o que torna a molécula Cl 2 é altamente reactivo. O ponto de ebulição na atmosfera normal é de cerca de -34 C, mas pode ser liquefeito à temperatura ambiente com pressões acima de 740 kPa.
Embora o cloro elementar é yelow-verde, de iões cloreto, em comum com outros iões halogeneto, não tem cor, quer em soluções ou minerais (exemplo, sal de mesa). Da mesma forma, (novamente como com outros halogênios) átomos de cloro transmitir sem cor a cloretos orgânicos quando substituem os átomos de hidrogênio em compostos orgânicos incolores, como tetraclorometano . O ponto de fusão e a densidade desses compostos é aumentada por substituição de hidrogénio em vez de cloro. Os compostos de cloro com outros halogéneos, no entanto, bem como muitos óxidos de cloro, são visivelmente colorido.
Características químicas
Juntamente com flúor , bromo , iodo e astatina , o cloro é um membro do halogéneo série que forma o grupo 17 (antigamente VII, VIIA, ou VIIB) da tabela periódica. Formas de cloro compostos com quase todos os elementos, para dar compostos que são normalmente chamados de cloretos. O gás de cloro reage com a maioria dos compostos orgânicos, e irá mesmo lentamente suporta a combustão de hidrocarbonetos.
A hidrólise de cloro livre ou de dismutação em água
A 25 ° C e à pressão atmosférica, uma litro de água dissolve-se 3,26 g ou 1,125 L de cloro gasoso. Soluções de cloro na água contêm cloro (Cl 2), ácido clorídrico, e ácido hipocloroso:
- Cl 2 + H2O
 HCl + HClO
HCl + HClO
Esta conversão para a direita é chamada desproporção, porque o cloro ingrediente ambos os aumentos e diminuições no estado de oxidação formal. A solubilidade de cloro na água é aumentada se a água contiver dissolvido hidróxido de metal alcalino, e, desta forma, lixívia de cloro é produzido.
- Cl 2 + 2 OH - → ClO - + Cl - + H 2 O
O gás de cloro só existe numa solução neutra ou ácida.
Química e compostos
O cloro existe em todos os ímpares numeradas estados de oxidação de -1 a 7, bem como o estado elementar de zero e quatro em dióxido de cloro (ver tabela abaixo, e também em estruturas clorito). Progredindo através dos estados, ácido clorídrico pode ser oxidado utilizando dióxido de manganês, ou gás de cloreto de hidrogénio cataliticamente oxidado pelo ar para formar gás de cloro elementar.
| Oxidação estado | Nome | Fórmula | Compostos característicos |
|---|---|---|---|
| -1 | cloretos | Cl - | cloretos iónicos, cloretos orgânicos, ácido clorídrico |
| 0 | cloro | Cl 2 | cloro elementar |
| +1 | hipocloritos | CIO - | hipoclorito de sódio, hipoclorito de cálcio |
| +3 | cloritas | CIO - 2 | clorito de sódio |
| 4 | cloro (IV) | ClO2 | dióxido de cloro |
| 5 | chloryl, cloratos | CIO - 3 ClO + 2 | clorato de potássio, ácido clorídrico, dichloryl trisulfate [ClO2] 2 [S 3 O 10]. |
| 6 | cloro (VI) | Cl 2 O 6 | hexa-óxido dichlorine (gás). Em disproportionates líquidos ou sólidos para misturar de cinco e sete estados de oxidação, como iônica perclorato chloryl [ClO 2] + [ClO 4] - |
| +7 | percloratos | CIO - 4 | ácido perclórico, sais de perclorato, tal como perclorato de magnésio, heptóxido de dicloro |
Cloretos
O cloro combina com quase todos os elementos para dar cloretos. Os compostos com oxigénio , azoto , xénon , e crípton são conhecidos, mas não formam por reacção directa dos elementos. O cloreto é um dos aniões mais comuns na natureza. O cloreto de hidrogénio e a sua solução aquosa, ácido clorídrico , são produzidos em escala megatonelada anualmente tanto como intermediários valiosos mas, por vezes, como poluentes indesejáveis.
Óxidos de cloro
O cloro forma uma variedade de óxidos, como visto acima: dióxido de cloro (ClO 2), monóxido de dichlorine (Cl 2 O), hexa-óxido dichlorine (Cl 2 O 6), heptoxide dichlorine (Cl 2 O 7). Os derivados aniónicos de óxidos desses mesmos são bem conhecidos, incluindo clorato (ClO -
3), clorito (CLO -
2), hipoclorito (ClO -), e perclorato (ClO -
4). Os derivados de ácido destes aniões são ácido hipocloroso (HOCl), ácido clorídrico (HClO 3) e ácido perclórico (HClO 4). O catião chloroxy chloryl (ClO 2 +) é conhecido e tem a mesma estrutura que clorito, mas com uma carga positiva e cloro no estado de oxidação +5. O composto "trióxido de cloro" não ocorre, mas sim na forma de gás é encontrado como o dimérica hexa-óxido dichlorine (Cl 2 O 6) com um estado de oxidação +6. Este composto em disproportionates forma líquida ou sólida a uma mistura de 5 e 7 estados de oxidação, que ocorre como o composto iónico perclorato chloryl, [ClO 2] + [ClO 4] -.
Em solução alcalina concentrada quente disproportionates hipoclorito:
- 2 ClO - → Cl - + ClO -
2 - CIO - + ClO -
2 → Cl - + ClO -
3
O clorato de sódio e clorato de potássio pode ser cristalizado a partir de soluções formadas pelas reacções anteriores. Se os seus cristais são aquecidos, eles passam por uma nova, disproporciona�o final:
- 4 ClO -
3 → Cl - + 3 ClO -
4
Esta mesma progressão de cloreto de perclorato pode ser conseguida por electrólise. A progressão da reacção do ânodo é:
Reação Elétrodo
potencialCl - + 2 OH - → ClO - + H2O + 2 e - 0,89 volts ClO - + 2 OH - → ClO -
2 + H2O + 2 e -0,67 volts CIO -
2 + 2 OH - → ClO -
3 + H2O + 2 e -0,33 volts CIO -
3 + 2 OH - → ClO -
4 + H2O + 2 e -0,35 volts
Cada passo é acompanhado por no cátodo
- 2 H2O + 2 e - → 2 OH - + H 2 (-0,83 volts)
Compostos interhalogénio
Cloro oxida os sais de brometo e iodeto de bromo e iodo, respectivamente. No entanto, não pode oxidar sais de fluoreto de flúor. Ele faz com que uma variedade de interhalogénio compostos, tais como os fluoretos de cloro, monofluoretado cloro (ClF), trifluoreto de cloro (ClF 3), pentafluoreto de cloro (ClF 5). Cloretos de bromo e iodo, também são conhecidos.
Compostos organoclorados
O cloro é usado extensivamente em química orgânica em e substituição reacções de adição. O cloro confere muitas vezes propriedades desejadas a um composto orgânico , em parte devido à sua electronegatividade.
Como os outros halogenetos, cloro sofre reações de adição eletrofílicos, o mais notável é a cloração de alcenos e compostos aromáticos com um Ácido de Lewis catalisador . Compostos de cloro orgânicos tendem a ser menos reactivo em substituição nucleofílica do que as reacções de derivados de bromo ou iodo correspondentes, mas eles tendem a ser mais barato. Eles podem ser activados por reacção com um substituindo grupo tosilato, ou pelo uso de uma quantidade catalítica de iodeto de sódio.
Ocorrência
No meio interestelar, o cloro é produzido em supernovas via processo-r.
Em meteoritos e na Terra, o cloro é encontrado principalmente como o ião cloreto o que ocorre em sais minerais. Na crosta da Terra, o cloro está presente em concentrações médias de cerca de 126 partes por milhão, predominantemente em minerais como halite ( cloreto de sódio ), silvinita ( cloreto de potássio), e carnallite (cloreto de magnésio hexahidratado de potássio).
O cloreto é um componente do sal que é depositado na terra ou dissolvido nos oceanos - cerca de 1,9% da massa de água do mar é iões cloreto. Mesmo concentrações mais elevadas de cloreto são encontrados no Mar Morto e no subterrâneo depósitos salmoura. A maioria dos sais de cloreto são solúveis em água, assim, minerais contendo cloreto só são geralmente encontrados em abundância em climas secos ou no subsolo.
Mais de 2000 ocorrem naturalmente compostos de cloro orgânicos são conhecidos.
Isótopos
O cloro possui uma ampla variedade de isótopos. Os dois estáveis isótopos são 35Cl (75,77%) e 37Cl (24,23%). Juntos, eles dão uma de cloro peso atômico de 35,4527 g / mol. O valor semi-inteiro para o peso do cloro causou alguma confusão nos primeiros dias de química, quando ele já tinha sido postulado que os átomos eram compostos de até unidades de hidrogênio (ver A lei de Proust), ea existência de químicos isótopos era insuspeita.
Traços de radioativo 36 Cl existir no ambiente, em uma proporção de cerca de 7x10 -13 a 1 com isótopos estáveis. Cl 36 é produzida na atmosfera pela spallation de 36 Ar por interações com raios cósmicos prótons . No ambiente subsuperficial, 36 Cl é gerado principalmente como resultado de captura de nêutrons por 35 ou Cl captura de muões por 40 Ca . 36 Cl decai para 36 S e 36 Ar , combinado com uma semi-vida de 308 mil anos. A meia-vida da presente isótopo não reactivo hidrofílico torna adequado para datação geológica na gama de 60.000 a 1 milhão de anos. Além disso, grandes quantidades de Cl 36 foram produzidos por irradiação de água do mar durante detonações atmosféricos de armas nucleares entre 1952 e 1958. O tempo de residência de 36 Cl na atmosfera é de cerca de 1 semana. Assim, como um marcador de eventos de 1950 de água no solo e águas subterrâneas, 36 Cl também é útil para datar águas menos de 50 anos antes do presente. Cl 36 tem visto o uso em outras áreas das ciências geológicas, incluindo namorando gelo e sedimentos.
História
O composto mais comum de cloro, cloreto de sódio, é conhecida desde os tempos antigos; arqueólogos encontraram provas de que o sal de rocha foi usado logo em 3000 aC e salmoura tão cedo quanto 6000 aC. Por volta de 1630, o cloro foi reconhecido como um gás pelo químico belga e médico Jan Baptist van Helmont.

Cloro elementar foi preparado pela primeira vez em 1774 e estudado pelo químico sueco Carl Wilhelm Scheele, e, portanto, ele é creditado para a sua descoberta. Ele o chamou de "ar ácido muriático deflogisticado" uma vez que é um gás (então chamados de "ares") e ele veio de ácido clorídrico (então conhecido como "ácido muriático"). No entanto, ele não conseguiu estabelecer o cloro como um elemento, achando que era o óxido obtido a partir do ácido clorídrico (ver teoria do flogisto). Ele nomeou o novo elemento dentro deste óxido como muriaticum. Independentemente do que ele pensava, Scheele fez isolar cloro pela reacção MnO2 (como o mineral pyrolusite) com HCl:
- 4 HCl + MnO2 → MnCl2 + 2 H2O + 2 Cl
Scheele observadas várias das propriedades de cloro: o efeito de branqueamento em decisivo, o efeito mortal em insetos, a cor verde amarela, eo cheiro semelhante ao água régia.
Na época, a teoria química comum era: qualquer ácido é um composto que contém oxigênio (ainda soando nos nomes alemães e holandeses de oxigênio : Sauerstoff ou zuurstof, tanto a tradução para o Inglês como material ácido), então um número de químicos, incluindo Claude Berthollet, sugeriu que deflogisticado ar ácido muriático de Scheele deve ser uma combinação de oxigénio e o elemento ainda não descoberto, muriaticum.
Em 1809, Joseph Louis Gay-Lussac e Louis-Jacques Thénard tentou decompor deflogisticado ar ácido muriático fazendo-o reagir com carvão para libertar o elemento de muriaticum livre (e dióxido de carbono). Eles não tiveram sucesso e publicou um relatório em que se considerou a possibilidade de que deflogisticado ar ácido muriático é um elemento, mas não estavam convencidos.
Em 1810, Sir Humphry Davy tentei o mesmo experimento novamente, e concluiu que é um elemento, e não um composto. Ele nomeou este novo elemento como o cloro, a partir da palavra grega χλωρος (Chloros), o que significa verde-amarelo. O nome de halogéneo , que significa "produtor de sal," foi originalmente usado para cloro em 1811 por Johann Christoph Salomo Schweigger. No entanto, este termo foi usado mais tarde como um termo genérico para descrever todos os elementos da família de cloro (flúor, bromo, iodo), após uma sugestão por Jöns Jakob Berzelius em 1842. Em 1823, Michael Faraday liquefeito cloro, pela primeira vez, e demonstraram que o que foi, em seguida, conhecida como "cloro sólida" tinha uma estrutura de hidrato de cloro (Cl 2 · H2O).
O gás de cloro foi usado pela primeira vez pelo químico francês Claude Berthollet para branquear têxteis em 1785. alvejantes modernos resultou da continuação dos trabalhos por Berthollet, que foi o primeiro produzido hipoclorito de sódio em 1789 em seu laboratório no cais Javel em Paris , França, fazendo passar cloro gasoso através de uma solução de carbonato de sódio. O líquido resultante, conhecido como "Eau de Javel" (" Javel água "), foi uma solução fraca de hipoclorito de sódio. No entanto, este processo não foi muito eficiente, e métodos alternativos de produção foram procurados. Químico escocês e industrial Charles Tennant produzido pela primeira vez uma solução de hipoclorito de cálcio ("cal clorado"), então hipoclorito de cálcio sólido (pó de branqueamento). Estes compostos produzidos baixos níveis de cloro elementar, e pode ser transportado de forma mais eficiente do que o hipoclorito de sódio, que permaneceu como soluções diluídas porque quando purificado para eliminar a água, tornou-se um oxidante poderoso e perigosamente instável. Perto do final do século XIX, ES Smith patenteou um método de produção de hipoclorito de sódio envolvendo eletrólise da salmoura para produzir hidróxido de sódio e cloro gasoso, o qual depois misturado para formar hipoclorito de sódio. Isto é conhecido como o processo de cloretos alcalinos, introduzido pela primeira vez, em escala industrial, em 1892, e agora a fonte de essencialmente toda a produção de cloro elementar e hidróxido de sódio moderna (uma reacção de electrólise de baixa temperatura relacionada, o Processo de Hooker, é agora responsável por água sanitária e produção de hipoclorito de sódio).
Soluções de cloro elementar, dissolvidos em água quimicamente básica (sódio e hipoclorito de cálcio) foi usado pela primeira vez como agentes anti-putrefação e desinfetantes na década de 1820, na França, muito antes da criação da teoria do germe da doença. Este trabalho é principalmente devido ao Antoine-Germain Labarraque, que adaptou lixívia de Berthollet "água Javel" e outras preparações de cloro para o efeito (ver uma história mais completa, veja abaixo). Cloro elementar tem servido desde então uma função contínua em anti-sepsia tópica (soluções de irrigação da ferida e similares), bem como o saneamento público (especialmente de natação e água potável).
Em 1826, cloreto de prata foi utilizado para produzir imagens fotográficas, pela primeira vez. Clorofórmio foi usado pela primeira vez como anestésico em 1847.
Cloreto de polivinila (PVC) foi inventado em 1912, inicialmente sem um propósito.
O gás de cloro foi introduzido pela primeira vez como uma arma em 22 de Abril de 1915, em Ypres pela Exército alemão, e os resultados desta arma foram desastrosos porque máscaras de gás não tinha sido distribuído em massa e foram complicado para chegar rapidamente.
Produção

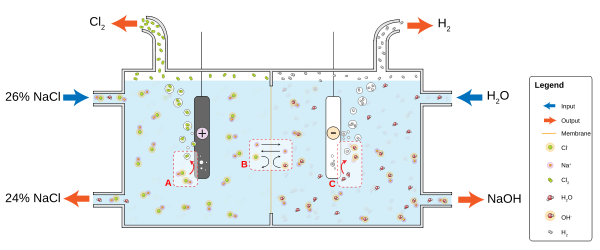
Na indústria, o cloro elementar é geralmente produzido através da electrólise de cloreto de sódio dissolvido em água. Este método, o alcalinos processo industrializado em 1892, agora prevê essencialmente todo o gás cloro industrial. Juntamente com o cloro, o método produz hidrogénio gás e hidróxido de sódio (com hidróxido de sódio, na verdade, sendo o mais importante dos três produtos industriais produzidos pelo processo). O processo prossegue de acordo com o seguinte equação química:
- 2 NaCI + 2 H2O → Cl + H 2 2 NaOH + 2
A electrólise de soluções de cloreto de todos proceder de acordo com as seguintes equações:
- Cátodo: H + 2 (aq) + 2 e - → H 2 (g)
- Ânodo: 2 Cl - (aq) → Cl 2 (g) + 2 e -
Processo geral: 2 de NaCl (ou KCl) + 2 H 2 O → 2 Cl 2 NaOH + 2 + H (ou KOH)
Em diafragma eletrólise celular, um amianto (ou polímero de fibra) do diafragma separa um cátodo e um ânodo, evitando a formação de cloro no ânodo a partir de re-mistura com o hidróxido de sódio e o hidrogénio formado no cátodo. A solução salina (solução salina) é alimentado continuamente ao compartimento anódico e flui através do diafragma para o compartimento do cátodo, onde o cáustico alcalino é produzido e a salmoura é parcialmente esgotada. Métodos de diafragma produzir diluir e ligeiramente impuro alcalino, mas eles não estão sobrecarregados com o problema da prevenção de descarga de mercúrio no meio ambiente e são mais eficientes em termos energéticos. Membrana de células de eletrólise emprego membrana permeável como uma permutador de iões. Solução saturada de cloreto de sódio (ou potássio) é passada através do compartimento do ânodo, deixando a um menor concentração. Este método é mais eficiente do que a célula de diafragma e produz muito pura de sódio (ou potássio) a uma concentração de hidróxido de cerca de 32%, mas exige salmoura muito puro.
Os métodos de laboratório
Pequenas quantidades de gás de cloro pode ser feita em laboratório através da combinação de ácido clorídrico e dióxido de manganês. Alternativamente, um ácido forte tal como ácido sulfúrico ou ácido clorídrico reage com uma solução de hipoclorito de sódio para libertar o gás de cloro reage com mas de clorato de sódio para produzir cloro gasoso e gás de dióxido de cloro bem. Em casa, os acidentes ocorrem quando as soluções de branqueamento de hipoclorito são combinados com certos drenagem lavagem ácidas.
Aplicações
Produção de produtos industriais e de consumo
Aplicações principais de cloro são na produção de uma vasta gama de produtos industriais e de consumo. Por exemplo, é utilizado na fabricação de plásticos, solventes para limpeza a seco e desengorduramento dos metais, têxteis, agroquímicos e farmacêuticos, inseticidas, tintas, produtos de limpeza doméstica, etc.
Muitos produtos industriais importantes são produzidos através de intermediários organoclorados. Exemplos incluem policarbonatos, poliuretanos, silicones, politetrafluoroetileno, carboximetil celulose, e óxido de propileno. Tal como os outros halogéneos, cloro participa Reacções de substituição de radical livre com compostos orgânicos que contêm hidrogénio. Quando aplicado a substratos orgânicos, a reacção é muitas vezes, mas não invariavelmente, não regiosselectiva, e, portanto, pode resultar numa mistura de produtos isoméricos. Muitas vezes, é difícil controlar o grau de substituição, bem como, de modo substituições múltiplas são comuns. Se os diferentes produtos da reacção são facilmente separados, por exemplo, por destilação, a cloração de radical livre substitutiva (em alguns casos acompanhada por desidrocloração térmica simultânea) pode ser uma rota sintética útil. Exemplos industriais disso são a produção de cloreto de metilo, cloreto de metileno, clorofórmio e tetracloreto de carbono a partir de metano, cloreto de alilo a partir de propileno, e tricloroetileno, e tetracloroetileno de 1,2-dicloroetano.
Quantitativamente, cerca de 63% e 18% de todo o cloro elementar produzido é utilizado no fabrico de compostos de cloro orgânicos e inorgânicos, respectivamente ,. Cerca de 15.000 compostos de cloro são utilizados comercialmente. Os restantes 19% é usado para alvejantes e produtos de desinfecção. A mais significativa de compostos orgânicos em termos de volume de produção são 1,2-dicloroetano e cloreto de vinilo, produtos intermediários na produção de PVC. Outros organoclorados particularmente importantes são cloreto de metilo, cloreto de metileno, clorofórmio, cloreto de vinilideno, tricloroetileno, percloroetileno, cloreto de alilo, epicloridrina, clorobenzeno, diclorobenzenos, e triclorobenzenos. Os principais compostos inorgânicos incluem HCl, Cl 2 O, HOCl, NaClO3, isocianuratos clorados, AlCl3, SiCl 4, SnCl 4, PCl 3, PCl 5, POCl 3, ASCL 3, SbCl 3, 5 SbCl, BiCl 3, S 2 Cl 2, SCl 2, SOCI 2, CIF 3, ICl, ICl 3, TiCl 3, TiCl 4, 5 MoCl, FeCl 3, ZnCl 2, etc.
Saneamento público, desinfecção e anti-sepsia
Combate à putrefação

Na França (como em outros lugares), houve uma necessidade de processar tripas de animais, a fim de fazer cordas instrumento musical, Baudruches e outros produtos. Este foi realizado em "fábricas gut" (boyauderies) como um negócio odiferous e insalubre. Em ou cerca de 1820, o Sociedade de encorajamento pour l'Industrie Nationale oferecido um prémio para a descoberta de um método, química ou mecânica, que pode ser utilizado para separar a membrana peritoneal de intestinos de animais sem causar putrefacção. Ele foi vencido por Antoine-Germain Labarraque, de 44 anos de idade, químico francês e farmacêutico que tinha descoberto que as soluções de branqueamento clorados de Berthollet (" Eau de Javel ") não só destruiu o cheiro de putrefação de decomposição do tecido animal, mas também retardou o processo de decomposição em si.
A pesquisa de Labarraque resultou em cloretos e hipocloritos de cal ( hipoclorito de cálcio) e de sódio ( hipoclorito de sódio) a ser utilizado não apenas nas boyauderies mas também para a desinfecção e desodorização de rotina latrinas, esgotos, mercados, matadouros, teatros e morgues anatômicas. Eles também foram usados, com sucesso, em hospitais, lazaretos, prisões, enfermarias (tanto em terra como no mar), magnaneries, estábulos, galpões de gado, etc .; e para exumações, embalsamamento, durante os surtos de epidemia de doença, febre, Blackleg (doença), em bovinos, etc.
Contra a infecção e contágio
Cal e soluções de soda clorados de Labarraque havia sido defendida em 1828 para prevenir a infecção (chamada de "infecção contagiosa", e presume-se ser transmitida por " miasmas ") e também no tratamento de putrefação de feridas existentes, incluindo feridas sépticas. Neste trabalho 1828, Labarraque recomendado para o médico para respirar cloro, lavar as mãos com cal clorada, e até mesmo polvilhe cal clorada sobre a cama do paciente, em casos de "infecção contagiosa." Em 1828, ele foi bem conhecido que algumas infecções eram contagiantes, embora a agência do micróbio não era para ser realizado ou descoberto há mais de meio século.
Durante o Paris surto de cólera de 1832, grandes quantidades de chamada cloreto de cal foram usadas para desinfetar a capital. Esta não era simplesmente moderno cloreto de cálcio , mas continha gás de cloro dissolvido em água de cal (diluir hidróxido de cálcio) para formar hipoclorito de cálcio (cal clorada). A descoberta de Labarraque ajudou a remover o terrível fedor de decadência dos hospitais e salas de dissecação, e, ao fazê-lo, de forma eficaz o desodorizado Quartier Latin de Paris. Estes "miasmas pútridos" foram pensados por muitos para ser responsável pela propagação de "contágio" e "infecção" - ambas as palavras utilizadas antes da teoria dos germes de infecção. O uso do cloreto de cal foi baseada na destruição de odores e "matéria pútrida." Uma fonte afirmou que o cloreto de cal foi usado por Dr. John Snow para desinfectar a água do poço que alimenta a bomba de Broad Street, em 1854, Londres contaminados com cólera. Três fontes respeitáveis que descreviam o famoso Broad Street epidemia de cólera bomba não mencionam Neve realizar qualquer desinfecção da água daquele poço. Em vez disso, uma referência torna claro que o cloreto de cal foi usado para desinfectar a miudezas e sujeira nas ruas circundantes a bomba de uma prática comum Broad Street, em meados do século XIX Inglaterra.
Semmelweis e experiências com anti-sepsia
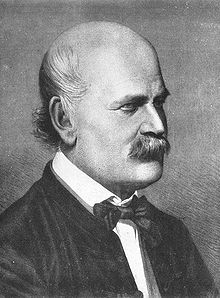
Talvez a mais famosa aplicação de cloro e de Labarraque soluções de bases químicas foi em 1847, quando Ignaz Semmelweis usadas (primeiro) de cloro em água (cloro simplesmente dissolvido em água pura), as soluções mais baratas, em seguida, cal clorados, para desinfetar as mãos dos médicos austríacos, que Semmelweis ainda notado realizados o cheiro de decomposição a partir dos quartos de dissecação para as salas de exame do paciente . Semmelweis, ainda muito antes da teoria do germe da doença, tinha a teoria de que "partículas de cadáveres" foram de alguma forma transmitir deterioração de cadáveres médicos frescos para pacientes vivos, e ele usou as "soluções de Labarraque" bem conhecidas como o único método conhecido para remover o cheiro de decadência e decomposição de tecido (que ele descobriu que o sabão não fez). As soluções provou ser anti-sépticos germicida muito mais eficazes do que o sabão (Semmelweis também estava ciente da sua maior eficácia, mas não a razão), e isso resultou em de (mais tarde) comemorou o sucesso Semmelweis em parar a transmissão de febre puerperal ("febre puerperal") nas maternidades de Hospital Geral de Viena, na Áustria, em 1847.
Muito mais tarde, durante a I Guerra Mundial, em 1916, uma modificação padronizada e diluiu-se a solução de Labarraque, contendo hipoclorito (0,5%) e ácido bórico, como um estabilizante acídico, foi desenvolvido pela Henry Dakin Drysdale (que deu todo o crédito ao trabalho antes do Labarraque nesta área). Chamado Solução de Dakin, o método de irrigação enrolada com soluções clorados permitido o tratamento anti-séptico de uma ampla variedade de feridas abertas, muito antes da era moderna antibiótico. Uma versão modificada desta solução continua a ser empregada na irrigação de feridas na era moderna, onde permanece eficaz contra bactérias resistentes a antibióticos multiplicam (veja Século Pharmaceuticals).
Saneamento público
Por volta de 1918, o US Department of Treasury chamado para toda a água potável a ser desinfectada com cloro. O cloro é atualmente uma importante substância química para purificação de água (como estações de tratamento de água), em desinfectantes, e em lixívia. O cloro em água é mais do que três vezes mais eficaz como desinfectante contra Escherichia coli do que uma concentração equivalente de bromo , e é mais do que seis vezes mais eficaz do que uma concentração equivalente de iodo .
O cloro é normalmente utilizado (sob a forma de ácido hipocloroso) para matar as bactérias e outros micróbios na água potável fontes e piscinas públicas. Na maioria das piscinas particulares, a própria de cloro não é utilizado, mas em vez hipoclorito de sódio, formada a partir de cloro e hidróxido de sódio , ou comprimidos sólidos de isocianuratos clorados. A desvantagem do uso de cloro em piscinas é que o cloro reage com cabelo e pele de um ser humano, porque o cabelo ea pele são feitos de proteína. (Reacção com grupos amino de proteínas) Mesmo pequenas fontes de água estão agora rotineiramente clorada.
É muitas vezes impraticável para armazenar e usar gás de cloro venenoso para o tratamento da água, de modo que métodos alternativos de adição de cloro são utilizados. Estes incluem soluções de hipoclorito, que gradualmente libera cloro na água e compostos como dicloro-s-triazinotriona de sódio (di-hidrato ou anidro), por vezes referido como "dichlor", e ,-triazinotriona tricloro-s por vezes referido como "tricloro". Estes compostos são estáveis, enquanto sólida e podem ser utilizados em, granular, em pó ou forma de comprimido. Quando adicionado em pequenas quantidades à água da piscina ou sistemas de água industriais, os átomos de cloro a partir de hidrolisar o resto da molécula formando o ácido hipocloroso (HOCl), que actua como um biocida geral, matar germes, microrganismos, algas, e assim por diante.
Use como uma arma
Primeira Guerra Mundial
O gás de cloro, também conhecido como bertholite, foi o primeiro usado como uma arma na Primeira Guerra Mundial pela Alemanha em 22 de abril de 1915 no Segunda Batalha de Ypres. Conforme descrito pelos soldados que tinha um cheiro característico de uma mistura entre pimenta e abacaxi. Também Experimentado metálico e picado parte de trás da garganta e do peito. O cloro pode reagir com água na mucosa dos pulmões, para formar o ácido clorídrico , um irritante que pode ser letal. Os danos causados pelo cloro gasoso pode ser evitado por uma máscara de gás, ou outro método de filtração, o que faz com que a possibilidade geral de morte por gás de cloro muito mais baixas do que as de outras armas químicas. Foi aberto caminho por um cientista alemão que mais tarde seria um laureado com o Nobel, Fritz Haber, do Instituto Kaiser Wilhelm, em Berlim, em colaboração com o conglomerado químico alemão IG Farben, que desenvolveu métodos para a descarga de gás de cloro contra um inimigo entrincheirado. Alega-se que o papel de Haber na utilização de cloro como uma arma mortal levou sua esposa, Clara Immerwahr, ao suicídio. Após a sua primeira utilização, o cloro foi utilizada por ambos os lados como uma arma química, mas foi logo substituído pelo mais mortal e fosgénio gás mostarda.
Guerra do Iraque
O gás de cloro também tem sido usado por insurgentes contra as forças da coalizão e da população local na Guerra do Iraque sob a forma de bombas de cloro. Em 17 de março de 2007, por exemplo, três caminhões cheios de cloro foram detonadas na província de Anbar, matando dois e nauseante sobre 350. Outros ataques a bomba de cloro resultou em morte portagens mais elevadas, com mais de 30 mortes em duas ocasiões separadas. A maioria das mortes foram causadas pela força das explosões, em vez dos efeitos de cloro, uma vez que o gás tóxico é prontamente disperso e diluiu-se na atmosfera pela explosão. As autoridades iraquianas reforçaram a segurança para o cloro elementar, que é essencial para o fornecimento de água potável para a população.
O cloro induzida craqueamento em materiais estruturais

O elemento é amplamente usado para purificar a água, devido às suas propriedades oxidantes poderosos, abastecimento de água potável e especialmente água utilizada em piscinas. Vários colapsos catastróficos de tectos piscina ter ocorrido devido à corrosão sob tensão de hastes de aço inoxidável utilizados para suspendê-las. Alguns polímeros também são sensíveis a atacar, incluindo resina acetal e polibuteno. Ambos os materiais foram utilizados no abastecimento de água domésticos quentes e frios, e corrosão sob tensão causada falhas generalizadas nos EUA na década de 1980 e 1990. A imagem à direita mostra um conjunto acetal em um sistema de abastecimento de água, que, quando fraturado, causado dano físico substancial para computadores nos laboratórios abaixo da oferta. As rachaduras começaram a injeção de defeitos de moldagem na articulação e cresceu lentamente até que finalmente acionado. A superfície de fratura mostra sais de ferro e cálcio que foram depositados na articulação do vazamento do abastecimento de água antes da falha.
Os efeitos na saúde do elemento livre e perigos
| NFPA 704 |
|---|
 0 3
0 OX |
O cloro é um gás tóxico que irrita as vias respiratórias. Uma vez que é mais pesado do que o ar, ele tende a acumular-se na parte inferior de espaços mal ventiladas. O cloro gasoso é um oxidante forte, que pode reagir com materiais inflamáveis.
O cloro é detectável com os dispositivos de medição em concentrações tão baixas como 0,2 partes por milhão (ppm), e pelo cheiro a 3 ppm. Tosse e vômitos podem ocorrer em 30 ppm e pulmão danos em 60 ppm. Cerca de 1000 ppm pode ser fatal após algumas respirações profundas do gás. Respiração concentrações mais baixas podem agravar o sistema respiratório, e exposição ao gás podem irritar os olhos. A toxicidade do cloro vem do seu poder oxidante. Quando o cloro é inalado em concentrações superiores a 30 ppm, que começa a reagir com água e com células, as quais transformá-lo em ácido clorídrico (HCl) e ácido hipocloroso (HClO).
Quando usados em níveis especificados de desinfecção da água, a reacção do cloro com água não é uma grande preocupação para a saúde humana. Outros materiais presentes na água podem gerar desinfecção subprodutos que estão associados com efeitos negativos sobre a saúde humana, embora o risco para a saúde é muito menor do que beber água undisinfected.
Compostos organoclorados como polutants
Alguns compostos organoclorados são poluentes graves. Estes são produzidos quer como produtos colaterais de processos industriais ou como produtos finais que são persistentes no meio ambiente, tais como certos pesticidas clorados e clorofluorocarbonetos. O cloro é adicionado tanto para pesticidas e produtos farmacêuticos para tornar as moléculas mais resistentes à degradação enzimática por bactérias, insectos e mamíferos, mas esta propriedade também tem o efeito de prolongar o tempo de residência destes compostos quando eles entram no ambiente. A este respeito orgânicos clorados têm alguma semelhança com compostos orgânicos fluorados.

