
De cobre (I), cloreto de
Você sabia ...
Crianças SOS oferecem um download completo desta seleção para as escolas para uso em escolas intranets. Patrocínio da criança ajuda as crianças uma a uma http://www.sponsor-a-child.org.uk/ .
| De cobre (I), cloreto de | |
|---|---|
 | |
 | |
De cobre (I), cloreto de | |
Outros nomes Cloreto cuproso | |
| Identificadores | |
| Número CAS | 7758-89-6 |
| Número RTECS | GL6990000 |
| Propriedades | |
| Fórmula molecular | CuCl |
| Massa molar | 98,99 g / mol |
| Aparência | pó branco, ligeiramente verde de impurezas oxidadas |
| Densidade | 4,140 g / cm 3, sólido |
| Ponto de fusão | 430 ° C (703 K) |
| Ponto de ebulição | 1490 ° C (1760 K), |
| Solubilidade em água | 0,0062 g / 100 ml (20 ° C) |
| Estrutura | |
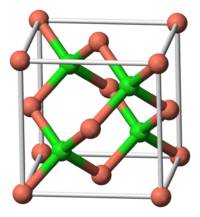
| A estrutura de cristal | Tetrahedral perto embalado ( Zinco estrutura blende) |
| Perigos | |
| MSDS | ScienceLab.com |
| R / S declaração | R: 22, 50, 53 S: 22, 60/61 |
| Principal Perigos | Irritante |
| NFPA 704 |  0 3
0 |
| Os compostos relacionados | |
| Outros aniões | De cobre (I), brometo De cobre (I) iodeto de |
| Outros cátions | O cobre (II), cloreto Prata (I), cloreto de |
| Excepto quando indicado, os dados são dados para materiais no seu estado normal (a 25 ° C, 100 kPa) | |
| Referências de Infobox | |
De cobre (I) cloreto, vulgarmente chamado de cloreto cuproso, é o mais baixo cloreto de cobre , com a fórmula de CuCl. Este sólido incolor é um precursor versátil para outros compostos de cobre, incluindo alguns de significado comercial. Ocorre naturalmente como o mineral raro nantokite. Ao contrário de outros halogenetos de metais de transição de primeira linha, ele forma uma estável complexos com monóxido de carbono . Cristaliza-se numa diamantóides motivo, reflectindo a tendência de cobre (I) para formar complexos tetraédricos.
Preparação
De cobre (I) cloreto é produzido industrialmente pela cloração directa de cobre:
- Cu + 2 Cl 2 → 2 CuCl
No laboratório, de cobre (I) cloreto pode ser preparado pela redução de sais de cobre (II) tais como CuSO4 usando dióxido de enxofre, bissulfito de sódio (NaHSO3), metabissulfito de sódio, ou cobre metálico.
- 2 CuCl2 + H2O + SO 3 2- → 2 CuCl + SO 4 2- + 2 Cl -
Os precipitados sólidos brancos a partir da solução. Após repouso em ar húmido, amostras de CuCl tornam-se verdes devido à formação de cloretos de cobre (II).
Propriedades químicas
CuCl é mais acessível e menos tóxico do que outros ácidos de Lewis suaves. Além disso, o cobre pode existir em vários estados de oxidação, incluindo I, II, e III. Esta combinação de propriedades definir algumas das características úteis de cobre (I) cloreto. É uma suave Ácido de Lewis, classificada como mole de acordo com o Conceito duro-Soft Ácido-Base. Assim, tende a formar estável complexos com suave Bases de Lewis, tais como trifenilfosfina:
- CuCl + P (C 6 H 5) 3 → [CuCl (P (C 6 H 5) 3)] 4
Embora CuCl é insolúvel em água, dissolve-se em soluções aquosas contendo moléculas de dador adequado. Ele forma complexos com iões haleto, por exemplo formando H3O + CuCl 2 - concentrado com ácido clorídrico . Também se dissolve em soluções que contenham CN -, S 2 O 3 2-, e NH3 para dar complexos.
Soluções de CuCl em HCl ou NH3 absorver monóxido de carbono para formar complexos incolores tais como o dímero com ponte de cloreto de [CuCl (CO)] 2. As mesmas soluções de ácido clorídrico também reagir com acetileno gás para formar [CuCl (C 2 H 2)]. amoniacais soluções de CuCl reagir com acetilenos para formar o explosivo de cobre (I) acetileto. Complexos de CuCl com alcenos podem ser preparados por redução de CuCl 2 por dióxido de enxofre na presença do alceno em solução alcoólica. Complexos com dienos tais como 1,5-ciclooctadieno são particularmente estável:
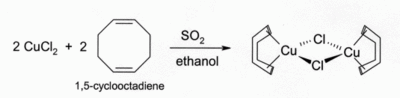
Embora apenas fracamente solúvel em água, a sua solução aquosa são instáveis em relação à desproporcionação em Cu e CuCl 2 . Em parte por esta razão amostras assumem uma coloração verde (ver fotografia no canto superior direito).
Usos
A principal utilização de cobre (I) é o cloreto como um precursor para o oxicloreto de cobre fungicida. Para esta finalidade de cobre aquoso (I), cloreto é gerado por comproporcionação e então oxidado ao ar:
- Cu + 2 CuCl2 → CuCl
- 6 CuCl + 3/2 O2 + 3 H2O → Cu 2 3 Cl 2 (OH) 4 + CuCl2
De cobre (I) cloreto catalisa uma variedade de reacções orgânicas, tal como discutido acima. A sua afinidade para o monóxido de carbono na presença de cloreto de alumínio é explorado no processo COPure SM.
Na síntese orgânica
No Reacção de Sandmeyer. O tratamento de uma arenodiazónio sal com CuCl leva a um cloreto de arilo, por exemplo:
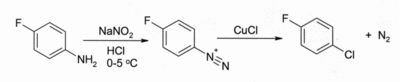 A reacção tem amplo alcance e geralmente dá bons rendimentos.
A reacção tem amplo alcance e geralmente dá bons rendimentos.
Os primeiros investigadores observaram que cobre (I) halogenetos de catalisar adição de 1,4- Reagentes de Grignard para alfa, beta-insaturado cetonas levou ao desenvolvimento de organocuprato reagentes que são amplamente utilizados hoje em síntese orgânica:
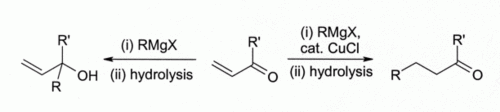 Esta descoberta levou ao desenvolvimento de química organocobre. Por exemplo, reage com CuCl metil-lítio (Li CH 3) para formar " Gilman "reagentes tais como (CH3) 2 CuLi, que encontram uso extensivo na síntese orgânica. Reagentes de Grignard reagir de forma semelhante. Apesar de cobre (I) outros compostos, tais como de cobre (I) iodeto são agora mais frequentemente utilizado para este tipo de reacções, de cobre (I) cloreto ainda é recomendado em alguns casos:
Esta descoberta levou ao desenvolvimento de química organocobre. Por exemplo, reage com CuCl metil-lítio (Li CH 3) para formar " Gilman "reagentes tais como (CH3) 2 CuLi, que encontram uso extensivo na síntese orgânica. Reagentes de Grignard reagir de forma semelhante. Apesar de cobre (I) outros compostos, tais como de cobre (I) iodeto são agora mais frequentemente utilizado para este tipo de reacções, de cobre (I) cloreto ainda é recomendado em alguns casos:
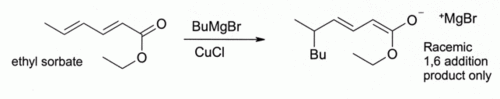 Aqui, indica um Bu n- grupo butilo. Sem CuCl, o Reagente de Grignard sozinho dá uma mistura de 1,2- e 1,4-produtos de adição (isto é, o butil adiciona no mais perto do C = O).
Aqui, indica um Bu n- grupo butilo. Sem CuCl, o Reagente de Grignard sozinho dá uma mistura de 1,2- e 1,4-produtos de adição (isto é, o butil adiciona no mais perto do C = O).
Na química de polímeros
De cobre (I) cloreto também é formado a partir de um intermediário de cobre (II), cloreto de o Processo Wacker. CuCl é utilizado como um catalisador em A polimerização radical de transferência de átomo (ATRP).

