
Corrosão
Fundo para as escolas Wikipédia
Esta seleção Escolas foi originalmente escolhido pelo SOS Children para as escolas no mundo em desenvolvimento sem acesso à internet. Ele está disponível como um download intranet. Antes de decidir sobre o patrocínio de uma criança, por que não aprender sobre as diferentes instituições de caridade de patrocínio primeiro ?
| |||||
A corrosão é a destruição gradual dos materiais, geralmente de metais, por reacção química com o seu ambiente. Na utilização mais comum da palavra, isto significa electroquímica oxidação de metais em reacção com um oxidante, tal como oxigénio . Oxidação, a formação de ferro óxidos, é um exemplo bem conhecido de corrosão electroquímica. Este tipo de dano normalmente produz óxido (s) ou sal (s) do metal original é. A corrosão também pode ocorrer em outros metais de materiais, tais como cerâmica ou polímeros, embora, neste contexto, o termo degradação é mais comum. Corrosão degrada as propriedades úteis de materiais e estruturas, incluindo resistência, aparência e permeabilidade a líquidos e gases.
Muitos estrutural ligas corroer meramente de exposição à humidade no ar, mas o processo pode ser fortemente afectada pela exposição a determinadas substâncias. A corrosão pode ser concentrada no local para formar um buraco ou rachar, ou pode se estender por uma vasta área mais ou menos uniformemente corroer a superfície. Devido à corrosão é um processo de difusão controlada, que ocorre em superfícies expostas. Como resultado, os métodos para reduzir a actividade da superfície exposta, tal como passivação e de conversão de cromato, pode aumentar a resistência à corrosão de um material. No entanto, alguns mecanismos de corrosão são menos visíveis e menos previsíveis.



Corrosão galvânica

Corrosão galvânica ocorre quando dois metais diferentes têm contacto físico ou eléctrico um com o outro e são imersas numa comum electrólito, ou quando o mesmo metal é exposto ao electrólito com diferentes concentrações. Em um par galvânico, o metal mais activo (o ânodo) se corrói a uma taxa acelerada e o mais metal nobre (o cátodo) se corrói a uma taxa retardado. Quando imerso em separado, cada metal corrói a sua própria taxa. O tipo de metal (s) a ser usada é prontamente determinada seguindo o série galvânica. Por exemplo, o zinco é frequentemente utilizado como um ânodo sacrificial para estruturas de aço. Corrosão galvânica é de grande interesse para a indústria naval e também em qualquer lugar da água (contendo sais) contatos tubos ou estruturas metálicas.
Fatores como o tamanho relativo de ânodo, tipos de metal, e as condições de operação ( temperatura , umidade, salinidade, etc.) afetam a corrosão galvânica. A relação da área de superfície do ânodo e catódico afecta directamente as taxas de corrosão dos materiais. Corrosão galvânica é frequentemente utilizada em ânodos de sacrifício.
Série galvânica
Em um determinado ambiente (um meio padrão é arejado, sala de temperatura da água do mar ), um metal vai ser mais nobre ou mais ativos do que outros, com base em quão fortemente os seus íons são ligados à superfície. Dois metais em partes contacto eléctrico os mesmos elétrons, de modo que o "cabo-de-guerra" em cada superfície é análoga à competição por elétrons livres entre os dois materiais. Usando o electrólito como um hospedeiro para o fluxo de iões na mesma direcção, o metal activo terá electrões de um nobre. O fluxo de massa resultante ou corrente elétrica pode ser medida para estabelecer uma hierarquia de materiais no meio de interesse. Esta hierarquia é chamado uma série galvânica e é útil na compreensão e previsão de corrosão.
Remoção de corrosão
Muitas vezes é possível remover quimicamente os produtos de corrosão. Por exemplo o ácido fosfórico sob a forma de geleia naval é frequentemente aplicado a ferramentas de ferrosos ou superfícies para remover a ferrugem. Remoção de corrosão não deve ser confundido com electropolimento, que remove algumas camadas do metal subjacente para tornar uma superfície lisa. Por exemplo, o ácido fosfórico também pode ser usado para electropolish cobre, mas isso é feito através da remoção de cobre, nem os produtos de corrosão de cobre.
A resistência à corrosão
Alguns metais são mais intrinsecamente resistentes à corrosão do que outros (para alguns exemplos, ver série galvânica). Existem várias maneiras de proteger metais da corrosão, incluindo pintura, A galvanização por imersão a quente, e combinações destes.
Química intrínseca

Os materiais mais resistentes à corrosão são aqueles para os quais a corrosão é termodinamicamente desfavorável. Quaisquer produtos de corrosão de ouro ou platina tendem a decompor-se espontaneamente no metal puro, razão pela qual estes elementos podem ser encontrados na forma metálica na Terra e têm sido muito valorizada. Mais "base" comum metais só pode ser protegido por meios mais temporários.
Alguns metais têm naturalmente lento cinética de reação, mesmo que a sua corrosão é termodinamicamente favorável. Estes incluem metais tais como zinco , magnésio , e cádmio . Enquanto corrosão destes metais é contínuo e permanente, isso acontece a uma taxa aceitavelmente lenta. Um exemplo extremo é grafite, que libera grandes quantidades de energia em cima oxidação, mas tem tais cinética lenta que é eficaz imunes à corrosão electroquímica sob condições normais.
Passivation
Refere-se a passivação a formação espontânea de uma película ultrafina de produtos de corrosão conhecidos como filme passivo, na superfície do metal que actuam como uma barreira à oxidação adicional. A composição química e microestrutura de uma película passiva são diferentes das do metal subjacente. Espessura da película passiva típica em alumínio, aços inoxidáveis e ligas é dentro de 10 nanômetros. O filme passivo é diferente de camadas de óxido que são formados durante o aquecimento e que se encontram na gama de micrómetros de espessura - o filme passivo se recupera removida ou danificada ao passo que a camada de óxido não. Passivation em ambientes naturais, tais como ar, água e solo em moderada pH é visto em materiais tais como o alumínio , aço inoxidável, titânio , e silício .
A passivação é determinada principalmente por factores metalúrgicos e ambientais. O efeito do pH é resumido usando Pourbaix diagramas, mas muitos outros fatores são influentes. Algumas condições que inibem a passivação incluem pH elevado para o alumínio e zinco, pH baixo ou a presença de iões cloreto para o aço inoxidável, a alta temperatura para o titânio (no caso em que o óxido se dissolve no metal, em vez de o electrólito) e íons de flúor para silício. Por outro lado, condições anormais poderão resultar em passivação dos materiais que são normalmente não protegido, como o ambiente alcalino concreto faz para aço vergalhões. A exposição a um metal líquido, tal como o mercúrio ou quente solda muitas vezes pode contornar mecanismos de passivação.
A corrosão em materiais passivados
A passivação é extremamente útil para mitigar os danos de corrosão, no entanto, mesmo uma liga de alta qualidade, se irão corroer a sua capacidade para formar uma película passivante é impedida. A selecção adequada do grau de material certo para o ambiente específico é importante para o desempenho de longa duração deste grupo de materiais. Se avaria ocorre no filme passivo devido a factores químicos ou mecânicos, os principais modos de corrosão resultantes podem incluir corrosão localizada, corrosão fenda e corrosão sob tensão.
Corrosão localizada

Algumas condições, tais como baixa concentração de oxigénio ou de concentrações elevadas de espécies, tais como cloreto de que completa como aniões , pode interferir com a capacidade de uma determinada liga para re-formar uma película passivante. No pior dos casos, quase toda a superfície permanecem protegidos, mas pequenas flutuações locais irá degradar a película de óxido em alguns pontos críticos. A corrosão nestes pontos será muito amplificado, e pode causar cavidades de corrosão de vários tipos, dependendo das condições. Enquanto as cavidades de corrosão única nucleate sob circunstâncias bastante extremos, eles podem continuar a crescer mesmo quando as condições voltarem ao normal, uma vez que o interior de um poço é naturalmente privado de oxigênio e localmente o pH diminui para valores muito baixos e as taxas de corrosão aumenta devido a um processo autocatalítico. Em casos extremos, as pontas afiadas da extremamente longas e estreitas cavidades de corrosão pode causar concentração de tensão até o ponto que as ligas de outra forma difíceis pode quebrar; uma fina película perfurada por um buraco invisivelmente pequeno pode esconder um poço polegar tamanho da vista. Estes problemas são particularmente perigosos porque são difíceis de detectar antes de uma parte ou da estrutura falha. Picada permanece entre as formas mais comuns e prejudiciais da corrosão em ligas passivadas, mas pode ser impedida por controle do ambiente da liga.
Desintegração da solda e ataque knifeline


Aço inoxidável pode representar desafios especiais de corrosão, uma vez que o seu comportamento passivador baseia-se na presença de um importante componente de liga ( crómio , pelo menos, 11,5%). Por causa das elevadas temperaturas de soldagem e tratamento térmico, crómio carbonetos pode formar no limites de grãos de ligas de aço inoxidável. Essa reação química rouba o material de cromo na zona perto da fronteira de grão, tornando essas áreas muito menos resistente à corrosão. Isto cria um par galvânico com a liga bem protegidos nas proximidades, que leva para soldar decaimento (corrosão das fronteiras de grãos nas zonas afectadas de calor) em ambientes altamente corrosivos.
Um aço inoxidável é dito para ser sensibilizados se carbonetos de crómio são formados na microestrutura. A microestrutura típica de um tipo-304 aço inoxidável normalizada não mostra sinais de sensibilização, enquanto um aço fortemente sensibilizados mostra a presença de precipitados de contorno de grão. As linhas escuras na microestrutura sensibilizado são redes de carbonetos de cromo formadas ao longo das fronteiras de grão.
Ligas especiais, ou com baixo teor de carbono ou com carbono adicionado " getters ", tais como o titânio e nióbio (nos 321 e 347, respectivamente), pode evitar este efeito, mas estes requerem um tratamento térmico especial após a soldadura para evitar o fenómeno de ataque knifeline semelhante. Como o seu nome indica, a corrosão é limitada para uma zona muito estreita ao lado da solda, muitas vezes apenas alguns micrômetros de diâmetro, tornando ainda menos perceptível.
Fenda corrosão

Fenda corrosão é uma forma localizada de corrosão que ocorre em espaços confinados (fendas), aos quais o acesso do fluido de trabalho a partir do ambiente é limitada. A formação de um diferencial de células de arejamento leva a corrosão no interior das fendas. Exemplos de fendas são as lacunas e as áreas de contato entre as partes, sob juntas ou vedações, rachaduras dentro e costuras, espaços cheios de depósitos e sob pilhas de lodo.
Fenda corrosão é influenciada pelo tipo fenda (metal-metal, metal não-metal), geometria fenda (tamanho, acabamento de superfície), e factores ambientais e metalúrgicas. A susceptibilidade à corrosão com fendas pode ser avaliada com procedimentos padrão ASTM. A temperatura crítica corrosão intersticial é comumente usado para classificar resistência de um material à corrosão com fendas.
Corrosão microbiana
Corrosão microbiana, ou vulgarmente conhecida como a corrosão influenciada microbiologicamente (CIM), é uma corrosão causada ou promovidos pela microorganismos, normalmente quimioautótrofos. Pode aplicar-se tanto a materiais metálicos e não metálicos, na presença ou ausência de oxigénio. Bactérias redutoras de sulfato são activas na ausência de oxigénio (anaeróbio); eles produzem sulfureto de hidrogénio, causando sulfeto de estresse rachaduras. Na presença de oxigénio (aeróbico), algumas bactérias podem oxidar directamente ferro em óxidos e hidróxidos de ferro, outras bactérias oxidar o enxofre e produzir o ácido sulfúrico causando sulfeto de corrosão biogênica. Células de concentração podem formar-se nos depósitos de produtos de corrosão, que conduz à corrosão localizada.
Corrosão acelerada de baixa-mar (ALWC) é uma forma particularmente agressiva da MIC que afeta estacas de aço na água do mar perto da marca de maré baixa água. É caracterizada por uma lama laranja, que tem um cheiro de sulfeto de hidrogénio quando tratados com ácido. As taxas de corrosão pode ser muito alto e subsídios projeto de corrosão pode ser ultrapassado em breve levando a falha prematura da pilha de aço. Pilhas de revestimento que têm sido e têm protecção catódica instalado no momento de construção não são susceptíveis a ALWC. Para pilhas desprotegidos, os ânodos de sacrifício pode ser instalado local para as áreas afectadas que inibem a corrosão ou a um sistema de ânodo de sacrifício completo adaptado pode ser instalado. As áreas afectadas podem também ser tratada electroquimicamente usando um eléctrodo para a primeira produção de cloro para matar as bactérias, e, em seguida, produzido a um depósito de calcário, que irá ajudar a proteger o metal de novos ataques.
De alta temperatura corrosão
De alta temperatura corrosão é a deterioração química de um material (tipicamente um metal) como um resultado de aquecimento. Esta forma não-galvânica de corrosão pode ocorrer quando um metal é sujeita a uma atmosfera quente contendo oxigénio, de enxofre ou outros compostos capazes de oxidante (ou ajudar a oxidação de) o material em questão. Por exemplo, os materiais utilizados na indústria aeroespacial, geração de energia e até mesmo em motores de automóveis têm de resistir a períodos prolongados a alta temperatura em que eles podem ser expostos a uma atmosfera contendo produtos altamente corrosivos de combustão potencialmente.
Os produtos de corrosão a alta temperatura pode potencialmente ser transformado para a vantagem de o engenheiro. A formação de óxidos de aços inoxidáveis, por exemplo, pode fornecer uma camada de protecção evitando mais ataque atmosférico, o que permite por um material a ser utilizado durante períodos contínuos a ambiente e temperaturas elevadas em condições hostis. Tais produtos de corrosão a alta temperatura, sob a forma de esmaltes camada de óxido compactadas, prevenir ou reduzir o desgaste durante a alta temperatura de contato deslizante de metal (ou metal e cerâmica) superfícies.
Limpar o Pó de metal
Metal polvilhamento é uma forma catastrófica de corrosão que ocorre quando os materiais são susceptíveis expostos a ambientes com elevadas actividades de carbono, tais como gás de síntese e outros ambientes de alta CO. A corrosão manifesta-se como um break-up de metal de grandes quantidades de pó metálico. O mecanismo suspeita é, em primeiro lugar o depósito de uma camada de grafite sobre a superfície do metal, geralmente a partir de monóxido de carbono (CO) na fase de vapor. Esta camada de grafite é então pensado para formar espécies metaestáveis H 3 C (em que M é o metal), que migram para longe da superfície do metal. No entanto, em alguns regimes há três espécies H C é observada indicando uma transferência directa de átomos de metal para dentro da camada de grafite.
Proteção contra corrosão
Tratamentos de superfície
Revestimentos Aplicadas

Chapeamento, pintura, e a aplicação de esmalte são os mais comuns tratamentos anti-corrosão. Eles trabalham, proporcionando uma barreira de material resistente à corrosão entre o meio ambiente e prejudicial o material estrutural. Além das questões cosméticas e de fabrico, há vantagens e desvantagens em flexibilidade mecânica contra a resistência à abrasão e temperatura elevada. Platings geralmente falham apenas em pequenas secções, e se o revestimento é mais nobre que o substrato (por exemplo, crómio no aço), um par galvânico causará qualquer área exposta à corrosão muito mais rapidamente do que o faria uma superfície não-revestidos. Por esta razão, é muitas vezes aconselhável para a chapa de metal activo, tal como o zinco ou o cádmio. Pintura quer por rolo ou pincel é mais desejável para espaços apertados; pulverizar seria melhor para áreas de revestimento maiores, como plataformas de aço e aplicações beira-mar. Revestimentos de poliuretano flexíveis, como Durabak-M26 por exemplo, podem fornecer uma vedação anti-corrosivo com uma membrana antiderrapante altamente durável. Revestimentos pintados são relativamente fáceis de aplicar e têm tempos de secagem rápida, ainda que a temperatura e humidade do ar podem provocar tempos de secagem para variar.
Revestimentos reactivos
Se o ambiente é controlada (especialmente em sistemas de recirculação), inibidores de corrosão muitas vezes pode ser adicionada a ele. Estes formam um revestimento isolante electricamente ou quimicamente impermeável sobre superfícies metálicas expostas, para suprimir reacções electroquímicas. Tais métodos, obviamente, tornar o sistema menos sensível a riscos ou defeitos no revestimento, uma vez que os inibidores adicionais podem ser disponibilizados de metal onde quer que fica exposta. Produtos químicos que inibem a corrosão incluem alguns dos sais em água dura (sistemas de água Roman são famosos por seus depósitos minerais ), cromatos, fosfatos, polianilina, outra polímeros condutores e uma vasta gama de produtos químicos especialmente desenhados que se assemelham agentes tensioactivos (isto é, de cadeia longa moléculas orgânicas com grupos terminais iónicos).
A anodização

As ligas de alumínio, muitas vezes submetidos a um tratamento de superfície. Condições eletroquímicas no banho são cuidadosamente ajustado para que os poros uniforme vários nanômetros de largura aparecem no filme de óxido do metal. Estes poros permitem que o óxido de crescer muito mais espessa do que as condições passivadores permitiria. No final do tratamento, os poros são permitidos para vedar, formar uma camada de superfície mais dura do que o usual. Se este revestimento é riscado, processos de passivação normais assumir para proteger a área danificada.
Anodização é muito resistente às intempéries e à corrosão, por isso é comumente usado para fachadas de edifícios e outras áreas que a superfície irá entrar em contacto regular com os elementos. Embora seja resiliente, ele deve ser limpo frequentemente. Se deixada sem limpeza, coloração aresta do painel irá ocorrer naturalmente.
Revestimentos de biofilme
Uma nova forma de protecção tem sido desenvolvido através da aplicação de certas espécies de películas bacterianas para a superfície de metais em ambientes altamente corrosivos. Este processo aumenta substancialmente a resistência à corrosão. Alternativamente, antimicrobiana produtoras biofilmes pode ser utilizado para inibir a corrosão de aço leve bactérias redutoras de sulfato.
Controlado cofragem de permeabilidade
Controlled cofragem permeabilidade (CPF) é um método de prevenir a corrosão de reforço, melhorando naturalmente a durabilidade do cobrir durante a colocação do concreto. CPF foi usado em ambientes para combater os efeitos de carbonatação, cloretos, geada e à abrasão.
A proteção catódica
A protecção catódica (CP) é uma técnica para controlar a corrosão de uma superfície metálica, fazendo que a superfície do cátodo de um célula electroquímica. Sistemas de protecção catódica são mais comumente usado para proteger o aço, água, combustível e oleodutos e tanques; cais de aço pilhas, navios e no mar plataformas de petróleo.
Proteção ânodo sacrificial

Para CP eficazes, o potencial da superfície do aço é polarizada (pressionado) mais negativo até que a superfície do metal tem um potencial uniforme. Com um potencial uniforme, a força motriz para a reacção de corrosão é interrompida. Para os sistemas de CP galvânicos, o material corrói ânodo, sob a influência do aço, e, eventualmente, tem de ser substituído. O polarização é causada pelo fluxo de corrente a partir do ânodo para o cátodo, accionado pela diferença de potencial electroquímico entre o ânodo e o cátodo.
Proteção catódica atuais impressos
Para estruturas maiores, ânodos galvânicos não pode economicamente fornecer corrente suficiente para fornecer proteção completa. Sistemas de proteção catódica atuais impressos (ICCP) usar ânodos ligados a uma Fonte de energia DC (por exemplo, uma catódica retificador proteção). Ânodos para sistemas ICCP são formas haste tubulares e sólidos de vários materiais especializados. Estes incluem silício de alta de ferro fundido, grafite, óxido de metal misto ou platina titânio revestido ou nióbio revestido haste e fios.
Proteção anódica
Protecção anódica imprime corrente anódica sobre a estrutura a ser protegida (oposta à protecção catódica). É adequado para os metais que exibem passividade (por exemplo, aço inoxidável) e adequadamente pequena corrente passiva ao longo de um vasto leque de potenciais. É utilizado em ambientes agressivos, por exemplo, soluções de ácido sulfúrico.
Taxa de corrosão
Um teste simples para medir a corrosão é o método de perda de peso. O método envolve a exposição de um pedaço pesado limpa do metal ou liga para o ambiente corrosivo para um período de tempo especificado, seguido por limpeza para remover produtos de corrosão e pesagem da peça para determinar a perda de peso. A taxa de corrosão (R) é calculado conforme
- R = KW / (ρAt)
onde k é uma constante, W é a perda de peso do metal no tempo t, A é a área de superfície do metal exposto, e ρ é a densidade do metal (em g / cm).
Impacto econômico

Em 2002, os EUA Administração Rodoviária Federal divulgou um estudo intitulado Custos de corrosão e estratégias preventivas nos Estados Unidos sobre os custos diretos associados com corrosão metálica na indústria os EUA. Em 1998, o custo direto anual total de corrosão em os EUA estavam CA. 276,000 milhões dólares (cerca de 3,2% de os EUA produto interno bruto ).
A ferrugem é uma das causas mais comuns de acidentes de pontes. Como a ferrugem tem um volume muito maior do que a massa de origem do ferro, a sua construção, também pode causar a falha, forçando além partes adjacentes. Foi a causa do colapso da Mianus ponte do rio em 1983, quando os rolamentos enferrujados internamente e empurrou um canto da laje fora de estrada o seu apoio. Três motoristas na estrada no momento morreram como a laje caiu no rio abaixo. A seguir NTSB investigação mostrou que um dreno na estrada tinha sido bloqueado por estrada re-pavimentação, e não tinha sido desbloqueado; Como resultado, a água de escoamento penetrou os cabides de apoio. Rust também foi um fator importante na Desastre ponte de prata de 1967, em West Virginia , quando um aço Ponte de suspensão em colapso dentro de um minuto, matando 46 motoristas e passageiros na ponte no momento.
Da mesma forma, corrosão do aço coberta de concreto e ferro pode causar o concreto spall, criando problemas estruturais graves. É um dos modos mais comuns de falha de betão armado pontes . Instrumentos de medição com base no potencial de meia-célula pode detectar os potenciais manchas de corrosão antes da falha total da estrutura de betão seja atingido.
Até há 20-30 anos; tubo de aço galvanizado foi amplamente utilizado nos sistemas de água potável para moradores de família simples e multi bem como construção comercial e público. Hoje, esses sistemas há muito consumido o zinco protetora e estão corroendo internamente, resultando em falhas de má qualidade da água e tubulações. O impacto econômico sobre os proprietários, moradores do condomínio, ea infra-estrutura pública é estimado em 22 bilhões de dólares como chaves do setor de seguros para uma onda de reclamações de falhas de tubulação.
Corrosão em não metais
Mais materiais cerâmicos são quase inteiramente imunes à corrosão. As fortes ligações químicas que segurá-los juntos deixar muito pouca energia química livre na estrutura; que pode ser pensado como já corroído. Quando a corrosão ocorre, é quase sempre uma simples dissolução do material de reacção ou química, em vez de um processo electroquímico. Um exemplo comum de protecção contra a corrosão em cerâmica é o cal adicionada à soda-cal de vidro para reduzir a sua solubilidade em água; embora ele não é tão solúvel como pura silicato de sódio, vidro normal faz formar falhas sub-microscópicos quando expostos à humidade. Devido à sua fragilidade, tais falhas causam uma redução dramática na resistência de um objecto de vidro durante os seus primeiros algumas horas à temperatura ambiente.
A corrosão dos polímeros
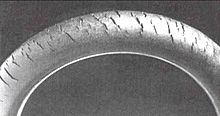
Degradação do polímero envolve vários processos físico-químicos complexos e muitas vezes mal-entendidos. Estes são notavelmente diferente dos outros processos aqui discutidos, e assim o termo "corrosão" só é aplicado a eles em um sentido amplo da palavra. Devido ao seu grande peso molecular, muito pouco de entropia pode ser obtida por mistura de uma dada massa de polímero com uma outra substância, tornando-os geralmente muito difíceis de dissolver. Embora a dissolução é um problema em algumas aplicações de polímeros, que é relativamente simples de conceber contra. Um problema mais comum é o inchaço e afins, onde as moléculas pequenas infiltrar a estrutura, reduzindo a resistência ea rigidez e causando uma alteração de volume. Por outro lado, muitos polímeros (nomeadamente flexível vinil) são intencionalmente inchou com plastificantes, que podem ser lixiviados para fora da estrutura, fazendo com que a fragilidade ou outras alterações indesejáveis. A forma mais comum de degradação, no entanto, é um decréscimo no comprimento da cadeia de polímero. Mecanismos que quebram as cadeias de polímero são familiares aos biólogos por causa de seu efeito sobre o ADN : radiação ionizante (mais comumente ultravioleta luz), radicais livres, e oxidantes, tais como oxigênio, ozônio e cloro . Ozone craqueamento é um problema conhecido que afeta a borracha natural , por exemplo. Os aditivos podem retardar esse processo de forma muito eficaz, e pode ser tão simples como um absorvente de UV pigmento (ou seja, dióxido de titânio ou negro de carbono). Sacolas plásticas muitas vezes não incluem estes aditivos para que eles quebram mais facilmente como maca .
A corrosão de vidros

Doença de vidro é a corrosão de vidros de silicato em soluções aquosas. É governada por dois mecanismos: lixiviação (troca de iões), controlada por difusão e a dissolução hidrolítica da rede de vidro. Ambos os mecanismos dependem fortemente do pH da solução contatando: a taxa de troca iônica diminui com pH como 10 -0.5pH Considerando que a taxa de hidrolíticas de dissolução aumenta com pH como 10 0.5pH.
Matematicamente, as taxas de corrosão de vidros são caracterizados por taxas de corrosão de elementos normalizados N ° I (g / cm2-d) que são determinadas como a relação da quantidade total de espécies libertados para a água M i (g) para a superfície de contacto com a água área S (cm2), o tempo de contacto T (dias) e fracção de peso de conteúdo do elemento de vidro no f i:
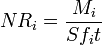 .
.
A taxa global de corrosão é uma soma de contribuições de ambos os mecanismos (lixiviação + dissolução) NR i = i + NRX NRh. Lixiviação (troca de iões), controlada por difusão é característica da fase inicial de corrosão e envolve a substituição de iões alcalinos no vidro por um hidrónio (H3O +) de iões da solução. Ela provoca um esgotamento íon-seletivo de camadas superficiais perto de óculos e dá uma dependência raiz quadrada inversa da taxa de corrosão com o tempo de exposição. A taxa de lixiviação normalizada controlado por difusão de catiões a partir de vidros (g / cm 2 · d) é dada por:
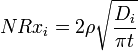 ,
,
onde t é o tempo, D i é o catião de coeficiente de ordem i eficaz de difusão (cm2 / d), que depende do pH da água contactando como D i = D i0 · 10 -Ph, e ρ é a densidade do vidro ( g / cm 3).
Dissolução de rede de vidro é característica das fases posteriores de corrosão e provoca a libertação de iões congruente na solução de água a uma velocidade independente do tempo em soluções diluídas (g / cm2-d):
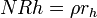 ,
,
onde Rh representa a estacionário taxa de hidrólise (dissolução) do vidro (cm / d). Em sistemas fechados, o consumo de protões a partir da fase aquosa aumenta o pH e provoca uma rápida transição de hidrólise. No entanto, uma situação de saturação da solução com sílica impede hidrólise e faz com que o vidro de voltar a uma permuta iónica, por exemplo, regime de difusão controlada de corrosão.
Em condições naturais típicos taxas de corrosão de vidros de silicato normalizados são muito baixos e são da ordem de 10 -10 -7 -5 g / (cm2-d). A altíssima durabilidade dos óculos de silicato na água os torna adequados para a imobilização dos resíduos perigosos e nucleares.
Testes de vidro corrosão
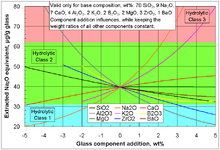
Existem numerosos procedimentos normalizados para medir a corrosão (também chamado durabilidade química) de copos em ambientes neutros, básicos e ácidos, sob condições ambientais simuladas, em fluido corporal simulado, a alta temperatura e pressão, e em outras condições.
O procedimento padrão ISO 719 descreve um teste de extracção de compostos básicos solúveis em água sob condições neutras: 2 g de vidro, de tamanho de partículas de 300-500 um, é mantida durante 60 min em 50 ml de água desionizada de grau 2 em 98 ° C; 25 ml da solução obtida é titulada com 0,01 mol / L de HCl solução. O volume de HCI necessário para a neutralização é classificada de acordo com a tabela abaixo.
| Montante de HCl 0,01 M necessária para neutralizar os óxidos básicos extraídos ml | Extraído Na2O equivalente, ug | Hidrolítica classe |
|---|---|---|
| <0,1 | <31 | 1 |
| 0,1-0,2 | 31-62 | 2 |
| 0,2-0,85 | 62-264 | 3 |
| 0,85-2,0 | 264-620 | 4 |
| 2,0-3,5 | 620-1085 | 5 |
| > 3.5 | > 1085 | > 5 |

