
Dubnium
Sobre este escolas selecção Wikipedia
Esta seleção Escolas foi originalmente escolhido pelo SOS Children para as escolas no mundo em desenvolvimento sem acesso à internet. Ele está disponível como um download intranet. Patrocinar uma criança para fazer uma diferença real.
| Dubnium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
105 dB | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aparência | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| desconhecido | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades gerais | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | dubnium, Db, 105 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pronúncia | / d u b n Eu ə m / DOOB -nee-əm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria elemento | de metal de transição | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | 5, 7, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atômico padrão | [268] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Rn ] 5f 14 6d três 7s 2 (Previsto) 2, 8, 18, 32, 32, 11, 2 (Previsto)  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| História | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Descoberta | Instituto Conjunto de Pesquisa Nuclear (1968) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido (prevista) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidade (perto RT) | 29 (prevista) · g cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades atômicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidação | 5, 4, 3 (prevista) (Estados de oxidação única em negrito são conhecidos experimentalmente) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energias de ionização ( Mais) | 1º: 664,8 (estimado) kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Segunda: 1546,7 (avaliado) kJ mol -1 · | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3: 2.378,4 (estimado) kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio atômico | 139 (avaliado) pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| O raio de covalência | 149 (avaliado) pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelânea | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registo CAS | 53850-35-4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de dubnium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dubnium é um elemento químico com o símbolo Db e número atômico 105, nomeado após a cidade de Dubna na Rússia , onde foi produzido pela primeira vez. É um elemento sintético (um elemento que pode ser criado num laboratório, mas não se encontra na natureza) e radioactivos; o mais estável conhecida isótopo , dubnium-268, tem uma meia-vida de aproximadamente 28 horas.
No tabela periódica dos elementos, é um elemento d-bloco e no elementos transactinide. Ele é um membro da 7a período que pertence à grupo 5 elemento. Experiências químicas confirmaram que dubnium comporta-se como o mais pesado homólogo de tântalo no grupo 5. As propriedades químicas de dubnium são caracterizados apenas parcialmente. Eles são semelhantes às de outros grupos de cinco elementos.
Na década de 1960, quantidades microscópicas de dubnium foram produzidos nos laboratórios da ex- União Soviética e na Califórnia . A prioridade da descoberta e, por conseguinte, o nomeação do elemento foi disputada entre cientistas soviéticos e norte-americanos, e não foi até 1997 que União Internacional de Química Pura e Aplicada (IUPAC) estabeleceu dubnium como o nome oficial para o elemento.
História
Descoberta
Dubnium era declaradamente descoberto pela primeira vez em 1968 no Instituto Conjunto de Pesquisa Nuclear em Dubna (então na União Soviética ). Pesquisadores há bombardeado uma alvo amerício-243 com neon-22 íons . Eles relataram uma MeV 9,40 e um 9,70 MeV alfa-atividade e atribuídos os decaimentos até o isótopo 260 ou 261 Db Db:
- 243
Am + 95 22
10 Ne → 265- x
105 Db + x n
Dois anos mais tarde a equipa Dubna separados seus produtos de reacção por cromatografia em gradiente térmico após a conversão para os cloretos por interacção com NbCl5. A equipe identificou um 2,2 segundo atividade espontânea fissão contidos dentro de um cloreto volátil retratando propriedades eka-tântalo, provavelmente dubnium-261 pentacloreto, 261 dBcL 5.
No mesmo ano, uma equipe liderada por Albert Ghiorso trabalhando no University of California, Berkeley conclusivamente sintetizado o elemento bombardeando um alvo califórnio-249 com íons de nitrogênio-15. A equipa publicada uma síntese convincente de 260 dB na reacção entre alvo califórnio-249 e nitrogênio-15 íons e mediu o decaimento alfa de 260 Db com uma meia-vida de 1,6 segundos e uma energia de decaimento de 9,10 MeV, correlacionada com a decadência filha de lawrencium -256:
- 249
98 Cf + 15
7 260 N →
105 Db + 4 n
Estes resultados pelos cientistas de Berkeley não confirmou os soviéticos achados em relação a 9,40 MeV ou 9,70 MeV alfa-decadência do dubnium-260, deixando apenas dubnium-261 possível isótopo produzido. Em 1971, a equipe de Dubna repetiu sua reação usando um melhor set-up e foram capazes de confirmar os dados de decaimento para 260 Db usando a reação:
- 243
Am + 95 22
10 Ne → 260
105 Db + 5 n
Em 1976, a equipe de Dubna continuou seu estudo da reação utilizando cromatografia de gradiente térmico e foram capazes de identificar o produto como dubnium-260 pentabrometo, 260 DbBr 5.
Em 1992, a IUPAC / IUPAP Grupo de Trabalho Transfermium avaliou as reivindicações dos dois grupos e concluiu que a confiança na descoberta cresceu a partir dos resultados de ambos os laboratórios e que o pedido de descoberta deve ser compartilhado.
Naming controvérsia


A Soviética, depois da Rússia, a equipe propôs a nielsbohrium de nomes (NS) em homenagem ao físico nuclear dinamarquês Niels Bohr . A equipe americana propôs que o novo elemento deve ser nomeado hahnium (Ha), em honra do falecido alemão químico Otto Hahn. Consequentemente hahnium era o nome que os cientistas europeus mais americanos e ocidentais usadas e aparece em muitos artigos publicados na época, e nielsbohrium foi usada na União Soviética e Países de Leste.
Um elemento que nomeia a controvérsia irrompeu entre os dois grupos. O União Internacional de Química Pura e Aplicada (IUPAC) unnilpentium assim aprovado (Unp) como temporário, nome de elemento sistemático. A tentativa de resolver o problema, em 1994, a IUPAC propôs o nome joliotium (Jl), em homenagem ao físico francês Frédéric Joliot-Curie, que foi originalmente proposto pela equipe soviética para o elemento 102, mais tarde nomeado nobelium . Os dois principais demandantes ainda discordaram sobre os nomes dos elementos 104-106. No entanto, em 1997, eles resolveram a disputa e adotou o nome atual, dubnium (Db), após o russo cidade de Dubna, a localização do Instituto Conjunto de Pesquisa Nuclear. Foi alegado pela IUPAC que o laboratório Berkeley já tinha sido reconhecido várias vezes na nomeação de elementos (ou seja, berquélio , califórnio , amerício ) e que a aceitação do nomes rutherfordium e seaborgium para os elementos 104 e 106 devem ser compensados através do reconhecimento da contribuições da equipe da Rússia para a descoberta de elementos 104, 105 e 106.
Propriedades químicas
Propriedades extrapoladas
O elemento 105 é projetado para ser o terceiro membro da série 6d de metais de transição e o membro mais pesado do grupo V na Tabela Periódica, abaixo de vanádio , nióbio e tântalo . Porque ele está posicionado logo abaixo tântalo, ele também pode ser chamado de eka-tântalo. Todos os membros do grupo facilmente retratar seu estado de oxidação de 5 e o estado torna-se mais estável à medida que o grupo está descido. Assim, é esperado dubnium para formar um 5 estado estável. Para este grupo, quatro e três estados também são conhecidos para os membros mais pesados e dubnium também podem formar estes redutores estados de oxidação.
Em uma extrapolação das químicas de nióbio e tântalo , dubnium deve reagir com o oxigênio para formar uma pentóxido inerte, Db 2 O 5. Em alcalino, a formação de um complexo orthodubnate, DBO 3-
4, é esperado. Reação com os halogênios deve prontamente formar os penta, DBX 5. Os pentachlorides de nióbio e tântalo existir como sólidos voláteis ou moléculas bipiramidal trigonal monoméricas em fase de vapor. Assim, dBcL 5 está prevista para ser um sólido volátil. Da mesma forma, o pentafluoride, DBF 5, deve ser ainda mais volátil. A hidrólise dos halogenetos é conhecido por formar prontamente os oxi-halogenetos, MOX 3. Assim, os halogenetos DBX 5 deve reagir com água para formar dbox 3. A reacção com iões de fluoreto é também bem conhecida para os homólogos de mais leves e dubnium é esperado para formar uma variedade de complexos de flúor. Em particular, a reacção de IC com o pentafluoreto deve formar um ião hexafluorodubnate, dbf -
6. O excesso de flúor deve levar a DBF 2-
7 e DbOF 2-
5. Se as propriedades eka-tântalo são retratados, maiores concentrações de flúor deve, em última instância formar DBF 3-
8 desde NBF 3-
8 não é conhecido.
Química experimental
A química do dubnium foi estudado por vários anos usando thermochromatography gás. Os experimentos têm estudado as características de adsorção relativas de isótopos de nióbio , tântalo e dubnium radioisótopos. Os resultados indicaram a formação de um grupo típico 5 halogenetos e oxi-halogenetos, nomeadamente dBcL 5, DbBr 5, 3 e DbOCl DbOBr 3. Os relatórios dessas primeiras experiências geralmente se referem a Dubnium como hahnium.
| Fórmula | Nomes (s) |
|---|---|
| DBcL 5 | dubnium pentacloreto; dubnium (V) de cloreto de |
| DbBr 5 | dubnium pentabrometo; dubnium (V) brometo |
| DbOCl 3 | oxicloreto dubnium; dubnium (V) tricloreto de óxido de; dubnyl (V) de cloreto de |
| DbOBr 3 | oxibrometo dubnium; dubnium (V) de óxido de tribrometo; dubnyl (V) brometo |
História Nucleosynthesis
A fusão a frio
Esta seção lida com a síntese de núcleos de dubnium pelos chamados "frios" reações de fusão. Estes são processos que criam núcleos compostos em baixa energia de excitação (~ 10-20 MeV, portanto, "frio"), levando a uma maior probabilidade de sobrevivência de fissão. O núcleo animado então decai para o estado fundamental através da emissão de apenas um ou dois nêutrons.
- 209 Bi (50 Ti, xn) 259-x Db (x = 1,2,3)
As primeiras tentativas de sintetizar dubnium utilizando reacções de fusão a frio foram realizados em 1976 pela equipe do FLNR, Dubna usando a reação acima. Eles foram capazes de detectar a 5 s fissão (SF) atividade espontânea que eles atribuíram a 257 Db. Esta atribuição foi posteriormente corrigida para 258 Db. Em 1981, a equipe da GSI estudou esta reacção utilizando a técnica melhorada de correlação genética de pai-filha decai. Eles foram capazes de identificar positivamente 258 Db, o produto a partir do canal evaporação 1N de nêutrons. Em 1983, a equipe em Dubna revisitou a reação usando o método de identificação de um descendente usando separação química. Eles conseguiram medir alfa decai de descendentes conhecidos da cadeia de decaimento que começam com 258 Db. Isto foi tomado como proporcionando alguma evidência para a formação de núcleos dubnium. A equipe da GSI revisitou a reação em 1985 e foram capazes de detectar 10 átomos de 257 Db. Depois de uma atualização significativa de suas instalações em 1993, em 2000, a equipe mediu 120 decaimentos de 257 Db, 16 decaimentos de 256 dB e decadência de 258 Db na medição das funções 1N, 2N e 3N de excitação. Os dados recolhidos para 257 Db permitiu um estudo espectroscópico primeiro deste isótopo e identificou um isômero, 257m Db, e uma primeira determinação de uma estrutura de nível decadência para 257 Db. A reacção foi usada em estudos de espectroscopia de isótopos de mendelevium e einsteinium em 2003-2004.
- 209 Bi (49 Ti, xn) 258-x Db (x = 2?)
Esta reação foi estudada por Yuri Oganessian ea equipe em Dubna em 1983. Eles observaram um 2.6 s atividade SF provisoriamente atribuído a 256 Db. Resultados posteriores sugerem uma possível transferência para 256 Rf, resultante do ~ 30% filial da CE em 256 Db.
- 209 Bi (48 Ti, xn) 257-x Db (x = 1?)
Esta reação foi estudada por Yuri Oganessian ea equipe em Dubna em 1983. Eles observaram um 1.6 s atividade com um ramo alpha ~ 80% com um ~ 20% ramo SF. A atividade foi provisoriamente atribuído a 255 Db. Resultados posteriores sugerem uma reafectação a 256 Db.
- 208 Pb (51 V, xn) 259-x Db (x = 1,2)
A equipe em Dubna também estudou essa reação em 1976 e foram novamente capaz de detectar a 5 s atividade SF, primeiro tentativamente atribuído a 257 Db e depois para 258 Db. Em 2006, a equipe da LBNL novo inquérito essa reação como parte de seu programa de projétil odd-Z. Eles foram capazes de detectar 258 dB e 257 Db em sua medição dos canais de evaporação de nêutron 1N e 2N.
- 207 Pb (51 V, xn) 258-x Db
A equipe em Dubna também estudou essa reação em 1976, mas desta vez eles não foram capazes de detectar a 5 s atividade SF, primeiro tentativamente atribuído a 257 Db e depois para 258 Db. Em vez disso, eles foram capazes de medir a 1,5 s atividade SF, provisoriamente atribuído a 255 Db.
- 205 Tl (54 Cr, xn) 259-x Db (x = 1?)
A equipe em Dubna também estudou essa reação em 1976 e foram novamente capaz de detectar a 5 s atividade SF, primeiro tentativamente atribuído a 257 Db e depois para 258 Db.
Fusão quente
Esta seção lida com a síntese de núcleos de dubnium pelos chamados "hot" reações de fusão. Estes são processos que criam núcleos compostos em alta energia de excitação (~ 40-50 MeV, portanto, "quente"), que conduz a uma reduzida probabilidade de sobrevivência de fissão e quasi-fissão. O núcleo animado depois decai para o estado fundamental por meio da emissão de neutrões 3-5.
- 232 Th (31 P, xn) 263-x Db (x = 5)
Há relatos muito limitadas que esta reação rara utilizando um feixe de P-31 foi estudado em 1989 por Andreyev et al. no FLNR. Uma fonte sugere que não foram detectados átomos enquanto uma melhor fonte de os próprios russos indica que Db 258 foi sintetizado do canal 5n com um rendimento de 120 pb.
- 238 U (27 Al, xn) 265-x Db (x = 4,5)
Em 2006, como parte de seu estudo sobre a utilização de alvos de urânio em síntese elemento superpesado, a equipe liderada por Ken LBNL Gregorich estudou as funções de excitação para os canais 4n e 5N nesta nova reação.
- 236 U (27 Al, xn) 263-x Db (x = 5,6)
Esta reacção foi estudada pela primeira vez por Andreyev et al. no FLNR, Dubna em 1992. Eles foram capazes de observar 258 dB e 257 dB na canais 5N e saída 6n com rendimentos de 450 pb e 75 pb, respectivamente.
- 243 Am (22 Ne, xn) 265-x Db (x = 5)
As primeiras tentativas de sintetizar dubnium foram realizados em 1968 pela equipe do Laboratório Flerov de reações nucleares (FLNR) em Dubna, Rússia. Eles observaram duas linhas alfa que provisoriamente atribuídos a 261 dB e 260 Db. Eles repetiram o experimento em 1970 à procura de fissão espontânea. Eles encontraram um 2.2 s atividade SF que eles atribuído a 261 Db. Em 1970, a equipe começou a trabalhar em Dubna usando thermochromatography gradiente, a fim de detectar dubnium em experiências químicas como cloreto volátil. Em sua primeira corrida eles detectaram uma atividade SF volátil, com propriedades de adsorção semelhantes aos NbCl5 e ao contrário HfCl4. Isto foi tomado para indicar a formação de núcleos de dvi-nióbio como dBcL 5. Em 1971, repetiram a experiência da química usando uma sensibilidade mais elevada e observaram alfa decai de um componente DVI-nióbio, feita para confirmar a formação de 260 Db. O método foi repetido em 1976 usando a formação de brometos e obteve resultados quase idênticos, indicando a formação de um volátil,-dvi-nióbio como DbBr 5.
- 241 Am (22 Ne, xn) 263-x Db (x = 4,5)
Em 2000, cientistas chineses do Instituto de Física Moderna (IMP), Lanzhou, anunciou a descoberta do isótopo previamente desconhecida 259 Db formado no canal de evaporação de nêutron 4n. Eles também foram capazes de confirmar as propriedades de decaimento para 258 Db.
- 248 cm (19 F, xn) 267-x Db (x = 4,5)
Esta reacção foi estudada pela primeira vez em 1999 no Instituto Paul Scherrer (PSI), a fim de produzir 262 dB para estudos químicos. Apenas a 4 átomos foram detectados com uma secção transversal de 260 pb. Cientistas japoneses na JAERI estudaram a reação ainda mais em 2002 e determinou rendimentos para o isótopo 262 dB durante seus esforços para estudar a química aquosa de dubnium.
- 249 Bk (18O, xn) 267-x Db (x = 4,5)
Na sequência da descoberta de 260 Db por Albert Ghiorso em 1970 na Universidade da Califórnia (UC), a mesma equipe continuou em 1971 com a descoberta do novo isótopo 262 Db. Eles também observaram 25 s atividade SF não atribuído, provavelmente associado ao ramo SF agora conhecida de 263 Db. Em 1990, uma equipe liderada por Kratz em LBNL definitivamente descobriu o novo isótopo 263 Db no canal de evaporação de nêutron 4n. Esta reação tem sido usada pela mesma equipe em várias ocasiões, a fim de tentar confirmar uma captura de elétrons ramo (CE) no 263 Db levando a longa vida 263 Rf (ver rutherfordium ).
- 249 Bk (16O, xn) 265-x Db (x = 4)
Na sequência da descoberta de 260 Db por Albert Ghiorso em 1970 na Universidade da Califórnia (UC), a mesma equipe continuou em 1971 com a descoberta do novo isótopo 261 Db.
- 250 CF (15 N, xn) 265-x Db (x = 4)
Na sequência da descoberta de 260 Db por Ghiorso em 1970 no LBNL, a mesma equipe continuou em 1971 com a descoberta do novo isótopo 261 Db.
- 249 CF (15 N, xn) 264-x Db (x = 4)
Em 1970, a equipe do Laboratório Nacional Lawrence Berkeley (LBNL) estudaram essa reação e identificou o isótopo 260 Db em sua experiência de descoberta. Eles usaram a técnica moderna de correlação genética de pai-filha decai para confirmar a sua atribuição. Em 1977, a equipe da Oak Ridge repetiu a experiência e foram capazes de confirmar a descoberta pela identificação de K raios-X da filha lawrencium .
- 254 Es (13 C, xn) 267-x Db
Em 1988, cientistas como o Laboratório Nacional Lawrence Livermore (LLNL) usou a reação de fusão quente assimétrica com um alvo einsteinium-254 para procurar os novos nuclídeos 264 dB e 263 dB. Devido à baixa sensibilidade do experimento causado pelo pequeno alvo Es-254, eles foram incapazes de detectar eventuais resíduos de evaporação (ER).
Decadência dos nuclidos mais pesados
Isótopos de dubnium também foram identificados no decaimento de elementos mais pesados. As observações até à data estão resumidos no quadro a seguir:
| Resíduo de evaporação | Observado isótopo dubnium |
|---|---|
| 294 Uus | 270 Db |
| 288 UUP | 268 Db |
| 287 UUP | 267 Db |
| 282 Uut | 266 Db |
| 267 Bh | 263 Db |
| 278 Uut, 266 Bh | 262 Db |
| 265 Bh | 261 Db |
| 272 Rg | 260 Db |
| 266 Mt, 262 Bh | 258 Db |
| 261 Bh | 257 Db |
| 260 Bh | 256 Db |
Isótopos
| Isótopo | Ano descoberto | reação descoberta |
|---|---|---|
| 256 Db | 1983 ?, 2000 | 209 Bi (50 Ti, 3n) |
| Db 257 g | 1985 | 209 Bi (Ti 50, 2n) |
| Db 257 m | 2000 | 209 Bi (Ti 50, 2n) |
| 258 Db | 1976 ?, 1981 | 209 Bi (50 Ti, n) |
| 259 Db | 2001 | 241 Am (22 Ne, 4n) |
| 260 Db | 1970 | 249 Cf (15 N, 4n) |
| 261 Db | 1971 | 249 Bk (16 S, 4n) |
| 262 Db | 1971 | 249 Bk (18 O, 5N) |
| 263 Db | 1971 ?, 1990 | 249 Bk (18O, 4n) |
| 264 Db | desconhecido | |
| 265 Db | desconhecido | |
| 266 Db | 2006 | 237 NP (48 Ca, 3n) |
| 267 Db | 2003 | 243 Am (48 Ca, 4n) |
| 268 Db | 2003 | 243 Am (48 Ca, 3n) |
| 269 Db | desconhecido | |
| 270 Db | 2009 | 249 BK (Ca 48, 3n) |
Isomeria
- 260 Db
Dados recentes sobre a decadência de 272 Rg revelou que algumas cadeias de desintegração continuará até 260 dB, com extraordinárias mais longos tempos de vida do que o esperado. Estes decaimentos têm sido associados a um nível de decomposição isomérica por decaimento alfa com uma semi-vida de 19 ~ s. Mais pesquisas são necessárias para permitir uma atribuição definitiva.
- 258 Db
Evidência para um estado isomeric em 258 Db foi recolhida a partir do estudo da decadência de 266 Mt e 262 Bh. Tem-se observado que esses decaimentos atribuídos a um ramo de captura de electrões (CE) tem uma meia-vida significativamente diferentes para aqueles decomposição por emissão alfa. Esta foi levado a sugerir a existência de um estado isomérico decomposição por CE com uma meia-vida de 20 ~ s. Outros experimentos são necessários para confirmar esta atribuição.
- 257 Db
Um estudo sobre a formação e decomposição de 257 Db provou a existência de um estado isomérico. Inicialmente, 257 Db foi levado à decadência por emissão alfa com energias 9.16,9.07 e 8,97 MeV. Uma medição das correlações destes decai com aqueles de 253 Lr têm mostrado que a deterioração 9.16 MeV pertence a um isómero separado. A análise dos dados em conjunto com a teoria atribuiu esta atividade para um estado estável meta, 257m Db. O estado fundamental decai por emissão alfa com energias 9,07 e 8,97 MeV. Fissão espontânea de 257m, g Db não foi confirmada em experimentos recentes.
Esquemas nível decadência espectroscópicas
- 257 Db
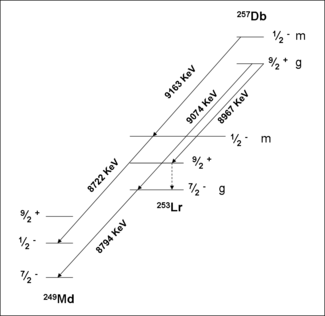
Isótopos retraídos
- 255 Db
Em 1983, cientistas Dubna realizou uma série de experimentos de apoio em sua busca para a descoberta de Bohrium . Em dois desses experimentos, eles alegaram que havia detectado um ~ 1,5 s atividade espontânea fissão do reações 207 Pb (51 V, xn) e 209 Bi (48 Ti, xn). A actividade foi atribuída a 255 Db. Estudos posteriores sugeriram que a atribuição deve ser alterado para 256 Db. Como tal, o isótopo 255 Db não é atualmente reconhecido no gráfico de radionuclídeos e mais pesquisas são necessárias para confirmar este isótopo.

