
Éter
Fundo para as escolas Wikipédia
Crianças SOS oferecem um download completo desta seleção para as escolas para uso em escolas intranets. Todas as crianças disponíveis para apadrinhamento de crianças de Crianças SOS são cuidadas em uma casa de família pela caridade. Leia mais ...
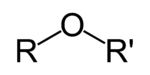
Éter é uma classe de compostos químicos que contêm um éter grupo - um oxigénio átomo ligado a dois (substituído) alquilo ou - grupos arilo de fórmula geral R-O-R '. Um exemplo típico é o solvente e anestésico éter dietílico, vulgarmente referido simplesmente como "éter" (etoxietano, CH 3 -CH 2 -O-CH 2 -CH 3).
Propriedades físicas
Éter moléculas não podem formar ligações de hidrogénio entre si, o que resulta em um relativamente baixo ponto de ebulição comparável à dos análogos álcoois . No entanto, as diferenças entre os pontos de ebulição dos seus éteres e álcoois isométricos tornar-se menor à medida que as cadeias de carbono tornam-se mais, como o natureza hidrofóbica da cadeia de carbono se torna mais predominante sobre a presença de ligação de hidrogénio.
Éteres são ligeiramente polar como o R - C - O - C - ângulo de ligação Z no grupo funcional é de cerca de 110 graus, eo C - O dipolo faz cancelam. Os éteres são menos polares do que os alcenos, mas não tão polar como álcoois, ésteres ou amidas de estrutura comparável. No entanto, a presença de dois pares de electrões solitários sobre os átomos de oxigénio faz com que a ligação de hidrogénio com as moléculas possíveis de água, fazendo com que a solubilidade de álcoois (por exemplo, butan-1-ol) e éteres (etoxietano) a ser bastante diferente.
Éteres cíclicos tais como e tetra-hidrofurano 1,4-dioxano são totalmente miscíveis em água por causa do átomo de oxigénio mais expostos para ligação de hidrogénio, em comparação com éteres alifáticos.
Os éteres podem actuar como Bases de Lewis. Por exemplo, éter dietílico forma um complexo com boro , tais como compostos eterato de dietilo de trifluoreto de boro (BF3. OEt 2). Éteres também coordenar a magnésio em Reagentes de Grignard (RMgBr).
Nomenclatura
Na nomenclatura da IUPAC do sistema, éteres são nomeados com a fórmula geral "alkoxyalkane", por exemplo, CH 3 -CH 2 -O-CH 3 é metoxietano. Se o éter é parte de uma molécula mais complexa, que é descrito como um substituinte alcoxi, -OCH3 modo seria considerado uma " metoxi- "grupo. O mais simples alquilo radical está escrito na frente, de modo CH 3 -O-CH 2 CH 3 seria dado como metoxi (CH 3) etano (CH 2 CH 3). A nomenclatura para descrever os grupos alquilo e dois acrescentando "éter", por exemplo "éter metil-etil" no exemplo acima, é um uso trivial.
Estruturas similares
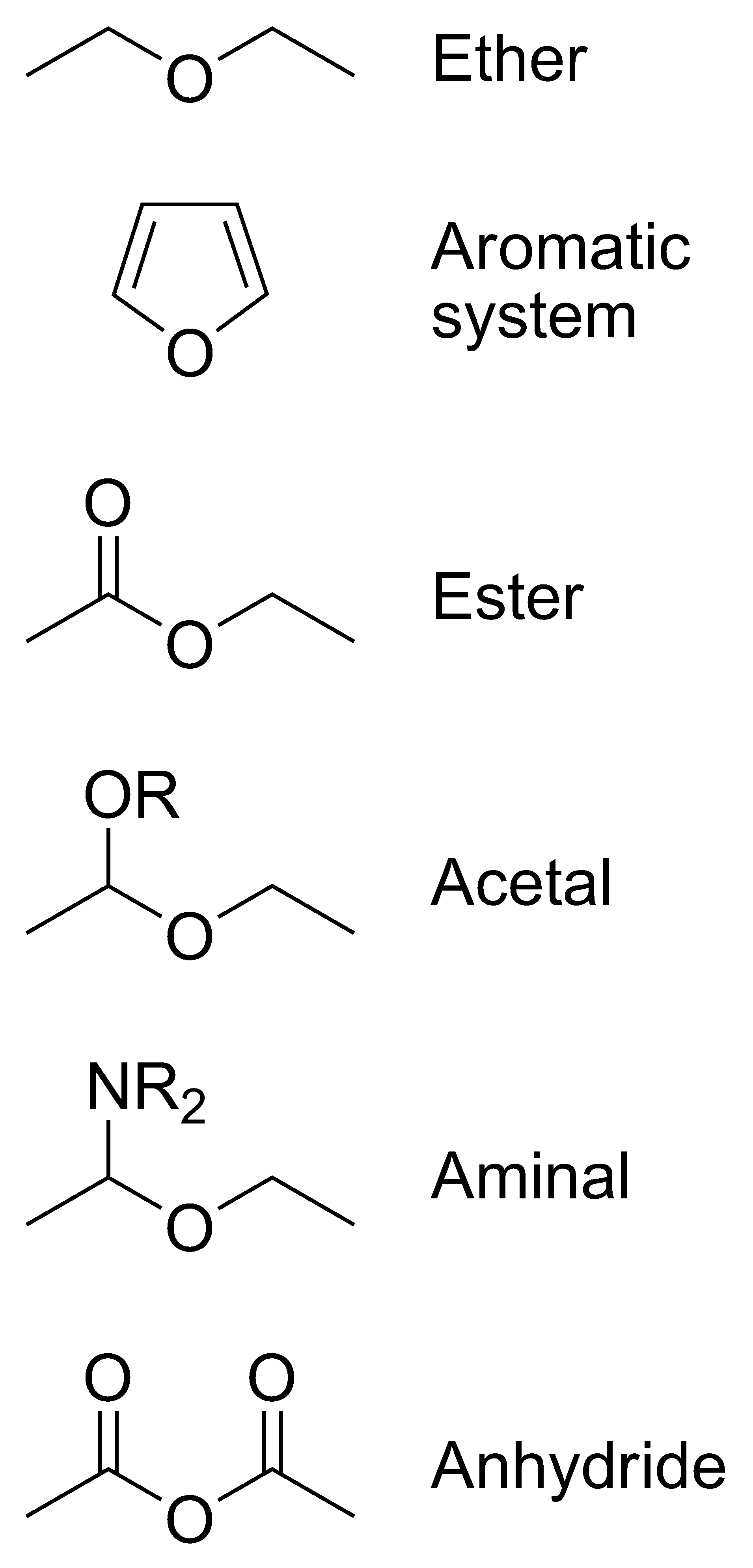
Éteres não devem ser confundidas com as seguintes classes de compostos com a mesma estrutura geral ROR.
- Compostos aromáticos como furano, onde o oxigénio é parte do sistema aromático.
- Os compostos em que um dos átomos de carbono junto ao oxigénio está ligado a oxigénio, azoto , ou enxofre :
- Ésteres RC (= O) -OR
- Os acetais R-CH (OR) -OR
- Aminais R-CH (-NH-R) -OR
- Anidridos RC (= O) -OC (= O) -R
Primário, secundário, terciário e éteres
Os termos "éter primária", "éter secundário" e "terciário éter" são ocasionalmente usados e referem-se a átomo de carbono ao lado do oxigénio de éter. Em um éter primário esta de carbono está ligado apenas a um outro carbono como em éter dietílico CH 3 -CH 2 -O-CH 2 -CH 3. Um exemplo de um éter é secundário éter di-isopropílico (CH3) 2 CH-O-CH (CH 3) 2 e de um éter que é terciário éter di-terc-butilo (CH 3) 3 COC (CH3) 3.
![]()
![]()
![]()
![]()
O éter dimetílico, um primário, um secundária, terciária e um éter.
Poliéteres
Os poliéteres são compostos com mais de um grupo éter. Embora o termo refere-se geralmente como polímeros polietileno glicol e polipropileno glicol, compostos de baixo peso molecular, tais como o éteres de coroa, por vezes, podem ser incluídos.
Reações orgânicas
Síntese
Os éteres podem ser preparados no laboratório, de várias maneiras diferentes.
- A desidratação intermolecular de álcoois :
- R-OH + R-OH → ROR + H2O
- Esta reacção directa requer condições drásticas (aquecimento a 140 graus Celsius e de um catalisador ácido, de ácido sulfúrico concentrado em geral). Eficaz para fazer éteres simétricos, mas não é tão útil para sintetizar éteres assimétricos porque a reacção irá produzir uma mistura de éteres, tornando-se geralmente não aplicáveis:
- 3R-OH + 3R'-OH → ROR + R'-OR + R'-OR '+ 3 H2O
- As condições também deve ser controlada para evitar o sobreaquecimento a 170 graus, que vai causar a desidratação intramolecular, uma reacção que produz alcenos. Além disso, o álcool deve estar em excesso.
- R-CH 2 -CH 2 (OH) → R-CH = CH2 + H2O
- Tais condições podem destruir as estruturas delicadas de alguns grupos funcionais. Existem vários métodos mais suaves para produzir éteres.
- Deslocamento nucleofílico de halogenetos de alquilo por alc�idos
- RO - + RX → ROR + X -
- Esta reacção é chamado o Síntese de Williamson. Ele envolve o tratamento de um dos pais álcool com um forte base para formar o alcóxido de anião seguida por adição de um composto alifático apropriado tendo um adequado grupo de saída (RX). Grupos de saída adequados incluem (X) iodeto, brometo, ou sulfonatos. Este método não funciona quando R é aromático como em bromobenzeno (Br-C 6 H 5), no entanto, se o grupo de saída é separado por pelo menos um carbono do benzeno, a reacção deverá prosseguir (como no Br-CH 2 -C 6 H 5). De igual modo, este método só dá os melhores rendimentos para carbonos primários, como átomos de carbono secundários e terciários E2 vai sofrer eliminação na exposição ao anião alcóxido de base utilizada na reacção devido a impedimento estereoquímico dos grandes grupos alquilo. Éteres de arilo pode ser preparado da Condensação Ullmann.
- Deslocamento nucleofílico de halogenetos de alquilo por fenóxidos
- O RX não pode ser usado para reagir com o álcool. No entanto, fenóis pode ser usado para substituir o álcool, mantendo ao mesmo tempo o halogeneto de alquilo. Desde fenóis são ácidas, elas reagem prontamente com uma forte base tal como hidróxido de sódio para formar o fenóxido de iões. O ião fenóxido vai então substituir o grupo -X no halogeneto de alquilo, formando um éter com um grupo arilo ligado a ela de uma reacção com um Mecanismo SN2.
- HO-C 6 H 5 OH + - → O - C 6 H 5
- O - C 6 H 5 + RX → ROC 6 H 5
- Adição electrofílica de álcoois para alcenos .
- R 2 C = CR 2 + R-OH → R 2 CH-C (OR) 2 -R
- Ácido catálise é necessária para esta reacção. Muitas vezes, trif luoroacetato de mercúrio (Hg (OCOCF3) 2 é usada como um catalisador para a reacção, a criação de um éter com Markovnikov regioquímica. Éteres de tetra-hidropiranilo são utilizados como Os grupos protectores para os álcoois.
Éteres cíclicos, que também são conhecidos como epóxidos podem ser preparados:
- Pela oxidação de alcenos com um peroxiácido tal como m-CPBA.
- Pela substituição nuclephilic bases intramolecular de uma halo-hidrina.
Reações
Éteres em geral, são de muito baixa química reatividade. Reações orgânicas são:
- A hidrólise.
- Os éteres são hidrolisado somente sob condições drásticas como aquecimento com tribrometo de boro ou de ebulição nas ácido bromídrico. Ácidos minerais inferior contendo um átomo de halogénio, tais como ácido clorídrico vai clivar os éteres, mas muito lentamente. Ácido bromídrico e ácido iodídrico são os dois únicos que fazê-lo a uma taxa apreciável. Determinados éteres de arilo pode ser clivada por cloreto de alumínio .
- Epóxidos, éteres cíclicos ou em anéis de três elementos, é altamente susceptível a ataque nucleófilo reactivo e são desta forma.
- Formação de peróxido.
- Éteres primários e secundários com um grupo CH ao lado do oxigénio de éter formar facilmente altamente explosivo peróxidos orgânicos (por exemplo, peróxido de éter dietílico), na presença de oxigénio, luz, e de metal e impurezas de aldeído. Por esta razão, éteres como éter dietílico e THF são geralmente evitados como solventes em processos industriais
Éteres importantes
 | O óxido de etileno | A menor éter cíclico. |
| | O éter dimetílico | Um aerosol spray de propulsor. |
| | Éter dietílico | Um solvente de ebulição baixo comum (pb 34,6 ° C). |
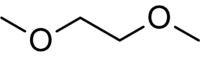 | Dimetoxietano (DME) | Um solvente de ponto de ebulição elevado (ponto de ebulição 85 ° C): |
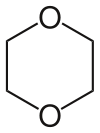 | Dioxano | Um éter cíclico e solvente de elevado ponto de ebulição (ponto de ebulição de 101,1 ° C). |
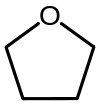 | Tetra-hidrofurano (THF) | Um éter cíclico, um dos mais simples éteres polares que é utilizado como um solvente. |
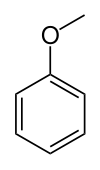 | Anisole (metoxibenzeno) | Um éter de arilo e um dos principais constituintes do óleo essencial de sementes de anis. |
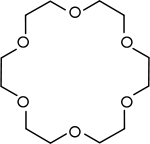 | Os éteres de coroa | Poliéteres cíclicos que são utilizados como catalisadores de transferência de fase. |
| | O polietileno glicol (PEG) | Um poliéter linear, por exemplo, utilizado em cosméticos: |

