
Európio
Informações de fundo
Crianças SOS têm produzido uma seleção de artigos da Wikipédia para escolas desde 2005. Clique aqui para mais informações sobre Crianças SOS.
| Európio | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
63 Eu | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Aparência | ||||||||||||||||||||||||||||||||||
branco prateado, mas raramente visto sem descoloração óxido  | ||||||||||||||||||||||||||||||||||
| Propriedades gerais | ||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | európio, Eu, 63 | |||||||||||||||||||||||||||||||||
| Pronúncia | / j ʊ r oʊ p Eu ə m / EW ROH -pee-əm | |||||||||||||||||||||||||||||||||
| Categoria elemento | lantanídeos | |||||||||||||||||||||||||||||||||
| Grupo, período, bloco | n / D, 6, f | |||||||||||||||||||||||||||||||||
| Peso atômico padrão | 151,964 | |||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Xe ] 6s 4f 7 2 2, 8, 18, 25, 8, 2 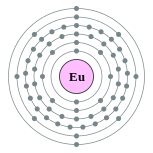 | |||||||||||||||||||||||||||||||||
| História | ||||||||||||||||||||||||||||||||||
| Descoberta | Eugène-Anatole Demarçay (1896) | |||||||||||||||||||||||||||||||||
| Primeiro isolamento | Eugène-Anatole Demarçay (1901) | |||||||||||||||||||||||||||||||||
| Propriedades físicas | ||||||||||||||||||||||||||||||||||
| Fase | sólido | |||||||||||||||||||||||||||||||||
| Densidade (perto RT) | 5,264 g · cm -3 | |||||||||||||||||||||||||||||||||
| Líquido densidade no pf | 5,13 g cm -3 · | |||||||||||||||||||||||||||||||||
| Ponto de fusão | 1099 K , 826 ° C, 1519 ° F | |||||||||||||||||||||||||||||||||
| Ponto de ebulição | 1802 K, 1529 ° C, 2784 ° F | |||||||||||||||||||||||||||||||||
| Calor de fusão | 9.21 kJ mol -1 · | |||||||||||||||||||||||||||||||||
| Calor de vaporização | 176 kJ mol -1 · | |||||||||||||||||||||||||||||||||
| Capacidade calorífica molar | 27,66 J · · mol -1 K -1 | |||||||||||||||||||||||||||||||||
| Pressão de vapor | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Propriedades atômicas | ||||||||||||||||||||||||||||||||||
| Estados de oxidação | 3, 2, 1 (Levemente óxido de base) | |||||||||||||||||||||||||||||||||
| Eletronegatividade | ? 1,2 (escala de Pauling) | |||||||||||||||||||||||||||||||||
| Energias de ionização | 1º: 547,1 kJ · mol -1 | |||||||||||||||||||||||||||||||||
| 2: 1085 kJ · mol -1 | ||||||||||||||||||||||||||||||||||
| 3: 2404 kJ · mol -1 | ||||||||||||||||||||||||||||||||||
| Raio atômico | 180 pm | |||||||||||||||||||||||||||||||||
| O raio de covalência | 198 ± 18:00 | |||||||||||||||||||||||||||||||||
| Miscelânea | ||||||||||||||||||||||||||||||||||
| A estrutura de cristal | cúbica de corpo centrado  | |||||||||||||||||||||||||||||||||
| Ordenamento magnético | paramagnético | |||||||||||||||||||||||||||||||||
| Resistividade elétrica | ( RT) (poli) 0,900 μΩ · m | |||||||||||||||||||||||||||||||||
| Condutividade térmica | est. 13,9 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||
| Expansão térmica | ( RT) (poli) 35,0 mm / (m · K) | |||||||||||||||||||||||||||||||||
| O módulo de Young | 18,2 GPa | |||||||||||||||||||||||||||||||||
| Módulo de cisalhamento | 7,9 GPa | |||||||||||||||||||||||||||||||||
| Massa de módulo | 8,3 GPa | |||||||||||||||||||||||||||||||||
| Rácio de Poisson | 0,152 | |||||||||||||||||||||||||||||||||
| Dureza de Vickers | 167 MPa | |||||||||||||||||||||||||||||||||
| Número de registo CAS | 7440-53-1 | |||||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | ||||||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de európio | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
Európio é um elemento químico com o símbolo da UE e número atômico 63. É nomeado após o continente da Europa . É um moderadamente dura, prateado de metal que se oxida facilmente em ar e água . Ser um membro típico da lanthanide série, európio geralmente assume o estado de oxidação +3, mas o estado de oxidação +2 é também comum: todos os compostos de európio com estado de oxidação +2 são ligeiramente redução. Európio não tem um papel biológico importante e é relativamente não-tóxicos em comparação com outros metais pesados. A maioria dos aplicativos de európio explorar a fosforescência de compostos de európio.
Características
Propriedades físicas


Európio é um metal dúctil com uma dureza semelhante à do chumbo . Cristaliza-se numa corpo centrada em rede cúbica. Algumas propriedades do európio são fortemente influenciados pelo seu meio-cheio escudo do elétron. Európio tem o ponto de fusão segundo mais baixo e menor densidade de todos os lantanídeos.
Európio torna-se um supercondutor quando é arrefecida abaixo de 1,8 K e comprimido para acima de 80 GPa. Isto é porque európio é divalente no estado metálico, e é convertido para o estado trivalente pela pressão aplicada. No estado divalente, o momento magnético local forte (J = 7/2) suprime a supercondutividade, que é induzida pela eliminação deste momento local (J = 0 em Eu3 +).
Propriedades químicas
Európio é o mais reactivo terra-rara. É rapidamente oxida no ar, de modo que a oxidação de grandes quantidades de uma amostra de tamanho centímetro-ocorre no prazo de vários dias. A sua reactividade com água é comparável à de cálcio , e a reacção é
- 2 Eu + 6 H2O → 2 Eu (OH) 3 + 3 H 2
Devido à elevada reactividade, as amostras de európio sólido raramente têm a aparência brilhante do metal fresco, mesmo quando revestidos com uma camada protectora de óleo mineral. Európio inflama em ar a 150 a 180 ° C, para formar európio (III), óxido de:
- 4 Eu + 3 O 2 → 2 Eu 2 O 3
Európio dissolve prontamente em diluída de ácido sulfúrico para formar soluções de rosa pálido da UE hidratado (III), que existe como uma nona-hidratado:
- 2 Eu + 3 H 2 SO 4 + 18 H 2 O 2 → [Eu (H2O) 9] 3+ + 3 SO 2-
4 + 3 H 2
Eu (II) vs Eu (III)
Embora geralmente trivalente, európio forma prontamente compostos divalentes. Esse comportamento é incomum para a maioria dos lantanídeos , que formam quase exclusivamente compostos com um estado de oxidação de +3. O estado tem um 2 configuração electrónica 4 f 7 f -shell porque o meio-cheio dá mais estabilidade. Em termos de tamanho e número de coordenação, európio (II) e bário (II) são semelhantes. Por exemplo, os sulfatos de bário e de ambos európio (II) também são altamente insolúveis em água. Divalente európio é um agente redutor suave, oxidação ao ar para formar compostos Eu (III). Em anaeróbia, em condições, nomeadamente geotérmicas, na forma divalente é suficientemente estável, que tende a ser incorporados em minerais de cálcio e as outras terras alcalinas. Este processo de permuta iónica é a base do "anomalia európio negativo", o baixo teor de európio em muitos minerais de lantanídeos, tais como a monazite, em relação ao abundância condritos. Bastnäsite tende a mostrar menos de uma anomalia európio negativo que faz a monazite, e, portanto, é a principal fonte de európio hoje. O desenvolvimento de métodos fáceis de separar európio dos outros lantanídeos trivalentes de európio feito acessível, mesmo quando presentes em baixa concentração, como é normalmente.
Isótopos
Naturalmente que ocorre európio é composto por 2 isótopos , 151 e 153 Eu Eu, com 153 Eu sendo o mais abundante (52,2% abundância natural). Enquanto 153 Eu é estável, 151 Eu foi encontrado recentemente para ser instável para decaimento alfa com meia-vida de 5 11
-3 × 10 18 anos, dando cerca de 1 decaimento alfa por dois minutos em cada quilograma de európio natural. Este valor está de acordo razoável com as previsões teóricas. Além do radioisótopo 151 naturais Eu, 35 radioisótopos artificiais têm sido caracterizados, os mais estáveis o 150 da UE, com uma meia-vida de 36,9 anos, 152 Eu com uma meia-vida de 13,516 anos, e 154 da UE, com uma meia-vida de 8.593 anos. Todos os restantes isótopos radioativos apresentam meias-vidas mais curtas do que 4,7612 anos, ea maioria destes com meias-vidas mais curto do que 12,2 segundo. Este elemento apresenta também oito meta estados, sendo o mais estável 150m estar Eu (T ½ = 12,8 horas), 152m1 Eu (T ½ = 9,3116 horas) e 152m2 da UE (t ½ = 96 minutos).
O primário modo de decaimento de isótopos mais leves do que 153 UE é a captura eletrônica, eo primeiro modo de isótopos mais pesados é decaimento beta menos. O primário produtos de decaimento antes do 153 da UE são isótopos de samário (SM) e os primeiros produtos após são os isótopos de gadolínio (Gd).
Európio como um produto de fissão nuclear
| Isótopo | Eu 151 | Eu 152 | Eu 153 | Eu 154 | Eu 155 |
|---|---|---|---|---|---|
| Rendimento | ~ 10 | baixo | 1580 | > 2,5 | 330 |
| Barns | 5900 | 12800 | 312 | 1340 | 3950 |
| Prop: Unidade: | t½ um | Rendimento % | Q * keV | βγ * |
|---|---|---|---|---|
| Eu 155 | 4.76 | 0,0803 | 252 | βγ |
| 85 Kr | 10,76 | 0,2180 | 687 | βγ |
| 113m Cd | 14,1 | 0,0008 | 316 | β |
| 90 Sr | 28,9 | 4.505 | 2826 | β |
| 137 Cs | 30.23 | 6,337 | 1176 | β γ |
| 121m Sn | 43,9 | 0,00005 | 390 | βγ |
| 151 Sm | 90 | 0,5314 | 77 | β |
| Hover sublinhou: mais informações | ||||
Európio é produzido por fissão nuclear, mas o rendimentos de produtos de cisão de isótopos de európio são baixos perto do topo do intervalo de massas para produtos de fissão.
Como outros lantanídeos , muitos isótopos, especialmente isótopos com números ímpares de massa e isótopos nêutron-pobres como 152 Eu, têm alta seções transversais para captura de nêutrons, muitas vezes altos o suficiente para ser venenos.
151 UE é o produto de decaimento beta de samário-151, mas uma vez que este tem uma longa decadência meia-vida curta e tempo médio de absorção de nêutrons, mais 151 Sm vez acaba como 152 Sm.
152 Eu (meia-vida de 13,516 anos) e 154 Eu (meia-vida de 8,593 anos) não podem ser produtos de decaimento beta porque 152 Sm e Sm 154 são para não-radioativo, mas 154 UE é o único longa vida "blindado" nuclídeo, excepto 134 Cs, de ter um rendimento de fissão mais de 2,5 partes por milhão de fissões. A maior quantidade de 154 Eu é produzido por ativação de nêutrons de uma parcela significativa da não-radioativo 153 UE; No entanto, grande parte desta é ainda convertido para 155 Eu.
155 Eu (meia-vida 4,7612 anos) tem um rendimento de fissão de 330 partes por milhão (ppm) para urânio-235 e neutrões térmicos; a maior parte dele é transmutada para não-radioativo e disabsortivas gadolínio-156 até o final de combustível queimar.
No geral, európio é ofuscada por césio-137 e estrôncio-90 como um perigo de radiação, e por samário e outros como um veneno de nêutron.
Ocorrência

Európio não é encontrado na natureza como de um elemento livre. Muitos minerais contêm európio, com as fontes mais importantes de ser bastnäsite, monazita, xenotime e loparite.
O esgotamento ou enriquecimento de európio em minerais em relação a outros elementos de terras raras é conhecido como o anomalia európio. Európio é comumente incluída em estudos de microelementos em geoquímica e petrologia de compreender os processos que formam rochas ígneas (rochas que refrigerados a partir de magma ou a lava ). A natureza do európio anomalia encontrada ajuda a reconstruir as relações dentro de um conjunto de rochas ígneas.
Bivalente európio (Eu 2+) em pequenas quantidades é o ativador do azul brilhante fluorescência de algumas amostras do mineral fluorita (CaF 2). A redução de Eu 3+ a Eu 2+ é induzida por irradiação com partículas energéticas. Os exemplos mais proeminentes deste originado em torno de Weardale e partes adjacentes do norte da Inglaterra; foi a fluorite encontrada aqui que fluorescência foi nomeado depois, embora não tenha sido até muito mais tarde que európio foi determinada como sendo a causa.
Produção
Európio está associado com a outra Elementos das terras raras e, portanto, é extraído em conjunto com eles. A separação dos elementos de terras raras é um passo no processamento posterior. Elementos das terras raras são encontrados nos minerais bastnäsite, loparite, xenotime, e monazita em quantidades lavráveis. Os dois primeiros são minerais de ortofosfato LnPO 4 (Ln indica uma mistura de todos os lantanídeos excepto promécio ), e o terceiro é um fluorocarbonate LNCO 3 F. Monazita também contém tório e ítrio , o que dificulta a manipulação porque tório e seus produtos de decaimento são radioativos. Para a extracção do minério e o isolamento dos lantanídeos individuais, têm sido desenvolvidos vários métodos. A escolha do método baseia-se na concentração e composição do minério e na distribuição dos lantanídeos individuais no concentrado resultante. Torrefacção o minério e posterior lixiviação ácida e básica é utilizada principalmente para produzir um concentrado de lantanídeos. Se cério é o lantanídeo dominante, em seguida, é convertido de cério (III) para o cério (IV) e, em seguida, precipitada. Além disso a separação por extracções de solvente ou cromatografia de permuta de iões produz uma fracção que é enriquecida em európio. Esta fracção é reduzido com zinco, zinco / amálgama, electrólise ou outros métodos de conversão do európio (III) de európio (II). Európio (II) reage de uma maneira semelhante à do metais alcalino-terrosos e, por conseguinte, ele pode ser precipitado como carbonato ou é co-precipitado com sulfato de bário. Európio de metal está disponível através da electrólise de uma mistura de EuCl fundido 3 e NaCl (ou CaCl 2) numa célula de grafite, que serve como cátodo, utilizando grafite como ânodo. O outro produto é cloro gás.
Algumas grandes depósitos de produzir ou produziram uma quantidade significativa da produção mundial. O Bayan Obo depósito de minério de ferro contém quantidades significativas de bastnäsite e monazita e é, com uma estimativa de 36 milhões de toneladas de óxidos de terra-rara, o maior depósito conhecido. As operações de mineração no depósito Bayan Obo feito China o maior fornecedor de elementos de terras raras na década de 1990. Apenas 0,2% do teor de terra-rara é európio. A segunda fonte grande para elementos de terras raras entre 1965 e seu encerramento no final de 1990 foi o Mountain Pass mina de terras raras. O bastnäsite minado lá é especialmente rico na luz elementos de terras raras (La-Gd, SC, e Y) e contém apenas 0,1% de európio. Outra grande fonte de elementos de terras raras é a loparite encontrados na península de Kola. Ele contém além de nióbio, tântalo e titânio até 30% de elementos de terras raras e é a maior fonte destes elementos na Rússia.
Compostos

Halides
Európio de metal reage com todos os halogéneos:
- Eu + 2 X 3 2 2 → eux 3 (X = F, Cl, Br, I)
Esta via dá európio branco (III) flúor (FUE 3), amarelo európio (III), cloreto de (EuCl 3), európio cinzento (III) brometo de (EuBr 3), e incolor európio (III), iodeto de (EUI 3). Európio também forma os di-halogenetos correspondentes: európio amarelo-verde (II) fluoreto (euf 2), európio incolor (II) cloreto de (2 EuCl), európio incolor (II) de brometo de (EuBr 2), európio e verde (II) de iodeto de ( Eui 2).
Chalcogenides e pnictides
Európio forma compostos estáveis com todos os Calcogênios, mas os mais pesados Calcogênios estabilizar o estado de oxidação inferior. Três óxidos são conhecidos: óxido de európio (II) (Euo), európio (III), óxido de (Eu 2 O 3), e o óxido misto (Eu 3 O 4). Caso contrário, os principais são calcogenetos európio (II) de sulfureto de (USE), európio (II) seleneto (euse) e európio (II) telureto (EuTe): todos os três destes são sólidos pretos. EuS é preparado por sulfídicos o óxido a temperaturas suficientemente elevadas para decompor o Eu 2 O 3:
- Eu 2 O 3 + 3H 2 S → EuS 2 + 3 H 2 O + S
A principal nitreto é európio nitreto (III) (EUN).
História
Embora európio está presente na maioria dos minerais que contêm outros elementos raros, devido às dificuldades em separar os elementos que não foi até o final de 1800 que o elemento foi isolado. William Crookes observados os espectros fosforescente dos elementos raros e linhas espectrais observadas depois atribuídas a európio.
Európio foi encontrada pela primeira vez por Paul Émile Lecoq de Boisbaudran em 1890, que obteve frações básicas a partir de concentrados samário-gadolínio que tinham linhas espectrais não contabilizados por samário ou gadolínio . No entanto, a descoberta do európio é geralmente creditado em Francês químico Eugène-Anatole Demarçay, que suspeitava que amostras do samário elemento recentemente descoberto estavam contaminadas com um elemento desconhecido em 1896 e que foi capaz de isolá-lo em 1901; ele então nomeou-európio.
Quando o európio-dopado ítrio ortovanadato de fósforo vermelho foi descoberto na década de 1960, e entende-se prestes a causar uma revolução na indústria de televisão a cor, houve uma corrida para o fornecimento limitado de európio na mão entre os processadores de monazita, como o conteúdo típico európio em monazita é de cerca de 0,05%. No entanto, a Molycorp bastnäsite depósito no Mountain Pass mina de terras raras, Califórnia , cujo lantanídeos tinha um teor anormalmente elevado európio de 0,1%, estava prestes a vir on-line e fornecer európio suficiente para sustentar a indústria. Antes de európio, o fósforo vermelho cor-de TV era muito fraco, e as outras cores de fósforo teve que ser cortado, para manter o equilíbrio de cores. Com o brilhante fósforo európio vermelho, já não era necessário para silenciar as outras cores, e uma imagem muito mais brilhante TV a cores foi o resultado. Európio tem continuado a ser utilizado na indústria de televisão, desde então, e, é claro, também em monitores de computador. Bastnäsite californiano enfrenta agora a concorrência de Bayan Obo, na China, com uma ainda mais "rica" conteúdo európio de 0,2%.
Frank Spedding, célebre por seu desenvolvimento da tecnologia de troca iônica que revolucionou a indústria de terras raras, em meados da década de 1950, uma vez relacionados com a história de como ele estava dando uma palestra sobre as terras raras em 1930, quando um senhor idoso se aproximou dele com uma oferta de um presente de várias libras de óxido de európio. Esta foi uma quantidade inédita na época, e Spedding não tomar o homem a sério. No entanto, um pacote devidamente chegou pelo correio, contendo várias libras de óxido de európio genuíno. O senhor idoso tinha acabou por ser Herbert Newby McCoy que tinha desenvolvido um método famoso de purificação európio envolvendo a química redox.
Aplicações

Em relação à maioria dos outros elementos, para aplicações comerciais európio são poucos e bastante especializado. Quase invariavelmente, eles exploram sua fosforescência, quer no seu estado duas ou três oxidação.
É um dopante em alguns tipos de vidro em lasers e outros dispositivos optoelectrónicos. Óxido de európio (Eu 2 O 3) é amplamente usado como um vermelho -fósforo em aparelhos de televisão e lâmpadas fluorescentes, e como um ativador para ítrio fósforos baseados. As telas de TV Cor conter entre 0,5 e 1 g de európio. Considerando európio trivalente dá fósforos vermelhos, a luminescência do európio bivalente depende da rede hospedeira, mas tende a estar no lado azul. As duas classes de fósforo à base de európio (vermelho e azul), combinados com o amarelo / verde térbio fósforos dar "branco" de luz, a temperatura de cor que pode ser variada, alterando a proporção ou a composição específica dos fósforos individuais. Este sistema de fósforo normalmente é encontrado em helicoidais lâmpadas fluorescentes. Combinando as mesmas três classes é uma forma de tornar os sistemas de tricromáticas em telas de TV e computador. Európio é também utilizado no fabrico de vidro fluorescente. Uma das persistentes fósforos mais comuns pós-brilho além de cobre dopado sulfeto de zinco é európio dopado de aluminato de estrôncio. Európio fluorescência é usado para interrogar interacções biomoleculares em telas droga-descoberta. Ele também é usado nos fósforos anti-falsificação em Euro notas.
Uma aplicação que tem quase caído para fora de uso, com a introdução de imans supercondutores acessíveis é o uso de complexos de európio, tal como Eu (fod) 3, como reagentes de deslocamento em Espectroscopia de RMN. Reagentes de deslocamento quiral, tais como Eu (hfc) 3 ainda são utilizados para determinar pureza enantiomérica.
Precauções
Não há indicações claras de que európio é particularmente tóxico em comparação com outros metais pesados. Nitrato de cloreto de európio e óxido foram testados quanto à toxicidade: cloreto de európio apresenta uma DL 50 toxicidade aguda intraperitoneal de 550 mg / kg por via oral e o LD 50 de toxicidade aguda é de 5000 mg / kg. Nitrato de európio mostra um pouco maior intraperitoneal toxicidade LD 50 de 320 mg / kg, enquanto que a toxicidade oral é superior a 5000 mg / kg. O pó metálico apresenta um risco de incêndio e explosão.

