
Germânio
Sobre este escolas selecção Wikipedia
Crianças SOS voluntários ajudaram a escolher artigos e fez outro material currículo Clique aqui para saber mais sobre apadrinhamento de crianças.
| Germânio | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
32 Ge | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Aparência | |||||||||||||||||||||||||||||||||||||||||||||||||
branco-acinzentado  A 12 gramas (2x3 cm) bloco policristalino de Ge com superfícies irregulares clivadas | |||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades gerais | |||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | germânio, Ge, 32 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Pronúncia | / dʒ ər m eɪ n Eu ə m / jər- PODE -nee-əm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria elemento | metalóide | ||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | 14, 4, p | ||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atômico padrão | 72,63 (1) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Ar ] 3d 10 4s 2 4p 2 2, 8, 18, 4 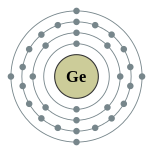 | ||||||||||||||||||||||||||||||||||||||||||||||||
| História | |||||||||||||||||||||||||||||||||||||||||||||||||
| Predição | Dmitri Mendeleev (1871) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Descoberta | Clemens Winkler (1886) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densidade (perto RT) | 5,323 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Líquido densidade no pf | 5,60 g cm -3 · | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de fusão | 1211,40 K , 938,25 ° C, 1720,85 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de ebulição | 3106 K, 2833 ° C, 5131 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusão | 36.94 kJ mol -1 · | ||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de vaporização | 334 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidade calorífica molar | 23,222 J · · mol -1 K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Pressão de vapor | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades atômicas | |||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidação | 4, 3, 2, 1, 0, -1, -2, -3, -4 ( óxido anfotérico) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Eletronegatividade | 2,01 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Energias de ionização | 1º: 762 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2: 1537,5 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| 3: 3302,1 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Raio atômico | 122 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| O raio de covalência | 122 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals raio | 211 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelânea | |||||||||||||||||||||||||||||||||||||||||||||||||
| A estrutura de cristal | diamante cúbico | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamento magnético | Diamagnética | ||||||||||||||||||||||||||||||||||||||||||||||||
| Resistividade elétrica | (20 ° C) 1 Ω · m | ||||||||||||||||||||||||||||||||||||||||||||||||
| Condutividade térmica | 60,2 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Expansão térmica | 6,0 um / (m · K) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidade do som (haste fina) | (20 ° C) 5400 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| O módulo de Young | 103 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de cisalhamento | 41 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Massa de módulo | 75 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Rácio de Poisson | 0.26 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza de Mohs | 6 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registo CAS | 7440-56-4 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Banda energia lacuna a 300 K | 0.67 eV | ||||||||||||||||||||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | |||||||||||||||||||||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de germânio | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
O germânio é um elemento químico com o símbolo Ge e número atômico 32. É um brilhante, duro, branco-acinzentado metalóide no grupo de carbono, quimicamente semelhante a seus vizinhos grupo estanho e silício . Germânio purificada é um semicondutor , com uma aparência mais semelhante ao silício elementar. Como o silício, germânio naturalmente reage e forma complexos com o oxigênio na natureza. Ao contrário de silício, que é muito reativa para ser encontrado naturalmente na Terra no estado livre (nativo).
Porque contêm muito poucas minerais que em alta concentração, germânio foi descoberto relativamente tarde na história da química. Germânio fileiras perto quinquagésimo em abundância relativa dos elementos na crosta da Terra. Em 1869, Dmitri Mendeleev previu sua existência e algumas de suas propriedades com base em sua posição sobre a sua tabela periódica e chamou o elemento ekasilicon. Quase duas décadas depois, em 1886, Clemens Winkler encontrou o novo elemento, juntamente com a prata e enxofre, em um mineral raro chamado argyrodite. Embora o novo elemento pouco se assemelhava arsênio e antimônio na aparência, os seus rácios combinando em compostos do novo elemento acordado com as previsões de Mendeleiev para um parente previsto de silício. Winkler nomeado o elemento após o seu país, Alemanha. Hoje, germânio é extraído em primeiro lugar a partir de sphalerite (o minério primário de zinco), embora germânio também é recuperado comercialmente de prata , chumbo e cobre minérios.
Germânio "metal" (isolado germânio) é utilizado como semicondutor em transistores e outros dispositivos eletrônicos. Historicamente a primeira década da semicondutores eletrônicos foram inteiramente baseado em germânio, embora a sua produção para tal uso hoje é uma pequena fracção (2%) do que de ultra-alta pureza de silício, que tem substituído-lo. Grande final do germânio usa no presente são de fibra óptica e sistemas ópticas infravermelhos. É utilizado em aplicações em células solares. Compostos de germânio são utilizados para catalisadores de polimerização. Germânio é encontrar um novo uso em nanofios. Germânio forma um grande número de compostos organometálicos, como o tetraethylgermane, que são úteis em química.
Germânio não é pensado para ser um elemento essencial para qualquer organismo vivo. Alguns compostos orgânicos germânio complexados estão sendo investigados como possíveis produtos farmacêuticos, mas nenhum teve sucesso. Semelhante ao silício e alumínio, germânio compostos naturais, que tendem a ser insolúveis em água, têm pouca toxicidade oral. No entanto, sais solúveis sintéticas são germânio compostos de germânio quimicamente reativos nefrotóxicas e sintéticos com halogênios e hidrogénio são irritantes e toxinas.
História
Em seu relatório sobre a Lei Periódica dos elementos químicos, em 1869, o químico russo Dmitri Ivanovich Mendeleev previu a existência de vários desconhecidos elementos químicos , incluindo uma que iria preencher uma lacuna no família de carbono na sua Tabela Periódica dos Elementos, localizado entre o silício e estanho . Devido à sua posição em sua tabela periódica, Mendeleev chamou ekasilicon (Es), e ele estimou seu peso atômico como cerca de 72,0.
Em meados de 1885, em uma mina perto Freiberg, Saxônia, um novo mineral foi descoberto e nomeado argyrodite, devido ao seu elevado prata conteúdo. O químico Clemens Winkler analisados neste novo mineral, o que provou ser uma combinação de prata, enxofre, e um novo elemento. Winkler foi capaz de isolar este elemento novo e achei que era um pouco semelhante ao antimônio , em 1886. Antes de Winkler publicou seus resultados sobre o novo elemento, ele decidiu que iria nomear seu neptunium elemento, uma vez que a recente descoberta de planeta Netuno , em 1846, tinha sido precedido por previsões matemáticas de sua existência. No entanto, o nome "neptunium" já tinha sido dada a outro elemento químico proposto (embora não o elemento que hoje leva o nome neptunium , que foi descoberto em 1940), então em vez disso, Winkler nomeado o novo elemento germânio (do latim palavra, Germania, para a Alemanha ) em homenagem a sua terra natal. Argyrodite provou ser empiricamente Ag 8 GeS 6.
Porque este novo elemento apresentou algumas semelhanças com a elementos arsênico e antimônio, o seu devido lugar na tabela periódica estava sob consideração, mas suas semelhanças com o previsto elemento "ekasilicon" de Dmitri Mendeleev confirmou que pertencia a este lugar na tabela periódica. Com mais material a partir de 500 kg de minério das minas em Saxony, Winkler confirmaram as propriedades químicas do elemento novo em 1887. Ele também determinou um peso atômico de 72,32 analisando puro tetracloreto de germânio (GECL 4), enquanto Lecoq de Boisbaudran deduziu 72,3 por comparação das linhas na faísca espectro do elemento.
Winkler foi capaz de preparar vários novos compostos de germânio, incluindo os fluoretos, cloretos, sulfuretos, dióxido de germânio, e tetraethylgermane (Ge (C 2 H 5) 4), o primeiro organogermane. Os dados físicos a partir destes compostos - o que correspondeu bem com previsões de Mendeleiev - fez a descoberta uma importante confirmação da idéia de Mendeleev elemento de periodicidade . Aqui está uma comparação entre a previsão e os dados de Winkler:
| Propriedade | Ekasilicon | Germânio |
|---|---|---|
| massa atômica | 72,64 | 72,59 |
| Densidade (g / cm 3) | 5.5 | 5.35 |
| ponto de fusão (° C) | alto | 947 |
| cor | cinza | cinza |
| Tipo de óxido | dióxido de refratário | dióxido de refratário |
| densidade de óxido de (g / cm 3) | 4.7 | 4.7 |
| atividade do óxido | debilmente básico | debilmente básico |
| ponto de ebulição de cloreto de (° C) | abaixo de 100 | 86 (GECL 4) |
| cloreto de densidade (g / cm 3) | 1.9 | 1.9 |
Até o final da década de 1930, germânio foi pensado para ser um metal de fraca condução. Germânio não se tornou economicamente significativa até depois de 1945, quando suas propriedades como um semicondutor foram reconhecidos como sendo muito útil em eletrônica . No entanto, durante a Segunda Guerra Mundial , pequenas quantidades de germânio começou a ser utilizado em algumas especiais dispositivos electrónicos , principalmente diodos. Seu primeiro uso importante foi o ponto de contato Diodos Schottky para radar de detecção de pulso durante a guerra. O primeiro ligas de silício-germânio foram obtidos em 1955. Antes de 1945, apenas algumas centenas de quilos de germânio foram produzidos em fundições de cada ano, mas até o final da década de 1950, a produção anual mundial havia alcançado 40 toneladas métricas.
O desenvolvimento de germânio transistor em 1948 abriu as portas para inúmeras aplicações de eletrônica de estado sólido. De 1950 até o início dos anos 1970, esta área desde um mercado crescente de germânio, mas, em seguida, silício de alta pureza começaram a substituir germânio em transistores, diodos, e retificadores. Por exemplo, a empresa que se tornou Fairchild Semiconductor foi fundada em 1957 com o propósito expresso de produzir transistores de silício. Silício tem propriedades eléctricas superiores, mas isto requer muito mais elevado grau de pureza, e essa pureza não pode ser comercialmente obtido nos primeiros anos de eletrônicos semicondutores.
Enquanto isso, a demanda por germânio para uso em fibra óptica redes de comunicação, infravermelho sistemas de visão noturna, e polimerização catalisadores aumentou dramaticamente. Estas utilizações finais representaram 85% do consumo mundial de germânio em 2000. O governo dos EUA germânio ainda designado como um material estratégico e crítico, chamando para uma 146 tonelada (132 t) oferta no arsenal de defesa nacional em 1987.
Germânio difere de silício em que o fornecimento de germânio é limitado pela disponibilidade de fontes exploráveis, embora o suprimento de silício é limitado apenas pela capacidade de produção uma vez que o silício vem de areia comum ou de quartzo . Como resultado, enquanto silício poderia ser comprado em 1998 por menos de US $ 10 por kg, o preço de 1 kg de germânio foi, então, quase 800 dólares.
Características
Sob condições normais de germânio é um prateado-branco, elemento frágil, semi-metálico. Esta forma constitui um alótropo tecnicamente conhecido como α-germânio, que tem um brilho metálico e uma diamante estrutura cristalina cúbica, o mesmo que diamante . A pressões superiores a 120 kbar, um alótropo diferente conhecida como formas β-germânio, que tem a mesma estrutura que β- estanho . Juntamente com o silício, gálio , bismuto , antimónio , e água , é uma das poucas substâncias que se expande quando solidifica (ou seja congela) a partir do seu estado fundido.
Germânio é um semicondutor . Técnicas de refinação Zona levaram à produção de semicondutores por germânio cristalino que possui uma impureza de apenas uma parte em 10 10, e é um dos materiais mais puros nunca obtidos. O primeiro material metálico descoberto (em 2005) a tornar-se um supercondutor , na presença de um extremamente forte foi um campo electromagnético liga de germânio com urânio e ródio.
Germânio puro é conhecido para fazer a extrusão de forma espontânea muito longo luxações parafuso. Eles são uma das principais razões para o fracasso de diodos e transistores mais antigos feitos de germânio; dependendo do que eles, eventualmente, tocar, eles podem levar a um curto-circuito.
Química
Germânio elementar oxida lentamente a GeO2 a 250 ° C. Germânio é insolúvel em ácidos diluídos e álcalis, mas se dissolve lentamente em concentrado ácido sulfúrico e reage violentamente com bases de fundição para produzir germanatos (GEO [3] 2-). Germânio ocorre principalmente no estado de oxidação quatro, embora muitos compostos são conhecidos com o estado de oxidação de +2. Outros estados de oxidação são raros, tais como 3 encontrados em compostos, tais como Ge 2 Cl 6, e 3 e um observadas na superfície de óxidos, ou estados de oxidação negativos em Germanes, como -4 em GeH 4. Ânions de cluster (germânio Iões Zintl), tais como Ge 4 2-, 4- Ge 9, Ge 9 2- [(Ge 9) 2] 6- foram preparadas por extracção a partir de ligas contendo metais alcalinos e de germânio em amoníaco líquido na presença de etilenodiamina ou um cryptand. Os estados de oxidação do elemento de estes iões não são inteiros semelhantes ao ozonídeos O 3 -.
Dois óxidos de germânio são conhecidos: dióxido de germânio (GeO2, Alemanha) e monóxido de germânio, (GEO). O dióxido de, GeO 2 pode ser obtido por torrefacção germânio dissulfureto (BEE 2), e é um pó branco que é apenas ligeiramente solúvel em água, mas reage com álcalis para formar germanatos. O monóxido de carbono, óxido de germanous, pode ser obtido pela reacção de alta temperatura de GeO2 com Ge metal. O dióxido de (e os óxidos e germanatos relacionados) exibe a invulgar propriedade de ter um elevado índice de refracção para a luz visível, mas a transparência luz infravermelha. Germanato de bismuto, Bi 4 Ge 3 S 12, (BGO) é utilizado como um cintilador.
Compostos binários com outra Calcogênios são também conhecidos, tais como o di sulfureto (BEE 2), di seleneto (GESE 2), e o monossulfureto (SGE), seleneto (GESE), e telureto (Gete). GeS 2, a forma de um precipitado branco quando se sulfureto de hidrogénio é passada através de soluções fortemente ácidas contendo Ge (IV). O dissulfureto é apreciavelmente solúvel em água e em soluções de álcalis cáusticos alcalinos ou sulfuretos. No entanto, ela não é solúvel em água ácida, o que permitiu Winkler para descobrir o elemento. Ao aquecer o dissulfureto numa corrente de hidrogénio , o monossulfureto (BEE) é formada, que sublima em placas finas de uma cor e brilho metálico escuro, e é solúvel em soluções de álcalis cáusticos. Após a fusão com carbonatos alcalinos e de enxofre , compostos de germânio formar sais conhecidos como thiogermanates.
Quatro tetra halogenetos são conhecidos. Sob condições normais de gei 4 é um sólido, o GEF 4 um gás e os outros líquidos voláteis. Por exemplo, tetracloreto de germânio, GECL 4, é obtido na forma de um líquido incolor fumegante de ebulição de 83,1 ° C por aquecimento do metal com cloro. Todos os tetra-halogenetos são prontamente hidrolisado para o dióxido de germânio hidratado. GECL 4 é utilizado na produção de compostos organogermanium. Todos os quatro são conhecidas di-halogenetos e em contraste com os tetra-halogenetos são sólidos poliméricos. Além disso Ge 2 Cl 6 e alguns compostos mais elevados de fórmula Ge n Cl 2 N 2 são conhecidos. O composto incomum Ge 6 Cl 16 foi preparado que contém a unidade Ge 5 Cl 12 com um estrutura neopentano.
Pertinente (GeH 4) é um composto semelhante em estrutura ao metano . Polygermanes-compostos que são semelhantes aos alcanos -com fórmula Ge N H 2 N 2 contendo até cinco átomos de germânio são conhecidos. Os Germanes são menos voláteis e menos reativo que os seus análogos de silício correspondentes. GEH 4 reage com metais alcalinos em amoníaco líquido para formar cristalino branco MGeH 3 que contêm a GeH 3 - anião . Os hidro-haletos de germânio com um, dois e três átomos de halogénio reactivos são líquidos incolores.
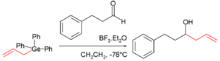
O primeiro organogermanium composto foi sintetizado por Winkler em 1887; a reacção do tetracloreto de germânio com dietilzinco rendeu tetraethylgermane (Ge (C 2 H 5) 4). Organogermanes do tipo Ge R4 (em que R é um grupo alquilo ), tal como tetramethylgermane (Ge (CH3 4)) e tetraethylgermane são acessadas através do mais barato disponível precursor germânio tetracloreto de germânio e nucleófilos de alquilo. Hidretos de germânio orgânicos, tais como isobutylgermane ((CH 3) 2 CHCH 2 GeH 3) verificou-se ser menos perigoso e pode ser utilizado como um substituto para o líquido tóxico gás pertinente em semicondutores aplicações. Muitos germânio intermediários reativos são conhecidos: germilo radicais livres, germylenes (semelhante ao carbenos), e germynes (semelhante ao carbynes). O composto organogermanium 2-carboxyethylgermasesquioxane foi relatada pela primeira vez na década de 1970, e por um tempo foi utilizado como um suplemento dietético e possivelmente pensado para ter qualidades anti-tumorais.
Isótopos
Germânio tem cinco que ocorrem naturalmente isótopos , 70 Ge, 72 Ge, 73 Ge, 74 Ge, 76 Ge. Destes, 76 Ge é muito ligeiramente radioativo, deteriorando por decaimento beta duplo com uma meia-vida de 1,78 × 10 21 anos. 74 Ge é o isótopo mais comum, tendo uma abundância natural de aproximadamente 36%. 76 Ge é o menos comum com uma abundância natural de aproximadamente 7%. Quando bombardeados com partículas alfa, o isótopo 72 Ge irá gerar estável 77 Se, liberando elétrons de alta energia no processo. Devido a isto, é usado em combinação com o rádon para baterias nucleares.
Pelo menos 27 radioisótopos também foram sintetizados em massa atómica variando entre 58 e 89. A maior parte destes é estável 68 Ge, por decomposição por captura de electrões, com uma meia-vida de 270,95 d. A menos estável é de 60 Ge com uma meia-vida de 30 ms. Enquanto a maioria dos radioisótopos decadência do germânio por decaimento beta, 61 e 64 Ge Ge decadência por β + adiada emissão de prótons. 84 Ge através de 87 isótopos Ge também apresentam menor β - adiada nêutrons caminhos deterioração das emissões.
Ocorrência
Germânio é criado através de nucleossíntese estelar, principalmente pelo s-no processo Estrelas ramo gigante assimptótico. O s-processo é um processo lento nêutrons captura de elementos mais leves dentro pulsantes vermelhas gigantes estrelas. Germânio foi detectado na atmosfera de Júpiter e em algumas das estrelas mais distantes. Sua abundância na crosta da Terra é de aproximadamente 1,6 ppm. Há apenas alguns minerais como argyrodite, briartite, germanite, e renierite que contêm quantidades apreciáveis de germânio, mas não há depósitos mineráveis existem para qualquer um deles. Alguns corpos de minério de cobre-zinco-chumbo conter germânio o suficiente para que ele pode ser extraído a partir do concentrado de minério de final. Um processo de enriquecimento invulgar causa um elevado teor de germânio em algumas camadas de carvão, o que foi descoberto por Victor Moritz Goldschmidt durante um amplo levantamento de depósitos de germânio. A maior concentração foi já encontrado no Cinzas de carvão Hartley com até 1,6% de germânio. Os depósitos de carvão perto Xilinhaote, Inner Mongolia, contêm uma estimativa de 1600 toneladas de germânio.
Produção

Sobre 118 toneladas de germânio foi produzido em 2011 em todo o mundo, principalmente na China (80 t), a Rússia (5 t) e Estados Unidos (3 t). Germânio é recuperado como um produto secundário a partir de sphalerite zinco minérios onde é concentrada em quantidades de até 0,3%, especialmente de, maciço sedimentos hospedado Zn - Pb - Cu (- Ba ) e depósito de Zn-Pb hospedado-carbonato. Figuras para reservas Ge em todo o mundo não estão disponíveis, mas os EUA é estimado em 450 toneladas. Em 2007 35% da demanda foi atendida por germânio reciclado.
Enquanto que é produzida principalmente a partir de sphalerite, ele também é encontrado em prata , chumbo e cobre minérios. Outra fonte de germânio é cinzas volantes de centrais a carvão que utilizam carvão de certos depósitos de carvão com uma grande concentração de germânio. Rússia e China usaram isto como uma fonte para o germânio. Depósitos da Rússia estão localizados no leste distante do país em Sakhalin Island. As minas de carvão do nordeste de Vladivostok também têm sido utilizados como uma fonte de germânio. Os depósitos na China estão localizadas principalmente no minas de lenhite próximos Lincang, Yunnan; minas de carvão perto Xilinhaote, Inner Mongolia também são utilizados.
| Ano | Custo ( $ / kg) |
|---|---|
| 1999 | 1400 |
| 2000 | 1250 |
| 2001 | 890 |
| 2002 | 620 |
| 2003 | 380 |
| 2004 | 600 |
| 2005 | 660 |
| 2006 | 880 |
| 2007 | 1240 |
| 2008 | 1490 |
| 2009 | 950 |
Os concentrados de minério são principalmente sulfidic; eles são convertidos para o óxidos por aquecimento sob ar, num processo conhecido como torrefacção:
- GeS 2 + 3 O 2 → Geo 2 + 2 SO 2
Parte do germânio acaba no pó produzido durante este processo, enquanto que o restante é convertido a germanatos que são lixiviados em conjunto com o zinco a partir da cinza por ácido sulfúrico. Após neutralização apenas o zinco permanece em solução e o precipitado contém o germânio e outros metais. Depois de reduzir a quantidade de zinco no precipitado pelo processo Waelz , o óxido de Waelz residente é lixiviado uma segunda vez. O dióxido é obtido como um precipitado e convertido com cloro gasoso ou ácido clorídrico para tetracloreto de germânio, que tem um ponto de ebulição baixo e pode ser removido por destilação:
- GeO2 + 4 HCl → GECL 4 + 2 H2O
- GeO2 + 2 Cl 2 → GECL 4 + O2
Tetracloreto de germânio ou é hidrolisado para o óxido de (GeO2) ou purificado por destilação fraccionada e em seguida hidrolisado. O elevado grau de pureza GeO2 é agora apropriado para a produção de vidro de germânio. O óxido de germânio puro é reduzida através da reacção com hidrogénio para obter germânio adequado para a óptica de infravermelhos ou a indústria de semicondutores:
- GeO 2 + 2 H 2 → Ge + 2 H2O
O germânio para a produção de aço e de outros processos industriais normalmente é reduzida usando carbono:
- GeO2 + C → Ge + CO 2
Aplicações
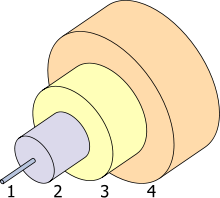
1. Núcleo 8 uM
2. Revestimento 125 uM
3. Tampão de 250 um
4. Jacket 400 mm
A principal utilização final para o germânio, em 2007, em todo o mundo, foram estimadas como sendo: 35% de fibra-óptica sistemas, 30% ópticos de infravermelhos, de 15% para catalisadores de polimerização, e 15% para a eletrônica e aplicações de energia solar. Os 5% restantes foram para outros usos, tais como fósforos, metalurgia, e quimioterapia.
Ótica
As características físicas mais notáveis germânia (GeO2) são a sua alta índice de refração e sua baixa dispersão óptica. Estes tornam especialmente útil para lentes da câmera grande angular, microscopia, e para a parte do núcleo de fibras ópticas . Ele também substituiu titânia como a sílica dopante para a fibra de sílica, eliminando a necessidade de um tratamento térmico subsequente, o que fez as fibras frágeis. No final de 2002, a indústria das fibras ópticas foi responsável por 60% da utilização germânio anual nos Estados Unidos, mas esta utilização é responsável por menos de 10% do consumo mundial. GeSbTe é um material de mudança de fase utilizado pelas suas propriedades ópticas, tais como em DVDs regraváveis.
Porque germânio é transparente no infravermelho é muito importante material óptico de infravermelhos, que pode ser facilmente cortado e polido em lentes e janelas. É especialmente utilizado como o elemento tico em frente câmeras de imagem térmica que trabalham no 8 a 14 mícron faixa de comprimento de onda para imagem térmica passiva e para a detecção de hot-spot nas forças armadas, sistema de visão noturna em carros, e de combate a incêndio aplicações. É, portanto, utilizado no infravermelho spectroscopes e outros equipamentos ópticos que exigem extremamente sensível Os detectores de infravermelhos. O material tem uma muito alta índice de refracção (4.0) e por isso necessita de ser anti-reflexo revestido. Particularmente, um revestimento anti-reflexo muito duro especial de de carbono diamante (DLC), índice de refração 2.0, é um bom jogo e produz uma superfície de diamante-dura que pode suportar tanto o tratamento áspero ambiental.
Eletrônica
Ligas de silício, germânio são rapidamente a tornar-se um importante material semicondutor, para utilização em circuitos integrados de alta velocidade. Circuitos que utilizam as propriedades das junções de Si-SiGe pode ser muito mais rápida do que os que utilizam silício sozinho. Silicon-germânio está começando a substituir arseneto de gálio (GaAs) em dispositivos de comunicação sem fio. Os chips SiGe, com propriedades de alta velocidade, pode ser feita com técnicas de produção de baixo custo, bem estabelecidos do chip de silício indústria.
O recente aumento do custo da energia tem melhorado a economia da painéis solares, um potencial importante nova utilização de germânio. Germânio é o substrato para as bolachas de alta eficiência células fotovoltaicas multijunction para aplicações espaciais.
Porque germânio e arsenieto de gálio têm constantes de rede muito semelhantes, substratos de germânio pode ser usado para fazer o arseneto de gálio células solares. Os Mars Exploration Rovers e vários satélites usar triplo arsenieto de gálio de junção em células de germânio.
Substratos de germânio sobre isolante são vistos como um potencial substituto para o silício em chips miniaturizados. Outros usos incluem em eletrônica fósforos em lâmpadas fluorescentes e germânio-base de estado sólido diodos emissores de luz (LEDs). Transistores de germânio ainda são utilizados em alguns pedais de efeitos de músicos que desejam reproduzir o caráter tonal distintivo da "Fuzz" -tone do início era do rock and roll, mais notavelmente o Dallas Arbiter Fuzz Face.
Outros usos

Dióxido de germânio, também é usado em catalisadores para de polimerização para a produção de tereftalato de polietileno (PET). O alto brilho do poliéster produzido é usado especialmente para garrafas PET comercializadas no Japão . No entanto, nos Estados Unidos, não germânio é usado para catalisadores de polimerização. Devido à semelhança entre a sílica (SiO2) e dióxido de germânio (GeO2), a fase estacionária de sílica em alguns colunas de cromatografia de gás pode ser substituído por GeO2.
Nos últimos anos tem visto germânio utilização crescente em ligas de metais preciosos. Em ligas de prata esterlina, por exemplo, verificou-se reduzir firescale, aumentar a resistência ao manchar, e aumentar a resposta da liga ao endurecimento por precipitação. A liga de prata esterlina à prova de manchas, de marca registrada Argentium, requer 1,2% de germânio.
Alta pureza germânio detectores de cristal único pode identificar com precisão as fontes de radiação para-exemplo em segurança do aeroporto. Germânio é útil para monocromadores para linhas de luz utilizado no único cristal espalhamento de nêutrons e sincrotrão de difracção de raios-X. A refletividade tem vantagens sobre silício em nêutron e aplicações de raios-X de alta energia. Os cristais de elevada pureza germânio são utilizados em detectores para espectroscopia gama e a busca de matéria escura .
Suplementos alimentares, desenvolvimento farmacêutico e perigo para a saúde
Germânio não está pensado para ser essencial para a saúde das plantas ou animais. Germânio no ambiente tem impacto pouca ou nenhuma saúde. Isto é primeiramente porque geralmente ocorre apenas como um oligoelemento e em minérios materiais carbonáceos, e é usado em quantidades muito pequenas que não são susceptíveis de ser ingerida, nas suas diversas aplicações industriais e electrónicos. Por razões semelhantes, germânio em utilizações finais tem pouco impacto sobre o meio ambiente como um risco biológico. Alguns compostos intermediários reativos de germânio são venenosas (veja precauções, abaixo).
Já em 1922, os médicos nos Estados Unidos utilizou a forma inorgânica de germânio (geralmente o sesquioxide) para tratar pacientes com anemia . Foi usado em outras formas de tratamentos, tais como um reforço do sistema imune pretendida, mas a sua eficiência tem sido duvidosa. O seu papel na tratamentos de câncer tem sido debatido, com a American Cancer Society alegando que não há efeitos anticancerígenos foram demonstrados. Pesquisa US Food and Drug Administration concluiu que o germânio, quando usado como suplemento nutricional ", apresenta potencial humano perigo para a saúde ".
Certos compostos de germânio estão disponíveis em dose baixa em os EUA como não-prescrição dietética "suplementos" em cápsulas ou comprimidos orais. Outros compostos de germânio foram administradas por médicos alternativos como soluções injectáveis não-FDA-permitidos. Formas inorgânicas solúveis de germânio usados em primeiro lugar, nomeadamente o sal de citrato-lactato, levou a um número de casos de renal disfunção, esteatose hepática e periférica neuropatia em indivíduos usá-los em uma base crônica. As concentrações plasmáticas e germânio urina nestes indivíduos, vários dos quais morreram, foram várias ordens de magnitude maior do que níveis endógenos. A forma orgânica mais recente, beta-carboxyethylgermanium sesquioxide ( propagermanium), não apresentaram o mesmo espectro de efeitos tóxicos.
Certos compostos de germânio possuem baixa toxicidade para os mamíferos , mas têm efeitos tóxicos contra certas bactérias . No entanto, nenhum composto de germânio foi ainda demonstrada uma utilização farmacêutica, como seja um agente antibacteriano ou cancro agente quimioterapêutico.
Precauções para compostos de germânio quimicamente reativos
Alguns dos compostos de germânio são muito reativos e apresentar um risco imediato para a saúde humana da exposição. Por exemplo, cloreto de germânio e germane (GeH 4) é um líquido e gás, respectivamente, que pode ser muito irritante para os olhos, pele, pulmões e garganta.

