Isótopo
Fundo para as escolas Wikipédia
Esta seleção Escolas foi originalmente escolhido pelo SOS Children para as escolas no mundo em desenvolvimento sem acesso à internet. Ele está disponível como um download intranet. Visite o site da SOS Children at http://www.soschildren.org/
Os isótopos são qualquer uma das diferentes formas de um elemento de cada massa atómica diferente tendo ( número de massa). Isótopos de um elemento têm núcleos com o mesmo número de protões (o mesmo número atómico ) mas diferentes números de neutrões . Por conseguinte, têm diferentes isótopos números de massa, o que dá o número total de nucleons-o número de protões e neutrões.
A nuclide é qualquer núcleo atômico especial com o número atômico Z específica e número de massa A; é equivalentemente um núcleo atômico com um número específico de prótons e nêutrons. Colectivamente, todos os isótopos de todos os elementos formam o conjunto de nuclídeos. A distinção entre os termos isótopo e nuclide tem um pouco turva, e eles são freqüentemente usados alternadamente Isotope é melhor usado quando se refere a vários nuclídeos diferentes do mesmo elemento;. Nuclide é mais genérico e é usado ao fazer referência a apenas um núcleo ou vários núcleos de diferentes elementos. Por exemplo, é mais correcto afirmar que um elemento, tais como flúor consiste de um nuclídeo estável em vez de que ele tem um isótopo estável.
Na nomenclatura IUPAC , isótopos e nuclídeos são especificados pelo nome do elemento particular, implicitamente dá o número atómico, seguida por um hífen e o número de massa (por exemplo, hélio-3, carbono-12, carbono-13, iodo-131 e urânio-238). Na forma simbólica, o número de núcleos é denotado como um prefixo sobrescrito ao símbolo químico (por exemplo, 3 He, 12 C, 13 C, 131 I e 238 L).
Cerca de 339 nuclides ocorrem naturalmente na Terra, dos quais cerca de 79% são estáveis. Contando os nuclídeos radioativos não encontradas na natureza que foram criados artificialmente, mais de 3100 nuclídeos são actualmente conhecidos.
História do termo
O termo foi cunhado isótopo em 1913 por Margaret Todd, um médico escocês, durante uma conversa com Frederick Soddy (a quem ela estava distantemente relacionado pelo casamento). Soddy, um químico da Universidade de Glasgow, explicou que apareceu de suas investigações como se vários elementos ocupado cada posição na tabela periódica . Daí Todd sugeriu o termo grego para "no mesmo lugar" como um nome adequado. Soddy adotou o termo e passou a ganhar o Prêmio Nobel de Química em 1921 por seu trabalho sobre substâncias radioactivas.
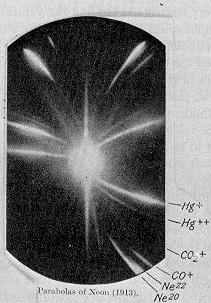
Em 1913, como parte da sua exploração para a composição do raios canal, JJ Thomson canalizada uma corrente de néon ionizado através de um campo magnético e um campo elétrico e mediu sua deflexão, colocando uma chapa fotográfica em seu caminho. Thomson observou duas manchas de luz na chapa fotográfica (ver imagem à direita), que sugeriu duas parábolas diferentes de deflexão. Thomson concluir-se que alguns dos átomos do gás foram de massa mais elevado do que o resto.
Variação nas propriedades entre isótopos
Propriedades químicas e atômicas
Um átomo neutro tem o mesmo número de electrões como protões. Assim, diferentes isótopos de um dado elemento todos têm o mesmo número de protões e electrões e a mesma estrutura electrónica, e por causa do comportamento químico de um átomo é em grande parte determinada pela sua estrutura electrónica, isótopos diferentes exibem comportamento químico quase idêntico. A principal exceção a isso é o efeito isotópico cinético: devido às suas massas maiores, isótopos mais pesados, tendem a reagir um pouco mais devagar do que os isótopos mais leves do mesmo elemento. Isso é mais pronunciado para protium (1 H) vis-à-vis deutério (2H), porque deutério tem o dobro da massa de protium. O efeito de massa entre deutério e o protium relativamente leve também afecta o comportamento das suas respectivas ligações químicas, por meio da mudança do centro de gravidade ( massa reduzida) dos sistemas atómicos. No entanto, para os elementos mais pesados, a massa absoluta de electrões em relação ao núcleo se muito mais, e a diferença relativa entre isótopos de massa é muito menor, e assim os efeitos de diferença de massa sobre a química são geralmente insignificante.
Da mesma forma, duas moléculas que diferem apenas na natureza dos seus átomos isotópica ( isotopólogos) terá estrutura eletrônica idênticas e propriedades físicas e químicas, portanto, quase indistinguíveis (novamente com deutério proporcionando a principal exceção a esta regra). Os modos de vibração de uma molécula são determinadas pela forma e pelas massas dos seus átomos constituintes. Consequentemente, isotopólogos terão diferentes conjuntos de modos vibracionais. Uma vez que modos de vibração permitem que uma molécula para absorver a fotões de energia correspondente, isotopólogos têm diferentes propriedades ópticas do gama dos infravermelhos.
Propriedades nucleares e estabilidade
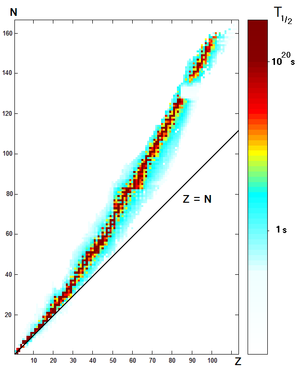
Os núcleos atômicos consistem em prótons e nêutrons unidos pelo força nuclear forte. Porque prótons são carregados positivamente, eles se repelem. Nêutrons, que são eletricamente neutros, permitir uma certa separação entre os prótons carregados positivamente, reduzindo a repulsão eletrostática. Nêutrons também estabilizar o núcleo porque a distâncias curtas que se atraem e prótons igualmente pelo força nuclear forte, e esta força extra de ligação também compensa a repulsão elétrica entre os prótons. Por esta razão, um ou mais neutrões são necessários para dois ou mais protões para ser ligado a um núcleo. Como o número de protões aumenta, uma proporção crescente de nêutrons são necessários para formar um núcleo estável (ver gráfico à direita). Por exemplo, embora o neutrões: proporção de protões de 3 Ele é de 1: 2, o neutrões: proporção de protões de 238 U é maior do que 3: 2. Como regra, não é, para cada número atômico (cada elemento) apenas um punhado de isótopos estáveis, sendo a média de 3,4 isótopos estáveis por elemento que tem quaisquer isótopos estáveis. Dezasseis elementos têm apenas um único isótopo estável, enquanto que o maior número de isótopos estáveis observados para qualquer elemento , é dez.
Embora isótopos apresentam comportamento eletrônico e químico quase idêntico, o seu comportamento nuclear varia drasticamente. Adição de nêutrons para isótopos podem variar seus spins nucleares e formas nucleares, causando diferenças em captura de nêutrons secções transversais e espectrografia de raios gama e propriedades de ressonância magnética nuclear.
Se muitos ou poucos nêutrons estão presentes no que diz respeito à proporção ideal, o núcleo torna-se instável e sujeito a certos tipos de decaimento nuclear. Isótopos instáveis com um número não-ideal de nêutrons decadência por decaimento alfa, decaimento beta, ou outros meios exóticas, tais como fissão espontânea e decadência cluster.
Ocorrência na natureza
Elementos são compostas de um ou isótopos, que são normalmente mais estável que ocorre naturalmente. Alguns elementos têm instáveis (isótopos radioactivos), porque a sua decadência é tão lento que uma fração ainda permanece desde que foram criados (exemplos: urânio, potássio), ou porque eles são criados continuamente através da radiação cósmica (trítio, carbono-14) ou pelo decaimento de um isótopo na primeira categoria (rádio, radônio).
Apenas 80 elementos têm isótopos estáveis, e 16 deles têm apenas um isótopo estável. A maioria dos elementos ocorrem naturalmente na Terra em vários isótopos estáveis, com o maior número de isótopos estáveis para um elemento sendo dez, para estanho (elemento número 50). Há cerca de 94 elementos encontrados naturalmente na Terra (até plutônio, elemento 94, inclusive), embora alguns são detectados apenas em quantidades muito pequenas, tais como plutônio-244. Lindsay estima que os elementos que ocorrem naturalmente na Terra (apenas como alguns radioisótopos) ocorrem como isótopos 339 (nuclídeos) no total. Apenas 269 destes isótopos naturais são estáveis, e os outros 70 são radioactivos, mas ocorrem na Terra devido aos seus relativamente longas semi-vidas, ou de outros meios de produção natural. Um ~ 2700 isótopos radioativos adicionais não encontradas na natureza foram criados em reatores nucleares e em aceleradores de partículas. Muitos isótopos de vida curta não encontrado naturalmente na Terra também foram observadas por análise espectroscópica, sendo criada naturalmente em estrelas ou supernovas. Um exemplo é de alumínio-26, que não se encontra naturalmente na Terra, mas que é encontrada em abundância em escala astronómicas.
As massas atómicas dos elementos tabelados são médias que representam a presença de vários isótopos com massas diferentes. Um bom exemplo é o cloro , tendo a composição 35 Cl, 75,8%, e 37 Cl, 24,2%, para originar uma massa atómica de 35,5. Valores como este confundiu cientistas antes da descoberta dos isótopos, como a maioria dos elementos de luz massas atômicas estão perto de números inteiros múltiplos de hidrogênio.
De acordo com geralmente aceitos cosmologia apenas os isótopos de hidrogênio e hélio, e vestígios de alguns isótopos de lítio, berílio e boro foram criados no Big Bang, enquanto todos os outros foram sintetizados nas estrelas e supernovas. (Ver nucleossíntese.) Suas respectivas abundâncias no resultado Terra a partir das quantidades formadas por estes processos, a sua propagação através da galáxia, e suas taxas de decomposição. Após a coalescência inicial do sistema solar, isótopos foram redistribuídos de acordo com a massa ea composição isotópica de elementos varia ligeiramente de planeta para planeta. Isso às vezes faz com que seja possível rastrear a origem dos meteoritos.
A massa molecular de isótopos
A massa molecular (Mr) de um elemento é determinado pelos seus núcleos. Por exemplo, Carbono-12 (12 C) tem 6 prótons e seis nêutrons . Quando uma amostra contém dois isótopos a equação a seguir em que M é aplicado r (1) e M R (2) são as massas moleculares de cada isótopo indivíduo, e abundância% é a percentagem de abundância isotópica que na amostra.
Aplicações de isótopos
Existem vários aplicativos que capitalizar sobre as propriedades dos diversos isótopos de um determinado elemento.
A utilização de propriedades químicas e biológicas
- As análises isotópicas é a determinação de assinatura isotópica, as abundâncias relativas dos isótopos de um determinado elemento em uma amostra em particular. Para substâncias biogénicas nomeadamente, as variações significativas de isótopos de C, N e O pode ocorrer. Análise de tais variações tem uma ampla gama de aplicações, tais como a detecção da adulteração de produtos alimentares. A identificação de certos meteoritos como tendo se originado em Marte é baseado em parte mediante a assinatura isotópica de gases-traço nelas contidas.
- Outra aplicação comum é rotulagem isotópica, o uso de isótopos incomuns como marcadores ou marcadores em reacções químicas. Normalmente, átomos de um dado elemento são indistinguíveis uns dos outros. No entanto, usando isótopos de massas diferentes, eles podem ser distinguidos por espectrometria de massa ou espectroscopia no infravermelho (veja "Propriedades"). Por exemplo, em 'rotulagem isótopo estável com ácidos aminados em cultura de células ( SILAC) 'isótopos estáveis são utilizados para quantificar proteínas . Se são utilizados isótopos radioactivos, que podem ser detectados pela radiação que emitem (isto é chamado rotulagem radioisotópica).
- Uma técnica semelhante à rotulagem radioisotópica é datação radiométrica: usando o conhecido meia-vida de um elemento instável, pode-se calcular a quantidade de tempo decorrido desde um nível conhecido de isótopo existia. O exemplo mais conhecido é radiocarbono usado para determinar a idade de materiais carbonáceos.
- Substituição isotópica pode ser utilizado para determinar o mecanismo de reacção, através do efeito isotópico cinético.
A utilização de propriedades nucleares
- Várias formas de espectroscopia dependem das propriedades únicas de isótopos nucleares específicos. Por exemplo, de ressonância magnética (RMN) nuclear pode ser usado somente para isótopos com um spin nuclear diferente de zero. Os isótopos mais comuns usadas com espectroscopia de RMN são um H, D 2, 15 N, 13 C e 31 P.
- Espectroscopia Mössbauer de também conta com as transições nucleares de isótopos específicos, como 57 Fe.
- Radionuclídeos também têm usos importantes. A energia nuclear e armas nucleares desenvolvimento exigem quantidades relativamente grandes de isótopos específicos. O processo de separação isotópica representa um desafio tecnológico significativo, mas mais ainda com elementos pesados como o urânio ou plutônio, do que com elementos mais leves, como hidrogênio, lítio, carbono, nitrogênio e oxigênio. Os elementos mais leves são geralmente separados por difusão de gás dos seus compostos, tais como CO e NO. Isótopos de urânio foram separados por difusão em grandes quantidades de gás, o gás centrifugação, separação de ionização de laser, e (no Manhattan Project) por um tipo de produção espectroscopia de massa .